2022年化学中考备考复习 流程图题精讲课件---工艺流程图题(二)(课件68页)
文档属性
| 名称 | 2022年化学中考备考复习 流程图题精讲课件---工艺流程图题(二)(课件68页) |  | |
| 格式 | zip | ||
| 文件大小 | 961.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-24 08:44:59 | ||
图片预览





文档简介
(共68张PPT)
2022年化学中考备考复习 流程图题精讲课件
---工艺流程图题(二)(适合安徽省)
题型突破
1
题型分类训练
2
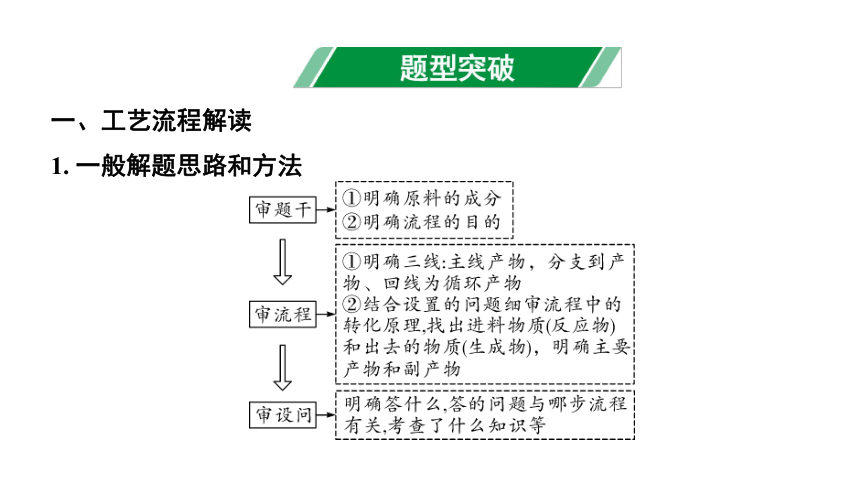
一、工艺流程解读
1. 一般解题思路和方法
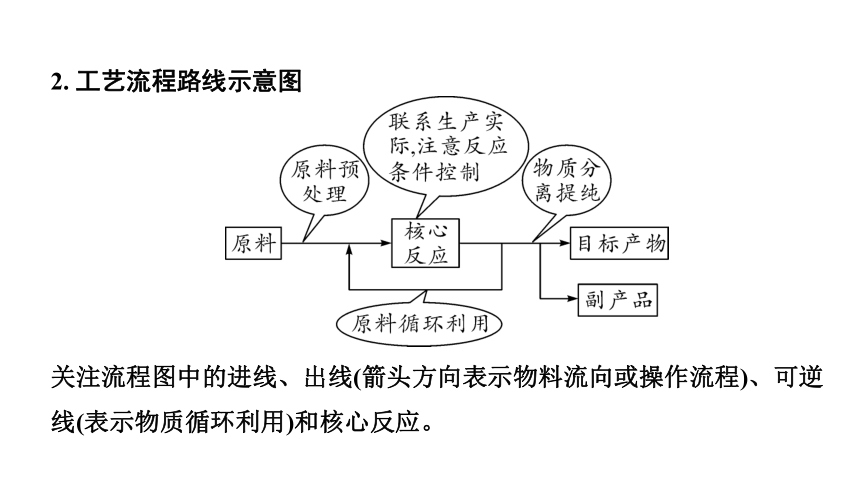
2. 工艺流程路线示意图
关注流程图中的进线、出线(箭头方向表示物料流向或操作流程)、可逆线(表示物质循环利用)和核心反应。
二、常考知识点
1. 原料预处理的常用方法及目的
(1)粉碎(研磨):____________________________________。
(2)搅拌:使反应物充分接触,加快反应(或溶解)速率。
(3)灼烧(煅烧、焙烧):使固体在高温下分解、氧化;除去可燃性杂质等。
(4)浸出:使原料中的物质溶解(或与浸取液接触反应),可溶性离子进入溶液,不溶物通过过滤除去。
①水浸:使可溶物溶解,与不溶物分离。
②酸浸:溶解金属、__________(如氧化铝等)、难溶性碱或碳酸盐等。
③碱浸:溶解二氧化硅、氧化铝等。
增大反应物间的接触面积,加快反应速率
金属氧化物
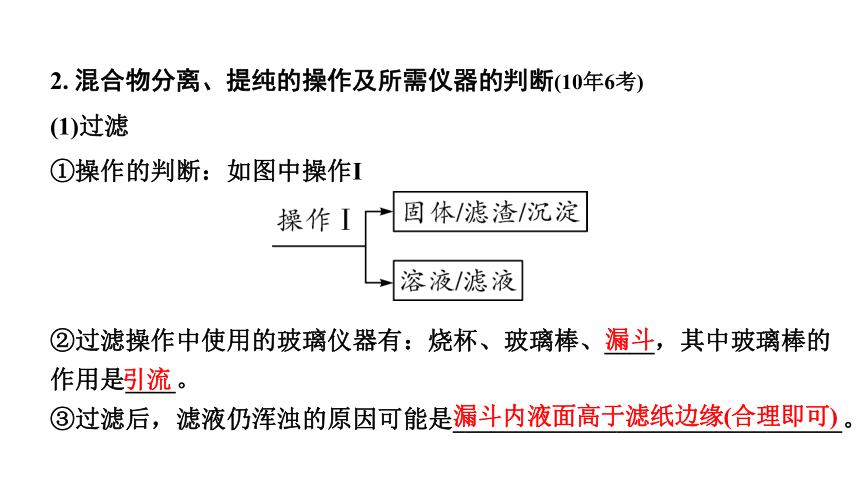
2. 混合物分离、提纯的操作及所需仪器的判断(10年6考)
(1)过滤
①操作的判断:如图中操作Ⅰ
②过滤操作中使用的玻璃仪器有:烧杯、玻璃棒、____,其中玻璃棒的
作用是____。
③过滤后,滤液仍浑浊的原因可能是_______________________________。
漏斗
引流
漏斗内液面高于滤纸边缘(合理即可)
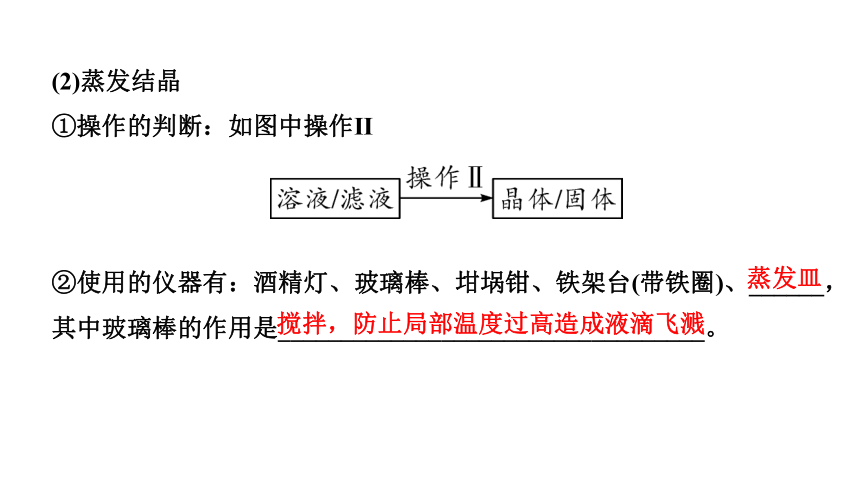
(2)蒸发结晶
①操作的判断:如图中操作Ⅱ
②使用的仪器有:酒精灯、玻璃棒、坩埚钳、铁架台(带铁圈)、______,其中玻璃棒的作用是__________________________________。
蒸发皿
搅拌,防止局部温度过高造成液滴飞溅
3. 物质成分分析
(1)判断所加的试剂:从加入试剂的目的、参加反应的物质、反应的产物分析判断。如:
上述流程中“酸浸”使用的试剂为_______(已知氧化铜锌矿主要成分为ZnO和CuO,其余成分不与酸反应,也不溶于水)。
稀硫酸
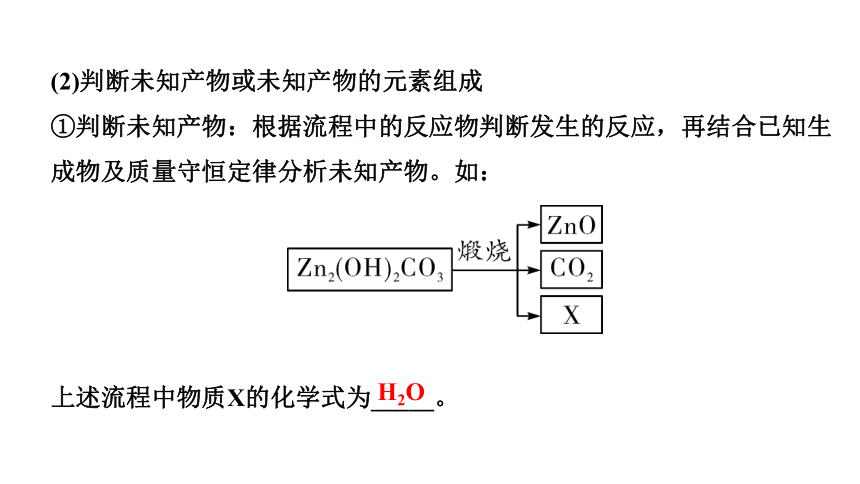
(2)判断未知产物或未知产物的元素组成
①判断未知产物:根据流程中的反应物判断发生的反应,再结合已知生成物及质量守恒定律分析未知产物。如:
上述流程中物质X的化学式为_____。
H2O
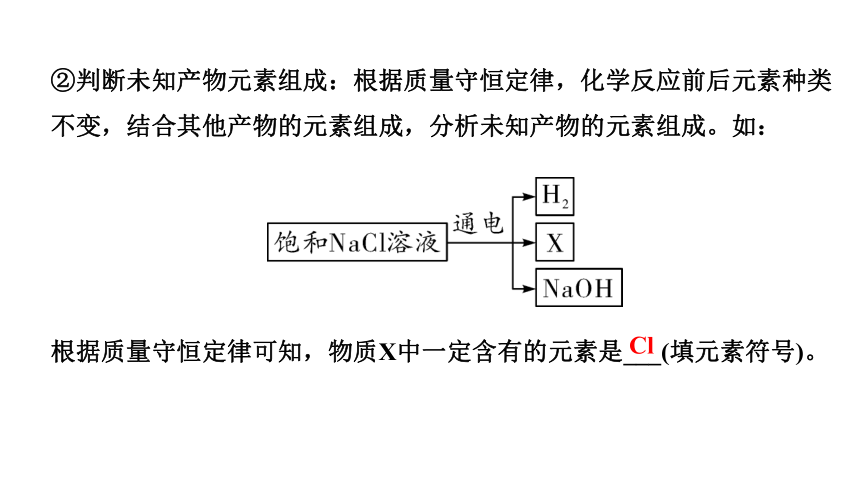
②判断未知产物元素组成:根据质量守恒定律,化学反应前后元素种类不变,结合其他产物的元素组成,分析未知产物的元素组成。如:
根据质量守恒定律可知,物质X中一定含有的元素是___(填元素符号)。
Cl
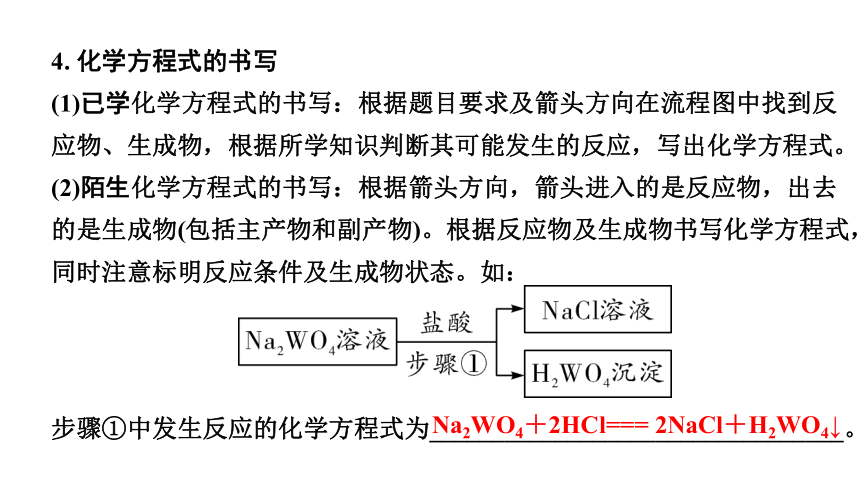
4. 化学方程式的书写
(1)已学化学方程式的书写:根据题目要求及箭头方向在流程图中找到反应物、生成物,根据所学知识判断其可能发生的反应,写出化学方程式。
(2)陌生化学方程式的书写:根据箭头方向,箭头进入的是反应物,出去的是生成物(包括主产物和副产物)。根据反应物及生成物书写化学方程式,同时注意标明反应条件及生成物状态。如:
步骤①中发生反应的化学方程式为_________________________________。
Na2WO4+2HCl=== 2NaCl+H2WO4↓
5. 基本反应类型的判断根据该步骤中反应物与生成物的种类进行判断:
(1)多变一→ 化合反应;
(2)一变多→ 分解反应;
(3)单换单→ 置换反应;
(4)双交换,价不变→ 复分解反应
6. 流程的作用及评价
(1)从成本考虑:所用原料价格低廉或将废弃物转化为有用的物质,流程中耗能少,实现了物质、能量的循环利用等。
(2)从环保考虑:无污染、无腐蚀、“三废”(废气、废渣、废水)的处理。
金属及金属矿物的利用
1. (2020安徽)硫酸亚铁晶体是重要的化学试剂。传统制备方法是用铁屑与稀硫酸反应,因铁屑中含有硫、磷等杂质,与稀硫酸反应会产生刺鼻、呛人的有毒气体。某科技小组改用铁屑与硫酸铜溶液反应制备硫酸亚铁晶体,流程如下:
铁屑中主要成分是铁,铁与硫酸铜反应生成FeSO4和Cu
蒸发结晶
Cu以及硫、磷等杂质
(1)步骤①中反应的化学方程式为________________________。
(2)操作Ⅰ的名称是_____。步骤②涉及到蒸发,蒸发时必需的仪器有铁架台(含铁圈)、酒精灯、玻璃棒、_______。
(3)用硫酸铜溶液代替稀硫酸制备硫酸亚铁晶体,优点是____________________________。
Fe+CuSO4=== FeSO4+Cu
过滤
蒸发皿
避免有毒气体的
产生(合理即可)
(4)步骤②中进行蒸发操作时,玻璃棒的作用是__________________________________。
(5)若用铁屑与稀硫酸反应制取硫酸亚铁,可能产生SO2等有毒气体,其易引起的环境问题是____。
搅拌,防止局部温度过高
造成液滴飞溅
酸雨
2. 五氧化二钒(V2O5)是一种工业催化剂,下图是制取V2O5
的工艺流程。
KVO3和NH4Cl发生复分解反应生成NH4VO3和KCl
固液分离采用过滤法
此反应为一变多,为分解反应,且由质量守恒定律可知物质X中必有氮元素和氢元素
(1)写出反应①的化学方程式__________________________________。
(2)操作a的名称是_____,实验室进行该操作所需的玻璃仪器有烧杯、玻璃棒和_____。
(3)反应②的反应类型是________,物质X中一定含有的元素是__________。
(4)写出副产物KCl的一种用途___________。
KVO3+NH4Cl === NH4VO3↓+KCl
过滤
漏斗
分解反应
可用作化肥
N和H(或N)
3. (高纯氧化锌广泛应用于电子工业,某研究小组设计如图流程制备高纯氧化锌:
高温灼烧将草酸锌分解为氧化锌、二氧化碳和一氧化碳
Zn和HCl反应生成H2和ZnCl
草酸铵和氯化锌溶液发生复分解反应,生成氯化铵溶液和草酸锌沉淀
(1)反应①的化学方程式为________________________。
(2)反应②的基本反应类型是__________。
(3)反应②后进行的分离操作名称是____,若得到的NH4Cl溶液有浑浊,原因可能是_________(写出一种即可)。
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为_____、____。
Zn+2HCl=== ZnCl2+H2↑
复分解反应
过滤
滤纸破损
CO2
CO
(5)反应②的化学方程式为______________________________________。
(6)副产物氯化铵溶液经处理后得到的氯化铵固体在农业上可用作_____(填“氮肥”“磷肥”“钾肥”或“复合肥”),其在施用时应注意的事项是______________________。
ZnCl2+(NH4)2C2O4=== 2NH4Cl+ZnC2O4↓
氮肥
避免与碱
性物质混合施用
4. (2021乐山改编)纳米碳酸钡是一种重要的无机化工产品,某工厂用含SiO2杂质的BaCO3为原料制备纳米碳酸钡的工艺流程如图所示:
(1)步骤1通过过滤分离物质的依据是___________________________。
加盐酸后形成的是固液混合物
(2)加入盐酸后发生反应的化学方程式为_______________________________。
(3)步骤3的操作是洗涤、干燥,该过程中发生的是____(填“物理”或“化学”)变化。
(4)从该流程推测SiO2具有的化学性质是________________。
BaCO3+2HCl===BaCl2+H2O+CO2↑
物理
不与盐酸发生反应
5. 某炉渣中含有FeO、Fe2O3及少量杂质(杂质不溶于水,也不与酸反应),现按如图所示流程制备绿矾(FeSO4·7H2O)。已知Fe与Fe2(SO4)3反应生成FeSO4。
(1)为了加快步骤①中的反应速率,可采取的措施有__(填字母序号)。
A. 加水稀释 B. 升高温度
B
(2)写出一个步骤①中发生反应的化学方程式_______________________
________________________________________。
(3)步骤②中发生反应的基本反应类型是________。
(4)步骤③中由FeSO4溶液得到绿矾的过程中涉及蒸发,实验室进行蒸发操作时停止加热的最佳时机是________________________。
FeO+H2SO4===FeSO4+
H2O[或Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O]
化合反应
当蒸发皿中出现较多固体时
6. Co2O3可用作釉料、颜料、催化剂等,如图是利用某含钴原料(主要成分为Co2O3,其余成分不溶于水也不与酸反应)制取Co2O3的工艺流程。
(1)Co2O3中钴元素的化合价为____。
+3
(2)若经操作a得到的CoSO4溶液仍浑浊,应进行的操作是________。
(3)步骤②中加入(NH4)2C2O4发生复分解反应的化学方程式为________
_________________________________。
(4)步骤③中的另一种产物是常见的温室气体,则该气体的化学式为____。
重新过滤
CoSO4+
(NH4)2C2O4=== CoC2O4↓+ (NH4)2SO4
CO2
7. 金属钛(Ti)的硬度大、熔点高、密度小,被广泛用于火箭、航天飞机、船舶等。如图是利用钛铁矿(主要成分为FeTiO3)制备金属钛的工艺流程(已知TiO2不溶于稀盐酸)。
(1)进行反应①前,需先将钛铁矿粉碎,其目的是____________________________________。
增大反应物间的接触面
积,加快反应速率
(2)反应②的化学方程式为______________________________。
(3)反应③需在氩气环境中进行,氩气起的作用是________________________________。
(4)利用上述方法制取的金属钛中可能会含有少量杂质,该杂质是金属___。
TiO2+2C+2Cl2 TiCl4+2CO
防止镁、钛在高温下与
氧气发生反应
Mg
8. (2021安徽)某燃煤电厂产生的固体废弃物粉煤灰中含有较多的氧化铝。从粉煤灰中提取氧化铝的工艺流程如下。
粉煤灰中主要为Al2O3,酸浸后产物为Al2(SO4)3,根据质量守恒定律选用的酸为H2SO4
沉淀后出现Al(OH)3滤渣,可知在沉淀操作时加入了碱
Al(OH)3煅烧后分解为H2O和Al2O3
三废的利用
(1)“酸浸”中使用的酸是___(填字母序号)。
A. HCl B. H2SO4 C. Na2SO4
(2)流程中涉及到的氧化物有_____________(写出1种即可)。
(3)“煅烧”过程发生反应的化学方程式为__________________________,反应类型是_________。
(4)该工艺的价值在于___________。
B
Al2O3(或H2O)
分解反应
废物再利用
2Al(OH)3 Al2O3+H2O↑
9. (2019安徽)Ba(NO3)2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO3、BaSO3、Fe2O3)可制取Ba(NO3)2,其部分流程如下:
①BaCO3与HNO3反应生成Ba(NO3)2、H2O和CO2
②BaSO3被转化为BaSO4沉淀
③Fe2O3与HNO3反应生成Fe(NO3)3和H2O
向Ba(NO3)2、Fe(NO3)3溶液加入试剂Y过滤得到Fe(OH)3沉淀和Ba(NO3)2溶液,所以试剂Y应是碱,因不能引入新的杂质所以Y是Ba(OH)2
冷却结晶
(1)Ba(NO3)2中钡元素的化合价为_____;流程中所涉及的氧化物是______
__________________(填1种即可)。
(2)BaCO3与稀HNO3反应的反应类型是____________;写出Fe2O3与稀HNO3反应的化学方程式:____________________________________。
+2
(或二氧化碳,或水)
复分解反应
Fe2O3+6HNO3=== 2Fe(NO3)3+3H2O
氧化铁
(3)试剂Y为____(填序号)。
①BaCl2溶液 ②Ba(OH)2溶液 ③NaOH溶液
(4)从Ba(NO3)2溶液中析出Ba(NO3)2晶体的方法是_________。
②
蒸发溶剂
10. (2018安徽)废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。
粉碎可增大接触面积,加快反应速率
由金属活动性表知活动性大小为Sn>Cu,因此Cu与SnCl4不反应,Sn与SnCl4反应生成SnCl2
SnCl2电解生成Sn和SnCl4
Cu等不反应物质
可循环使用
已知:Sn+SnCl4 ===== 2SnCl2
(1)SnCl4中锡元素的化合价是________。
(2)铜的金属活动性比锡的_____(填“强”或“弱”),固体A中一定含有的金属元素是_________。
弱
Cu(或铜)
+4
(3)写出步骤②发生反应的化学方程式______________________。
(4)相比于直接焚烧废旧电路板回收金属,该工艺主要优点是__________
_______________________。(回答一点即可)。
避免焚烧
塑料产生污染,更加环保
2SnCl2 Sn+SnCl4
电解
11. (2021连云港改编)回收含铜废料(主要成分为Cu)中的铜,部分流程如下。
已知:灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。
(1)“灼烧”的目的是_______________________________。
将含铜废料中的Cu全部转化为CuO
(2)“酸溶”过程中发生反应的化学方程式为___________________________。
(3)滤液X中的溶质为______(填化学式)。
CuO+H2SO4===CuSO4+H2O
FeSO4
(4)请你设计一种方案,从Cu、Fe混合物中分离得到金属Cu_________________________________________________________________________。
(5)写出铜在生活中的一种用途_______________。
将Cu、Fe混
合物加入足量稀硫酸中,充分反应后过滤、洗涤、干燥得到Cu(合理即可)
作导线(合理即可)
12. 废旧金属可回收利用,某化学兴趣小组用合金废料(含Fe、Cu、Al)制取FeSO4溶液并回收金属铜,实验流程如图所示(部分生成物已略去)。
已知:2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑,Fe和Cu不与氢氧化钠溶液反应。
(1)铁的金属活动性比铜___(填“强”或“弱”)。
强
(2)操作Ⅰ中玻璃棒的作用是_____。
(3)步骤B中发生反应的化学方程式为________________________。
(4)除上述步骤外,请再写出一条保护金属的途径_________________________________________。
引流
Fe+H2SO4=== FeSO4+H2↑
防止金属锈蚀(或寻找
金属代用品等合理即可)
13. 某化工厂用废硫酸制备硫酸钾的流程如下,请回答下列问题。
已知:氨气极易溶于水、CO2能溶于水。
(1)请结合氨气、二氧化碳的性质分析,进行步骤②时应________(填“先通氨气”或“先通二氧化碳”)。
先通氨气
(2)步骤③中发生反应的化学方程式为_____________________________________;洗涤步骤③中所得晶体时不用水而用饱和K2SO4溶液的目的是_______________。
(NH4)2SO4+2KCl=== K2SO4↓+
减少K2SO4的溶解
2NH4Cl
(3)该过程中使用CaSO4悬浊液而不用CaSO4溶液的原因是________________________________________。
硫酸钙微溶于
水,用悬浊液能增加反应物的量
(4)已知步骤②中发生的反应有水参与,写出该反应的化学方程式______
________________________________________。
(5)工艺流程中体现“绿色化学”理念的设计是___________________________。
CaSO4
+H2O+2NH3+CO2=== CaCO3↓+(NH4)2SO4
利用废硫酸生产制备(合理即可)
14. 海洋中有丰富的水生生物和化学资源。海水晒盐后,以其母液(卤水)和贝壳为原料,还可生产具有特殊用途的材料——纳米氧化镁,其简要流程如下:
贝壳煅烧后产物为CaO(生石灰)和CO2
生石灰(CaO)加水变为石灰乳[Ca(OH)2]
Ca(OH)2和卤水中MgCl2反应生成Mg(OH)2沉淀和CaCl2溶液
海水资源的利用)
(1)海水晒盐是_____(填“物理”或“化学”)变化,包括蒸发、____等过程。
(2)写出食盐的一种用途:____________。
(3)A步骤反应的化学方程式是_________________________。
(4)实验室进行a操作时,需要的玻璃仪器有烧杯、漏斗、________。
物理
结晶
可做调味品
玻璃棒
CaCO3 CaO+CO2↑
15. 如图是以海水(主要含有MgCl2、泥沙等杂质)为原料制取氢氧化钠溶液的实验流程:
(1)从海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是________________________________。
氯化钠的溶解度受温度影响变化不大
(2)除去氯化镁应选用的试剂是__________。
(3)蒸发浓缩过程中,溶液中NaCl的溶质质量分数____(填“增大”“减小”或“不变”)。
(4)电解饱和氯化钠溶液时发生反应的化学方程式为___________________________________。
NaOH溶液
增大
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
16. (2021合肥瑶海区二模改编)海水是一个巨大的资源宝库。如图是利用海水获取多种化学物质的流程图,请回答下列问题:
(1)在海水资源的利用中涉及溶解、过滤和蒸发等操作,实验室进行这些操作时均用到的玻璃仪器是_______。
玻璃棒
(2)反应②有NaCl生成,对应的化学反应方程式为________________________,该反应的基本类型为________。
(3)反应①②③中有元素化合价发生改变的是_______(填序号)。
2NaBr+Cl2===2NaCl
+Br2
置换反应
①②③
石灰石工业流程
17. (2021北京改编)真空热还原生产钙的主要转化过程如下(已知钙极易在空气中被氧化):
(1)石灰石属于_______(填“纯净物”或“混合物”)。
(2)步骤Ⅱ中发生反应的化学方程式为______________________________;该步骤反应必须在真空条件下进行的原因是____________________。
(3)结晶得到的钙可铸成钙锭,说明金属具有____性。
混合物
3CaO+2Al 3Ca↑+Al2O3
防止钙在空气中被氧化
延展
18. (2021合肥包河区二模改编)轻质碳酸钙广泛应用于橡胶、塑料以及造纸等行业,某同学在实验室以石灰石(杂质不反应也不溶于水)为原料制取轻质碳酸钙和氢氧化钠固体,设计流程如下:
(1)该流程中发生分解反应的步骤是___(填序号)。
(2)步骤②为_____(填“吸热”或“放热”)反应。
①
放热
(3)已知碳酸钙、二氧化碳和水能反应生成易溶于水的碳酸氢钙,则步骤③中应注意的操作事项是_______________________________。
(4)步骤④中发生反应的化学方程式为_____________________________________。
控制通入二氧化碳的量,防止过量
Ca(OH)2+Na2CO3=== CaCO3↓+
2NaOH
(5)检验步骤④得到的NaOH溶液中是否含有Na2CO3的方法是______________________________________________________________________________________。
(6)得到的氢氧化钠固体在保存时应注意的事项是________。
取少许步骤
④得到的溶液于试管中,滴加适量的氯化钡溶液,观察是否有白色沉淀
生成(合理即可)
密封保存
能源的利用
19. 甲醇是重要的液体燃料,通过“煤液化”技术用煤炭和水制取甲醇(CH3OH)的主要流程如下:
(1)混合气体通过冷却器后,分子间的间隔____(填“增大”或“减小”)。
减小
(2)该流程中涉及到的氧化物有___种。
(3)合成塔中CO和H2在高温高压、催化剂的作用下生成甲醇,据此写出
反应的化学方程式_______________________。
两
CO+2H2 CH3OH
(4)通过“煤液化”技术将煤炭转化为甲醇的优点是_________________________________________。
减少大气污染物的排放
(或提高了能源的利用率)
20. 甲烷不仅能用作燃料,也是制尿素[CO(NH2)2]的原料。如图是利用甲烷制尿素的主要流程,回答下列问题:
(1)步骤1中发生反应的化学方程式为__________________________。
CH4+2H2O CO2+4H2
(2)步骤2中的氮气是通过分离液态空气得到的,该过程中发生的是_____(填“物理”或“化学”)变化。
(3)写出产物尿素的一种用途_______。
(4)16 t 甲烷经过一系列化学反应后最多制得尿素___t(假设每一步化学反应中反应物和生成物都没有损耗)。
物理
作氮肥
60
拓展类型
21. (2021贵港改编)“太阳能光伏发电”能有效推进“碳中和”,发展“低碳经济”,其关键的材料是高纯硅。以下是利用石英砂(主要成分是SiO2)制取高纯硅的简易流程,回答下列问题:
(1)“精馏”是蒸馏的一种,其原理是利用混合物各成分的_____不同,将物质分离出来。
(2)上述流程中可循环使用的物质是____。
沸点
HCl
(3)流程⑤中发生反应的化学方程式为________________________。
(4)反应⑤中利用的是氢气的还原性,请再写出氢气的一条化学性质______。
SiHCl3+H2 Si+3HCl
可燃性
22. (2021德阳)为探究某化工厂固体废物的成分,以便回收有用物质,除掉有害物质。已知固体废物的主要成分是NaCl,还可能含有Na2CO3、K2SO4、NH4NO3、MgSO4、FeCl3,通过以下探究回答下列问题。
(1)气体乙的化学式为____。
CO2
(2)无色溶液A中存在的阴离子有______________________。
(3)反应生成气体甲的化学方程式为_______________________________________。
Cl-、OH-、 、
NH4NO3+NaOH NaNO3+NH3↑
+H2O
(4)原固体废物中一定存在的物质有________________________。
NaCl、Na2CO3和 NH4NO3
2022年化学中考备考复习 流程图题精讲课件
---工艺流程图题(二)(适合安徽省)
题型突破
1
题型分类训练
2
一、工艺流程解读
1. 一般解题思路和方法
2. 工艺流程路线示意图
关注流程图中的进线、出线(箭头方向表示物料流向或操作流程)、可逆线(表示物质循环利用)和核心反应。
二、常考知识点
1. 原料预处理的常用方法及目的
(1)粉碎(研磨):____________________________________。
(2)搅拌:使反应物充分接触,加快反应(或溶解)速率。
(3)灼烧(煅烧、焙烧):使固体在高温下分解、氧化;除去可燃性杂质等。
(4)浸出:使原料中的物质溶解(或与浸取液接触反应),可溶性离子进入溶液,不溶物通过过滤除去。
①水浸:使可溶物溶解,与不溶物分离。
②酸浸:溶解金属、__________(如氧化铝等)、难溶性碱或碳酸盐等。
③碱浸:溶解二氧化硅、氧化铝等。
增大反应物间的接触面积,加快反应速率
金属氧化物
2. 混合物分离、提纯的操作及所需仪器的判断(10年6考)
(1)过滤
①操作的判断:如图中操作Ⅰ
②过滤操作中使用的玻璃仪器有:烧杯、玻璃棒、____,其中玻璃棒的
作用是____。
③过滤后,滤液仍浑浊的原因可能是_______________________________。
漏斗
引流
漏斗内液面高于滤纸边缘(合理即可)
(2)蒸发结晶
①操作的判断:如图中操作Ⅱ
②使用的仪器有:酒精灯、玻璃棒、坩埚钳、铁架台(带铁圈)、______,其中玻璃棒的作用是__________________________________。
蒸发皿
搅拌,防止局部温度过高造成液滴飞溅
3. 物质成分分析
(1)判断所加的试剂:从加入试剂的目的、参加反应的物质、反应的产物分析判断。如:
上述流程中“酸浸”使用的试剂为_______(已知氧化铜锌矿主要成分为ZnO和CuO,其余成分不与酸反应,也不溶于水)。
稀硫酸
(2)判断未知产物或未知产物的元素组成
①判断未知产物:根据流程中的反应物判断发生的反应,再结合已知生成物及质量守恒定律分析未知产物。如:
上述流程中物质X的化学式为_____。
H2O
②判断未知产物元素组成:根据质量守恒定律,化学反应前后元素种类不变,结合其他产物的元素组成,分析未知产物的元素组成。如:
根据质量守恒定律可知,物质X中一定含有的元素是___(填元素符号)。
Cl
4. 化学方程式的书写
(1)已学化学方程式的书写:根据题目要求及箭头方向在流程图中找到反应物、生成物,根据所学知识判断其可能发生的反应,写出化学方程式。
(2)陌生化学方程式的书写:根据箭头方向,箭头进入的是反应物,出去的是生成物(包括主产物和副产物)。根据反应物及生成物书写化学方程式,同时注意标明反应条件及生成物状态。如:
步骤①中发生反应的化学方程式为_________________________________。
Na2WO4+2HCl=== 2NaCl+H2WO4↓
5. 基本反应类型的判断根据该步骤中反应物与生成物的种类进行判断:
(1)多变一→ 化合反应;
(2)一变多→ 分解反应;
(3)单换单→ 置换反应;
(4)双交换,价不变→ 复分解反应
6. 流程的作用及评价
(1)从成本考虑:所用原料价格低廉或将废弃物转化为有用的物质,流程中耗能少,实现了物质、能量的循环利用等。
(2)从环保考虑:无污染、无腐蚀、“三废”(废气、废渣、废水)的处理。
金属及金属矿物的利用
1. (2020安徽)硫酸亚铁晶体是重要的化学试剂。传统制备方法是用铁屑与稀硫酸反应,因铁屑中含有硫、磷等杂质,与稀硫酸反应会产生刺鼻、呛人的有毒气体。某科技小组改用铁屑与硫酸铜溶液反应制备硫酸亚铁晶体,流程如下:
铁屑中主要成分是铁,铁与硫酸铜反应生成FeSO4和Cu
蒸发结晶
Cu以及硫、磷等杂质
(1)步骤①中反应的化学方程式为________________________。
(2)操作Ⅰ的名称是_____。步骤②涉及到蒸发,蒸发时必需的仪器有铁架台(含铁圈)、酒精灯、玻璃棒、_______。
(3)用硫酸铜溶液代替稀硫酸制备硫酸亚铁晶体,优点是____________________________。
Fe+CuSO4=== FeSO4+Cu
过滤
蒸发皿
避免有毒气体的
产生(合理即可)
(4)步骤②中进行蒸发操作时,玻璃棒的作用是__________________________________。
(5)若用铁屑与稀硫酸反应制取硫酸亚铁,可能产生SO2等有毒气体,其易引起的环境问题是____。
搅拌,防止局部温度过高
造成液滴飞溅
酸雨
2. 五氧化二钒(V2O5)是一种工业催化剂,下图是制取V2O5
的工艺流程。
KVO3和NH4Cl发生复分解反应生成NH4VO3和KCl
固液分离采用过滤法
此反应为一变多,为分解反应,且由质量守恒定律可知物质X中必有氮元素和氢元素
(1)写出反应①的化学方程式__________________________________。
(2)操作a的名称是_____,实验室进行该操作所需的玻璃仪器有烧杯、玻璃棒和_____。
(3)反应②的反应类型是________,物质X中一定含有的元素是__________。
(4)写出副产物KCl的一种用途___________。
KVO3+NH4Cl === NH4VO3↓+KCl
过滤
漏斗
分解反应
可用作化肥
N和H(或N)
3. (高纯氧化锌广泛应用于电子工业,某研究小组设计如图流程制备高纯氧化锌:
高温灼烧将草酸锌分解为氧化锌、二氧化碳和一氧化碳
Zn和HCl反应生成H2和ZnCl
草酸铵和氯化锌溶液发生复分解反应,生成氯化铵溶液和草酸锌沉淀
(1)反应①的化学方程式为________________________。
(2)反应②的基本反应类型是__________。
(3)反应②后进行的分离操作名称是____,若得到的NH4Cl溶液有浑浊,原因可能是_________(写出一种即可)。
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为_____、____。
Zn+2HCl=== ZnCl2+H2↑
复分解反应
过滤
滤纸破损
CO2
CO
(5)反应②的化学方程式为______________________________________。
(6)副产物氯化铵溶液经处理后得到的氯化铵固体在农业上可用作_____(填“氮肥”“磷肥”“钾肥”或“复合肥”),其在施用时应注意的事项是______________________。
ZnCl2+(NH4)2C2O4=== 2NH4Cl+ZnC2O4↓
氮肥
避免与碱
性物质混合施用
4. (2021乐山改编)纳米碳酸钡是一种重要的无机化工产品,某工厂用含SiO2杂质的BaCO3为原料制备纳米碳酸钡的工艺流程如图所示:
(1)步骤1通过过滤分离物质的依据是___________________________。
加盐酸后形成的是固液混合物
(2)加入盐酸后发生反应的化学方程式为_______________________________。
(3)步骤3的操作是洗涤、干燥,该过程中发生的是____(填“物理”或“化学”)变化。
(4)从该流程推测SiO2具有的化学性质是________________。
BaCO3+2HCl===BaCl2+H2O+CO2↑
物理
不与盐酸发生反应
5. 某炉渣中含有FeO、Fe2O3及少量杂质(杂质不溶于水,也不与酸反应),现按如图所示流程制备绿矾(FeSO4·7H2O)。已知Fe与Fe2(SO4)3反应生成FeSO4。
(1)为了加快步骤①中的反应速率,可采取的措施有__(填字母序号)。
A. 加水稀释 B. 升高温度
B
(2)写出一个步骤①中发生反应的化学方程式_______________________
________________________________________。
(3)步骤②中发生反应的基本反应类型是________。
(4)步骤③中由FeSO4溶液得到绿矾的过程中涉及蒸发,实验室进行蒸发操作时停止加热的最佳时机是________________________。
FeO+H2SO4===FeSO4+
H2O[或Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O]
化合反应
当蒸发皿中出现较多固体时
6. Co2O3可用作釉料、颜料、催化剂等,如图是利用某含钴原料(主要成分为Co2O3,其余成分不溶于水也不与酸反应)制取Co2O3的工艺流程。
(1)Co2O3中钴元素的化合价为____。
+3
(2)若经操作a得到的CoSO4溶液仍浑浊,应进行的操作是________。
(3)步骤②中加入(NH4)2C2O4发生复分解反应的化学方程式为________
_________________________________。
(4)步骤③中的另一种产物是常见的温室气体,则该气体的化学式为____。
重新过滤
CoSO4+
(NH4)2C2O4=== CoC2O4↓+ (NH4)2SO4
CO2
7. 金属钛(Ti)的硬度大、熔点高、密度小,被广泛用于火箭、航天飞机、船舶等。如图是利用钛铁矿(主要成分为FeTiO3)制备金属钛的工艺流程(已知TiO2不溶于稀盐酸)。
(1)进行反应①前,需先将钛铁矿粉碎,其目的是____________________________________。
增大反应物间的接触面
积,加快反应速率
(2)反应②的化学方程式为______________________________。
(3)反应③需在氩气环境中进行,氩气起的作用是________________________________。
(4)利用上述方法制取的金属钛中可能会含有少量杂质,该杂质是金属___。
TiO2+2C+2Cl2 TiCl4+2CO
防止镁、钛在高温下与
氧气发生反应
Mg
8. (2021安徽)某燃煤电厂产生的固体废弃物粉煤灰中含有较多的氧化铝。从粉煤灰中提取氧化铝的工艺流程如下。
粉煤灰中主要为Al2O3,酸浸后产物为Al2(SO4)3,根据质量守恒定律选用的酸为H2SO4
沉淀后出现Al(OH)3滤渣,可知在沉淀操作时加入了碱
Al(OH)3煅烧后分解为H2O和Al2O3
三废的利用
(1)“酸浸”中使用的酸是___(填字母序号)。
A. HCl B. H2SO4 C. Na2SO4
(2)流程中涉及到的氧化物有_____________(写出1种即可)。
(3)“煅烧”过程发生反应的化学方程式为__________________________,反应类型是_________。
(4)该工艺的价值在于___________。
B
Al2O3(或H2O)
分解反应
废物再利用
2Al(OH)3 Al2O3+H2O↑
9. (2019安徽)Ba(NO3)2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO3、BaSO3、Fe2O3)可制取Ba(NO3)2,其部分流程如下:
①BaCO3与HNO3反应生成Ba(NO3)2、H2O和CO2
②BaSO3被转化为BaSO4沉淀
③Fe2O3与HNO3反应生成Fe(NO3)3和H2O
向Ba(NO3)2、Fe(NO3)3溶液加入试剂Y过滤得到Fe(OH)3沉淀和Ba(NO3)2溶液,所以试剂Y应是碱,因不能引入新的杂质所以Y是Ba(OH)2
冷却结晶
(1)Ba(NO3)2中钡元素的化合价为_____;流程中所涉及的氧化物是______
__________________(填1种即可)。
(2)BaCO3与稀HNO3反应的反应类型是____________;写出Fe2O3与稀HNO3反应的化学方程式:____________________________________。
+2
(或二氧化碳,或水)
复分解反应
Fe2O3+6HNO3=== 2Fe(NO3)3+3H2O
氧化铁
(3)试剂Y为____(填序号)。
①BaCl2溶液 ②Ba(OH)2溶液 ③NaOH溶液
(4)从Ba(NO3)2溶液中析出Ba(NO3)2晶体的方法是_________。
②
蒸发溶剂
10. (2018安徽)废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。
粉碎可增大接触面积,加快反应速率
由金属活动性表知活动性大小为Sn>Cu,因此Cu与SnCl4不反应,Sn与SnCl4反应生成SnCl2
SnCl2电解生成Sn和SnCl4
Cu等不反应物质
可循环使用
已知:Sn+SnCl4 ===== 2SnCl2
(1)SnCl4中锡元素的化合价是________。
(2)铜的金属活动性比锡的_____(填“强”或“弱”),固体A中一定含有的金属元素是_________。
弱
Cu(或铜)
+4
(3)写出步骤②发生反应的化学方程式______________________。
(4)相比于直接焚烧废旧电路板回收金属,该工艺主要优点是__________
_______________________。(回答一点即可)。
避免焚烧
塑料产生污染,更加环保
2SnCl2 Sn+SnCl4
电解
11. (2021连云港改编)回收含铜废料(主要成分为Cu)中的铜,部分流程如下。
已知:灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。
(1)“灼烧”的目的是_______________________________。
将含铜废料中的Cu全部转化为CuO
(2)“酸溶”过程中发生反应的化学方程式为___________________________。
(3)滤液X中的溶质为______(填化学式)。
CuO+H2SO4===CuSO4+H2O
FeSO4
(4)请你设计一种方案,从Cu、Fe混合物中分离得到金属Cu_________________________________________________________________________。
(5)写出铜在生活中的一种用途_______________。
将Cu、Fe混
合物加入足量稀硫酸中,充分反应后过滤、洗涤、干燥得到Cu(合理即可)
作导线(合理即可)
12. 废旧金属可回收利用,某化学兴趣小组用合金废料(含Fe、Cu、Al)制取FeSO4溶液并回收金属铜,实验流程如图所示(部分生成物已略去)。
已知:2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑,Fe和Cu不与氢氧化钠溶液反应。
(1)铁的金属活动性比铜___(填“强”或“弱”)。
强
(2)操作Ⅰ中玻璃棒的作用是_____。
(3)步骤B中发生反应的化学方程式为________________________。
(4)除上述步骤外,请再写出一条保护金属的途径_________________________________________。
引流
Fe+H2SO4=== FeSO4+H2↑
防止金属锈蚀(或寻找
金属代用品等合理即可)
13. 某化工厂用废硫酸制备硫酸钾的流程如下,请回答下列问题。
已知:氨气极易溶于水、CO2能溶于水。
(1)请结合氨气、二氧化碳的性质分析,进行步骤②时应________(填“先通氨气”或“先通二氧化碳”)。
先通氨气
(2)步骤③中发生反应的化学方程式为_____________________________________;洗涤步骤③中所得晶体时不用水而用饱和K2SO4溶液的目的是_______________。
(NH4)2SO4+2KCl=== K2SO4↓+
减少K2SO4的溶解
2NH4Cl
(3)该过程中使用CaSO4悬浊液而不用CaSO4溶液的原因是________________________________________。
硫酸钙微溶于
水,用悬浊液能增加反应物的量
(4)已知步骤②中发生的反应有水参与,写出该反应的化学方程式______
________________________________________。
(5)工艺流程中体现“绿色化学”理念的设计是___________________________。
CaSO4
+H2O+2NH3+CO2=== CaCO3↓+(NH4)2SO4
利用废硫酸生产制备(合理即可)
14. 海洋中有丰富的水生生物和化学资源。海水晒盐后,以其母液(卤水)和贝壳为原料,还可生产具有特殊用途的材料——纳米氧化镁,其简要流程如下:
贝壳煅烧后产物为CaO(生石灰)和CO2
生石灰(CaO)加水变为石灰乳[Ca(OH)2]
Ca(OH)2和卤水中MgCl2反应生成Mg(OH)2沉淀和CaCl2溶液
海水资源的利用)
(1)海水晒盐是_____(填“物理”或“化学”)变化,包括蒸发、____等过程。
(2)写出食盐的一种用途:____________。
(3)A步骤反应的化学方程式是_________________________。
(4)实验室进行a操作时,需要的玻璃仪器有烧杯、漏斗、________。
物理
结晶
可做调味品
玻璃棒
CaCO3 CaO+CO2↑
15. 如图是以海水(主要含有MgCl2、泥沙等杂质)为原料制取氢氧化钠溶液的实验流程:
(1)从海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是________________________________。
氯化钠的溶解度受温度影响变化不大
(2)除去氯化镁应选用的试剂是__________。
(3)蒸发浓缩过程中,溶液中NaCl的溶质质量分数____(填“增大”“减小”或“不变”)。
(4)电解饱和氯化钠溶液时发生反应的化学方程式为___________________________________。
NaOH溶液
增大
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
16. (2021合肥瑶海区二模改编)海水是一个巨大的资源宝库。如图是利用海水获取多种化学物质的流程图,请回答下列问题:
(1)在海水资源的利用中涉及溶解、过滤和蒸发等操作,实验室进行这些操作时均用到的玻璃仪器是_______。
玻璃棒
(2)反应②有NaCl生成,对应的化学反应方程式为________________________,该反应的基本类型为________。
(3)反应①②③中有元素化合价发生改变的是_______(填序号)。
2NaBr+Cl2===2NaCl
+Br2
置换反应
①②③
石灰石工业流程
17. (2021北京改编)真空热还原生产钙的主要转化过程如下(已知钙极易在空气中被氧化):
(1)石灰石属于_______(填“纯净物”或“混合物”)。
(2)步骤Ⅱ中发生反应的化学方程式为______________________________;该步骤反应必须在真空条件下进行的原因是____________________。
(3)结晶得到的钙可铸成钙锭,说明金属具有____性。
混合物
3CaO+2Al 3Ca↑+Al2O3
防止钙在空气中被氧化
延展
18. (2021合肥包河区二模改编)轻质碳酸钙广泛应用于橡胶、塑料以及造纸等行业,某同学在实验室以石灰石(杂质不反应也不溶于水)为原料制取轻质碳酸钙和氢氧化钠固体,设计流程如下:
(1)该流程中发生分解反应的步骤是___(填序号)。
(2)步骤②为_____(填“吸热”或“放热”)反应。
①
放热
(3)已知碳酸钙、二氧化碳和水能反应生成易溶于水的碳酸氢钙,则步骤③中应注意的操作事项是_______________________________。
(4)步骤④中发生反应的化学方程式为_____________________________________。
控制通入二氧化碳的量,防止过量
Ca(OH)2+Na2CO3=== CaCO3↓+
2NaOH
(5)检验步骤④得到的NaOH溶液中是否含有Na2CO3的方法是______________________________________________________________________________________。
(6)得到的氢氧化钠固体在保存时应注意的事项是________。
取少许步骤
④得到的溶液于试管中,滴加适量的氯化钡溶液,观察是否有白色沉淀
生成(合理即可)
密封保存
能源的利用
19. 甲醇是重要的液体燃料,通过“煤液化”技术用煤炭和水制取甲醇(CH3OH)的主要流程如下:
(1)混合气体通过冷却器后,分子间的间隔____(填“增大”或“减小”)。
减小
(2)该流程中涉及到的氧化物有___种。
(3)合成塔中CO和H2在高温高压、催化剂的作用下生成甲醇,据此写出
反应的化学方程式_______________________。
两
CO+2H2 CH3OH
(4)通过“煤液化”技术将煤炭转化为甲醇的优点是_________________________________________。
减少大气污染物的排放
(或提高了能源的利用率)
20. 甲烷不仅能用作燃料,也是制尿素[CO(NH2)2]的原料。如图是利用甲烷制尿素的主要流程,回答下列问题:
(1)步骤1中发生反应的化学方程式为__________________________。
CH4+2H2O CO2+4H2
(2)步骤2中的氮气是通过分离液态空气得到的,该过程中发生的是_____(填“物理”或“化学”)变化。
(3)写出产物尿素的一种用途_______。
(4)16 t 甲烷经过一系列化学反应后最多制得尿素___t(假设每一步化学反应中反应物和生成物都没有损耗)。
物理
作氮肥
60
拓展类型
21. (2021贵港改编)“太阳能光伏发电”能有效推进“碳中和”,发展“低碳经济”,其关键的材料是高纯硅。以下是利用石英砂(主要成分是SiO2)制取高纯硅的简易流程,回答下列问题:
(1)“精馏”是蒸馏的一种,其原理是利用混合物各成分的_____不同,将物质分离出来。
(2)上述流程中可循环使用的物质是____。
沸点
HCl
(3)流程⑤中发生反应的化学方程式为________________________。
(4)反应⑤中利用的是氢气的还原性,请再写出氢气的一条化学性质______。
SiHCl3+H2 Si+3HCl
可燃性
22. (2021德阳)为探究某化工厂固体废物的成分,以便回收有用物质,除掉有害物质。已知固体废物的主要成分是NaCl,还可能含有Na2CO3、K2SO4、NH4NO3、MgSO4、FeCl3,通过以下探究回答下列问题。
(1)气体乙的化学式为____。
CO2
(2)无色溶液A中存在的阴离子有______________________。
(3)反应生成气体甲的化学方程式为_______________________________________。
Cl-、OH-、 、
NH4NO3+NaOH NaNO3+NH3↑
+H2O
(4)原固体废物中一定存在的物质有________________________。
NaCl、Na2CO3和 NH4NO3
同课章节目录
