2022年化学中考备考复习 流程图题精讲课件---工艺流程图题(三)(课件50页)
文档属性
| 名称 | 2022年化学中考备考复习 流程图题精讲课件---工艺流程图题(三)(课件50页) |  | |
| 格式 | zip | ||
| 文件大小 | 718.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 09:51:28 | ||
图片预览







文档简介
(共50张PPT)
2022年化学中考备考复习 流程图题精讲课件
---工艺流程图题(三)(适合湖北省)
专题综合训练
2
专题精讲
1
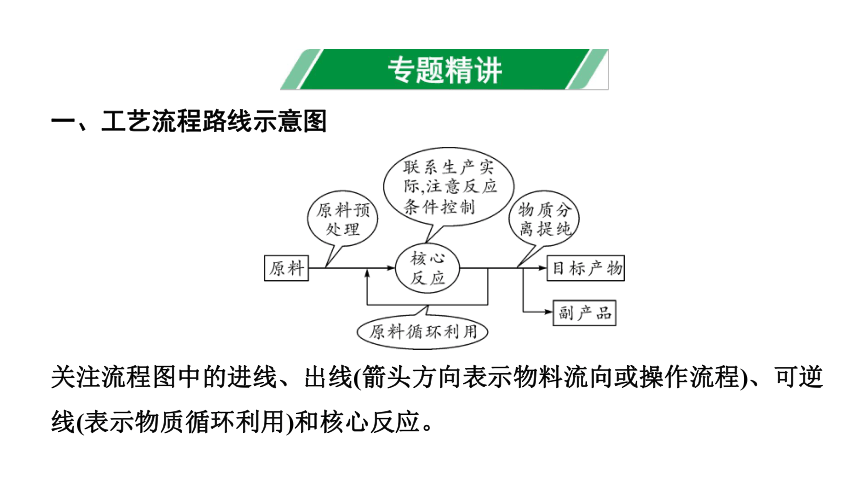
一、工艺流程路线示意图
关注流程图中的进线、出线(箭头方向表示物料流向或操作流程)、可逆线(表示物质循环利用)和核心反应。
二、常考知识点
1. 对原料进行预处理的常用方法及其目的
(1)粉碎(研磨):_________________________________________________。
(2)搅拌:________________________________。
(3)酸浸:溶解金属、金属氧化物、难溶性碱或碳酸盐等。
(4)灼烧(煅烧):使固体或杂质在高温条件下分解,使反应充分进行或增大转化率。
增大反应物间的接触面积,加快反应速率,使反应更充分
使反应物充分接触,加快反应速率
2. 流程中反应条件的控制
(1)调节pH的目的:使反应发生或避免某反应的发生。
(2)温度控制的目的:防止某种物质温度过高时分解。
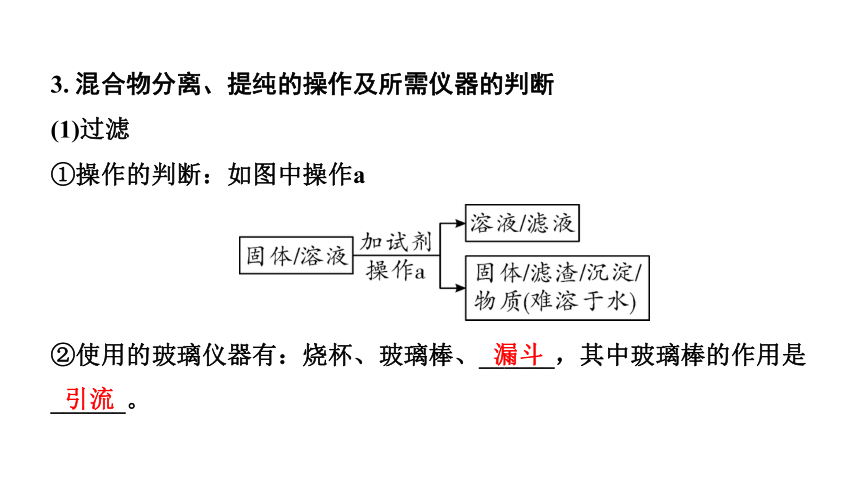
3. 混合物分离、提纯的操作及所需仪器的判断
(1)过滤
①操作的判断:如图中操作a
②使用的玻璃仪器有:烧杯、玻璃棒、______,其中玻璃棒的作用是______。
漏斗
引流
(2)蒸发
①操作的判断:如图中操作b
②使用的仪器有:酒精灯、玻璃棒、坩埚钳、铁架台(带铁圈)、_______,其中玻璃棒的作用是_______________________________________。
(3)结晶
①蒸发结晶:适用溶解度受温度影响变化不大的物质;
②降温结晶:适用溶解度受温度影响变化较大的物质。
蒸发皿
搅拌,防止因局部温度过高,造成液滴飞溅
4. 物质成分分析
从上一步操作中反应物可能发生的反应或题干所给信息入手进行分析。反应的生成物一定有,同时为了增大原料转化率,所用的试剂往往过量,过量的试剂留在滤液或滤渣中。如:
镁矿石的主要成分为MgCO3、SiO2,滤液b中的溶质是_______________
(填化学式)。
MgSO4、H2SO4
5. 化学方程式的书写
(1)已学化学方程式的书写:根据题目要求及箭头方向在流程图中找到反应物、生成物,根据所学知识判断其可能发生的反应,写出化学方程式。
(2)陌生化学方程式的书写:根据箭头方向,箭头进入的是反应物,出去的是生成物(包括主产物和副产物)。根据反应物及生成物书写化学方程式,同时注意标明反应条件及生成物状态。
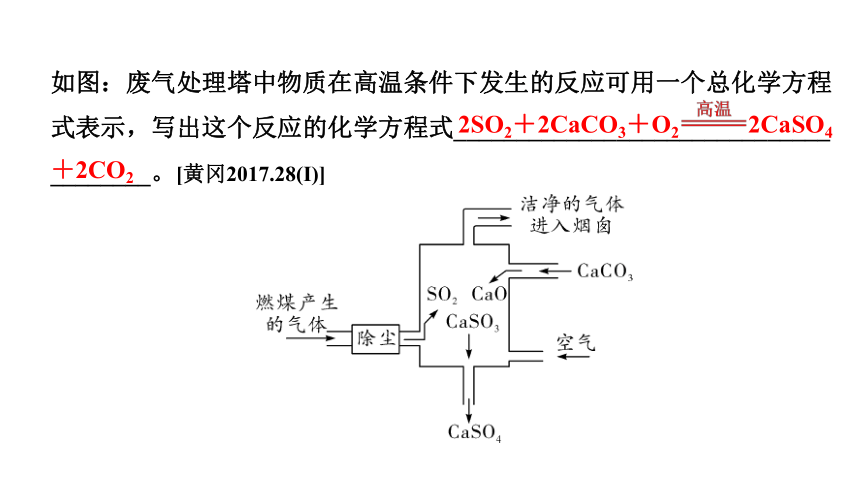
如图:废气处理塔中物质在高温条件下发生的反应可用一个总化学方程式表示,写出这个反应的化学方程式______________________________
________。[黄冈2017.28(I)]
2SO2+2CaCO3+O2 2CaSO4+2CO2
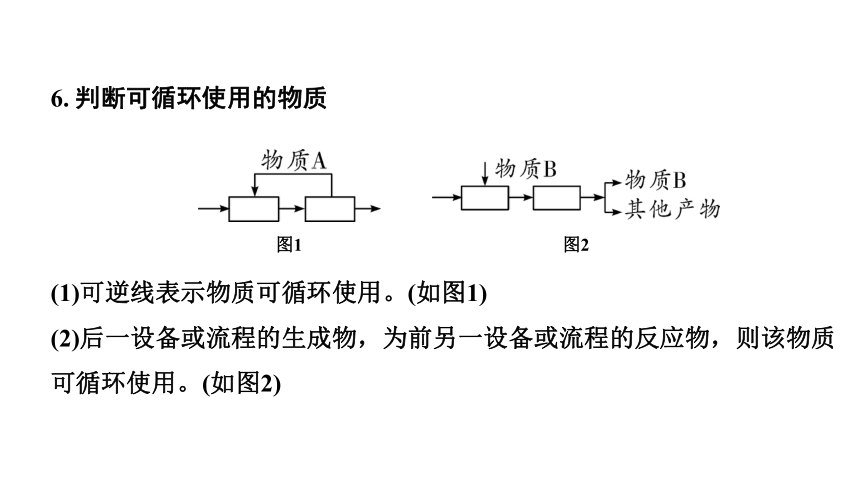
6. 判断可循环使用的物质
(1)可逆线表示物质可循环使用。(如图1)
(2)后一设备或流程的生成物,为前另一设备或流程的反应物,则该物质可循环使用。(如图2)
图2
图1
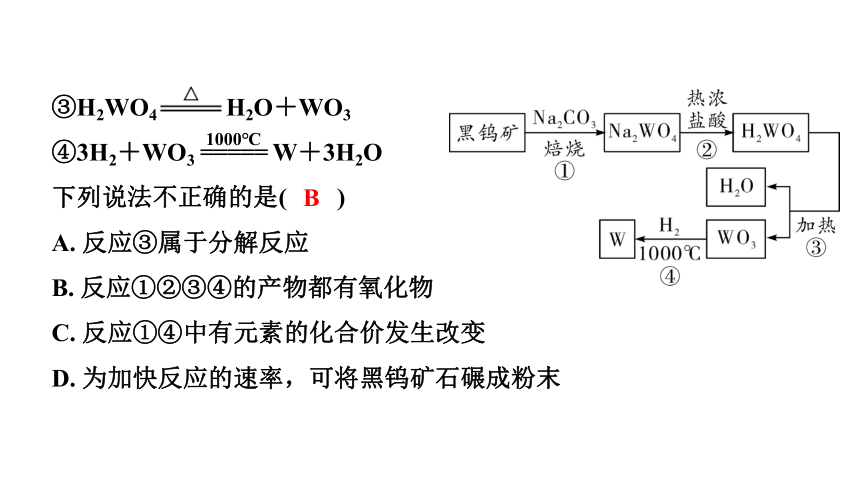
1. (黄冈)金属钨(W)可做白炽灯泡的灯丝。用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得金属钨(W)的工艺流程如下图所示:
其主要反应原理如下:
①4FeWO4+4Na2CO3+O2
4Na2WO4+2Fe2O3+4CO2
②Na2WO4+2HCl(热浓) ===
H2WO4+2NaCl
金属资源的回收及利用
B
③H2WO4 H2O+WO3
④3H2+WO3 ===== W+3H2O
下列说法不正确的是( )
A. 反应③属于分解反应
B. 反应①②③④的产物都有氧化物
C. 反应①④中有元素的化合价发生改变
D. 为加快反应的速率,可将黑钨矿石碾成粉末
1000℃
2. (2020咸宁)某硫酸厂以黄铁矿(主要成分是FeS2)为主要原料,生产硫酸的简要流程图如下:
(1)写出流程图中硫的一种氧化物名称:___________________。
(2)催化反应室中发生的是化合反应,写出该反应的化学方程式:
____________________。
二氧化硫(三氧化硫)
2SO2+O2 2SO3
(3)实验室里稀释浓硫酸的方法是:把__________________________,并不断搅拌。
(4)沸腾炉中的炉渣(Fe2O3)可用于炼铁,写出用一氧化碳和炉渣炼铁的化学方程式:____________________________。
浓硫酸沿器壁慢慢注入水中
3CO+Fe2O3 2Fe+3CO
(5)排放的废气中含有SO2,为实现“变废为宝”,该硫酸厂脱硫工艺的主要反应是2SO2+2CaO+O2 ======= 2CaSO4,该反应前后化合价升高的元素是____________。
一定条件
S(或硫元素)
3. (咸宁)某种手机电路板中含有Fe、Cu、Au、Ag、Ni(镍,银白色金属)等金属,如图是某工厂回收部分金属的流程图。已知:2Cu+O2+2H2SO4 2CuSO4+2H2O。
(1)操作①的名称是_____。
(2)写出滤液②中金属阳离子
符号_____。
过滤
Fe2+
(3)写出滤液③和铁粉发生反应的一个化学方程式____________________
__________________________________。
(4)Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是___________。
CuSO4+Fe === Cu+
FeSO4(或Fe+H2SO4 === FeSO4+H2↑)
Ni>Cu>Ag
4. (2021黄石)以黄铜矿(主要成分为CuFeS2)为原料,采用生物炼铜是现
代炼铜的新工艺,同时还可以获得绿矾(FeSO4·7H2O),流程如下:
(1)步骤①中的化学方程式:4CuFeS2+17O2+2H2SO4 ======== 4CuSO4+2Fe2(SO4)3+_______。
耐酸铜细菌
2H2O
(2)步骤②中的反应有两个:反应一是Fe+Fe2(SO4)3 === 3FeSO4,该反应属于________(填基本反应类型),反应二的化学方程式为___________
________________。
(3)加入的A是_______(填化学式)。
(4)获得绿矾的“一系列操作”为:
蒸发浓缩、_________、过滤等。
化合反应
Fe+CuSO4
=== FeSO4+Cu
H2SO4
降温结晶
5. (2020黄石)为了从某废旧电子产品提炼贵重金属,得到硫酸铜溶液,小军所在的学习小组设计了如下流程:
(1)废旧电子产品属于_________(填“厨余垃圾”“可回收物”或“有害垃圾”)。
可回收物
(2)②中发生反应的基本类型为_________,滤液中存在的金属阳离子有_____、_____(填离子符号)。
(3)滤渣Ⅱ中的贵重金属为_________。
(4)写出④中发生反应的化学方程式_____________________________。
置换反应
Al3+
Fe2+
金(或Au)
CuO+H2SO4 === CuSO4+H2O
6. (2021济宁)铝在地壳中主要以铝土矿的形式存在,铝土矿的主要成分为Al2O3(含有少量Fe2O3、SiO2等杂质)。工业上冶炼铝的工艺流程见下图:
(1)铝土矿中的SiO2不溶于水,也不与
盐酸反应,操作①的目的是_________。
(2)操作③得到的Al(OH)3受热分解生
成Al2O3,该反应的化学方程式为
___________________________,铝土
矿经过操作①~④的目的是_________
________。
除去SiO2
2Al(OH)3 Al2O3+3H2O
得到纯净
的Al2O3
(3)在冰晶石作助熔剂条件下,高温电解Al2O3得到金属铝,该反应的化
学方程式为
___________________________。
2Al2O3 ======== 4Al + 3O2↑
高温通电
冰晶石
7. 可充电锂离子电池是手机、笔记本电脑等现代数码产品中应用最广泛的电池。锂离子电池正极材料是将LiMn2O4、碳粉等涂覆在铝箔上制成的。回收废旧锂离子电池正极材
料,获得制取碳酸锂的流程如下,
根据流程回答问题:
已知:铝能与氢氧化钠溶液反应
生成可溶于水的偏铝酸钠。
(1)操作Ⅰ、Ⅱ、Ⅲ中,所用的玻璃仪器是___________________。
(2)反应①中过量A溶液的溶质为_______(填化学式)。
(3)已知反应③属于复分解反应,则该反应的化学方程式为____________________________
__________。
玻璃棒、烧杯、漏斗
NaOH
Li2SO4+Na2CO3 === Li2CO3↓
+Na2SO4
8. (2021江西)江西赣州被誉为“世界钨都”,钨(W)是一种重要的战略资源。下图是一种生产钨的工业流程:
已知:白钨矿的主要成分是钨酸钙(CaWO4),还含有CaO、SiO2等;
碳在高温条件下会与金属钨反应生成碳化钨。
(1)操作1中粉碎白钨矿的目的是___________________________________
_________________。
(2)操作2所得滤液中一定含有的阳离子是_____、_____。
增大反应物间的接触面积,加快反应速
率,使其充分反应
Ca2+
H+
(3)流程中氨水(NH3·H2O)和H2WO4反应生成(NH4)2WO4的化学方程式为________________________________________。
(4)用氢气还原WO3可获得高纯度的钨,此处不宜用焦炭代替氢气的原因是__________________________________________________________。
2NH3·H2O+H2WO4 === (NH4)2WO4+2H2O
不易获得高纯度的金属钨(或会引入碳杂质、会生成杂质碳化钨等)
9. (2021泰安)某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如图所示:
(1)工厂废液中加入过量A反应的化学方程式为_______________________。
(2)用化学式表示固体甲的成分________。
(3)溶液甲中的金属离子是___________(用离子符号表示)。
(4)完成步骤④的化学方程式:4Fe(OH)2+O2+2_____=== 4Fe(OH)3。
Fe+CuCl2 === FeCl2+Cu
Fe、Cu
Na+、Fe2+
H2O
(5)检验溶液乙中含有盐酸的实验方案是___________________________
_______________________(写一种)。
(6)写出步骤③发生反应的化学
方程式_____________________
_________________。
(7)反应⑤属于_________(填基
本反应类型)。
取少量溶液乙于试管中,加入碳酸钠溶液,有气泡产生
FeCl2+2NaOH ===
Fe(OH)2↓+2NaCl
分解反应
10. (2021黄冈、孝感、咸宁改编)煤燃烧时产生的粉煤灰(主要成分为Al2O3、SiO2及少量Fe2O3等)也是一种可利用的资源。以粉煤灰为原料制取Al2O3的部分工艺流程如下:
【资料】①SiO2既不溶于水也
溶于酸
②煅烧时发生的反应为:
2AlCl3·6H2O Al2O3+6HCl+9H2O
三废处理流程
(1)操作Ⅰ中玻璃棒的作用是______。
(2)写出“酸浸”步骤中盐酸与Al2O3发生反应的化学方程式_____________
__________________。
Al2O3+6HCl
=== 2AlCl3+3H2O
引流
(3)“除铁”时发生的反应为FeCl3+3NH4HCO3 === 3NH4Cl+X↓+3CO2↑,X的化学式为_________。
(4)流程中可循环利用的物质为_____。
(5)高温烧结的Al2O3,又称人造刚玉,
可用于制机械轴承、耐高温坩埚、高
强度陶瓷等。由此可推知Al2O3的性
质为_______________________(任写
一种)。
Fe(OH)3
盐酸
强度高(或耐磨、耐高温)
11. (2021云南省卷)“垃圾是放错的资源”。碘循环工艺不仅能吸收SO2,减少环境污染,而且还可以得到仅含一种元素的化工原料X,流程如下:
(1)流程中可循环利用的物质是________。
(2)膜反应器中发生的是分解反应,
X的化学式是____。
(3)反应器中发生反应的化学方程式为
___________________________________。
碘(或I2)
H2
SO2+I2+2H2O ======== H2SO4+2HI
20~100℃
(4)反应器中的物质属于氧化物的有___________。
(5)反应器中反应前后化合价发生变化的元素有碘和____。
(6)若用此工艺处理工厂排放的尾气,尾气中SO2的质量分数为10%,若吸收该尾气80 t,理论上能够生产硫酸的质量为_______t。
SO2、H2O
硫
12.25
12. (恩施州节选)今年春节期间播出的《舌尖3》,让籍籍无名的章丘铁锅名声大振,章丘手工铁锅制造需要历经十二道工序,再过十八遍火候,一千度高温锤炼,经受三万六千次锻打,其炉渣中主要含FeO、Fe2O3,还有一定量既不溶于水,也不与稀酸反应的杂质。现按如图工艺流程,用炉渣制备绿矾(FeSO4·7H2O)。请按要求回答问题:
查阅资料:氧化亚铁与稀硫酸、铁与硫酸铁反应均可生成硫酸亚铁。
(1)步骤一中,发生反应的化学方程式为___________________________、__________________________________。
(2)为提高步骤一的反应速率,可采取的措施有增大硫酸的浓度、升高反应物的温度、还可以采取___________(写一条,不考虑“搅拌”和“使用催化剂”)。
FeO+H2SO4 === FeSO4+H2O
Fe2O3+3H2SO4 === Fe2(SO4)3+3H2O
将炉渣粉碎
(3)步骤二中无气体生成的化学反应方程式为________________________,测得滤液2的pH明显大于滤液1,其原因是_________________________
_____________。
Fe+Fe2(SO4)3 === 3FeSO4
铁消耗了大量的硫酸,导致溶液酸性减弱
(4)某化学兴趣小组在实验室中利用该炉渣按照上述工艺流程制取绿矾。现取100 g炉渣,得到干燥杂质5 g,步骤二中加入15.6 g铁粉,得到滤渣5.6 g。要计算理论上制得绿矾的质量,除要利用上述给定的全部数据外,在实验过程中,还需测定的一个数据是___________。
氢气的质量
13. (黄冈)Si是重要的半导体材料,半导体工业中有一句行话“从沙滩到用户”,指的是利用砂子(主要成分SiO2)制取高纯度的Si,已知硅与碳有相似的化学性质,SiHCl3(三氯氢硅)能与水反应,其工艺流程和主要化学反应如下:
工业产品的制备
①2C+SiO2 Si(不纯)+2CO↑
②3HCl+Si(不纯) ========= SiHCl3+H2
③SiHCl3+H2 ====== 3HCl+Si(高纯)
下列说法不正确的是( )
A. ①的目的是将二氧化硅转化成单质硅
B. 物质A可循环利用
C. 整个制备过程必须达到
无水无氧
D. 反应③中SiHCl3是还原剂
200~300℃
1084℃
D
14. (咸宁改编)无水氯化钙的用途广泛。以石灰石矿粉(含有MgSO4、Fe2O3、SiO2等杂质)为原料,生产无水氯化钙的流程如下:
(1)操作A的名称_________。
(2)写出滤液1中含有的所有
金属阳离子的符号_______
___________。
蒸发结晶
Mg2+、
Fe3+、Ca2+
(3)滤渣3中的固体除有Ca(OH)2外,还有__________________(写化学式)。
(4)对滤液3调节pH值时发生反应的化学方程式为____________________
______________。
Mg(OH)2和Fe(OH)3
Ca(OH)2+2HCl ===
CaCl2+2H2O
15. Co2O3可用作釉料、颜料、催化剂等,如图是利用某含钴原料(主要成分为Co2O3,其余成分不溶于水也不与酸反应)制取Co2O3的工艺流程。
(1)Co2O3中钴元素的化合价为____。
(2)若经操作a得到的CoSO4溶液仍浑浊,可能的原因是_________。
+3
滤纸破损
(3)步骤②中加入(NH4)2C2O4发生复分解反应的化学方程式为__________
__________________________________。
(4)步骤③中的另一种产物是常见的温室气体,则该气体的化学式为_____。
CoSO4 + (NH4)2C2O4 === CoC2O4↓+(NH4)2SO4
CO2
16. (2021岳阳)84消毒液(主要成分是NaClO)是一种常用的环境消毒剂, 某同学用粗盐(含CaCl2、MgCl2、Na2SO4、 泥沙等杂质)制84消毒液的流程如下:
(1)操作①的名称是______。
(2)溶液E中加入适量稀盐酸
的目的是________________
__________________。
过滤
除去过量的NaOH
溶液和Na2CO3溶液
(3) NaCl溶液通电时生成Cl2 (黄绿色气体)、H2和NaOH的化学方程式为_____________________________________。
(4) NaClO溶液能与空气中的CO2反应而变质,所以84消毒液应_____储存。
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
密封
17. (2021广西北部湾经济区)某工厂生产高锰酸钾的流程如下图所示。请回答下列问题:
(1)“混合加热室”发生的主要是_________
(填“物理变化”或“化学变化”)。
(2)“电解室”反应中,反应前后化合价发生
变化的元素有________(写元素符号)。
物理变化
Mn、H
(3)生产流程中可循环利用的物质是______(写化学式)。
(4)写出氧化室中发生反应的化学方程式:_____________________________________。
(5)取47.4 g高锰酸钾,加热一段时间后
停止,共收集到3.2 g氧气。计算剩余
固体中氧元素的质量分数是_______
(计算结果保留到0.1%)。
KOH
4KOH+2MnO2+O2 2K2MnO4+2H2O
36.2%
2022年化学中考备考复习 流程图题精讲课件
---工艺流程图题(三)(适合湖北省)
专题综合训练
2
专题精讲
1
一、工艺流程路线示意图
关注流程图中的进线、出线(箭头方向表示物料流向或操作流程)、可逆线(表示物质循环利用)和核心反应。
二、常考知识点
1. 对原料进行预处理的常用方法及其目的
(1)粉碎(研磨):_________________________________________________。
(2)搅拌:________________________________。
(3)酸浸:溶解金属、金属氧化物、难溶性碱或碳酸盐等。
(4)灼烧(煅烧):使固体或杂质在高温条件下分解,使反应充分进行或增大转化率。
增大反应物间的接触面积,加快反应速率,使反应更充分
使反应物充分接触,加快反应速率
2. 流程中反应条件的控制
(1)调节pH的目的:使反应发生或避免某反应的发生。
(2)温度控制的目的:防止某种物质温度过高时分解。
3. 混合物分离、提纯的操作及所需仪器的判断
(1)过滤
①操作的判断:如图中操作a
②使用的玻璃仪器有:烧杯、玻璃棒、______,其中玻璃棒的作用是______。
漏斗
引流
(2)蒸发
①操作的判断:如图中操作b
②使用的仪器有:酒精灯、玻璃棒、坩埚钳、铁架台(带铁圈)、_______,其中玻璃棒的作用是_______________________________________。
(3)结晶
①蒸发结晶:适用溶解度受温度影响变化不大的物质;
②降温结晶:适用溶解度受温度影响变化较大的物质。
蒸发皿
搅拌,防止因局部温度过高,造成液滴飞溅
4. 物质成分分析
从上一步操作中反应物可能发生的反应或题干所给信息入手进行分析。反应的生成物一定有,同时为了增大原料转化率,所用的试剂往往过量,过量的试剂留在滤液或滤渣中。如:
镁矿石的主要成分为MgCO3、SiO2,滤液b中的溶质是_______________
(填化学式)。
MgSO4、H2SO4
5. 化学方程式的书写
(1)已学化学方程式的书写:根据题目要求及箭头方向在流程图中找到反应物、生成物,根据所学知识判断其可能发生的反应,写出化学方程式。
(2)陌生化学方程式的书写:根据箭头方向,箭头进入的是反应物,出去的是生成物(包括主产物和副产物)。根据反应物及生成物书写化学方程式,同时注意标明反应条件及生成物状态。
如图:废气处理塔中物质在高温条件下发生的反应可用一个总化学方程式表示,写出这个反应的化学方程式______________________________
________。[黄冈2017.28(I)]
2SO2+2CaCO3+O2 2CaSO4+2CO2
6. 判断可循环使用的物质
(1)可逆线表示物质可循环使用。(如图1)
(2)后一设备或流程的生成物,为前另一设备或流程的反应物,则该物质可循环使用。(如图2)
图2
图1
1. (黄冈)金属钨(W)可做白炽灯泡的灯丝。用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得金属钨(W)的工艺流程如下图所示:
其主要反应原理如下:
①4FeWO4+4Na2CO3+O2
4Na2WO4+2Fe2O3+4CO2
②Na2WO4+2HCl(热浓) ===
H2WO4+2NaCl
金属资源的回收及利用
B
③H2WO4 H2O+WO3
④3H2+WO3 ===== W+3H2O
下列说法不正确的是( )
A. 反应③属于分解反应
B. 反应①②③④的产物都有氧化物
C. 反应①④中有元素的化合价发生改变
D. 为加快反应的速率,可将黑钨矿石碾成粉末
1000℃
2. (2020咸宁)某硫酸厂以黄铁矿(主要成分是FeS2)为主要原料,生产硫酸的简要流程图如下:
(1)写出流程图中硫的一种氧化物名称:___________________。
(2)催化反应室中发生的是化合反应,写出该反应的化学方程式:
____________________。
二氧化硫(三氧化硫)
2SO2+O2 2SO3
(3)实验室里稀释浓硫酸的方法是:把__________________________,并不断搅拌。
(4)沸腾炉中的炉渣(Fe2O3)可用于炼铁,写出用一氧化碳和炉渣炼铁的化学方程式:____________________________。
浓硫酸沿器壁慢慢注入水中
3CO+Fe2O3 2Fe+3CO
(5)排放的废气中含有SO2,为实现“变废为宝”,该硫酸厂脱硫工艺的主要反应是2SO2+2CaO+O2 ======= 2CaSO4,该反应前后化合价升高的元素是____________。
一定条件
S(或硫元素)
3. (咸宁)某种手机电路板中含有Fe、Cu、Au、Ag、Ni(镍,银白色金属)等金属,如图是某工厂回收部分金属的流程图。已知:2Cu+O2+2H2SO4 2CuSO4+2H2O。
(1)操作①的名称是_____。
(2)写出滤液②中金属阳离子
符号_____。
过滤
Fe2+
(3)写出滤液③和铁粉发生反应的一个化学方程式____________________
__________________________________。
(4)Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是___________。
CuSO4+Fe === Cu+
FeSO4(或Fe+H2SO4 === FeSO4+H2↑)
Ni>Cu>Ag
4. (2021黄石)以黄铜矿(主要成分为CuFeS2)为原料,采用生物炼铜是现
代炼铜的新工艺,同时还可以获得绿矾(FeSO4·7H2O),流程如下:
(1)步骤①中的化学方程式:4CuFeS2+17O2+2H2SO4 ======== 4CuSO4+2Fe2(SO4)3+_______。
耐酸铜细菌
2H2O
(2)步骤②中的反应有两个:反应一是Fe+Fe2(SO4)3 === 3FeSO4,该反应属于________(填基本反应类型),反应二的化学方程式为___________
________________。
(3)加入的A是_______(填化学式)。
(4)获得绿矾的“一系列操作”为:
蒸发浓缩、_________、过滤等。
化合反应
Fe+CuSO4
=== FeSO4+Cu
H2SO4
降温结晶
5. (2020黄石)为了从某废旧电子产品提炼贵重金属,得到硫酸铜溶液,小军所在的学习小组设计了如下流程:
(1)废旧电子产品属于_________(填“厨余垃圾”“可回收物”或“有害垃圾”)。
可回收物
(2)②中发生反应的基本类型为_________,滤液中存在的金属阳离子有_____、_____(填离子符号)。
(3)滤渣Ⅱ中的贵重金属为_________。
(4)写出④中发生反应的化学方程式_____________________________。
置换反应
Al3+
Fe2+
金(或Au)
CuO+H2SO4 === CuSO4+H2O
6. (2021济宁)铝在地壳中主要以铝土矿的形式存在,铝土矿的主要成分为Al2O3(含有少量Fe2O3、SiO2等杂质)。工业上冶炼铝的工艺流程见下图:
(1)铝土矿中的SiO2不溶于水,也不与
盐酸反应,操作①的目的是_________。
(2)操作③得到的Al(OH)3受热分解生
成Al2O3,该反应的化学方程式为
___________________________,铝土
矿经过操作①~④的目的是_________
________。
除去SiO2
2Al(OH)3 Al2O3+3H2O
得到纯净
的Al2O3
(3)在冰晶石作助熔剂条件下,高温电解Al2O3得到金属铝,该反应的化
学方程式为
___________________________。
2Al2O3 ======== 4Al + 3O2↑
高温通电
冰晶石
7. 可充电锂离子电池是手机、笔记本电脑等现代数码产品中应用最广泛的电池。锂离子电池正极材料是将LiMn2O4、碳粉等涂覆在铝箔上制成的。回收废旧锂离子电池正极材
料,获得制取碳酸锂的流程如下,
根据流程回答问题:
已知:铝能与氢氧化钠溶液反应
生成可溶于水的偏铝酸钠。
(1)操作Ⅰ、Ⅱ、Ⅲ中,所用的玻璃仪器是___________________。
(2)反应①中过量A溶液的溶质为_______(填化学式)。
(3)已知反应③属于复分解反应,则该反应的化学方程式为____________________________
__________。
玻璃棒、烧杯、漏斗
NaOH
Li2SO4+Na2CO3 === Li2CO3↓
+Na2SO4
8. (2021江西)江西赣州被誉为“世界钨都”,钨(W)是一种重要的战略资源。下图是一种生产钨的工业流程:
已知:白钨矿的主要成分是钨酸钙(CaWO4),还含有CaO、SiO2等;
碳在高温条件下会与金属钨反应生成碳化钨。
(1)操作1中粉碎白钨矿的目的是___________________________________
_________________。
(2)操作2所得滤液中一定含有的阳离子是_____、_____。
增大反应物间的接触面积,加快反应速
率,使其充分反应
Ca2+
H+
(3)流程中氨水(NH3·H2O)和H2WO4反应生成(NH4)2WO4的化学方程式为________________________________________。
(4)用氢气还原WO3可获得高纯度的钨,此处不宜用焦炭代替氢气的原因是__________________________________________________________。
2NH3·H2O+H2WO4 === (NH4)2WO4+2H2O
不易获得高纯度的金属钨(或会引入碳杂质、会生成杂质碳化钨等)
9. (2021泰安)某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如图所示:
(1)工厂废液中加入过量A反应的化学方程式为_______________________。
(2)用化学式表示固体甲的成分________。
(3)溶液甲中的金属离子是___________(用离子符号表示)。
(4)完成步骤④的化学方程式:4Fe(OH)2+O2+2_____=== 4Fe(OH)3。
Fe+CuCl2 === FeCl2+Cu
Fe、Cu
Na+、Fe2+
H2O
(5)检验溶液乙中含有盐酸的实验方案是___________________________
_______________________(写一种)。
(6)写出步骤③发生反应的化学
方程式_____________________
_________________。
(7)反应⑤属于_________(填基
本反应类型)。
取少量溶液乙于试管中,加入碳酸钠溶液,有气泡产生
FeCl2+2NaOH ===
Fe(OH)2↓+2NaCl
分解反应
10. (2021黄冈、孝感、咸宁改编)煤燃烧时产生的粉煤灰(主要成分为Al2O3、SiO2及少量Fe2O3等)也是一种可利用的资源。以粉煤灰为原料制取Al2O3的部分工艺流程如下:
【资料】①SiO2既不溶于水也
溶于酸
②煅烧时发生的反应为:
2AlCl3·6H2O Al2O3+6HCl+9H2O
三废处理流程
(1)操作Ⅰ中玻璃棒的作用是______。
(2)写出“酸浸”步骤中盐酸与Al2O3发生反应的化学方程式_____________
__________________。
Al2O3+6HCl
=== 2AlCl3+3H2O
引流
(3)“除铁”时发生的反应为FeCl3+3NH4HCO3 === 3NH4Cl+X↓+3CO2↑,X的化学式为_________。
(4)流程中可循环利用的物质为_____。
(5)高温烧结的Al2O3,又称人造刚玉,
可用于制机械轴承、耐高温坩埚、高
强度陶瓷等。由此可推知Al2O3的性
质为_______________________(任写
一种)。
Fe(OH)3
盐酸
强度高(或耐磨、耐高温)
11. (2021云南省卷)“垃圾是放错的资源”。碘循环工艺不仅能吸收SO2,减少环境污染,而且还可以得到仅含一种元素的化工原料X,流程如下:
(1)流程中可循环利用的物质是________。
(2)膜反应器中发生的是分解反应,
X的化学式是____。
(3)反应器中发生反应的化学方程式为
___________________________________。
碘(或I2)
H2
SO2+I2+2H2O ======== H2SO4+2HI
20~100℃
(4)反应器中的物质属于氧化物的有___________。
(5)反应器中反应前后化合价发生变化的元素有碘和____。
(6)若用此工艺处理工厂排放的尾气,尾气中SO2的质量分数为10%,若吸收该尾气80 t,理论上能够生产硫酸的质量为_______t。
SO2、H2O
硫
12.25
12. (恩施州节选)今年春节期间播出的《舌尖3》,让籍籍无名的章丘铁锅名声大振,章丘手工铁锅制造需要历经十二道工序,再过十八遍火候,一千度高温锤炼,经受三万六千次锻打,其炉渣中主要含FeO、Fe2O3,还有一定量既不溶于水,也不与稀酸反应的杂质。现按如图工艺流程,用炉渣制备绿矾(FeSO4·7H2O)。请按要求回答问题:
查阅资料:氧化亚铁与稀硫酸、铁与硫酸铁反应均可生成硫酸亚铁。
(1)步骤一中,发生反应的化学方程式为___________________________、__________________________________。
(2)为提高步骤一的反应速率,可采取的措施有增大硫酸的浓度、升高反应物的温度、还可以采取___________(写一条,不考虑“搅拌”和“使用催化剂”)。
FeO+H2SO4 === FeSO4+H2O
Fe2O3+3H2SO4 === Fe2(SO4)3+3H2O
将炉渣粉碎
(3)步骤二中无气体生成的化学反应方程式为________________________,测得滤液2的pH明显大于滤液1,其原因是_________________________
_____________。
Fe+Fe2(SO4)3 === 3FeSO4
铁消耗了大量的硫酸,导致溶液酸性减弱
(4)某化学兴趣小组在实验室中利用该炉渣按照上述工艺流程制取绿矾。现取100 g炉渣,得到干燥杂质5 g,步骤二中加入15.6 g铁粉,得到滤渣5.6 g。要计算理论上制得绿矾的质量,除要利用上述给定的全部数据外,在实验过程中,还需测定的一个数据是___________。
氢气的质量
13. (黄冈)Si是重要的半导体材料,半导体工业中有一句行话“从沙滩到用户”,指的是利用砂子(主要成分SiO2)制取高纯度的Si,已知硅与碳有相似的化学性质,SiHCl3(三氯氢硅)能与水反应,其工艺流程和主要化学反应如下:
工业产品的制备
①2C+SiO2 Si(不纯)+2CO↑
②3HCl+Si(不纯) ========= SiHCl3+H2
③SiHCl3+H2 ====== 3HCl+Si(高纯)
下列说法不正确的是( )
A. ①的目的是将二氧化硅转化成单质硅
B. 物质A可循环利用
C. 整个制备过程必须达到
无水无氧
D. 反应③中SiHCl3是还原剂
200~300℃
1084℃
D
14. (咸宁改编)无水氯化钙的用途广泛。以石灰石矿粉(含有MgSO4、Fe2O3、SiO2等杂质)为原料,生产无水氯化钙的流程如下:
(1)操作A的名称_________。
(2)写出滤液1中含有的所有
金属阳离子的符号_______
___________。
蒸发结晶
Mg2+、
Fe3+、Ca2+
(3)滤渣3中的固体除有Ca(OH)2外,还有__________________(写化学式)。
(4)对滤液3调节pH值时发生反应的化学方程式为____________________
______________。
Mg(OH)2和Fe(OH)3
Ca(OH)2+2HCl ===
CaCl2+2H2O
15. Co2O3可用作釉料、颜料、催化剂等,如图是利用某含钴原料(主要成分为Co2O3,其余成分不溶于水也不与酸反应)制取Co2O3的工艺流程。
(1)Co2O3中钴元素的化合价为____。
(2)若经操作a得到的CoSO4溶液仍浑浊,可能的原因是_________。
+3
滤纸破损
(3)步骤②中加入(NH4)2C2O4发生复分解反应的化学方程式为__________
__________________________________。
(4)步骤③中的另一种产物是常见的温室气体,则该气体的化学式为_____。
CoSO4 + (NH4)2C2O4 === CoC2O4↓+(NH4)2SO4
CO2
16. (2021岳阳)84消毒液(主要成分是NaClO)是一种常用的环境消毒剂, 某同学用粗盐(含CaCl2、MgCl2、Na2SO4、 泥沙等杂质)制84消毒液的流程如下:
(1)操作①的名称是______。
(2)溶液E中加入适量稀盐酸
的目的是________________
__________________。
过滤
除去过量的NaOH
溶液和Na2CO3溶液
(3) NaCl溶液通电时生成Cl2 (黄绿色气体)、H2和NaOH的化学方程式为_____________________________________。
(4) NaClO溶液能与空气中的CO2反应而变质,所以84消毒液应_____储存。
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
密封
17. (2021广西北部湾经济区)某工厂生产高锰酸钾的流程如下图所示。请回答下列问题:
(1)“混合加热室”发生的主要是_________
(填“物理变化”或“化学变化”)。
(2)“电解室”反应中,反应前后化合价发生
变化的元素有________(写元素符号)。
物理变化
Mn、H
(3)生产流程中可循环利用的物质是______(写化学式)。
(4)写出氧化室中发生反应的化学方程式:_____________________________________。
(5)取47.4 g高锰酸钾,加热一段时间后
停止,共收集到3.2 g氧气。计算剩余
固体中氧元素的质量分数是_______
(计算结果保留到0.1%)。
KOH
4KOH+2MnO2+O2 2K2MnO4+2H2O
36.2%
同课章节目录
