2022年化学中考备考复习 流程图题精讲课件---工艺流程图题(四)(课件44页)
文档属性
| 名称 | 2022年化学中考备考复习 流程图题精讲课件---工艺流程图题(四)(课件44页) |  | |
| 格式 | zip | ||
| 文件大小 | 695.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 09:55:13 | ||
图片预览







文档简介
(共44张PPT)
专题突破
1
专题分类训练
2
2022年化学中考备考复习 流程图题精讲课件
---工艺流程图题(四)(适合江苏省)
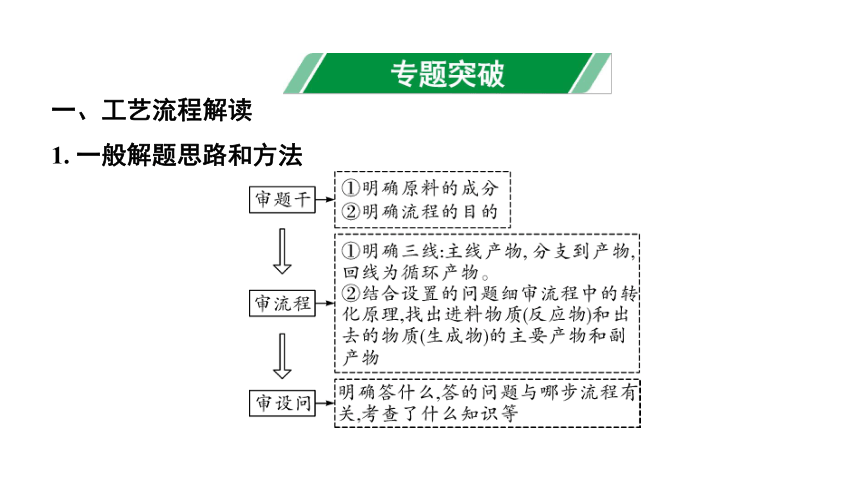
一、工艺流程解读
1. 一般解题思路和方法
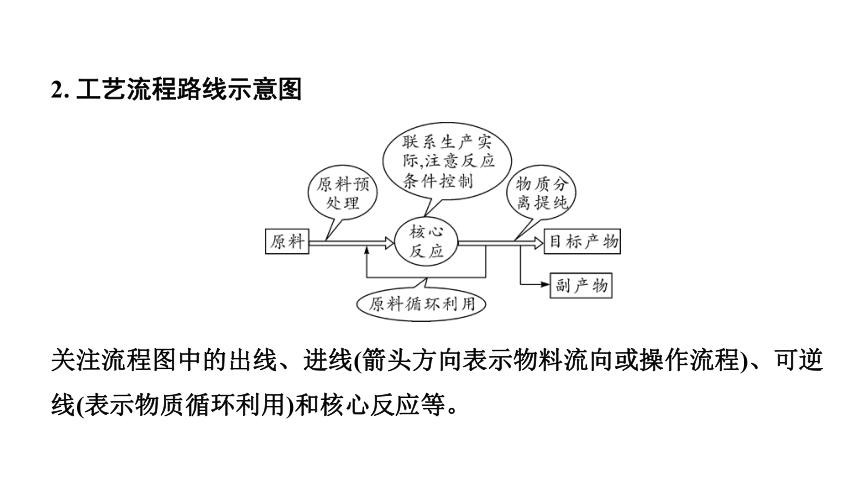
2. 工艺流程路线示意图
关注流程图中的出线、进线(箭头方向表示物料流向或操作流程)、可逆线(表示物质循环利用)和核心反应等。
二、常考内容梳理
1. 操作及目的
(1)粉碎(或研磨):__________________________________。
(2)搅拌:使物质充分接触,加快反应(或溶解)速率。
(3)灼烧(煅烧、焙烧):除去可燃性杂质(或使原料初步转化);杂质高温下氧化、分解。
(4)加入过量试剂:将原物质中的杂质完全反应或全部转化。
增大反应物接触面积,加快反应速率
2. 混合物分离、提纯的操作及所需仪器的判断
(1)过滤(徐州8年2考)
①操作的判断:如图中操作Ⅰ
②过滤操作中使用的玻璃仪器有:烧杯、玻璃棒、______,其中玻璃棒的作用是______。[徐州2020.23(2)]
③过滤后,滤液浑浊的原因可能是________。[徐州2021.23(2)]
漏斗
引流
滤纸破损
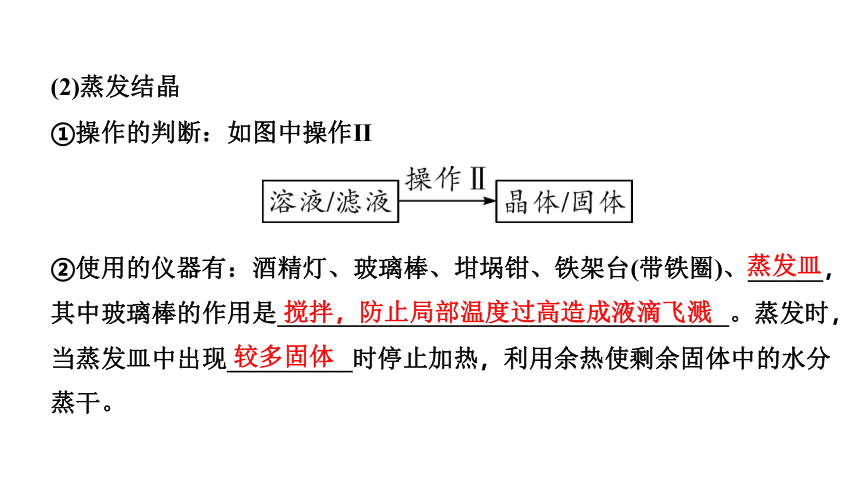
(2)蒸发结晶
①操作的判断:如图中操作Ⅱ
②使用的仪器有:酒精灯、玻璃棒、坩埚钳、铁架台(带铁圈)、______,其中玻璃棒的作用是____________________________________。蒸发时,当蒸发皿中出现__________时停止加热,利用余热使剩余固体中的水分蒸干。
蒸发皿
搅拌,防止局部温度过高造成液滴飞溅
较多固体
3. 物质成分的分析(物质化学式的推断或书写)
(1)判断所加的试剂:从加入试剂的目的、反应的产物入手进行分析。但一定要考虑是否会引入新的杂质或杂质离子。
(2)判断物质成分:从上一步操作中反应物可能发生的反应或题干所给信息入手进行分析。反应的生成物一定有,同时需注意所加试剂是否过量。
4. 化学方程式的书写
(1)已学化学方程式的书写
根据题目要求及箭头方向找到反应物、生成物,根据所学知识判断其可能发生的反应。
(2)陌生化学方程式的书写
①根据题干已给反应物、生成物。
②根据箭头方向,箭头进入的是反应物,出去的是生成物(包括主产物和副产物)。
【特别提醒】书写化学方程式时注意配平并标明反应条件及生成物状态。
5. 反应类型的判断
根据该步骤中反应物与生成物的种类进行判断:
(1)多变一→ 化合反应
(2)一变多→ 分解反应
(3)单换单→ 置换反应
(4)双交换,价不变→ 复分解反应
6. 流程的作用及评价
(1)从成本考虑:所用原料价格低廉或将废弃物转化为有用的物质,流程中的能耗少,实现了物质、能量的循环利用等。
(2)从环保考虑:无污染、“三废”(废气、废渣、废水)的处理等。
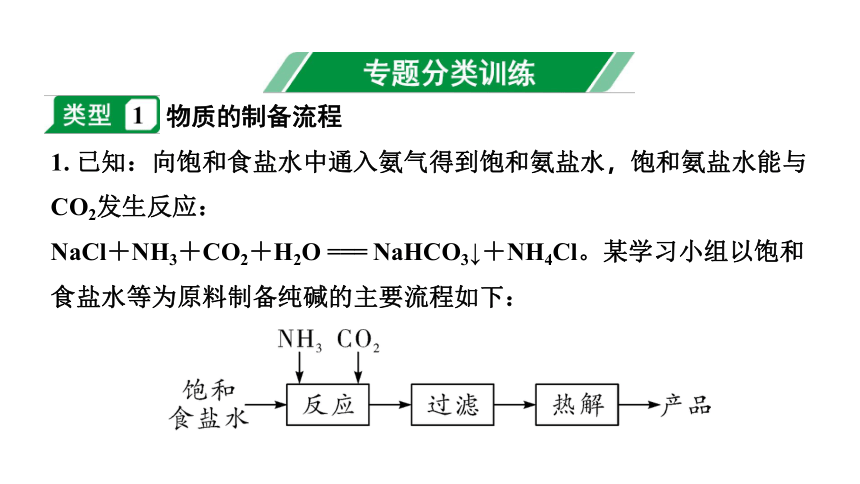
物质的制备流程
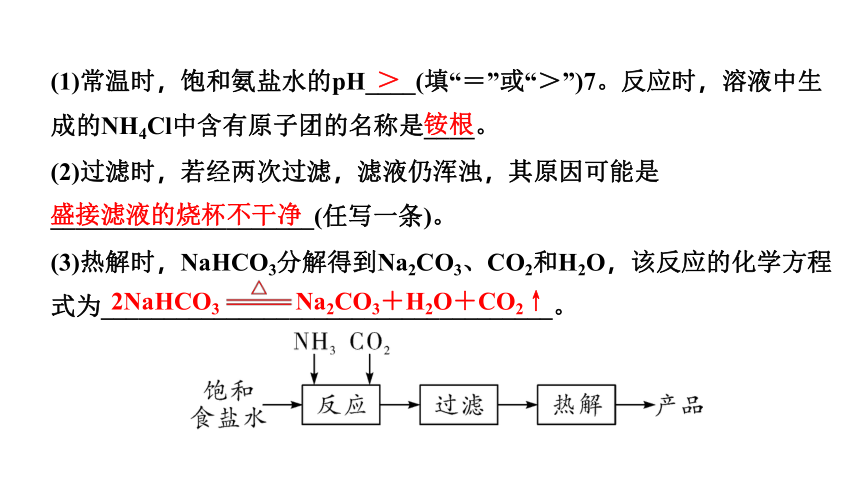
1. 已知:向饱和食盐水中通入氨气得到饱和氨盐水,饱和氨盐水能与CO2发生反应:
NaCl+NH3+CO2+H2O === NaHCO3↓+NH4Cl。某学习小组以饱和食盐水等为原料制备纯碱的主要流程如下:
(1)常温时,饱和氨盐水的pH____(填“=”或“>”)7。反应时,溶液中生成的NH4Cl中含有原子团的名称是____。
(2)过滤时,若经两次过滤,滤液仍浑浊,其原因可能是_____________________(任写一条)。
(3)热解时,NaHCO3分解得到Na2CO3、CO2和H2O,该反应的化学方程式为____________________________________。
>
铵根
盛接滤液的烧杯不干净
2NaHCO3 Na2CO3+H2O+CO2↑
2. (2021攀枝花)高纯氧化铁(Fe2O3)是电子工业的重要材料。用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁的生产流程如下图。
已知: Fe+Fe2(SO4)3=== 3FeSO4
回答下列问题:
(1)加入过量铁粉的作用是:①________________,②________________。
使Fe3+转化为Fe2+
除去过量稀硫酸
(2)滤液Ⅱ中加入(NH4)2CO3溶液,发生反应的化学方程式是__________________________________________。
(3)煅烧时FeCO3与空气中的O2反应生成Fe2O3和CO2,反应的化学方程式是_______________________________。
FeSO4+(NH4)2CO3 === FeCO3↓+ (NH4)2SO4
4FeCO3+O2 2Fe2O3+4CO2
3. (2021苏州)碳酸氢铵是一种常用的化学肥料。工业生产碳酸氢铵的一种流程如下:
已知:“合成”步骤中发生的反应为N2+3H2 2NH3。
(1)碳酸氢铵属于化肥中的_____肥。
(2)“造气”步骤中为加快反应速率,可采取的具体措施有_________(写一条即可)。
催化剂
高温、高压
氮
将煤粉碎
(3)“碳酸化”步骤的化学方程式为____________________________。该步骤在较低温度下进行的原因是_____________________。
(4)“碳酸化”步骤的作用是制取碳酸氢铵和______________________。
(5)“循环”的目的是______________________________。
NH3+CO2+H2O===NH4HCO3
防止碳酸氢铵受热分解
吸收CO2,分离出N2和H2
提高N2、H2的利用率,节约资源
4. 金属钛(Ti)的硬度大、熔点高、密度小,被广泛用于火箭、航天飞机、船舶等。如图是利用钛铁矿(主要成分为FeTiO3)制备金属钛的工艺流程。
(1)进行反应①前,需先将钛铁矿粉碎,其目的是__________________________________。
增大反应物接触面积,加快反应速率
(2)反应②除生成TiCl4外,还生成一种有毒气体X,该气体的化学式为____。
(3)反应③需在氩气环境中进行,氩气起的作用是____________________
____。写出反应③的化学方程式为
____________________________。
(4)利用上述方法制取的金属钛中可
能会含有少量杂质,该杂质是_____。
CO
作保护气,防止发生副反应
2Mg+TiCl4 Ti+2MgCl2
Mg
海水资源的利用
5. 已知:NaOH溶液能与MgSO4溶液反应生成Na2SO4和难溶于水的Mg(OH)2。镁大多是从海水中提取。某小组从预先处理后的海水中提取镁的主要步骤如下:
(1)沉淀时,NaOH应过量的目的是_____________________________
____________。
使海水中的镁元素全部转化为氢氧化镁沉淀
(2)过滤时,使用玻璃棒的作用是_____。
(3)溶解时,稀盐酸与Mg(OH)2发生反应的化学方程式为________________________________,该反应的反应类型为__________。
引流
2HCl+Mg(OH)2 === MgCl2+2H2O
复分解反应
6. 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。I2的一种制备方法如图所示,据图回答下列问题:
(1)图中属于盐的化学式为____________。
(2)碘化钠与氯化钠的化学性质类似,写出碘化钠与硝酸银发生反应的化学方程式_____________________________。
(3)已知通入氯气过程中发生某一反应的化学方程式为FeI2+Cl2=== X+I2,则X的化学式为______。
NaI、AgNO3
NaI+AgNO3=== AgI↓+NaNO3
FeCl2
7. 海水中含有丰富的自然资源,其中90%左右是氯化钠,还含有氯化镁和氯化钙等。如图是利用海水制备硫酸镁的流程:
(1)操作A的名称是______。
(2)写出氢氧化镁和稀硫酸反应的化学方程式__________________________________。
过滤
Mg(OH)2+H2SO4 === MgSO4+2H2O
(3)实验室经常要将浓硫酸稀释成稀硫酸,稀释浓硫酸时应____________
___________________,并用玻璃棒不断搅拌。
(4)上述流程中所得的溶液B显_____(填“酸性”“碱性”或“中性”)。
(5)由硫酸镁溶液得到硫酸镁固体需要进行的操作是_________,写出实验室进行该操作的注意事项______________________________________
________________________(写一条)。
将浓硫酸沿烧杯壁缓慢注入水中
酸性
蒸发结晶
待蒸发皿中出现较多固体时停止加热,利用余热慢慢蒸干剩余液体
分离、提纯和除杂流程
8. (2021安徽)某燃煤电厂产生的固体废弃物粉煤灰中含有较多的氧化铝。从粉煤灰中提取氧化铝的工艺流程如下。
(1)“酸浸”中使用的酸是__(填字母序号)。
A. HCl B. H2SO4 C. Na2SO4
(2)流程中涉及到的氧化物有_____________(写出1种即可)。
B
Al2O3(或H2O)
(3)“煅烧”过程发生反应的化学方程式为____________________________,反应类型是________。
(4)该工艺的价值在于____________。
2Al(OH)3 Al2O3+3H2O↑
分解反应
废物再利用
9. (2020淮安改编)高纯碳酸钙广泛应用于精密电子陶瓷、医药等的生产。某兴趣小组按图示实验步骤,模拟工业流程制备高纯碳酸钙。请回答下列问题。
(1)“酸溶”过程中,将一定浓度的盐酸缓慢加入粉碎后的优质石灰石中。发生反应的化学方程式是___________________________________。
2HCl+CaCO3 === CaCl2+H2O+CO2↑
(2)“操作1”“操作2”步骤中,需要用到的玻璃仪器有烧杯、玻璃棒和____。
(3)“操作2”中分离得到的NH4Cl,在农业上可用作_____。
漏斗
氮肥
10. (2021宜宾)氯化钠既是一种重要的调味品,又是重要的化工原料。工业上以粗盐(主要成分NaCl,含有少量MgCl2、CaCl2、Na2SO4和泥沙)为原料制备较纯的NaCl晶体的流程如图1所示。
已知:Mg(OH)2和BaCO3均为难溶物
回答下列问题:
(1)加水“溶解”粗盐时,需要进行搅拌,
目的是_______________。
(2)Ba(OH)2溶液与“滤液1”中的_____、
_____(填离子符号)生成难溶性沉淀。
加快粗盐的溶解
Mg2+
图1
(3)“滤液2”的pH_____7(填“>”“<”或“=”)。
(4)加入过量Na2CO3溶液的目的是________________________。
(5)加入盐酸“调pH”为7时,发生反应的化学方程式是__________________________、__________________________________。
(6)实验室“蒸发结晶”时,不需要的仪器有____(填字母序号)。
图2
>
除去溶液中的Ca2+和Ba2+
HCl+NaOH=== NaCl+H2O
2HCl+Na2CO3=== 2NaCl+H2O+CO2↑
BD
(7)滤渣3的成分是_______________(填化学式)。
(8)实验时加入的盐酸不慎过量,对氯化钠的纯度____(填“有”或“无”)影响,理由是___________________________________________________。
BaCO3、CaCO3
无
多加入的盐酸在后续的蒸发过程中会转化成氯化氢气体逸出
图1
(9)若氢氧化钡溶液与碳酸钠溶液的加入顺序互换,对实验结果造成的影响是___________________________________________________。
(10)最终获得的NaCl晶体的质量大于粗盐的质量,造成这种情况的原因是___________________________________。
后加入的氢氧化钡会导致溶液中混入Ba2+,且无法被除去
提纯后的精盐尚未完全干燥就称其质量
回收利用流程
11. (2021云南)“垃圾是放错的资源”。碘循环工艺不仅能吸收SO2,减少环境污染,而且还可以得到仅含一种元素的化工原料X,流程如下:
(1)流程中可循环利用的物质是________。
(2)膜反应器中发生的是分解反应,
X的化学式是_____。
(3)反应器中发生反应的化学方程式为
___________________________________。
碘(或I2)
H2
SO2 + I2 + 2H2O ===== H2SO4 + 2HI
20~100 ℃
12. 木炭还原氧化铜实验后的混合粉末中含有铜、木炭粉,某化学兴趣小组设计回收铜的方案如图:
(1)将混合粉末灼烧的目的是_______________________________。
(2)写出反应①的化学方程式_____________________________。
(3)滤液中的溶质为______(写化学式)。反应③中加入的试剂A为______________。
将混合粉末中的碳粉通过反应除去
H2SO4+CuO === H2O+CuSO4
FeSO4
稀盐酸或稀硫酸
13. (淮安)胆矾(CuSO4·5H2O)在工农业生产中有广泛的用途。实验室利用废旧电池的铜帽(主要含铜和锌)为原料制备胆矾。实验流程如图所示:
查阅资料:氧化锌能溶于氢氧化钠溶液。
(1)废旧电池铜帽的表面常有油污,可用洗洁精预先除去,洗洁精在除去油污的过程中起______作用。
乳化
(2)“碱溶”步骤中,为加快反应速率可采取多种措施,如搅拌、_______________________________等。
(3)“酸溶”时,发生反应的化学方程式是______________________________。
(4)“灼烧”完全(已充分反应)的判断依据是________________。
CuO+H2SO4 === CuSO4+H2O
固体质量不再增加
加热(或增大氢氧化钠溶液的浓度)
14. (2021泰安)某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示:
请回答下列问题:
(1)工厂废液中加入过量A反应的化学
方程式为________________________。
(2)用化学式表示固体甲的成分________。
(3)溶液甲中的金属离子是___________(用离子符号表示)。
(4)完成步骤④的化学方程式:4Fe(OH)2+O2+2_____=== 4Fe(OH)3。
Fe+CuCl2=== FeCl2+Cu
Fe、Cu
Na+、Fe2+
H2O
(5)步骤中的盐酸能否用硫酸代替,原因是__________________________
____。
(6)写出步骤③发生反应的化学方程式
___________________________________。
不能,因为会引入杂质硫酸根离子
2NaOH+FeCl2=== 2NaCl+Fe(OH)2↓
拓展类型(设备流程)
15. (2021大庆)某化肥厂以煤、空气、水为原料合成氨。生产流程如图所示。下列说法错误的是( )
A. 氨气转变为液氨是放热过程
B. 设备1中此反应C+H2O(气) CO+H2一定发生
C. 设备2中发生的反应,属于基本
反应类型中的化合反应
D. 设备3中参加反应的N2和H2的质
量比为14∶1
D
16. (2021北京)高纯CO可用于半导体领域某些芯片的刻蚀。利用甲酸(HCOOH) 制取高纯CO的主要流程如下:
(1)甲酸中碳元素和氧元素的质量比为_____。
图1
3∶8
(2)反应塔中甲酸分解的微观示意图如下,在方框中补全另一种产物的微粒图示。
(3)反应塔中发生副反应产生微量CO2。洗涤器中加入NaOH溶液的目的是中和未反应的甲酸蒸气,并除去CO2,NaOH与CO2反应的化学方程式为______________________________。
图2
2NaOH+CO2=== Na2CO3+H2O
17. (2021山西)造纸术是中国古代四大发明之一。一直以来,传统工艺不断改进。现阶段,利用方解石(主要成分为CaCO3,还含有少量MgO、Fe2O3、SiO2等杂质)造纸已较为普遍,它取代传统的植物纤维造纸,全程无需用水,原料造价仅为传统造纸的 。(已知:SiO2、聚乙烯塑料、粘合剂均难溶于水,且不与盐酸反应)分析生产过程,回答下列问题:
(1)将方解石粉碎成纳米级超细粉末
的目的是_____________。
(2)混合器内需要进行的操作是____。
提高纸张质量
搅拌
(3)利用方解石作原料生产纸张的优点是____________________。
(4)从绿色环保的角度分析,对使用的原料需要改进的地方是________________________________________。
(5)成品纸张在保存过程中应避免与酸接触,若遇到稀盐酸,则可能发生反应的化学方程式为_________________________________________
________________________________(写1个)。
成本低(或节省木材等)
使用可降解塑料(或使用无毒无害的粘合剂等)
CaCO3+2HCl === CaCl2+H2O+CO2↑(或Fe2O3+6HCl === 2FeCl3+3H2O等)
18. 碳酸锂(Li2CO3)是制备锂电池的重要原料。工业上以锂辉石精矿(主要成分为Li2O)为原料制取碳酸锂的主要工艺流程如图所示。
已知:Li2CO3的溶解度随温度的升高而减小。
(1) Li2CO3中锂元素的化合价为____。
+1
(2)酸浸槽中需要用搅拌器不断搅拌。其目的是______________________
________,酸浸槽中发生反应的化学方程式为_____________________________。
(3)洗涤槽中使用热水的原因是____________________________________
__________________________________。
碳酸锂的溶解度随温度的升高而减小,使
用热水可减少洗涤过程中碳酸锂的损耗
使反应物充分接触,加快反应速率
Li2O+H2SO4=== Li2SO4+H2O
专题突破
1
专题分类训练
2
2022年化学中考备考复习 流程图题精讲课件
---工艺流程图题(四)(适合江苏省)
一、工艺流程解读
1. 一般解题思路和方法
2. 工艺流程路线示意图
关注流程图中的出线、进线(箭头方向表示物料流向或操作流程)、可逆线(表示物质循环利用)和核心反应等。
二、常考内容梳理
1. 操作及目的
(1)粉碎(或研磨):__________________________________。
(2)搅拌:使物质充分接触,加快反应(或溶解)速率。
(3)灼烧(煅烧、焙烧):除去可燃性杂质(或使原料初步转化);杂质高温下氧化、分解。
(4)加入过量试剂:将原物质中的杂质完全反应或全部转化。
增大反应物接触面积,加快反应速率
2. 混合物分离、提纯的操作及所需仪器的判断
(1)过滤(徐州8年2考)
①操作的判断:如图中操作Ⅰ
②过滤操作中使用的玻璃仪器有:烧杯、玻璃棒、______,其中玻璃棒的作用是______。[徐州2020.23(2)]
③过滤后,滤液浑浊的原因可能是________。[徐州2021.23(2)]
漏斗
引流
滤纸破损
(2)蒸发结晶
①操作的判断:如图中操作Ⅱ
②使用的仪器有:酒精灯、玻璃棒、坩埚钳、铁架台(带铁圈)、______,其中玻璃棒的作用是____________________________________。蒸发时,当蒸发皿中出现__________时停止加热,利用余热使剩余固体中的水分蒸干。
蒸发皿
搅拌,防止局部温度过高造成液滴飞溅
较多固体
3. 物质成分的分析(物质化学式的推断或书写)
(1)判断所加的试剂:从加入试剂的目的、反应的产物入手进行分析。但一定要考虑是否会引入新的杂质或杂质离子。
(2)判断物质成分:从上一步操作中反应物可能发生的反应或题干所给信息入手进行分析。反应的生成物一定有,同时需注意所加试剂是否过量。
4. 化学方程式的书写
(1)已学化学方程式的书写
根据题目要求及箭头方向找到反应物、生成物,根据所学知识判断其可能发生的反应。
(2)陌生化学方程式的书写
①根据题干已给反应物、生成物。
②根据箭头方向,箭头进入的是反应物,出去的是生成物(包括主产物和副产物)。
【特别提醒】书写化学方程式时注意配平并标明反应条件及生成物状态。
5. 反应类型的判断
根据该步骤中反应物与生成物的种类进行判断:
(1)多变一→ 化合反应
(2)一变多→ 分解反应
(3)单换单→ 置换反应
(4)双交换,价不变→ 复分解反应
6. 流程的作用及评价
(1)从成本考虑:所用原料价格低廉或将废弃物转化为有用的物质,流程中的能耗少,实现了物质、能量的循环利用等。
(2)从环保考虑:无污染、“三废”(废气、废渣、废水)的处理等。
物质的制备流程
1. 已知:向饱和食盐水中通入氨气得到饱和氨盐水,饱和氨盐水能与CO2发生反应:
NaCl+NH3+CO2+H2O === NaHCO3↓+NH4Cl。某学习小组以饱和食盐水等为原料制备纯碱的主要流程如下:
(1)常温时,饱和氨盐水的pH____(填“=”或“>”)7。反应时,溶液中生成的NH4Cl中含有原子团的名称是____。
(2)过滤时,若经两次过滤,滤液仍浑浊,其原因可能是_____________________(任写一条)。
(3)热解时,NaHCO3分解得到Na2CO3、CO2和H2O,该反应的化学方程式为____________________________________。
>
铵根
盛接滤液的烧杯不干净
2NaHCO3 Na2CO3+H2O+CO2↑
2. (2021攀枝花)高纯氧化铁(Fe2O3)是电子工业的重要材料。用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁的生产流程如下图。
已知: Fe+Fe2(SO4)3=== 3FeSO4
回答下列问题:
(1)加入过量铁粉的作用是:①________________,②________________。
使Fe3+转化为Fe2+
除去过量稀硫酸
(2)滤液Ⅱ中加入(NH4)2CO3溶液,发生反应的化学方程式是__________________________________________。
(3)煅烧时FeCO3与空气中的O2反应生成Fe2O3和CO2,反应的化学方程式是_______________________________。
FeSO4+(NH4)2CO3 === FeCO3↓+ (NH4)2SO4
4FeCO3+O2 2Fe2O3+4CO2
3. (2021苏州)碳酸氢铵是一种常用的化学肥料。工业生产碳酸氢铵的一种流程如下:
已知:“合成”步骤中发生的反应为N2+3H2 2NH3。
(1)碳酸氢铵属于化肥中的_____肥。
(2)“造气”步骤中为加快反应速率,可采取的具体措施有_________(写一条即可)。
催化剂
高温、高压
氮
将煤粉碎
(3)“碳酸化”步骤的化学方程式为____________________________。该步骤在较低温度下进行的原因是_____________________。
(4)“碳酸化”步骤的作用是制取碳酸氢铵和______________________。
(5)“循环”的目的是______________________________。
NH3+CO2+H2O===NH4HCO3
防止碳酸氢铵受热分解
吸收CO2,分离出N2和H2
提高N2、H2的利用率,节约资源
4. 金属钛(Ti)的硬度大、熔点高、密度小,被广泛用于火箭、航天飞机、船舶等。如图是利用钛铁矿(主要成分为FeTiO3)制备金属钛的工艺流程。
(1)进行反应①前,需先将钛铁矿粉碎,其目的是__________________________________。
增大反应物接触面积,加快反应速率
(2)反应②除生成TiCl4外,还生成一种有毒气体X,该气体的化学式为____。
(3)反应③需在氩气环境中进行,氩气起的作用是____________________
____。写出反应③的化学方程式为
____________________________。
(4)利用上述方法制取的金属钛中可
能会含有少量杂质,该杂质是_____。
CO
作保护气,防止发生副反应
2Mg+TiCl4 Ti+2MgCl2
Mg
海水资源的利用
5. 已知:NaOH溶液能与MgSO4溶液反应生成Na2SO4和难溶于水的Mg(OH)2。镁大多是从海水中提取。某小组从预先处理后的海水中提取镁的主要步骤如下:
(1)沉淀时,NaOH应过量的目的是_____________________________
____________。
使海水中的镁元素全部转化为氢氧化镁沉淀
(2)过滤时,使用玻璃棒的作用是_____。
(3)溶解时,稀盐酸与Mg(OH)2发生反应的化学方程式为________________________________,该反应的反应类型为__________。
引流
2HCl+Mg(OH)2 === MgCl2+2H2O
复分解反应
6. 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。I2的一种制备方法如图所示,据图回答下列问题:
(1)图中属于盐的化学式为____________。
(2)碘化钠与氯化钠的化学性质类似,写出碘化钠与硝酸银发生反应的化学方程式_____________________________。
(3)已知通入氯气过程中发生某一反应的化学方程式为FeI2+Cl2=== X+I2,则X的化学式为______。
NaI、AgNO3
NaI+AgNO3=== AgI↓+NaNO3
FeCl2
7. 海水中含有丰富的自然资源,其中90%左右是氯化钠,还含有氯化镁和氯化钙等。如图是利用海水制备硫酸镁的流程:
(1)操作A的名称是______。
(2)写出氢氧化镁和稀硫酸反应的化学方程式__________________________________。
过滤
Mg(OH)2+H2SO4 === MgSO4+2H2O
(3)实验室经常要将浓硫酸稀释成稀硫酸,稀释浓硫酸时应____________
___________________,并用玻璃棒不断搅拌。
(4)上述流程中所得的溶液B显_____(填“酸性”“碱性”或“中性”)。
(5)由硫酸镁溶液得到硫酸镁固体需要进行的操作是_________,写出实验室进行该操作的注意事项______________________________________
________________________(写一条)。
将浓硫酸沿烧杯壁缓慢注入水中
酸性
蒸发结晶
待蒸发皿中出现较多固体时停止加热,利用余热慢慢蒸干剩余液体
分离、提纯和除杂流程
8. (2021安徽)某燃煤电厂产生的固体废弃物粉煤灰中含有较多的氧化铝。从粉煤灰中提取氧化铝的工艺流程如下。
(1)“酸浸”中使用的酸是__(填字母序号)。
A. HCl B. H2SO4 C. Na2SO4
(2)流程中涉及到的氧化物有_____________(写出1种即可)。
B
Al2O3(或H2O)
(3)“煅烧”过程发生反应的化学方程式为____________________________,反应类型是________。
(4)该工艺的价值在于____________。
2Al(OH)3 Al2O3+3H2O↑
分解反应
废物再利用
9. (2020淮安改编)高纯碳酸钙广泛应用于精密电子陶瓷、医药等的生产。某兴趣小组按图示实验步骤,模拟工业流程制备高纯碳酸钙。请回答下列问题。
(1)“酸溶”过程中,将一定浓度的盐酸缓慢加入粉碎后的优质石灰石中。发生反应的化学方程式是___________________________________。
2HCl+CaCO3 === CaCl2+H2O+CO2↑
(2)“操作1”“操作2”步骤中,需要用到的玻璃仪器有烧杯、玻璃棒和____。
(3)“操作2”中分离得到的NH4Cl,在农业上可用作_____。
漏斗
氮肥
10. (2021宜宾)氯化钠既是一种重要的调味品,又是重要的化工原料。工业上以粗盐(主要成分NaCl,含有少量MgCl2、CaCl2、Na2SO4和泥沙)为原料制备较纯的NaCl晶体的流程如图1所示。
已知:Mg(OH)2和BaCO3均为难溶物
回答下列问题:
(1)加水“溶解”粗盐时,需要进行搅拌,
目的是_______________。
(2)Ba(OH)2溶液与“滤液1”中的_____、
_____(填离子符号)生成难溶性沉淀。
加快粗盐的溶解
Mg2+
图1
(3)“滤液2”的pH_____7(填“>”“<”或“=”)。
(4)加入过量Na2CO3溶液的目的是________________________。
(5)加入盐酸“调pH”为7时,发生反应的化学方程式是__________________________、__________________________________。
(6)实验室“蒸发结晶”时,不需要的仪器有____(填字母序号)。
图2
>
除去溶液中的Ca2+和Ba2+
HCl+NaOH=== NaCl+H2O
2HCl+Na2CO3=== 2NaCl+H2O+CO2↑
BD
(7)滤渣3的成分是_______________(填化学式)。
(8)实验时加入的盐酸不慎过量,对氯化钠的纯度____(填“有”或“无”)影响,理由是___________________________________________________。
BaCO3、CaCO3
无
多加入的盐酸在后续的蒸发过程中会转化成氯化氢气体逸出
图1
(9)若氢氧化钡溶液与碳酸钠溶液的加入顺序互换,对实验结果造成的影响是___________________________________________________。
(10)最终获得的NaCl晶体的质量大于粗盐的质量,造成这种情况的原因是___________________________________。
后加入的氢氧化钡会导致溶液中混入Ba2+,且无法被除去
提纯后的精盐尚未完全干燥就称其质量
回收利用流程
11. (2021云南)“垃圾是放错的资源”。碘循环工艺不仅能吸收SO2,减少环境污染,而且还可以得到仅含一种元素的化工原料X,流程如下:
(1)流程中可循环利用的物质是________。
(2)膜反应器中发生的是分解反应,
X的化学式是_____。
(3)反应器中发生反应的化学方程式为
___________________________________。
碘(或I2)
H2
SO2 + I2 + 2H2O ===== H2SO4 + 2HI
20~100 ℃
12. 木炭还原氧化铜实验后的混合粉末中含有铜、木炭粉,某化学兴趣小组设计回收铜的方案如图:
(1)将混合粉末灼烧的目的是_______________________________。
(2)写出反应①的化学方程式_____________________________。
(3)滤液中的溶质为______(写化学式)。反应③中加入的试剂A为______________。
将混合粉末中的碳粉通过反应除去
H2SO4+CuO === H2O+CuSO4
FeSO4
稀盐酸或稀硫酸
13. (淮安)胆矾(CuSO4·5H2O)在工农业生产中有广泛的用途。实验室利用废旧电池的铜帽(主要含铜和锌)为原料制备胆矾。实验流程如图所示:
查阅资料:氧化锌能溶于氢氧化钠溶液。
(1)废旧电池铜帽的表面常有油污,可用洗洁精预先除去,洗洁精在除去油污的过程中起______作用。
乳化
(2)“碱溶”步骤中,为加快反应速率可采取多种措施,如搅拌、_______________________________等。
(3)“酸溶”时,发生反应的化学方程式是______________________________。
(4)“灼烧”完全(已充分反应)的判断依据是________________。
CuO+H2SO4 === CuSO4+H2O
固体质量不再增加
加热(或增大氢氧化钠溶液的浓度)
14. (2021泰安)某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示:
请回答下列问题:
(1)工厂废液中加入过量A反应的化学
方程式为________________________。
(2)用化学式表示固体甲的成分________。
(3)溶液甲中的金属离子是___________(用离子符号表示)。
(4)完成步骤④的化学方程式:4Fe(OH)2+O2+2_____=== 4Fe(OH)3。
Fe+CuCl2=== FeCl2+Cu
Fe、Cu
Na+、Fe2+
H2O
(5)步骤中的盐酸能否用硫酸代替,原因是__________________________
____。
(6)写出步骤③发生反应的化学方程式
___________________________________。
不能,因为会引入杂质硫酸根离子
2NaOH+FeCl2=== 2NaCl+Fe(OH)2↓
拓展类型(设备流程)
15. (2021大庆)某化肥厂以煤、空气、水为原料合成氨。生产流程如图所示。下列说法错误的是( )
A. 氨气转变为液氨是放热过程
B. 设备1中此反应C+H2O(气) CO+H2一定发生
C. 设备2中发生的反应,属于基本
反应类型中的化合反应
D. 设备3中参加反应的N2和H2的质
量比为14∶1
D
16. (2021北京)高纯CO可用于半导体领域某些芯片的刻蚀。利用甲酸(HCOOH) 制取高纯CO的主要流程如下:
(1)甲酸中碳元素和氧元素的质量比为_____。
图1
3∶8
(2)反应塔中甲酸分解的微观示意图如下,在方框中补全另一种产物的微粒图示。
(3)反应塔中发生副反应产生微量CO2。洗涤器中加入NaOH溶液的目的是中和未反应的甲酸蒸气,并除去CO2,NaOH与CO2反应的化学方程式为______________________________。
图2
2NaOH+CO2=== Na2CO3+H2O
17. (2021山西)造纸术是中国古代四大发明之一。一直以来,传统工艺不断改进。现阶段,利用方解石(主要成分为CaCO3,还含有少量MgO、Fe2O3、SiO2等杂质)造纸已较为普遍,它取代传统的植物纤维造纸,全程无需用水,原料造价仅为传统造纸的 。(已知:SiO2、聚乙烯塑料、粘合剂均难溶于水,且不与盐酸反应)分析生产过程,回答下列问题:
(1)将方解石粉碎成纳米级超细粉末
的目的是_____________。
(2)混合器内需要进行的操作是____。
提高纸张质量
搅拌
(3)利用方解石作原料生产纸张的优点是____________________。
(4)从绿色环保的角度分析,对使用的原料需要改进的地方是________________________________________。
(5)成品纸张在保存过程中应避免与酸接触,若遇到稀盐酸,则可能发生反应的化学方程式为_________________________________________
________________________________(写1个)。
成本低(或节省木材等)
使用可降解塑料(或使用无毒无害的粘合剂等)
CaCO3+2HCl === CaCl2+H2O+CO2↑(或Fe2O3+6HCl === 2FeCl3+3H2O等)
18. 碳酸锂(Li2CO3)是制备锂电池的重要原料。工业上以锂辉石精矿(主要成分为Li2O)为原料制取碳酸锂的主要工艺流程如图所示。
已知:Li2CO3的溶解度随温度的升高而减小。
(1) Li2CO3中锂元素的化合价为____。
+1
(2)酸浸槽中需要用搅拌器不断搅拌。其目的是______________________
________,酸浸槽中发生反应的化学方程式为_____________________________。
(3)洗涤槽中使用热水的原因是____________________________________
__________________________________。
碳酸锂的溶解度随温度的升高而减小,使
用热水可减少洗涤过程中碳酸锂的损耗
使反应物充分接触,加快反应速率
Li2O+H2SO4=== Li2SO4+H2O
同课章节目录
