2022年化学中考备考复习 流程图题精讲课件---工艺流程图题(五)(课件29页)
文档属性
| 名称 | 2022年化学中考备考复习 流程图题精讲课件---工艺流程图题(五)(课件29页) |  | |
| 格式 | zip | ||
| 文件大小 | 553.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 09:59:27 | ||
图片预览



文档简介
(共29张PPT)
题型分类训练
2
1
题型攻略
2022年化学中考备考复习 流程图题精讲课件
---工艺流程图题(五)
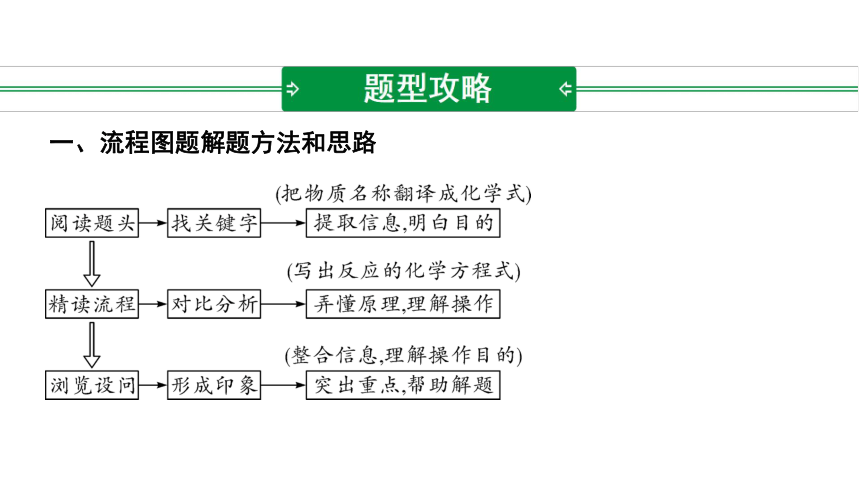
一、流程图题解题方法和思路
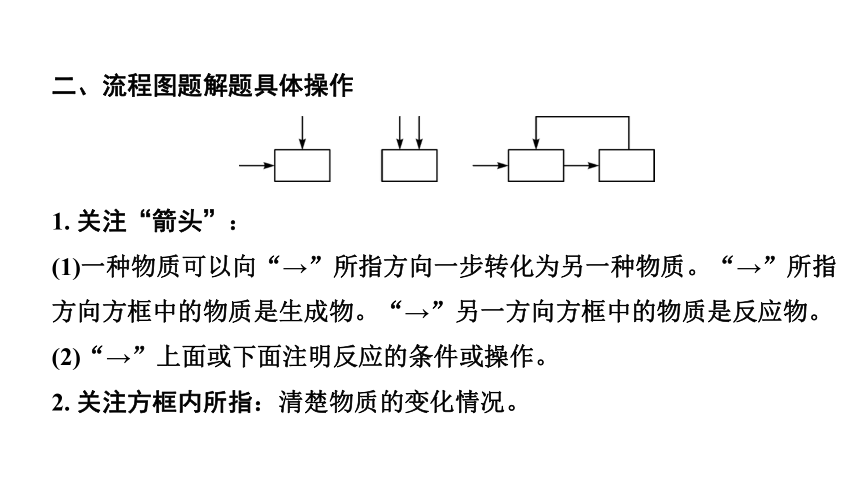
二、流程图题解题具体操作
1. 关注“箭头”:
(1)一种物质可以向“→”所指方向一步转化为另一种物质。“→”所指方向方框中的物质是生成物。“→”另一方向方框中的物质是反应物。
(2)“→”上面或下面注明反应的条件或操作。
2. 关注方框内所指:清楚物质的变化情况。
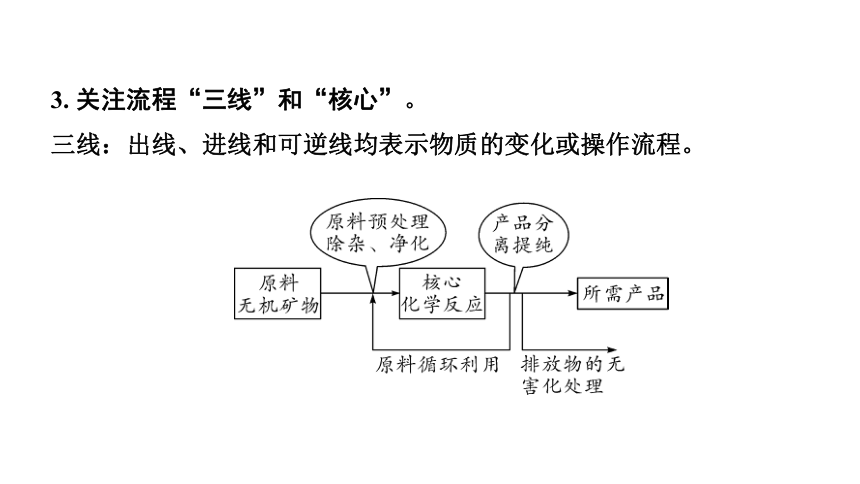
3. 关注流程“三线”和“核心”。
三线:出线、进线和可逆线均表示物质的变化或操作流程。
1. 海洋蕴藏着丰富的自然资源。工业上可利用海水中的氯化镁来制取金属镁,其简化后的流程如图所示:
海水 氢氧化镁 氯化镁 镁
请回答下列问题:
(1)操作1的名称是______。
(2)石灰乳与海水混合发生反应的化学方程式为_____________________
_________________。
(3)试剂X为_______。
金属的回收利用与制备
加石灰乳
操作1
加试剂X
通电
过滤
MgCl2+Ca(OH)2 ===
Mg(OH)2↓+CaCl2
稀盐酸
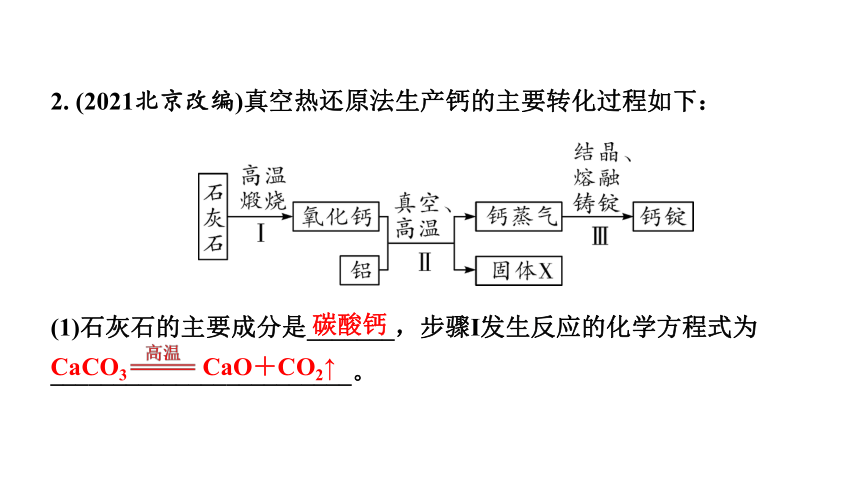
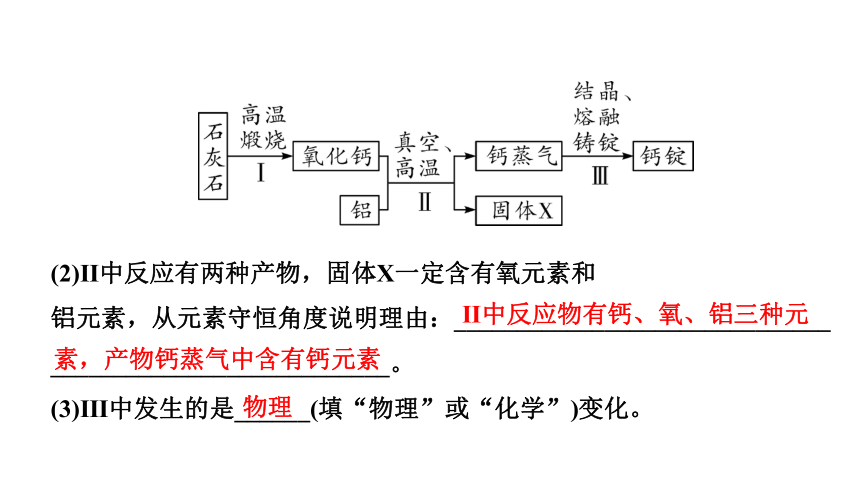
2. (2021北京改编)真空热还原法生产钙的主要转化过程如下:
(1)石灰石的主要成分是_______,步骤Ⅰ发生反应的化学方程式为________________________。
碳酸钙
CaCO3 CaO+CO2↑
(2)Ⅱ中反应有两种产物,固体X一定含有氧元素和
铝元素,从元素守恒角度说明理由:______________________________
___________________________。
(3)Ⅲ中发生的是______(填“物理”或“化学”)变化。
Ⅱ中反应物有钙、氧、铝三种元
素,产物钙蒸气中含有钙元素
物理
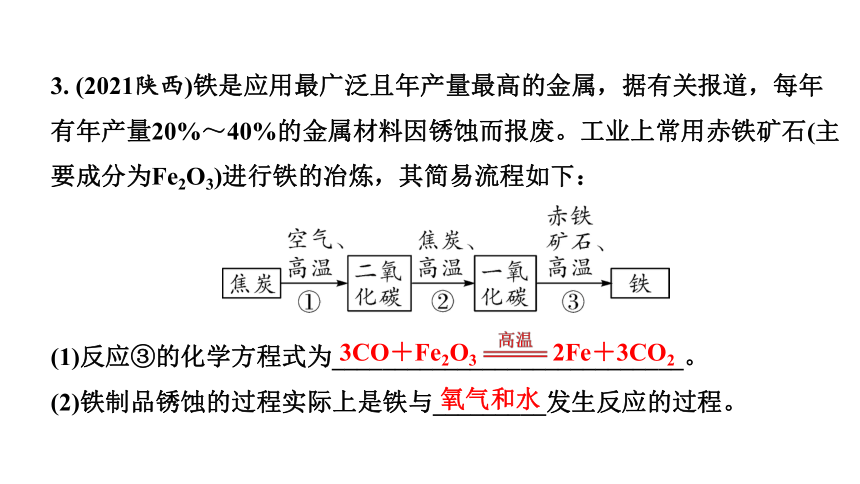
3. (2021陕西)铁是应用最广泛且年产量最高的金属,据有关报道,每年有年产量20%~40%的金属材料因锈蚀而报废。工业上常用赤铁矿石(主要成分为Fe2O3)进行铁的冶炼,其简易流程如下:
(1)反应③的化学方程式为____________________________。
(2)铁制品锈蚀的过程实际上是铁与_________发生反应的过程。
3CO+Fe2O3 2Fe+3CO2
氧气和水
(3)为防止铁制品锈蚀,常在其表面镀一层金属锌或铜等,为了验证铁、铜、锌的金属活动性强弱,可选择的试剂是_____(填字母)。
A. 铁片、ZnSO4溶液、CuSO4溶液
B. 铜片、ZnSO4溶液、FeSO4溶液
C. 锌片、铜片、FeSO4溶液
D. 铜片、铁片、ZnSO4溶液
AC
4. 工业上生产电路板及处理废液的工艺流程如下:
已知:Fe+2FeCl3=== 3FeCl2
(1)由步骤①可判断FeCl3与铜反应生成的两种产物是_____________。
(2)步骤②中发生置换反应的化学方程式为_______________________。
(3)步骤③加入稀盐酸充分搅拌,当观察到_______________的现象时,说明滤渣只剩铜。
FeCl2、CuCl2
Fe+CuCl2 === FeCl2+Cu
不再有气泡产生
5. (2021安徽节选)某燃煤电厂产生的固体废弃物粉煤灰中含有较多的氧化铝。从粉煤灰中提取氧化铝的工艺流程如下。
(1)“酸浸”中使用的酸是____(填字母序号)。
A. HCl B. H2SO4 C. Na2SO4
B
(2)流程中涉及到的氧化物有_______(写出1种即可)。
(3)“煅烧”过程发生反应的化学方程式为__________________________。
(4)该工艺的价值在于___________。
Al2O3
2Al(OH)3 Al2O3+3H2O
废物再利用
6. (2021乐山改编)纳米碳酸钡是一种重要的无机化工产品,某工厂用含SiO2杂质的BaCO3为原料制备纳米碳酸钡的工艺流程如图所示:
酸碱盐相关的流程图
请回答:
(1)SiO2性质稳定,但常温下易与氢氟酸反应,该反应的化学方程式为SiO2+4HF=== X+2H2O,则X的化学式为_____。
(2)流程中加入盐酸时发生反应的化学方程式为______________________
___________________。
(3)写出副产品的用途_______(写一条即可)。
SiF4
BaCO3+2HCl ===
BaCl2+CO2↑+H2O
作氮肥
7. (2021陕西定心卷)同学们进行实验活动时在实验室发现一瓶烧碱溶液,为探究此溶液是否变质以及变质的程度,同学们设计了如下方案,请你一起参与并回答问题。
方案一:烧碱样品 产生气泡
方案二:烧碱样品 无色滤液
(1)方案一中X溶液是_______。
(2)方案二中加入BaCl2溶液时发生反应的化学方程式为_______________
___________________。
足量X溶液
过量BaCl2溶液
反应后过滤
稀盐酸
Na2CO3+BaCl2
=== BaCO3↓+2NaCl
(3)取方案二中的无色滤液于试管中,滴加无色酚酞溶液,观察到_____
_____,证明该瓶烧碱溶液部分变质,下列方案能得出相同结论的是_____
(填字母)。
A. 取方案二中的无色滤液于试管中,滴加FeCl3溶液
B. 用pH试纸测定方案二中无色滤液的pH
C. 取方案二中的无色滤液于试管中,通入CO2
溶液
变红
ABC
8. 某化学兴趣小组同学在处理实验后残留的废液时,发现其中含有Na2CO3、KNO3和Na2SO4,在老师的指导下,该化学小组同学设计如图所示流程回收其中的KNO3。
(1)步骤①发生反应的化学方程式为________________________________
(任写一个)。
(2)滤液B中的阴离子有___________________(写离子符号)。
(3)步骤④包含的基本操作是加热浓缩、________、过滤。
Na2SO4+BaCl2=== BaSO4↓+2NaCl
、 、Cl-
降温结晶
9. 水垢(主要成分为碳酸钙、氢氧化镁)俗称“水锈、水碱”,是指硬水煮沸后所含矿物质附着在容器内壁逐渐形成的白色块状或粉末状的物质。实验室用水垢制取氯化钙的流程如下:
(1)步骤①中观察到的现象是__________。
有气泡产生
(2)步骤②中选用氢氧化钙不用氢氧化钠的原因是___________________
_________________________;发生反应的化学方程式为_____________
_____________________(任写一个)。
(3)步骤③过滤后所得滤液中的溶质成分是________________(写化学式)。
(4)步骤④加入过量盐酸不会影响产物的纯度,原因是________________
_______________________________。
氢氧化钠与稀盐酸、
氯化镁反应产生氯化钠杂质
Ca(OH)2+
2HCl === 2H2O+CaCl2
CaCl2、Ca(OH)2
盐酸具有挥发性,
加热蒸发氯化氢气体会全部挥发掉
10. (2021高新一中七模改编)实验室有一包白色固体粉末,可能由氢氧化钠、硫酸钠、硝酸镁、硫酸铜、碳酸钙中的一种或几种物质组成。为确定其成分,化学兴趣小组同学设计并进行了如下实验:
请回答:(1)步骤①中加水溶解需用的仪器有玻璃棒和______。
(2)写出步骤②中可能发生反应的化学方程式____________________________
__________。
(3)由以上的实验可知,这包白色固体中
一定含有的物质是____________
________(填化学式)。
(4)根据步骤⑤中的实验现象,小东认为
原固体中一定还含有NaOH,小亮不同
意他的观点,理由是________________
__________________________________
___________。
烧杯
Mg(OH)2+2HCl===MgCl2
CaCO3、
Na2SO4
加入的氢氧化钡与
酞溶液变红
硫酸钠反应生成的氢氧化钠也能使酚
+2H2O
11. (2021山西)造纸术是中国古代四大发明之一。一直以来,传统工艺不断改进。现阶段,利用方解石(主要成分为CaCO3,还含有少量MgO、Fe2O3、SiO2等杂质)造纸已较为普遍,它取代传统的植物纤维造纸,全程无需用水,原料造价仅为传统造纸的 。(已知:SiO2、聚乙烯塑料、粘合剂均难溶于水,且不与盐酸反应。)分析生产过程,回答下列问题:
(1)将方解石粉碎成纳米级超细粉末的目的是______________。
(2)混合器内需要进行的操作是______。
(3)利用方解石作原料生产纸张的优点是________。
(4)从绿色环保的角度分析,对使用的原料需要改进的地方是__________
_______。
(5)成品纸张在保存过程中应避免与酸接触,若遇到稀盐酸,则可能发生反应的化学方程式为___________________________________(写1个)。
提高纸张质量
搅拌
成本低
使用可降
解塑料
CaCO3+2HCl === CaCl2+H2O+CO2↑
拓展类
12. (2021云南)“垃圾是放错的资源”。碘循环工艺不仅能吸收SO2,减少环境污染,而且还可以得到仅含一种元素的化工原料X,流程如下:
(1)流程中可循环利用的物质是____。
(2)膜反应器中发生的是分解反应,X的化学式是____。
(3)反应器中发生反应的化学方程式为_______________________________。
碘
H2
SO2+I2+2H2O ===== H2SO4+2HI
20~100 ℃
13. (2021西工大附中八模)2021年3月全国两会期间,政府工作报告中提到“中国将力争碳排放于2030年前达到峰值,争取在2060年前实现碳中和”。“碳中和”是指某个地区在一定时间内,人类活动直接和间接排放的碳总量,与通过植树造林、工业固碳等方式吸收的碳总量相互抵消,实现碳“净零排放”。“碳捕获”并封存被认为是目前减缓全球变暖最经济可行的方式。如图是一种利用NaOH溶液实现“碳捕获”的技术主要流程。
(1)分离器中,Na2CO3发生反应的化学方程式为___________________
______________________。
(2)用该技术进行“碳捕获”有效利用了原材料,在该过程没有涉及到的基本反应类型是_____反应。
(3)下列措施对实现“碳中和”有利的是________。
A. 一定条件下,将CO2转化为CH3OH,实现CO2的资源化利用
B. 推动使用太阳能等可再生能源
C. 为维持好碳、氧循环,大力植树造林,减少化石燃料燃烧
D. 电动汽车替代燃油汽车,减少大气污染
Na2CO3+Ca(OH)2
=== CaCO3↓+ 2NaOH
置换
ABCD
题型分类训练
2
1
题型攻略
2022年化学中考备考复习 流程图题精讲课件
---工艺流程图题(五)
一、流程图题解题方法和思路
二、流程图题解题具体操作
1. 关注“箭头”:
(1)一种物质可以向“→”所指方向一步转化为另一种物质。“→”所指方向方框中的物质是生成物。“→”另一方向方框中的物质是反应物。
(2)“→”上面或下面注明反应的条件或操作。
2. 关注方框内所指:清楚物质的变化情况。
3. 关注流程“三线”和“核心”。
三线:出线、进线和可逆线均表示物质的变化或操作流程。
1. 海洋蕴藏着丰富的自然资源。工业上可利用海水中的氯化镁来制取金属镁,其简化后的流程如图所示:
海水 氢氧化镁 氯化镁 镁
请回答下列问题:
(1)操作1的名称是______。
(2)石灰乳与海水混合发生反应的化学方程式为_____________________
_________________。
(3)试剂X为_______。
金属的回收利用与制备
加石灰乳
操作1
加试剂X
通电
过滤
MgCl2+Ca(OH)2 ===
Mg(OH)2↓+CaCl2
稀盐酸
2. (2021北京改编)真空热还原法生产钙的主要转化过程如下:
(1)石灰石的主要成分是_______,步骤Ⅰ发生反应的化学方程式为________________________。
碳酸钙
CaCO3 CaO+CO2↑
(2)Ⅱ中反应有两种产物,固体X一定含有氧元素和
铝元素,从元素守恒角度说明理由:______________________________
___________________________。
(3)Ⅲ中发生的是______(填“物理”或“化学”)变化。
Ⅱ中反应物有钙、氧、铝三种元
素,产物钙蒸气中含有钙元素
物理
3. (2021陕西)铁是应用最广泛且年产量最高的金属,据有关报道,每年有年产量20%~40%的金属材料因锈蚀而报废。工业上常用赤铁矿石(主要成分为Fe2O3)进行铁的冶炼,其简易流程如下:
(1)反应③的化学方程式为____________________________。
(2)铁制品锈蚀的过程实际上是铁与_________发生反应的过程。
3CO+Fe2O3 2Fe+3CO2
氧气和水
(3)为防止铁制品锈蚀,常在其表面镀一层金属锌或铜等,为了验证铁、铜、锌的金属活动性强弱,可选择的试剂是_____(填字母)。
A. 铁片、ZnSO4溶液、CuSO4溶液
B. 铜片、ZnSO4溶液、FeSO4溶液
C. 锌片、铜片、FeSO4溶液
D. 铜片、铁片、ZnSO4溶液
AC
4. 工业上生产电路板及处理废液的工艺流程如下:
已知:Fe+2FeCl3=== 3FeCl2
(1)由步骤①可判断FeCl3与铜反应生成的两种产物是_____________。
(2)步骤②中发生置换反应的化学方程式为_______________________。
(3)步骤③加入稀盐酸充分搅拌,当观察到_______________的现象时,说明滤渣只剩铜。
FeCl2、CuCl2
Fe+CuCl2 === FeCl2+Cu
不再有气泡产生
5. (2021安徽节选)某燃煤电厂产生的固体废弃物粉煤灰中含有较多的氧化铝。从粉煤灰中提取氧化铝的工艺流程如下。
(1)“酸浸”中使用的酸是____(填字母序号)。
A. HCl B. H2SO4 C. Na2SO4
B
(2)流程中涉及到的氧化物有_______(写出1种即可)。
(3)“煅烧”过程发生反应的化学方程式为__________________________。
(4)该工艺的价值在于___________。
Al2O3
2Al(OH)3 Al2O3+3H2O
废物再利用
6. (2021乐山改编)纳米碳酸钡是一种重要的无机化工产品,某工厂用含SiO2杂质的BaCO3为原料制备纳米碳酸钡的工艺流程如图所示:
酸碱盐相关的流程图
请回答:
(1)SiO2性质稳定,但常温下易与氢氟酸反应,该反应的化学方程式为SiO2+4HF=== X+2H2O,则X的化学式为_____。
(2)流程中加入盐酸时发生反应的化学方程式为______________________
___________________。
(3)写出副产品的用途_______(写一条即可)。
SiF4
BaCO3+2HCl ===
BaCl2+CO2↑+H2O
作氮肥
7. (2021陕西定心卷)同学们进行实验活动时在实验室发现一瓶烧碱溶液,为探究此溶液是否变质以及变质的程度,同学们设计了如下方案,请你一起参与并回答问题。
方案一:烧碱样品 产生气泡
方案二:烧碱样品 无色滤液
(1)方案一中X溶液是_______。
(2)方案二中加入BaCl2溶液时发生反应的化学方程式为_______________
___________________。
足量X溶液
过量BaCl2溶液
反应后过滤
稀盐酸
Na2CO3+BaCl2
=== BaCO3↓+2NaCl
(3)取方案二中的无色滤液于试管中,滴加无色酚酞溶液,观察到_____
_____,证明该瓶烧碱溶液部分变质,下列方案能得出相同结论的是_____
(填字母)。
A. 取方案二中的无色滤液于试管中,滴加FeCl3溶液
B. 用pH试纸测定方案二中无色滤液的pH
C. 取方案二中的无色滤液于试管中,通入CO2
溶液
变红
ABC
8. 某化学兴趣小组同学在处理实验后残留的废液时,发现其中含有Na2CO3、KNO3和Na2SO4,在老师的指导下,该化学小组同学设计如图所示流程回收其中的KNO3。
(1)步骤①发生反应的化学方程式为________________________________
(任写一个)。
(2)滤液B中的阴离子有___________________(写离子符号)。
(3)步骤④包含的基本操作是加热浓缩、________、过滤。
Na2SO4+BaCl2=== BaSO4↓+2NaCl
、 、Cl-
降温结晶
9. 水垢(主要成分为碳酸钙、氢氧化镁)俗称“水锈、水碱”,是指硬水煮沸后所含矿物质附着在容器内壁逐渐形成的白色块状或粉末状的物质。实验室用水垢制取氯化钙的流程如下:
(1)步骤①中观察到的现象是__________。
有气泡产生
(2)步骤②中选用氢氧化钙不用氢氧化钠的原因是___________________
_________________________;发生反应的化学方程式为_____________
_____________________(任写一个)。
(3)步骤③过滤后所得滤液中的溶质成分是________________(写化学式)。
(4)步骤④加入过量盐酸不会影响产物的纯度,原因是________________
_______________________________。
氢氧化钠与稀盐酸、
氯化镁反应产生氯化钠杂质
Ca(OH)2+
2HCl === 2H2O+CaCl2
CaCl2、Ca(OH)2
盐酸具有挥发性,
加热蒸发氯化氢气体会全部挥发掉
10. (2021高新一中七模改编)实验室有一包白色固体粉末,可能由氢氧化钠、硫酸钠、硝酸镁、硫酸铜、碳酸钙中的一种或几种物质组成。为确定其成分,化学兴趣小组同学设计并进行了如下实验:
请回答:(1)步骤①中加水溶解需用的仪器有玻璃棒和______。
(2)写出步骤②中可能发生反应的化学方程式____________________________
__________。
(3)由以上的实验可知,这包白色固体中
一定含有的物质是____________
________(填化学式)。
(4)根据步骤⑤中的实验现象,小东认为
原固体中一定还含有NaOH,小亮不同
意他的观点,理由是________________
__________________________________
___________。
烧杯
Mg(OH)2+2HCl===MgCl2
CaCO3、
Na2SO4
加入的氢氧化钡与
酞溶液变红
硫酸钠反应生成的氢氧化钠也能使酚
+2H2O
11. (2021山西)造纸术是中国古代四大发明之一。一直以来,传统工艺不断改进。现阶段,利用方解石(主要成分为CaCO3,还含有少量MgO、Fe2O3、SiO2等杂质)造纸已较为普遍,它取代传统的植物纤维造纸,全程无需用水,原料造价仅为传统造纸的 。(已知:SiO2、聚乙烯塑料、粘合剂均难溶于水,且不与盐酸反应。)分析生产过程,回答下列问题:
(1)将方解石粉碎成纳米级超细粉末的目的是______________。
(2)混合器内需要进行的操作是______。
(3)利用方解石作原料生产纸张的优点是________。
(4)从绿色环保的角度分析,对使用的原料需要改进的地方是__________
_______。
(5)成品纸张在保存过程中应避免与酸接触,若遇到稀盐酸,则可能发生反应的化学方程式为___________________________________(写1个)。
提高纸张质量
搅拌
成本低
使用可降
解塑料
CaCO3+2HCl === CaCl2+H2O+CO2↑
拓展类
12. (2021云南)“垃圾是放错的资源”。碘循环工艺不仅能吸收SO2,减少环境污染,而且还可以得到仅含一种元素的化工原料X,流程如下:
(1)流程中可循环利用的物质是____。
(2)膜反应器中发生的是分解反应,X的化学式是____。
(3)反应器中发生反应的化学方程式为_______________________________。
碘
H2
SO2+I2+2H2O ===== H2SO4+2HI
20~100 ℃
13. (2021西工大附中八模)2021年3月全国两会期间,政府工作报告中提到“中国将力争碳排放于2030年前达到峰值,争取在2060年前实现碳中和”。“碳中和”是指某个地区在一定时间内,人类活动直接和间接排放的碳总量,与通过植树造林、工业固碳等方式吸收的碳总量相互抵消,实现碳“净零排放”。“碳捕获”并封存被认为是目前减缓全球变暖最经济可行的方式。如图是一种利用NaOH溶液实现“碳捕获”的技术主要流程。
(1)分离器中,Na2CO3发生反应的化学方程式为___________________
______________________。
(2)用该技术进行“碳捕获”有效利用了原材料,在该过程没有涉及到的基本反应类型是_____反应。
(3)下列措施对实现“碳中和”有利的是________。
A. 一定条件下,将CO2转化为CH3OH,实现CO2的资源化利用
B. 推动使用太阳能等可再生能源
C. 为维持好碳、氧循环,大力植树造林,减少化石燃料燃烧
D. 电动汽车替代燃油汽车,减少大气污染
Na2CO3+Ca(OH)2
=== CaCO3↓+ 2NaOH
置换
ABCD
同课章节目录
