2022年化学中考精准复习之技巧性计算题课件(三)(共39页)
文档属性
| 名称 | 2022年化学中考精准复习之技巧性计算题课件(三)(共39页) |

|
|
| 格式 | zip | ||
| 文件大小 | 741.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 00:00:00 | ||
图片预览










文档简介
(共39张PPT)
2022年化学中考精准复习之
技巧性计算题课件(三)
专题分类突破
1
专题综合训练
2
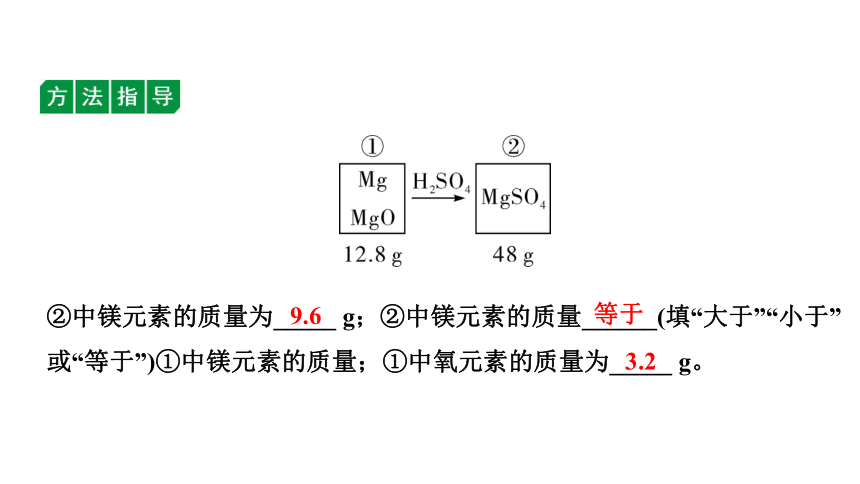
例1 有一包Mg和MgO的混合物共12.8 g,与一定量的稀硫酸恰好完全反应,所得溶液中溶质的质量为48 g,则原混合物中氧元素的质量为( )
A. 9.6 g B. 3.2 g C. 2.4 g D. 1.6 g
守恒法(始终态)
B
②中镁元素的质量为_____ g;②中镁元素的质量______(填“大于”“小于”或“等于”)①中镁元素的质量;①中氧元素的质量为_____ g。
9.6
等于
3.2
1. 碳酸钙和氧化钙组成的混合物中钙元素的质量分数为50%,将30 g该混合物高温煅烧至固体质量不再改变,则生成二氧化碳的质量为( )
A. 15 g B. 13.2 g C. 9 g D. 6.6 g
C
2. (2021郑州外国语三模)铝不仅能跟酸反应,还能跟碱溶液反应。将一定量的铝放入60 g氢氧化钠溶液中,恰好反应,生成NaAlO2和一种气体单质,其反应的化学方程式为____________________________________
_____,如反应前后溶液中钠元素的质量分数之比为27∶25,则生成氢气为____ g。
2Al+2NaOH+2H2O === 2NaAlO2
0.6
3H2↑
极值法(确定混合物成分)
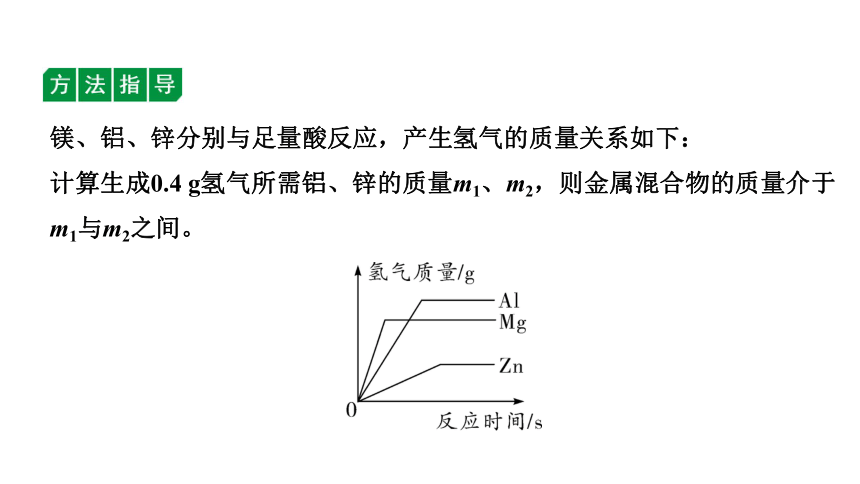
例2 将一定量的镁粉、铝粉、锌粉的混合物与足量的稀硫酸完全反应,生成0.4 g氢气,则金属混合物的质量不可能是( )
A. 4.8 g B. 5.4 g C. 9.2 g D. 13.0 g
D
镁、铝、锌分别与足量酸反应,产生氢气的质量关系如下:
计算生成0.4 g氢气所需铝、锌的质量m1、m2,则金属混合物的质量介于m1与m2之间。
1. (2021达州)已知一包铁粉中含有两种杂质,小明同学取5.6 g该粉末,向其中加入足量的稀硫酸,充分反应后,得到0.5 g氢气。则该样品中的杂质可能是( )
A. Mg和Zn B. Al和Zn
C. Zn和Cu D. Mg和Cu
B
2. (2020洛阳二模)现有7.45 g KCl样品(其中混有少量下列某种盐类),加水溶解,当它跟足量硝酸银溶液充分反应后, 得到AgCl沉淀14 g,则可能混入的盐是( )
A. NaCl B. MgCl2
C. CaCl2 D. BaCl2
D
差量法(质量变化)
例3 现有NaCl和NaBr的混合物共2.2 g,溶于水并加入过量AgNO3溶液后,生成AgCl和AgBr沉淀共4.75 g,则原混合物中含钠元素的质量为______ g。
0.69
①银元素与钠元素的质量差(Δm)为______ g;
②钠元素质量(x)与该质量差的比例关系式为____________。
2.55
1. 现有CaCl2和BaCl2的混合物共17.75 g,溶于水后加入足量的Na2CO3溶液后,生成沉淀共16.65 g,则原混合物中氯元素的质量分数为( )
A. 40% B. 50%
C. 60% D. 无法计算
2. 向20 g碳酸钠和硫酸钠的混合物中,加入100 g稀硫酸,恰好完全反应后将滤液蒸干,得固体23.6 g,则原混合物中硫酸钠的质量分数为_____。
A
47%
假设法
例4 向某氯化钡溶液中加入一定质量的硫酸溶液,二者恰好完全反应,过滤,所得溶液的质量与原氯化钡溶液的质量相等。则所加硫酸溶液中溶质质量分数的计算式为( )
B
假设硫酸钡的质量为233 g,可计算出H2SO4和硫酸溶液的质量分别为____g、_____g。
98
233
1. 铜粉和锌粉的混合物与足量的稀盐酸充分反应后,过滤,将滤渣在空气中充分加热,冷却后称量,测得固体质量恰好等于原混合物的质量,则原混合物中锌的质量分数为( )
A. 20% B. 25%
C. 75% D. 80%
A
固定组成法
例5 现有Na2S、Na2SO3、Na2SO4组成的混合物,经测定其中硫元素的质量分数为32%,则该混合物中氧元素的质量分数为( )
A. 16% B. 22%
C. 32% D. 46%
B
①硫元素与钠元素的质量比为_______,则钠元素的质量分数为______;
②则混合物中氧元素的质量分数为100%-______-_______=_______。
32∶46
46%
46%
32%
22%
1. 有C5H10、C3H6O、C6H12O6组成的混合物,经测定含氧元素的质量分数为30%,则碳元素的质量分数为( )
A. 60% B. 45%
C. 30% D. 22.5%
A
转化关系法
例6 20 g Fe2O3和CuO的混合物与200 g稀硫酸恰好完全反应后再滴加100 g 24%的NaOH溶液至恰好沉淀完全,则所用稀硫酸的溶质质量分数为( )
A. 9.8% B. 14.7%
C. 19.6% D. 29.4%
B
1
2
①反应中H2SO4中的SO42-最终转化为Na2SO4中的SO42-,NaOH中Na+最终转化为Na2SO4中的Na+。
②配平关系: H2SO4~ NaOH。
1. (2021洛阳二模)将20 g镁和铝的混合物加到一定质量稀硫酸中恰好完全反应。测得溶液质量增加了18 g,将反应后溶液蒸干,得到硫酸盐固体的质量是( )
A. 118 g B. 116 g
C. 98 g D. 144 g
B
1. 等质量的氢气、乙醇、木炭分别与足量的氧气反应,消耗氧气的质量由多到少的顺序正确的是( )
A. 木炭、乙醇、氢气 B. 氢气、乙醇、木炭
C. 乙醇、氢气、木炭 D. 氢气、木炭、乙醇
D
2. (荆州)由CO和SO2组成的混合气体,测得其中碳元素的质量分数是24%,则该混合气体中硫元素的质量分数是( )
A. 16% B. 18%
C. 20% D. 22%
D
3. 某过氧化氢溶液中氧元素的质量分数为90%,加入二氧化锰充分反应后,过滤得135 g液体,则生成氧气的质量为( )
A. 60.75 g B. 10 g C. 15 g D. 121.5 g
4. 由Mg(OH)2和MgO组成的混合物,测得镁元素的质量分数为48%。取该混合物10 g,将其投入110 g稀硫酸中恰好完全反应,所得溶液中溶质的质量分数为( )
A. 12% B. 24% C. 20% D. 30%
C
C
5. (2021贺州)将含有CH4和H2的混合气体6 g完全燃烧,把产生的气体通入足量的澄清石灰水中,得到20 g白色沉淀。则原混合气体中CH4和H2的质量比为( )
A. 2∶3 B. 3∶10
C. 8∶1 D. 8∶7
D
6. (2021河南省实验二模)我国生产的新冠病毒疫苗属于灭活疫苗。灭活疫苗是指先对病毒或细菌培养,然后用加热或化学方法将其杀死,但保留相应抗原的免疫原性。生产灭活疫苗时常用到甲醛的水溶液来杀死细菌病毒。已知某甲醛(HCHO)水溶液中氧元素的质量分数为75.2%,则该溶液中甲醛的质量分数为( )
A. 9.4% B. 15.4%
C. 38.5% D. 40%
C
7. 相同质量的碳酸镁和碳酸氢钠分别与足量的盐酸反应,下列有关说法正确的是( )
A. 消耗的氯化氢一样多
B. 碳酸镁消耗的氯化氢少
C. 生成的二氧化碳一样多
D. 碳酸氢钠生成的二氧化碳少
C
8. (2021郑州73中一模)向30 g纯碱和氯化钠的混合物中加入100 g稀盐酸,恰好完全反应将反应后溶液蒸干,得固体32.2 g,则原混合物中氯化钠的质量是( )
A. 2.2 g B. 8.8 g C. 16.2 g D. 29.2 g
9. 一定质量的氧化铁加入到某稀硫酸中,恰好完全反应,所得溶液的质量为氧化铁质量的16倍,则所得溶液中溶质的质量分数约为( )
A. 15.6% B. 8.2% C. 6.3% D. 12.5%
B
A
10. (2021河南省实验一模)已知某种氧化铜样品中含有下列选项四种杂质中的两种,取8 g样品与100 g溶质质量分数为7.3%的稀盐酸恰好完全反应,则该样品中一定含有( )
A. Fe2O3 B. Cu
C. Cu(OH)2 D. CaCO3
A
11. 现有MgCO3和BaCO3组成的固体混合物6 g,放入到100 g某浓度的稀盐酸中恰好完全反应,得到不饱和溶液的质量为103.8 g,则原固体混合物中Mg、Ba两种元素的质量分数总和为_______。
12. 取9.3 g已部分变质的氢氧化钠固体与73 g溶质质量分数为10%的盐酸恰好完全反应,将所得溶液蒸干,理论上得到固体物质的质量为_____ g。
50%
11.7
13. 充分加热24 g含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为3∶4,则该反应生成水和二氧化碳的质量之和为____ g。
6
14. (2021湘潭)取一定质量的Fe(OH)3固体加热至550 ℃完全分解为Fe2O3和H2O,温度提高到1400 ℃时,Fe2O3继续分解为复杂的铁的氧化物和O2;将产生的气体先通过浓硫酸,浓硫酸质量增加5.4克,再通过灼热的铜网,铜网质量增加0.8克(产生的气体均被完全吸收)。则所得复杂的铁的氧化物化学式为( )
A. FeO B. Fe3O4 C. Fe4O5 D. Fe5O7
C
15. 在H2SO4和CuSO4的混合溶液中,加入适量铁粉,使其恰好完全反应,反应后经过过滤得到固体的质量与所加铁粉的质量相等,则混合溶液中H2SO4和CuSO4的质量比为( )
A. 7∶8 B. 8∶7
C. 7∶80 D. 80∶7
C
16. (2021开封二模)有一包金属粉末,可能由Mg、Al、Fe、Cu中的一种或几种组成。取一定质量该金属粉末,加入100 g 19.6%的稀硫酸,恰好完全反应,只得到氢气和无色溶液,则所得无色溶液中溶质的质量可能为( )
A. 23.4 g B. 26.6 g
C. 27.2 g D. 30.4 g
A
17. 等质量的硫酸镁、硫酸铜和硫酸钠三种溶液分别与等质量、等浓度的氯化钡溶液均恰好完全反应且生成的沉淀质量相等,则原三种溶液的溶质质量分数的大小关系为( )
A. 硫酸镁=硫酸钠=硫酸铜
B. 硫酸铜>硫酸镁>硫酸钠
C. 硫酸铜>硫酸钠>硫酸镁
D. 硫酸镁>硫酸钠>硫酸铜
C
18. (2020郑州八中一模改编)在密闭容器中,点燃C2H4和O2的混合气体,充分燃烧后,容器中的气体全部转化为CO2、CO和H2O。冷却至室温后,检验反应后的混合气体中,碳元素与氧元素的质量比为3∶10。则反应前C2H4和O2的质量比为( )
A. 3∶20 B. 1∶4
C. 11∶30 D. 7∶30
B
19. (2021开封二模)木炭和碳酸钙的混合物24.2 g在空气中受强热后,碳酸钙全部分解,木炭完全转化成二氧化碳,如果生成的二氧化碳总质量等于混合物的总质量,则混合物中木炭的质量为_____ g。
20. (2020河南19题1分)现有乙醇和乙醛(CH3CHO)的混合物共13.4 g,完全燃烧后生成26.4 g CO2,则生成H2O的质量为_____ g。
4.2
12.6
21. (2021河南定心卷)康康同学对化学中的计算问题十分感兴趣,他自己命制了两道试题请同学解答。
(1)试题1:将四种盐①Na2CO3、②NaHCO3、③CaCO3、④K2CO3分别投入等质量、等浓度的足量稀盐酸中,充分反应后所得四种溶液的质量相等,则投入盐的质量由小到大的顺序为__________(填序号)。
④①③②
(2)试题2:在由上述四种盐组成的混合物中,若氧元素的质量分数为32%,则混合物中碳元素的质量分数为多少?小明同学经过思考后,指出该题存在一个科学性错误,请你指出该错误:____________________
_________________________________________________________________________。
四种盐中碳酸钾中氧
元素的质量分数最小,约为34.8%,因此混合物中氧元素的质量分数不
可能为32%
2022年化学中考精准复习之
技巧性计算题课件(三)
专题分类突破
1
专题综合训练
2
例1 有一包Mg和MgO的混合物共12.8 g,与一定量的稀硫酸恰好完全反应,所得溶液中溶质的质量为48 g,则原混合物中氧元素的质量为( )
A. 9.6 g B. 3.2 g C. 2.4 g D. 1.6 g
守恒法(始终态)
B
②中镁元素的质量为_____ g;②中镁元素的质量______(填“大于”“小于”或“等于”)①中镁元素的质量;①中氧元素的质量为_____ g。
9.6
等于
3.2
1. 碳酸钙和氧化钙组成的混合物中钙元素的质量分数为50%,将30 g该混合物高温煅烧至固体质量不再改变,则生成二氧化碳的质量为( )
A. 15 g B. 13.2 g C. 9 g D. 6.6 g
C
2. (2021郑州外国语三模)铝不仅能跟酸反应,还能跟碱溶液反应。将一定量的铝放入60 g氢氧化钠溶液中,恰好反应,生成NaAlO2和一种气体单质,其反应的化学方程式为____________________________________
_____,如反应前后溶液中钠元素的质量分数之比为27∶25,则生成氢气为____ g。
2Al+2NaOH+2H2O === 2NaAlO2
0.6
3H2↑
极值法(确定混合物成分)
例2 将一定量的镁粉、铝粉、锌粉的混合物与足量的稀硫酸完全反应,生成0.4 g氢气,则金属混合物的质量不可能是( )
A. 4.8 g B. 5.4 g C. 9.2 g D. 13.0 g
D
镁、铝、锌分别与足量酸反应,产生氢气的质量关系如下:
计算生成0.4 g氢气所需铝、锌的质量m1、m2,则金属混合物的质量介于m1与m2之间。
1. (2021达州)已知一包铁粉中含有两种杂质,小明同学取5.6 g该粉末,向其中加入足量的稀硫酸,充分反应后,得到0.5 g氢气。则该样品中的杂质可能是( )
A. Mg和Zn B. Al和Zn
C. Zn和Cu D. Mg和Cu
B
2. (2020洛阳二模)现有7.45 g KCl样品(其中混有少量下列某种盐类),加水溶解,当它跟足量硝酸银溶液充分反应后, 得到AgCl沉淀14 g,则可能混入的盐是( )
A. NaCl B. MgCl2
C. CaCl2 D. BaCl2
D
差量法(质量变化)
例3 现有NaCl和NaBr的混合物共2.2 g,溶于水并加入过量AgNO3溶液后,生成AgCl和AgBr沉淀共4.75 g,则原混合物中含钠元素的质量为______ g。
0.69
①银元素与钠元素的质量差(Δm)为______ g;
②钠元素质量(x)与该质量差的比例关系式为____________。
2.55
1. 现有CaCl2和BaCl2的混合物共17.75 g,溶于水后加入足量的Na2CO3溶液后,生成沉淀共16.65 g,则原混合物中氯元素的质量分数为( )
A. 40% B. 50%
C. 60% D. 无法计算
2. 向20 g碳酸钠和硫酸钠的混合物中,加入100 g稀硫酸,恰好完全反应后将滤液蒸干,得固体23.6 g,则原混合物中硫酸钠的质量分数为_____。
A
47%
假设法
例4 向某氯化钡溶液中加入一定质量的硫酸溶液,二者恰好完全反应,过滤,所得溶液的质量与原氯化钡溶液的质量相等。则所加硫酸溶液中溶质质量分数的计算式为( )
B
假设硫酸钡的质量为233 g,可计算出H2SO4和硫酸溶液的质量分别为____g、_____g。
98
233
1. 铜粉和锌粉的混合物与足量的稀盐酸充分反应后,过滤,将滤渣在空气中充分加热,冷却后称量,测得固体质量恰好等于原混合物的质量,则原混合物中锌的质量分数为( )
A. 20% B. 25%
C. 75% D. 80%
A
固定组成法
例5 现有Na2S、Na2SO3、Na2SO4组成的混合物,经测定其中硫元素的质量分数为32%,则该混合物中氧元素的质量分数为( )
A. 16% B. 22%
C. 32% D. 46%
B
①硫元素与钠元素的质量比为_______,则钠元素的质量分数为______;
②则混合物中氧元素的质量分数为100%-______-_______=_______。
32∶46
46%
46%
32%
22%
1. 有C5H10、C3H6O、C6H12O6组成的混合物,经测定含氧元素的质量分数为30%,则碳元素的质量分数为( )
A. 60% B. 45%
C. 30% D. 22.5%
A
转化关系法
例6 20 g Fe2O3和CuO的混合物与200 g稀硫酸恰好完全反应后再滴加100 g 24%的NaOH溶液至恰好沉淀完全,则所用稀硫酸的溶质质量分数为( )
A. 9.8% B. 14.7%
C. 19.6% D. 29.4%
B
1
2
①反应中H2SO4中的SO42-最终转化为Na2SO4中的SO42-,NaOH中Na+最终转化为Na2SO4中的Na+。
②配平关系: H2SO4~ NaOH。
1. (2021洛阳二模)将20 g镁和铝的混合物加到一定质量稀硫酸中恰好完全反应。测得溶液质量增加了18 g,将反应后溶液蒸干,得到硫酸盐固体的质量是( )
A. 118 g B. 116 g
C. 98 g D. 144 g
B
1. 等质量的氢气、乙醇、木炭分别与足量的氧气反应,消耗氧气的质量由多到少的顺序正确的是( )
A. 木炭、乙醇、氢气 B. 氢气、乙醇、木炭
C. 乙醇、氢气、木炭 D. 氢气、木炭、乙醇
D
2. (荆州)由CO和SO2组成的混合气体,测得其中碳元素的质量分数是24%,则该混合气体中硫元素的质量分数是( )
A. 16% B. 18%
C. 20% D. 22%
D
3. 某过氧化氢溶液中氧元素的质量分数为90%,加入二氧化锰充分反应后,过滤得135 g液体,则生成氧气的质量为( )
A. 60.75 g B. 10 g C. 15 g D. 121.5 g
4. 由Mg(OH)2和MgO组成的混合物,测得镁元素的质量分数为48%。取该混合物10 g,将其投入110 g稀硫酸中恰好完全反应,所得溶液中溶质的质量分数为( )
A. 12% B. 24% C. 20% D. 30%
C
C
5. (2021贺州)将含有CH4和H2的混合气体6 g完全燃烧,把产生的气体通入足量的澄清石灰水中,得到20 g白色沉淀。则原混合气体中CH4和H2的质量比为( )
A. 2∶3 B. 3∶10
C. 8∶1 D. 8∶7
D
6. (2021河南省实验二模)我国生产的新冠病毒疫苗属于灭活疫苗。灭活疫苗是指先对病毒或细菌培养,然后用加热或化学方法将其杀死,但保留相应抗原的免疫原性。生产灭活疫苗时常用到甲醛的水溶液来杀死细菌病毒。已知某甲醛(HCHO)水溶液中氧元素的质量分数为75.2%,则该溶液中甲醛的质量分数为( )
A. 9.4% B. 15.4%
C. 38.5% D. 40%
C
7. 相同质量的碳酸镁和碳酸氢钠分别与足量的盐酸反应,下列有关说法正确的是( )
A. 消耗的氯化氢一样多
B. 碳酸镁消耗的氯化氢少
C. 生成的二氧化碳一样多
D. 碳酸氢钠生成的二氧化碳少
C
8. (2021郑州73中一模)向30 g纯碱和氯化钠的混合物中加入100 g稀盐酸,恰好完全反应将反应后溶液蒸干,得固体32.2 g,则原混合物中氯化钠的质量是( )
A. 2.2 g B. 8.8 g C. 16.2 g D. 29.2 g
9. 一定质量的氧化铁加入到某稀硫酸中,恰好完全反应,所得溶液的质量为氧化铁质量的16倍,则所得溶液中溶质的质量分数约为( )
A. 15.6% B. 8.2% C. 6.3% D. 12.5%
B
A
10. (2021河南省实验一模)已知某种氧化铜样品中含有下列选项四种杂质中的两种,取8 g样品与100 g溶质质量分数为7.3%的稀盐酸恰好完全反应,则该样品中一定含有( )
A. Fe2O3 B. Cu
C. Cu(OH)2 D. CaCO3
A
11. 现有MgCO3和BaCO3组成的固体混合物6 g,放入到100 g某浓度的稀盐酸中恰好完全反应,得到不饱和溶液的质量为103.8 g,则原固体混合物中Mg、Ba两种元素的质量分数总和为_______。
12. 取9.3 g已部分变质的氢氧化钠固体与73 g溶质质量分数为10%的盐酸恰好完全反应,将所得溶液蒸干,理论上得到固体物质的质量为_____ g。
50%
11.7
13. 充分加热24 g含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为3∶4,则该反应生成水和二氧化碳的质量之和为____ g。
6
14. (2021湘潭)取一定质量的Fe(OH)3固体加热至550 ℃完全分解为Fe2O3和H2O,温度提高到1400 ℃时,Fe2O3继续分解为复杂的铁的氧化物和O2;将产生的气体先通过浓硫酸,浓硫酸质量增加5.4克,再通过灼热的铜网,铜网质量增加0.8克(产生的气体均被完全吸收)。则所得复杂的铁的氧化物化学式为( )
A. FeO B. Fe3O4 C. Fe4O5 D. Fe5O7
C
15. 在H2SO4和CuSO4的混合溶液中,加入适量铁粉,使其恰好完全反应,反应后经过过滤得到固体的质量与所加铁粉的质量相等,则混合溶液中H2SO4和CuSO4的质量比为( )
A. 7∶8 B. 8∶7
C. 7∶80 D. 80∶7
C
16. (2021开封二模)有一包金属粉末,可能由Mg、Al、Fe、Cu中的一种或几种组成。取一定质量该金属粉末,加入100 g 19.6%的稀硫酸,恰好完全反应,只得到氢气和无色溶液,则所得无色溶液中溶质的质量可能为( )
A. 23.4 g B. 26.6 g
C. 27.2 g D. 30.4 g
A
17. 等质量的硫酸镁、硫酸铜和硫酸钠三种溶液分别与等质量、等浓度的氯化钡溶液均恰好完全反应且生成的沉淀质量相等,则原三种溶液的溶质质量分数的大小关系为( )
A. 硫酸镁=硫酸钠=硫酸铜
B. 硫酸铜>硫酸镁>硫酸钠
C. 硫酸铜>硫酸钠>硫酸镁
D. 硫酸镁>硫酸钠>硫酸铜
C
18. (2020郑州八中一模改编)在密闭容器中,点燃C2H4和O2的混合气体,充分燃烧后,容器中的气体全部转化为CO2、CO和H2O。冷却至室温后,检验反应后的混合气体中,碳元素与氧元素的质量比为3∶10。则反应前C2H4和O2的质量比为( )
A. 3∶20 B. 1∶4
C. 11∶30 D. 7∶30
B
19. (2021开封二模)木炭和碳酸钙的混合物24.2 g在空气中受强热后,碳酸钙全部分解,木炭完全转化成二氧化碳,如果生成的二氧化碳总质量等于混合物的总质量,则混合物中木炭的质量为_____ g。
20. (2020河南19题1分)现有乙醇和乙醛(CH3CHO)的混合物共13.4 g,完全燃烧后生成26.4 g CO2,则生成H2O的质量为_____ g。
4.2
12.6
21. (2021河南定心卷)康康同学对化学中的计算问题十分感兴趣,他自己命制了两道试题请同学解答。
(1)试题1:将四种盐①Na2CO3、②NaHCO3、③CaCO3、④K2CO3分别投入等质量、等浓度的足量稀盐酸中,充分反应后所得四种溶液的质量相等,则投入盐的质量由小到大的顺序为__________(填序号)。
④①③②
(2)试题2:在由上述四种盐组成的混合物中,若氧元素的质量分数为32%,则混合物中碳元素的质量分数为多少?小明同学经过思考后,指出该题存在一个科学性错误,请你指出该错误:____________________
_________________________________________________________________________。
四种盐中碳酸钾中氧
元素的质量分数最小,约为34.8%,因此混合物中氧元素的质量分数不
可能为32%
同课章节目录
