2021—2022学年高一(下)化学鲁科版(2019)必修第二册第2章:化学键 化学反应规律课后题(Word版含答案)
文档属性
| 名称 | 2021—2022学年高一(下)化学鲁科版(2019)必修第二册第2章:化学键 化学反应规律课后题(Word版含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 729.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 08:04:12 | ||
图片预览


文档简介
2021—2022学年高一(下)化学鲁科版(2019)必修第二册第2章:化学键 化学反应规律课后题含答案
一、选择题。(14题)
1、反应C(s)+H2O(g) ===CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变会使反应速率加快的是( )
A.增加 C的质量
B.将容器的体积缩小一半
C.保持体积不变,充入氦气使体系压强增大
D.保持压强不变,充入氮气使容器体积增大
2、科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是( )
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O2H2↑+O2↑
D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂
3、已知拆开1 mol H—H键吸收能量E1,拆开1 mol O==O键吸收能量E2,结合1 mol H—O键放出能量E3,对于氢气燃烧生成水的反应的能量变化描述,下列各项正确的是( )
A.2E1+E2>2E3 B.2E1+E2<4E3
C.2E1+E2>4E3 D.2E1+E2<2E3
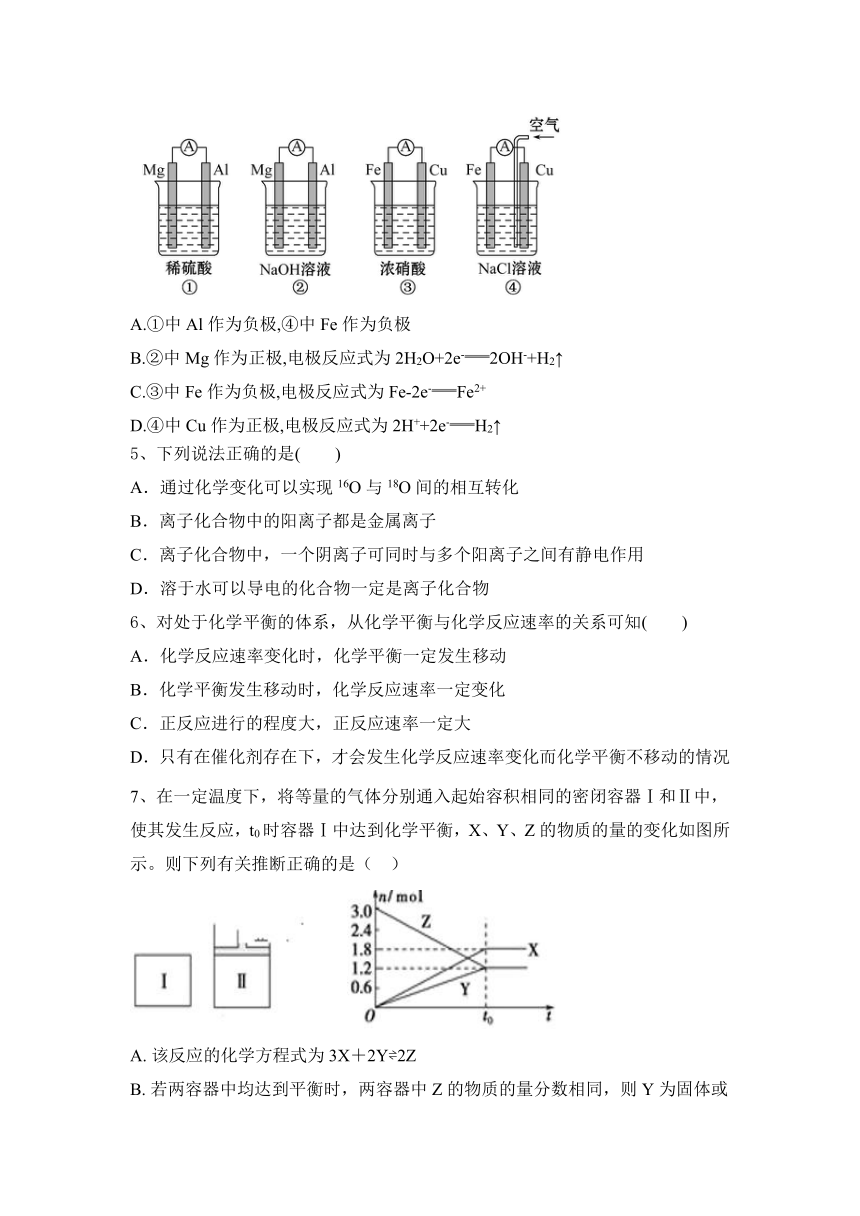
4、分析如图所示的四个原电池装置,其中结论正确的是 ( )
A.①中Al作为负极,④中Fe作为负极
B.②中Mg作为正极,电极反应式为2H2O+2e-2OH-+H2↑
C.③中Fe作为负极,电极反应式为Fe-2e-Fe2+
D.④中Cu作为正极,电极反应式为2H++2e-H2↑
5、下列说法正确的是( )
A.通过化学变化可以实现16O与18O间的相互转化
B.离子化合物中的阳离子都是金属离子
C.离子化合物中,一个阴离子可同时与多个阳离子之间有静电作用
D.溶于水可以导电的化合物一定是离子化合物
6、对处于化学平衡的体系,从化学平衡与化学反应速率的关系可知( )
A.化学反应速率变化时,化学平衡一定发生移动
B.化学平衡发生移动时,化学反应速率一定变化
C.正反应进行的程度大,正反应速率一定大
D.只有在催化剂存在下,才会发生化学反应速率变化而化学平衡不移动的情况
7、在一定温度下,将等量的气体分别通入起始容积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
A. 该反应的化学方程式为3X+2Y 2Z
B. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固体或液体
C. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
D. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
8、在通风橱中进行下列实验:
实验
现象 生铁(铁碳合金)棒表面产生大量无色气泡,液面上方变为红棕色 棒表面产生少量红棕色气体后,迅速停止 棒、棒表面均产生红棕色气体
下列说法正确的是( )
A.Ⅰ中发生原电池反应,正极产物是和
B.Ⅱ中发生原电池反应,红棕色气体是正极产物
C.Ⅲ中发生原电池反应期间,一直从向移动
D.Ⅲ中正极反应为
9、下列说法正确的是( )
A.共价化合物和离子化合物中,一定都含有非金属元素
B.阴阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小
C.失电子难的原子获得电子的能力一定强
D.含有共价键的化合物必是共价化合物
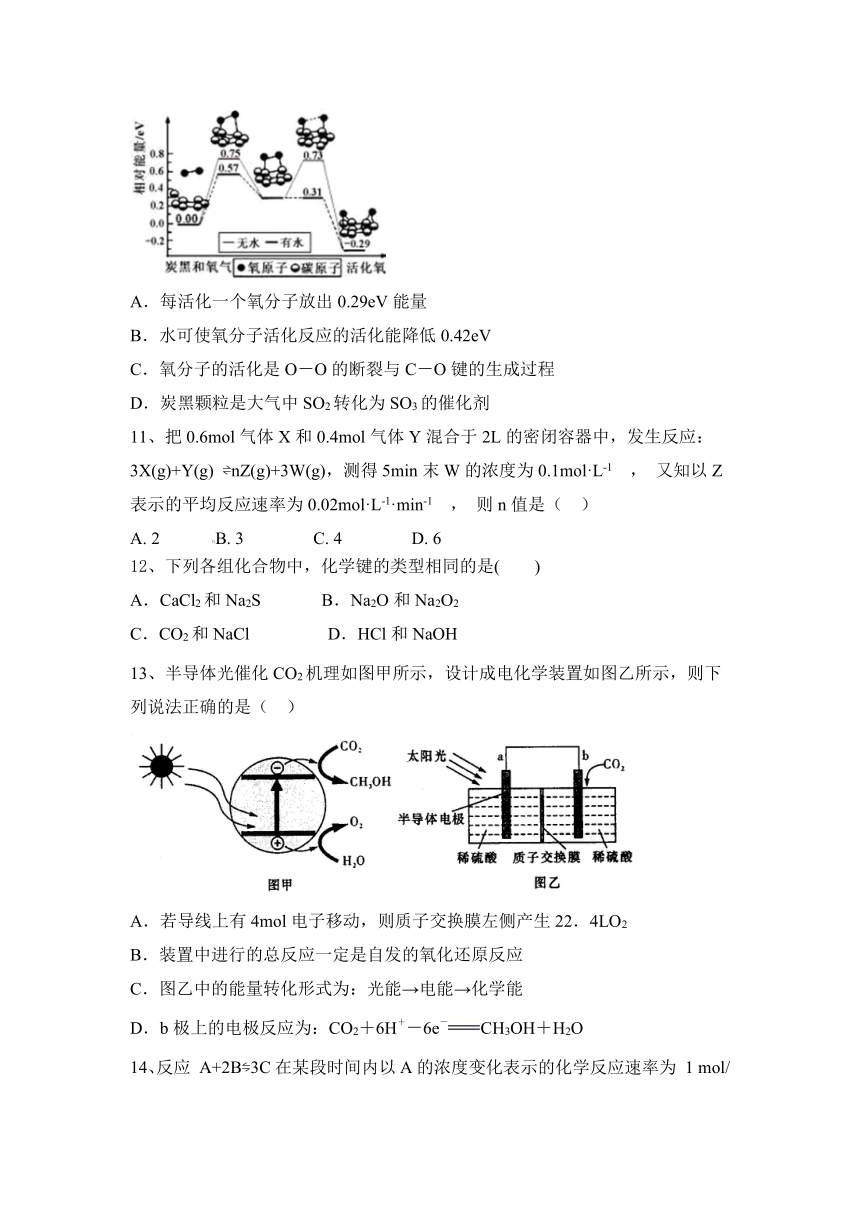
10、炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如右图所示。活化氧可以快速氧化 SO2。下列说法不正确的是( )
A.每活化一个氧分子放出0.29eV能量
B.水可使氧分子活化反应的活化能降低0.42eV
C.氧分子的活化是O-O的断裂与C-O键的生成过程
D.炭黑颗粒是大气中SO2转化为SO3的催化剂
11、把0.6mol气体X和0.4mol气体Y混合于2L的密闭容器中,发生反应:3X(g)+Y(g) nZ(g)+3W(g),测得5min末W的浓度为0.1mol·L-1 , 又知以Z表示的平均反应速率为0.02mol·L-1·min-1 , 则n值是( )
A. 2 B. 3 C. 4 D. 6
12、下列各组化合物中,化学键的类型相同的是( )
A.CaCl2和Na2S B.Na2O和Na2O2
C.CO2和NaCl D.HCl和NaOH
13、半导体光催化CO2机理如图甲所示,设计成电化学装置如图乙所示,则下列说法正确的是( )
A.若导线上有4mol电子移动,则质子交换膜左侧产生22.4LO2
B.装置中进行的总反应一定是自发的氧化还原反应
C.图乙中的能量转化形式为:光能→电能→化学能
D.b极上的电极反应为:CO2+6H+-6e-CH3OH+H2O
14、反应 A+2B 3C在某段时间内以A的浓度变化表示的化学反应速率为 1 mol/( L·min),则此段时间内以B的浓度变化表示的化学反应速率为( )
A. 0.5mol/( L·min) B. 1mol/( L·min)
C. 2mol/( L·min) D. 3mol/( L·min)
二、非选择题。
15、对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答)。
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 ① ②
2 ③ ④ ⑤ ⑥
3 ⑦ ⑧ ⑨ ⑩
(1)其原子能形成共价键的主族元素有__________________________。
(2)其原子只需形成1个共价单键就能达到稳定结构的元素有________。
(3)气态氢化物溶于水呈碱性的化合物是________。
(4)⑩号元素最高正价含氧酸只含有________键。
(5)含氧量最高的共价化合物是________(用电子式表示)。
(6)①⑤⑦形成化合物的化学式为________,含有的化学键类型是________,属于________化合物。
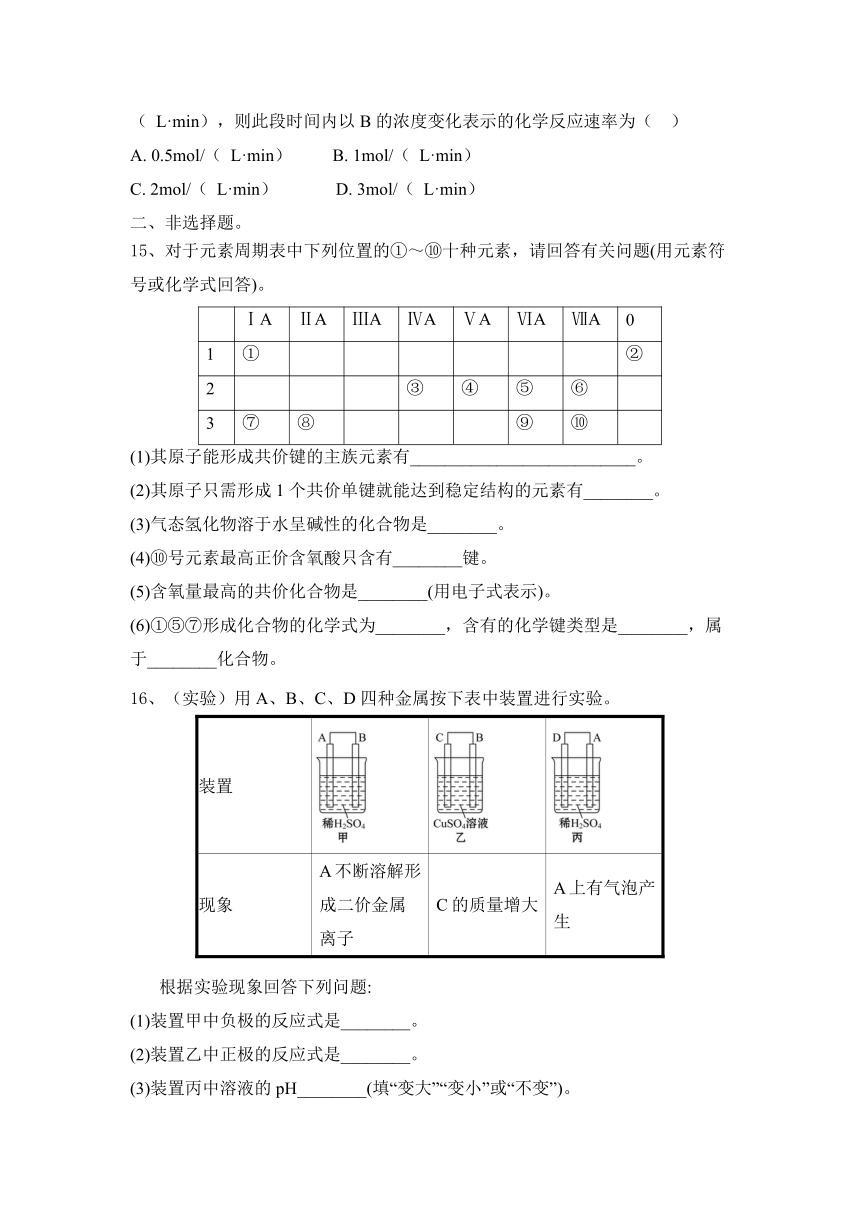
16、(实验)用A、B、C、D四种金属按下表中装置进行实验。
装置
现象 A不断溶解形成二价金属离子 C的质量增大 A上有气泡产生
根据实验现象回答下列问题:
(1)装置甲中负极的反应式是________。
(2)装置乙中正极的反应式是________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属的活泼性由强到弱的顺序是________。
17、在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) ===2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)A点处v(正)________v(逆),A点正反应速率________B点正反应速率(填“大于”“等于”或“小于”)。
(2)图中表示NO2变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=_________________________________________________________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
18、(推断题)已知五种元素的原子序数的大小顺序为C>A>B>D>E;其中,A、C同周期,B、C同主族;A与B形成的离子化合物,中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)画出元素C的原子结构示意图__________________________。
(2)写出元素D在元素周期表中的位置:第__________周期,第__________族;该元素形成的单质的结构式为:__________。
(3)写出下列物质的电子式:A、B、E形成的化合物__________,D、E形成的化合物__________。
(4)D、E形成的化合物受热蒸发,吸收的热量用于克服__________________。
(5)E、C两元素组成的化合物属于____________(填“离子”或“共价”化合物)。
写出其在氧气中完全燃烧的化学方程式________________________________。
2021—2022学年高一(下)化学鲁科版(2019)必修第二册第2章:化学键 化学反应规律课后题含答案
一、选择题。(14题)
1、反应C(s)+H2O(g) ===CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变会使反应速率加快的是( )
A.增加 C的质量
B.将容器的体积缩小一半
C.保持体积不变,充入氦气使体系压强增大
D.保持压强不变,充入氮气使容器体积增大
【答案】B
2、科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是( )
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O2H2↑+O2↑
D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂
【答案】C
3、已知拆开1 mol H—H键吸收能量E1,拆开1 mol O==O键吸收能量E2,结合1 mol H—O键放出能量E3,对于氢气燃烧生成水的反应的能量变化描述,下列各项正确的是( )
A.2E1+E2>2E3 B.2E1+E2<4E3
C.2E1+E2>4E3 D.2E1+E2<2E3
【答案】B
4、分析如图所示的四个原电池装置,其中结论正确的是 ( )
A.①中Al作为负极,④中Fe作为负极
B.②中Mg作为正极,电极反应式为2H2O+2e-2OH-+H2↑
C.③中Fe作为负极,电极反应式为Fe-2e-Fe2+
D.④中Cu作为正极,电极反应式为2H++2e-H2↑
【答案】B
5、下列说法正确的是( )
A.通过化学变化可以实现16O与18O间的相互转化
B.离子化合物中的阳离子都是金属离子
C.离子化合物中,一个阴离子可同时与多个阳离子之间有静电作用
D.溶于水可以导电的化合物一定是离子化合物
【答案】C
6、对处于化学平衡的体系,从化学平衡与化学反应速率的关系可知( )
A.化学反应速率变化时,化学平衡一定发生移动
B.化学平衡发生移动时,化学反应速率一定变化
C.正反应进行的程度大,正反应速率一定大
D.只有在催化剂存在下,才会发生化学反应速率变化而化学平衡不移动的情况
【答案】B
7、在一定温度下,将等量的气体分别通入起始容积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
A. 该反应的化学方程式为3X+2Y 2Z
B. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固体或液体
C. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
D. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
【答案】B
8、在通风橱中进行下列实验:
实验
现象 生铁(铁碳合金)棒表面产生大量无色气泡,液面上方变为红棕色 棒表面产生少量红棕色气体后,迅速停止 棒、棒表面均产生红棕色气体
下列说法正确的是( )
A.Ⅰ中发生原电池反应,正极产物是和
B.Ⅱ中发生原电池反应,红棕色气体是正极产物
C.Ⅲ中发生原电池反应期间,一直从向移动
D.Ⅲ中正极反应为
【答案】D
9、下列说法正确的是( )
A.共价化合物和离子化合物中,一定都含有非金属元素
B.阴阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小
C.失电子难的原子获得电子的能力一定强
D.含有共价键的化合物必是共价化合物
【答案】A
10、炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如右图所示。活化氧可以快速氧化 SO2。下列说法不正确的是( )
A.每活化一个氧分子放出0.29eV能量
B.水可使氧分子活化反应的活化能降低0.42eV
C.氧分子的活化是O-O的断裂与C-O键的生成过程
D.炭黑颗粒是大气中SO2转化为SO3的催化剂
【答案】B
11、把0.6mol气体X和0.4mol气体Y混合于2L的密闭容器中,发生反应:3X(g)+Y(g) nZ(g)+3W(g),测得5min末W的浓度为0.1mol·L-1 , 又知以Z表示的平均反应速率为0.02mol·L-1·min-1 , 则n值是( )
A. 2 B. 3 C. 4 D. 6
【答案】B
12、下列各组化合物中,化学键的类型相同的是( )
A.CaCl2和Na2S B.Na2O和Na2O2
C.CO2和NaCl D.HCl和NaOH
【答案】A
13、半导体光催化CO2机理如图甲所示,设计成电化学装置如图乙所示,则下列说法正确的是( )
A.若导线上有4mol电子移动,则质子交换膜左侧产生22.4LO2
B.装置中进行的总反应一定是自发的氧化还原反应
C.图乙中的能量转化形式为:光能→电能→化学能
D.b极上的电极反应为:CO2+6H+-6e-CH3OH+H2O
【答案】C
14、反应 A+2B 3C在某段时间内以A的浓度变化表示的化学反应速率为 1 mol/( L·min),则此段时间内以B的浓度变化表示的化学反应速率为( )
A. 0.5mol/( L·min) B. 1mol/( L·min)
C. 2mol/( L·min) D. 3mol/( L·min)
【答案】C
二、非选择题。
15、对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答)。
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 ① ②
2 ③ ④ ⑤ ⑥
3 ⑦ ⑧ ⑨ ⑩
(1)其原子能形成共价键的主族元素有__________________________。
(2)其原子只需形成1个共价单键就能达到稳定结构的元素有________。
(3)气态氢化物溶于水呈碱性的化合物是________。
(4)⑩号元素最高正价含氧酸只含有________键。
(5)含氧量最高的共价化合物是________(用电子式表示)。
(6)①⑤⑦形成化合物的化学式为________,含有的化学键类型是________,属于________化合物。
【答案】(1)H、C、N、O、F、S、Cl
(2)H、F、Cl (3)NH3 (4)共价
(6)NaOH 离子键、共价键 离子
解析:根据元素在周期表中的位置可推出①~⑩号元素分别为H、He、C、N、O、F、Na、Mg、S、Cl。(1)H、C、N、O、F、S和Cl都是主族非金属元素,其原子可形成共价键;Na、Mg都是主族活泼的金属元素,其原子可形成离子键。(2)H原子的K层上只有1个电子,获得1个电子后便形成2电子稳定结构,F原子的L层、Cl原子的M层都是有7个电子,获得1个电子便形成8电子稳定结构,因此,H、F、Cl元素的原子只需要形成1个共价单键就能达到稳定结构。(3)能形成气态氢化物的元素是C、N、O、F、S和Cl,CH4和H2O都呈中性,NH3呈碱性,HF、H2S和HCl都呈酸性。(4)Cl的最高价含氧酸是HClO4,它是共价化合物,其中的化学键都是共价键。(5)含氧量最高的共价化合物在H、C、N、F、S和Cl元素的含氧共价化合物之中,该种共价化合物应具备分子中氧原子数目多,其他元素种类少、原子数目小、相对原子质量小等条件,它是H2O2。(6)H、O、Na形成的化合物是NaOH,它是含有共价键的离子化合物,离子键在Na+与OH-之间,共价键在OH-内的O原子与H原子之间。
16、(实验)用A、B、C、D四种金属按下表中装置进行实验。
装置
现象 A不断溶解形成二价金属离子 C的质量增大 A上有气泡产生
根据实验现象回答下列问题:
(1)装置甲中负极的反应式是________。
(2)装置乙中正极的反应式是________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属的活泼性由强到弱的顺序是________。
【答案】(1)A-2e-A2+ (2)Cu2++2e-Cu (3)变大 (4)D>A>B>C
【解析】题中装置甲、乙、丙均为原电池。甲中A不断溶解,则A为负极、B为正极,活泼性:A>B;乙中C的质量增大,即C电极上析出Cu,则B为负极,活泼性:B>C;丙中A上有气泡产生,则A为正极,活泼性:D>A,随着溶液中H+的消耗,溶液的pH变大。
17、在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) ===2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)A点处v(正)________v(逆),A点正反应速率________B点正反应速率(填“大于”“等于”或“小于”)。
(2)图中表示NO2变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=_________________________________________________________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
【答案】(1)大于 大于 (2)b 1.5×10-3 mol·L-1·s-1 (3)bc (4)bcd
【解析】(1)A点,反应未达平衡,由表中数据知n(NO)随反应进行不断减小,说明反应从正向开始,所以A点v(正)>v(逆);A点处反应物的浓度大于B点,所以A点正反应速率大于B点。(2)图中纵坐标为浓度,平衡时消耗n(NO)=0.020 mol-0.007 mol=0.013 mol,生成n(NO2)=0.013 mol。平衡时c(NO2)=0.006 5 mol·L-1,所以NO2的变化曲线为b。0~2 s内,NO的消耗浓度为==0.006 mol·L-1,故v(O2)==1.5×10-3 mol·L-1·s-1。(3)a表示是同一方向的速率,在任何时候都成立,而d中容器的体积及气体的总质量都不变,气体的密度也始终不变。(4)分离出NO2气体后,浓度减小,反应速率减慢,而升高温度,选择高效催化剂及增大反应物浓度都会使反应速率增大。
18、(推断题)已知五种元素的原子序数的大小顺序为C>A>B>D>E;其中,A、C同周期,B、C同主族;A与B形成的离子化合物,中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)画出元素C的原子结构示意图__________________________。
(2)写出元素D在元素周期表中的位置:第__________周期,第__________族;该元素形成的单质的结构式为:__________。
(3)写出下列物质的电子式:A、B、E形成的化合物__________,D、E形成的化合物__________。
(4)D、E形成的化合物受热蒸发,吸收的热量用于克服__________________。
(5)E、C两元素组成的化合物属于____________(填“离子”或“共价”化合物)。
写出其在氧气中完全燃烧的化学方程式________________________________。
【答案】 二 VA ; 分子间作用力(包括氢键和范德华力) 共价 2H2S+3O2=2H2O+2SO2
一、选择题。(14题)
1、反应C(s)+H2O(g) ===CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变会使反应速率加快的是( )
A.增加 C的质量
B.将容器的体积缩小一半
C.保持体积不变,充入氦气使体系压强增大
D.保持压强不变,充入氮气使容器体积增大
2、科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是( )
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O2H2↑+O2↑
D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂
3、已知拆开1 mol H—H键吸收能量E1,拆开1 mol O==O键吸收能量E2,结合1 mol H—O键放出能量E3,对于氢气燃烧生成水的反应的能量变化描述,下列各项正确的是( )
A.2E1+E2>2E3 B.2E1+E2<4E3
C.2E1+E2>4E3 D.2E1+E2<2E3
4、分析如图所示的四个原电池装置,其中结论正确的是 ( )
A.①中Al作为负极,④中Fe作为负极
B.②中Mg作为正极,电极反应式为2H2O+2e-2OH-+H2↑
C.③中Fe作为负极,电极反应式为Fe-2e-Fe2+
D.④中Cu作为正极,电极反应式为2H++2e-H2↑
5、下列说法正确的是( )
A.通过化学变化可以实现16O与18O间的相互转化
B.离子化合物中的阳离子都是金属离子
C.离子化合物中,一个阴离子可同时与多个阳离子之间有静电作用
D.溶于水可以导电的化合物一定是离子化合物
6、对处于化学平衡的体系,从化学平衡与化学反应速率的关系可知( )
A.化学反应速率变化时,化学平衡一定发生移动
B.化学平衡发生移动时,化学反应速率一定变化
C.正反应进行的程度大,正反应速率一定大
D.只有在催化剂存在下,才会发生化学反应速率变化而化学平衡不移动的情况
7、在一定温度下,将等量的气体分别通入起始容积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
A. 该反应的化学方程式为3X+2Y 2Z
B. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固体或液体
C. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
D. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
8、在通风橱中进行下列实验:
实验
现象 生铁(铁碳合金)棒表面产生大量无色气泡,液面上方变为红棕色 棒表面产生少量红棕色气体后,迅速停止 棒、棒表面均产生红棕色气体
下列说法正确的是( )
A.Ⅰ中发生原电池反应,正极产物是和
B.Ⅱ中发生原电池反应,红棕色气体是正极产物
C.Ⅲ中发生原电池反应期间,一直从向移动
D.Ⅲ中正极反应为
9、下列说法正确的是( )
A.共价化合物和离子化合物中,一定都含有非金属元素
B.阴阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小
C.失电子难的原子获得电子的能力一定强
D.含有共价键的化合物必是共价化合物
10、炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如右图所示。活化氧可以快速氧化 SO2。下列说法不正确的是( )
A.每活化一个氧分子放出0.29eV能量
B.水可使氧分子活化反应的活化能降低0.42eV
C.氧分子的活化是O-O的断裂与C-O键的生成过程
D.炭黑颗粒是大气中SO2转化为SO3的催化剂
11、把0.6mol气体X和0.4mol气体Y混合于2L的密闭容器中,发生反应:3X(g)+Y(g) nZ(g)+3W(g),测得5min末W的浓度为0.1mol·L-1 , 又知以Z表示的平均反应速率为0.02mol·L-1·min-1 , 则n值是( )
A. 2 B. 3 C. 4 D. 6
12、下列各组化合物中,化学键的类型相同的是( )
A.CaCl2和Na2S B.Na2O和Na2O2
C.CO2和NaCl D.HCl和NaOH
13、半导体光催化CO2机理如图甲所示,设计成电化学装置如图乙所示,则下列说法正确的是( )
A.若导线上有4mol电子移动,则质子交换膜左侧产生22.4LO2
B.装置中进行的总反应一定是自发的氧化还原反应
C.图乙中的能量转化形式为:光能→电能→化学能
D.b极上的电极反应为:CO2+6H+-6e-CH3OH+H2O
14、反应 A+2B 3C在某段时间内以A的浓度变化表示的化学反应速率为 1 mol/( L·min),则此段时间内以B的浓度变化表示的化学反应速率为( )
A. 0.5mol/( L·min) B. 1mol/( L·min)
C. 2mol/( L·min) D. 3mol/( L·min)
二、非选择题。
15、对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答)。
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 ① ②
2 ③ ④ ⑤ ⑥
3 ⑦ ⑧ ⑨ ⑩
(1)其原子能形成共价键的主族元素有__________________________。
(2)其原子只需形成1个共价单键就能达到稳定结构的元素有________。
(3)气态氢化物溶于水呈碱性的化合物是________。
(4)⑩号元素最高正价含氧酸只含有________键。
(5)含氧量最高的共价化合物是________(用电子式表示)。
(6)①⑤⑦形成化合物的化学式为________,含有的化学键类型是________,属于________化合物。
16、(实验)用A、B、C、D四种金属按下表中装置进行实验。
装置
现象 A不断溶解形成二价金属离子 C的质量增大 A上有气泡产生
根据实验现象回答下列问题:
(1)装置甲中负极的反应式是________。
(2)装置乙中正极的反应式是________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属的活泼性由强到弱的顺序是________。
17、在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) ===2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)A点处v(正)________v(逆),A点正反应速率________B点正反应速率(填“大于”“等于”或“小于”)。
(2)图中表示NO2变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=_________________________________________________________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
18、(推断题)已知五种元素的原子序数的大小顺序为C>A>B>D>E;其中,A、C同周期,B、C同主族;A与B形成的离子化合物,中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)画出元素C的原子结构示意图__________________________。
(2)写出元素D在元素周期表中的位置:第__________周期,第__________族;该元素形成的单质的结构式为:__________。
(3)写出下列物质的电子式:A、B、E形成的化合物__________,D、E形成的化合物__________。
(4)D、E形成的化合物受热蒸发,吸收的热量用于克服__________________。
(5)E、C两元素组成的化合物属于____________(填“离子”或“共价”化合物)。
写出其在氧气中完全燃烧的化学方程式________________________________。
2021—2022学年高一(下)化学鲁科版(2019)必修第二册第2章:化学键 化学反应规律课后题含答案
一、选择题。(14题)
1、反应C(s)+H2O(g) ===CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变会使反应速率加快的是( )
A.增加 C的质量
B.将容器的体积缩小一半
C.保持体积不变,充入氦气使体系压强增大
D.保持压强不变,充入氮气使容器体积增大
【答案】B
2、科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是( )
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O2H2↑+O2↑
D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂
【答案】C
3、已知拆开1 mol H—H键吸收能量E1,拆开1 mol O==O键吸收能量E2,结合1 mol H—O键放出能量E3,对于氢气燃烧生成水的反应的能量变化描述,下列各项正确的是( )
A.2E1+E2>2E3 B.2E1+E2<4E3
C.2E1+E2>4E3 D.2E1+E2<2E3
【答案】B
4、分析如图所示的四个原电池装置,其中结论正确的是 ( )
A.①中Al作为负极,④中Fe作为负极
B.②中Mg作为正极,电极反应式为2H2O+2e-2OH-+H2↑
C.③中Fe作为负极,电极反应式为Fe-2e-Fe2+
D.④中Cu作为正极,电极反应式为2H++2e-H2↑
【答案】B
5、下列说法正确的是( )
A.通过化学变化可以实现16O与18O间的相互转化
B.离子化合物中的阳离子都是金属离子
C.离子化合物中,一个阴离子可同时与多个阳离子之间有静电作用
D.溶于水可以导电的化合物一定是离子化合物
【答案】C
6、对处于化学平衡的体系,从化学平衡与化学反应速率的关系可知( )
A.化学反应速率变化时,化学平衡一定发生移动
B.化学平衡发生移动时,化学反应速率一定变化
C.正反应进行的程度大,正反应速率一定大
D.只有在催化剂存在下,才会发生化学反应速率变化而化学平衡不移动的情况
【答案】B
7、在一定温度下,将等量的气体分别通入起始容积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
A. 该反应的化学方程式为3X+2Y 2Z
B. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固体或液体
C. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
D. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
【答案】B
8、在通风橱中进行下列实验:
实验
现象 生铁(铁碳合金)棒表面产生大量无色气泡,液面上方变为红棕色 棒表面产生少量红棕色气体后,迅速停止 棒、棒表面均产生红棕色气体
下列说法正确的是( )
A.Ⅰ中发生原电池反应,正极产物是和
B.Ⅱ中发生原电池反应,红棕色气体是正极产物
C.Ⅲ中发生原电池反应期间,一直从向移动
D.Ⅲ中正极反应为
【答案】D
9、下列说法正确的是( )
A.共价化合物和离子化合物中,一定都含有非金属元素
B.阴阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小
C.失电子难的原子获得电子的能力一定强
D.含有共价键的化合物必是共价化合物
【答案】A
10、炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如右图所示。活化氧可以快速氧化 SO2。下列说法不正确的是( )
A.每活化一个氧分子放出0.29eV能量
B.水可使氧分子活化反应的活化能降低0.42eV
C.氧分子的活化是O-O的断裂与C-O键的生成过程
D.炭黑颗粒是大气中SO2转化为SO3的催化剂
【答案】B
11、把0.6mol气体X和0.4mol气体Y混合于2L的密闭容器中,发生反应:3X(g)+Y(g) nZ(g)+3W(g),测得5min末W的浓度为0.1mol·L-1 , 又知以Z表示的平均反应速率为0.02mol·L-1·min-1 , 则n值是( )
A. 2 B. 3 C. 4 D. 6
【答案】B
12、下列各组化合物中,化学键的类型相同的是( )
A.CaCl2和Na2S B.Na2O和Na2O2
C.CO2和NaCl D.HCl和NaOH
【答案】A
13、半导体光催化CO2机理如图甲所示,设计成电化学装置如图乙所示,则下列说法正确的是( )
A.若导线上有4mol电子移动,则质子交换膜左侧产生22.4LO2
B.装置中进行的总反应一定是自发的氧化还原反应
C.图乙中的能量转化形式为:光能→电能→化学能
D.b极上的电极反应为:CO2+6H+-6e-CH3OH+H2O
【答案】C
14、反应 A+2B 3C在某段时间内以A的浓度变化表示的化学反应速率为 1 mol/( L·min),则此段时间内以B的浓度变化表示的化学反应速率为( )
A. 0.5mol/( L·min) B. 1mol/( L·min)
C. 2mol/( L·min) D. 3mol/( L·min)
【答案】C
二、非选择题。
15、对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答)。
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 ① ②
2 ③ ④ ⑤ ⑥
3 ⑦ ⑧ ⑨ ⑩
(1)其原子能形成共价键的主族元素有__________________________。
(2)其原子只需形成1个共价单键就能达到稳定结构的元素有________。
(3)气态氢化物溶于水呈碱性的化合物是________。
(4)⑩号元素最高正价含氧酸只含有________键。
(5)含氧量最高的共价化合物是________(用电子式表示)。
(6)①⑤⑦形成化合物的化学式为________,含有的化学键类型是________,属于________化合物。
【答案】(1)H、C、N、O、F、S、Cl
(2)H、F、Cl (3)NH3 (4)共价
(6)NaOH 离子键、共价键 离子
解析:根据元素在周期表中的位置可推出①~⑩号元素分别为H、He、C、N、O、F、Na、Mg、S、Cl。(1)H、C、N、O、F、S和Cl都是主族非金属元素,其原子可形成共价键;Na、Mg都是主族活泼的金属元素,其原子可形成离子键。(2)H原子的K层上只有1个电子,获得1个电子后便形成2电子稳定结构,F原子的L层、Cl原子的M层都是有7个电子,获得1个电子便形成8电子稳定结构,因此,H、F、Cl元素的原子只需要形成1个共价单键就能达到稳定结构。(3)能形成气态氢化物的元素是C、N、O、F、S和Cl,CH4和H2O都呈中性,NH3呈碱性,HF、H2S和HCl都呈酸性。(4)Cl的最高价含氧酸是HClO4,它是共价化合物,其中的化学键都是共价键。(5)含氧量最高的共价化合物在H、C、N、F、S和Cl元素的含氧共价化合物之中,该种共价化合物应具备分子中氧原子数目多,其他元素种类少、原子数目小、相对原子质量小等条件,它是H2O2。(6)H、O、Na形成的化合物是NaOH,它是含有共价键的离子化合物,离子键在Na+与OH-之间,共价键在OH-内的O原子与H原子之间。
16、(实验)用A、B、C、D四种金属按下表中装置进行实验。
装置
现象 A不断溶解形成二价金属离子 C的质量增大 A上有气泡产生
根据实验现象回答下列问题:
(1)装置甲中负极的反应式是________。
(2)装置乙中正极的反应式是________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属的活泼性由强到弱的顺序是________。
【答案】(1)A-2e-A2+ (2)Cu2++2e-Cu (3)变大 (4)D>A>B>C
【解析】题中装置甲、乙、丙均为原电池。甲中A不断溶解,则A为负极、B为正极,活泼性:A>B;乙中C的质量增大,即C电极上析出Cu,则B为负极,活泼性:B>C;丙中A上有气泡产生,则A为正极,活泼性:D>A,随着溶液中H+的消耗,溶液的pH变大。
17、在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) ===2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)A点处v(正)________v(逆),A点正反应速率________B点正反应速率(填“大于”“等于”或“小于”)。
(2)图中表示NO2变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=_________________________________________________________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
【答案】(1)大于 大于 (2)b 1.5×10-3 mol·L-1·s-1 (3)bc (4)bcd
【解析】(1)A点,反应未达平衡,由表中数据知n(NO)随反应进行不断减小,说明反应从正向开始,所以A点v(正)>v(逆);A点处反应物的浓度大于B点,所以A点正反应速率大于B点。(2)图中纵坐标为浓度,平衡时消耗n(NO)=0.020 mol-0.007 mol=0.013 mol,生成n(NO2)=0.013 mol。平衡时c(NO2)=0.006 5 mol·L-1,所以NO2的变化曲线为b。0~2 s内,NO的消耗浓度为==0.006 mol·L-1,故v(O2)==1.5×10-3 mol·L-1·s-1。(3)a表示是同一方向的速率,在任何时候都成立,而d中容器的体积及气体的总质量都不变,气体的密度也始终不变。(4)分离出NO2气体后,浓度减小,反应速率减慢,而升高温度,选择高效催化剂及增大反应物浓度都会使反应速率增大。
18、(推断题)已知五种元素的原子序数的大小顺序为C>A>B>D>E;其中,A、C同周期,B、C同主族;A与B形成的离子化合物,中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)画出元素C的原子结构示意图__________________________。
(2)写出元素D在元素周期表中的位置:第__________周期,第__________族;该元素形成的单质的结构式为:__________。
(3)写出下列物质的电子式:A、B、E形成的化合物__________,D、E形成的化合物__________。
(4)D、E形成的化合物受热蒸发,吸收的热量用于克服__________________。
(5)E、C两元素组成的化合物属于____________(填“离子”或“共价”化合物)。
写出其在氧气中完全燃烧的化学方程式________________________________。
【答案】 二 VA ; 分子间作用力(包括氢键和范德华力) 共价 2H2S+3O2=2H2O+2SO2
