2022年化学中考备考复习 《 化学计算题》精讲课件 (一) (课件48页)
文档属性
| 名称 | 2022年化学中考备考复习 《 化学计算题》精讲课件 (一) (课件48页) |  | |
| 格式 | zip | ||
| 文件大小 | 537.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 11:23:44 | ||
图片预览








文档简介
(共48张PPT)
2022年化学中考备考复习 《 化学计算题》精讲课件 (一)
答题模板及计算公式
1
专题分类训练
2
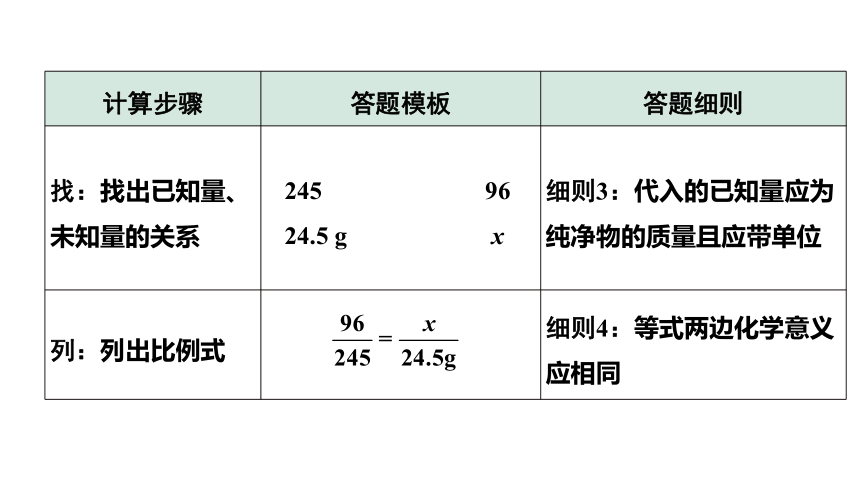
1. 答题模板(以计算24.5 g氯酸钾分解生成氧气的质量为例)
计算步骤 答题模板 答题细则
设:根据题意设未知数 解:设24.5 g KClO3分解可以得到O2的质量为x 细则1:设未知数时不带单位
写:正确书写化学方程式 2KClO3 2KCl+3O2↑ 细则2:化学方程式要配平
计算步骤 答题模板 答题细则
找:找出已知量、未知量的关系 245 96 24.5 g x 细则3:代入的已知量应为纯净物的质量且应带单位
列:列出比例式 细则4:等式两边化学意义应相同
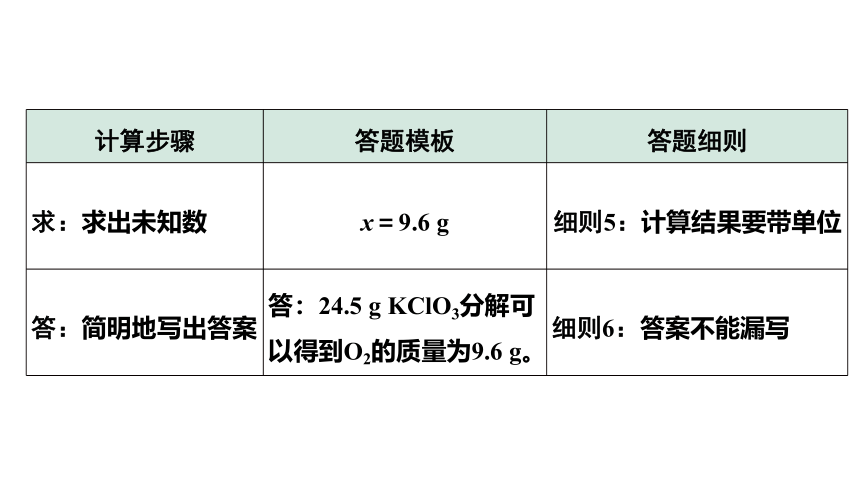
计算步骤 答题模板 答题细则
求:求出未知数 x=9.6 g 细则5:计算结果要带单位
答:简明地写出答案 答:24.5 g KClO3分解可以得到O2的质量为9.6 g。 细则6:答案不能漏写
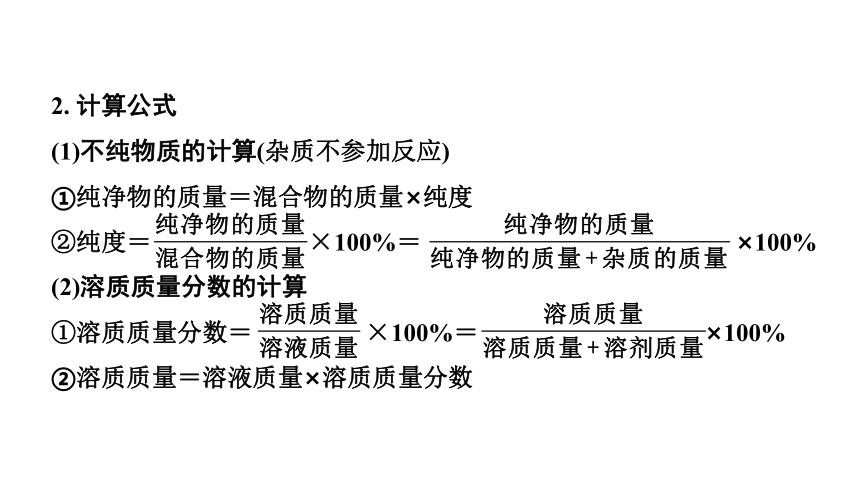
2. 计算公式
(1)不纯物质的计算(杂质不参加反应)
①纯净物的质量=混合物的质量×纯度
②纯度= ×100%= ×100%
(2)溶质质量分数的计算
①溶质质量分数= ×100%= ×100%
②溶质质量=溶液质量×溶质质量分数
文字叙述型
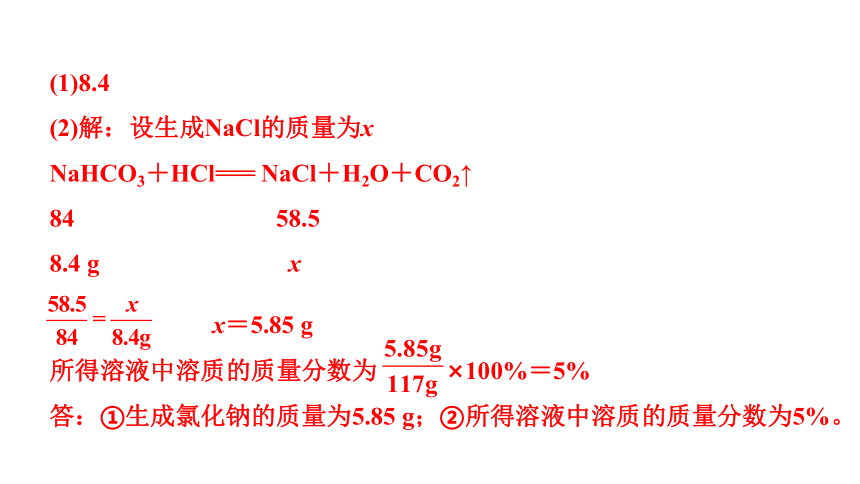
1. 实验室欲配制84 g质量分数为10%的碳酸氢钠溶液用于实验,请计算:
(1)需要碳酸氢钠的质量为_____g。
(2)已知碳酸氢钠与稀盐酸发生如下反应:NaHCO3+HCl===NaCl+H2O+CO2↑。
向84 g 10%的碳酸氢钠溶液中加入一定量的稀盐酸,恰好完全反应,反应后剩余溶液质量为117 g(假设生成的气体全部逸出)。
求:①生成氯化钠的质量;
②所得溶液中溶质的质量分数。
【提示】已知溶液的溶质质量分数,根据溶质质量=溶液质量×溶质质量分数,计算出溶质的质量,即为代入化学方程式计算的纯净物质量。
(1)8.4
(2)解:设生成NaCl的质量为x
NaHCO3+HCl=== NaCl+H2O+CO2↑
84 58.5
8.4 g x
x=5.85 g
所得溶液中溶质的质量分数为 ×100%=5%
答:①生成氯化钠的质量为5.85 g;②所得溶液中溶质的质量分数为5%。
2. 农业生产上常用一定溶质质量分数的氯化钠溶液进行选种。实验小组取该溶液36 g,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤、洗涤、干燥后,用电子秤称得沉淀质量为14.35 g。
(1)配制选种所用氯化钠溶液的步骤:计算、称量、________、溶解。
(2)计算该氯化钠溶液中溶质的质量分数(写出计算过程)。
【提示】分析反应过程,充分反应后生成物的质量(沉淀的质量),即为代入化学方程式计算的纯净物质量。
(1)量取
(2)解:设该氯化钠溶液中溶质的质量为x
NaCl+AgNO3=== AgCl↓+NaNO3
58.5 143.5
x 14.35 g
x=5.85 g
该氯化钠溶液中溶质的质量分数为 ×100%=16.25%
答:该氯化钠溶液中溶质的质量分数为16.25%。
3. 工业上采用离子交换膜电解槽电解饱和食盐水,可得到高浓度的烧碱溶液(含NaOH 35%~48%),某兴趣小组欲验证一化工厂生产的NaOH溶液是否达到了高浓度标准,进行了如下操作,请你参与计算:
(1)用37%的浓盐酸配制200 g 7.3%的盐酸,需要加水(密度为1 g·mL-1)
________mL。(计算结果保留一位小数)
(2)采集该化工厂电解槽中的NaOH溶液20 g,向其中滴入所配制的盐酸,当溶液的pH=7时,消耗盐酸100 g,判断电解槽中NaOH溶液是否达到高浓度标准。(写出计算过程)
(1)160.5
(2)解:设NaOH溶液中溶质质量为x
NaOH+HCl=== NaCl+H2O
40 36.5
x 100 g×7.3%
x=8 g
NaOH溶液中溶质的质量分数为 ×100%=40%,35%<40%<48%,所以该NaOH溶液达到高浓度标准
答:NaOH溶液中溶质质量分数为40%,达到高浓度标准。
4. (2021河南改编)某温室大棚需用到440 L CO2(按标准状况计算,CO2密度为1.964 g/L),用足量稀盐酸与石灰石反应制取。
(1)若用400 g质量分数为38%的浓盐酸可配制________g 10%的稀盐酸。
(2)需要含碳酸钙80%的石灰石的质量是多少?
【提示】已知气体的密度,根据质量=密度×体积,得出代入化学方程式计算的纯净物质量。
(1)1520
(2)解:设需要CaCO3的质量为x
CaCO3+2HCl=== CaCl2+H2O+CO2↑
100 44
x 440 L×1.964 g/L
x=1 964 g
需要含CaCO3 80%的石灰石的质量为1964 g÷80%=2455 g
答:需要含CaCO3 80%的石灰石的质量为2455 g。
5. 为测定某氮肥中硫酸铵的质量分数,小刚取15 g该氮肥样品完全溶于50 g水中配成溶液,加入氯化钡溶液至不再产生沉淀,用去氯化钡溶液208 g,过滤后称得滤液质量为249.7 g。请计算:
(1)反应后生成沉淀的质量是______g。
(2)该氮肥样品中硫酸铵的质量分数。
【已知: (NH4)2SO4+BaCl2=== BaSO4↓+2NH4Cl】
【提示】根据质量守恒定律,生成沉淀(或气体)的质量=反应前物质的总质量-反应后溶液(或剩余物质)的总质量,得出代入化学方程式计算的纯净物质量。
(1)23.3
(2)解:设该氮肥样品中硫酸铵的质量为x
(NH4)2SO4+BaCl2=== BaSO4↓+2NH4Cl
132 233
x 23.3 g
x=13.2 g
样品中硫酸铵的质量分数为 ×100%=88%
答:该氮肥样品中硫酸铵的质量分数为88%。
6. 铁矿石是钢铁生产企业的重要原材料,我国铁矿石储存量世界排名前五。某校科技小组同学为测定本地赤铁矿中氧化铁的质量分数,进行了以下实验:
(1)取10 g赤铁矿样品,与足量稀盐酸充分混合(杂质不溶于水,也不与酸反应),反应结束后过滤,经洗涤、干燥,称得固体质量为2 g。该样品中氧化铁的质量分数为________。
(2)为测定上述稀盐酸的质量分数,另一小组同学另取20 g赤铁矿样品研碎后,向其中不断滴加稀盐酸至装置内剩余固体质量不再变化,此时共消耗225 g稀盐酸。请计算该稀盐酸的溶质质量分数。(写出计算过程,结果精确到0.1%)
【提示】先计算出赤铁矿的纯度,纯度= ×100%=
×100%,再根据纯度计算纯净物的质量,即纯净物的质量=混合物的质量×纯度。
(1)80%
(2)解:设参加反应的HCl的质量为x
Fe2O3 +6HCl === 2FeCl3 + 3H2O
160 219
20 g×80% x
x=21.9 g
则该稀盐酸的溶质质量分数为 ×100%≈9.7%
答:该稀盐酸的溶质质量分数约为9.7%。
坐标曲线型断
7. 中和反应在工农业生产中应用广泛。现向40 g 10%的氢氧化钠溶液中不断滴加盐酸,同时测定溶液pH的变化(曲线如图)。请分析计算:
(1)40 g 10%的氢氧化钠溶液中含有___ g的氢氧化钠;当滴入36.5 g盐酸时,溶液的pH为____。
(2)所用盐酸的溶质质量分数(写出计算过程)。
【提示】根据溶质质量分数计算参加反应的溶质的质量。
分析图像,找出恰好完全反应时消耗盐酸的质量并进行
相关计算。
(1)4 7
(2)解:设36.5 g稀盐酸中溶质的质量为x
NaOH+HCl === NaCl+H2O
40 36.5
4 g x
x=3.65 g
所用盐酸的溶质质量分数为 ×100%=10%
答:所用稀盐酸的溶质质量分数为10%。
8. 实验室有一瓶含杂质的氯化镁样品,为探究其中镁元素的含量,化学兴趣小组取3 g样品于烧杯中,加足量的水溶解(烧杯中无不溶性固体),再向所得溶液中逐滴滴入200 g一定溶质质量分数的AgNO3溶液(杂质不含镁元素且不与AgNO3溶液反应)。实验过程中生成沉淀的质量与滴入AgNO3溶液的质量关系如图所示。试计算:
(1)恰好完全反应时生成沉淀质量为________g。
(2)样品中镁元素的质量分数是多少?
【提示】明确图像横纵坐标的意义,分析曲线起点、拐点含义。拐点对应的纵坐标值为生成沉淀的质量,可代入化学方程式计算。
(1)5.74
(2)解:设样品中含MgCl2的质量为x
MgCl2+2AgNO3=== 2AgCl↓+ Mg(NO3)2
95 287
x 5.74 g
x=1.9 g
MgCl2中Mg元素的质量分数为 ×100%≈25.26%
样品中镁元素的质量分数为1.9 g× ≈16%
答:样品中Mg元素的质量分数约为16%。
9. (2021黄石改编)某化学小组实验室进行一氧化碳还原氧化铜实验,实验结束后取固体残留物20 g,向其中加入稀硫酸,剩余固体质量与加入稀硫酸质量关系如图所示,请回答下列问题。
(1)所取固体残留物中铜的质量为______ g。
(2)所用稀硫酸的溶质质量分数(写出计算过程)。
【提示】图像的纵坐标为剩余固体的质量,质量
差(反应前的质量-剩余的质量)即为计算代入化
学方程式的纯净物的质量。
(1)17.5
(2)解:设稀硫酸的溶质质量分数为x
H2SO4 + CuO=== CuSO4+H2O
98 80
37.5 g×x 2.5 g
x≈0.08=8%
答:所用稀硫酸的溶质质量分数约为8%。
表格型
10. 有一份铜锌合金粉末样品(设只含铜、锌),为认识其组成,某学习小组进行了以下探究,请参与并完成有关计算:
(1)取样品20 g和足量稀硫酸充分混合,待反应完全后过滤,将滤渣洗涤、干燥后称得其质量为13.5 g。该样品中铜的质量分数为________。
(2)再取三份不同质量的样品,分别加入到三份100 g相同浓度的硫酸溶液中,充分反应后,测得的数据如下表:
实验序号 ① ② ③
样品的质量/g 10 20 30
生成气体的质量/g 0.1 0.2 0.25
试计算所用硫酸溶液的溶质质量分数(写出计算过程,结果精确到0.01%)。
【提示】分析给出的数据,成正比例关系的都是完全反应的,打破“比例”关系的数据存在过量问题,即未完全反应。找出反应物(稀硫酸)消耗完时生成气体的质量代入计算。
(2)解:设100 g硫酸溶液中硫酸的质量为x
Zn+H2SO4=== ZnSO4+H2↑
98 2
x 0.25 g
x=12.25 g
硫酸溶液中硫酸的质量分数为 ×100%=12.25%
答:所用硫酸溶液的溶质质量分数为12.25%。
(1)67.5%
11. 徐州地区石灰石资源丰富。某化学兴趣小组称取4.0 g石灰石样品,把40 g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),所得实验数据如下表。请计算:
稀盐酸的用量 剩余固体的质量
第一次加入10 g 3.0 g
第二次加入10 g 2.0 g
第三次加入10 g 1.0 g
第四次加入10 g 0.6 g
(1)4.0 g石灰石样品中碳酸钙的质量是______g。
(2)10 g稀盐酸能与____g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
【提示】根据剩余固体的质量计算出参与反应的物质的质量,再根据参与反应的物质之间的比例关系分析,选取一组符合比例关系即完全反应的数据代入进行相关计算。
(3)解:设盐酸中HCl的质量为x
CaCO3+2HCl=== CaCl2+H2O+CO2↑
100 73
1.0 g x
x=0.73 g
盐酸中溶质质量分数为 ×100%=7.3%
答:稀盐酸的溶质质量分数为7.3%。
(1)3.4 (2)1.0
12. 碳酸锶(SrCO3)可用于制造红色火焰、荧光玻璃等。小赵同学为测定某SrCO3和NaCl固体混合物中SrCO3的质量分数,在三个烧杯中进行相关实验,实验所用稀盐酸的溶质的质量分数相同。所得数据如下表所示:
烧杯编号 ① ② ③
稀盐酸质量/g 100 200 300
固体混合物质量/g 100 100 100
反应后烧杯中物质的质量/g 195.6 291.2 391.2
试求:(1)烧杯②中产生CO2的质量为_____g。
(2)原固体混合物中SrCO3的质量分数(计算结果精确到0.1%)。
【温馨提示:SrCO3+2HCl=== SrCl2+CO2↑+H2O,Sr的相对原子质量为88】
【提示】根据生成气体的质量=反应前物质的总质量-反应后物质的总质量,计算出代入化学方程式的纯净物的质量。
(2)解:设100 g固体混合物中SrCO3的质量为x
SrCO3+2HCl === SrCl2+CO2↑+H2O
148 44
x 8.8 g
x=29.6 g
原固体混合物中SrCO3的质量分数为 ×100%=29.6%
答:原固体混合物中SrCO3的质量分数为29.6%。
(1)8.8
13. (2021遂宁改编)某工厂生产的NaCl产品中含有杂质MgCl2,化学兴趣小组取一定量样品加水完全溶解,向该溶液中分5次加入一定浓度的氢氧化钠溶液,每次30 g,充分反应。测得实验数据如表所示(假设实验中所用溶液的密度为1 g/mL):
次数 1 2 3 4 5
加入氢氧化钠溶液的质量/g 30 30 30 30 30
累计生成沉淀的质量/g 2.9 5.8 8.7 11.6 11.6
(1)第____次恰好完全反应。
(2)计算所用氢氧化钠溶液的溶质质量分数。(写出计算过程,结果精确到0.1%)
【提示】累计生成沉淀的质量不再改变时,说明某一反应物恰好反应完,即选择该组数据代入化学方程式进行相关计算。
(2)解:设恰好完全反应时参加反应的氢氧化钠的质量为x
MgCl2+2NaOH === 2NaCl+Mg(OH)2↓
80 58
x 11.6 g
x=16 g
消耗氢氧化钠溶液的质量为30 g×4=120 g,质量分数为
×100%≈13.3%
答:所用氢氧化钠溶液的溶质质量分数约为13.3%。
(1)4
实物图型
14. (2021徐州市二模) 化学兴趣小组为测定某石灰石样品中碳酸钙的质量分数,进行如图所示实验。已知石灰石中所含杂质既不溶于水也不与酸反应。请计算:
(1)反应生成二氧化碳的质量是_____g。(假设二氧化碳气体全部逸出)
(2)稀盐酸中溶质HCl的质量分数(写出运算过程)。
【提示】先“读图”,反应前后物质的质量差即反应生成气体的质量,再代入化学方程式进行相关计算。
(2)解:设稀盐酸中HCl的质量分数为x
2HCl+CaCO3 === CaCl2+H2O+CO2↑
73 44
100 g×x 8.8 g
x=0.146=14.6%
即稀盐酸中HCl的质量分数为14.6%
答:稀盐酸中HCl的质量分数为14.6%。
(1)8.8
15. (2021江西节选)国家标准规定工业纯碱中碳酸钠的质量分数≥98.0%为合格品。为测定某工业纯碱是否为合格品,兴趣小组成员分别进行了下图的实验。(杂质不参与反应,过滤后滤渣损失忽略不计)
(1)溶解时玻璃棒的作用是_________________。
(2)实验中加入过量CaCl2溶液的目的是___________________________。
(3)通过计算判断该工业纯碱是否为合格品。(写出计算过程,结果精确到0.1%)。
【提示】分析图中实验过程,判断“滤渣”的成分,找出代入化学方程式计算的纯净物质量。
(3)解:设10.8 g样品中碳酸钠的质量为x
CaCl2+Na2CO3=== CaCO3↓+2NaCl
106 100
x 10.0 g
x=10.6 g
样品中碳酸钠的质量分数为 ×100%≈98.1%>98.0%
答:该工业纯碱为合格品。
(1)搅拌,加速溶解
(2)使样品中碳酸钠完全反应
拓展类型
16. [流程图型]元明粉又名无水硫酸钠,常用于制造玻璃、洗涤剂等。兴趣小组同学为测定某元明粉样品中硫酸钠的质量分数,设计实验流程如图所示(假设元明粉中只含有杂质氯化钠,忽略操作中的损耗)。
(1)40.0 g溶质质量分数为10.4%的氯化钡溶液中氯化钡的质量为____g;
(2)计算该样品中硫酸钠的质量分数。(写出计算过程,结果精确到0.1%)
(2)解:设样品中硫酸钠的质量为x
Na2SO4 + BaCl2 === BaSO4↓+2NaCl
142 208
x 4.16 g
x=2.84 g
样品中硫酸钠的质量分数为 ×100%≈94.7%
答:样品中硫酸钠的质量分数约为94.7%。
(1)4.16
17. [实物图与表格结合型]为测定某CuSO4溶液中溶质的质量分数,取150 g CuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 42.45 44.9 44.9
(1)50 g CuSO4溶液完全反应时,所得沉淀的质量为_____g。
(2)CuSO4溶液中溶质的质量分数。
(2)解:设50 g CuSO4溶液中溶质的质量为x
2NaOH+CuSO4 === Na2SO4+Cu(OH)2↓
160 98
x 4.9 g
x=8 g
则该CuSO4溶液中溶质的质量分数为 ×100%=16%
答:CuSO4溶液中溶质的质量分数为16%。
(1)4.9
2022年化学中考备考复习 《 化学计算题》精讲课件 (一)
答题模板及计算公式
1
专题分类训练
2
1. 答题模板(以计算24.5 g氯酸钾分解生成氧气的质量为例)
计算步骤 答题模板 答题细则
设:根据题意设未知数 解:设24.5 g KClO3分解可以得到O2的质量为x 细则1:设未知数时不带单位
写:正确书写化学方程式 2KClO3 2KCl+3O2↑ 细则2:化学方程式要配平
计算步骤 答题模板 答题细则
找:找出已知量、未知量的关系 245 96 24.5 g x 细则3:代入的已知量应为纯净物的质量且应带单位
列:列出比例式 细则4:等式两边化学意义应相同
计算步骤 答题模板 答题细则
求:求出未知数 x=9.6 g 细则5:计算结果要带单位
答:简明地写出答案 答:24.5 g KClO3分解可以得到O2的质量为9.6 g。 细则6:答案不能漏写
2. 计算公式
(1)不纯物质的计算(杂质不参加反应)
①纯净物的质量=混合物的质量×纯度
②纯度= ×100%= ×100%
(2)溶质质量分数的计算
①溶质质量分数= ×100%= ×100%
②溶质质量=溶液质量×溶质质量分数
文字叙述型
1. 实验室欲配制84 g质量分数为10%的碳酸氢钠溶液用于实验,请计算:
(1)需要碳酸氢钠的质量为_____g。
(2)已知碳酸氢钠与稀盐酸发生如下反应:NaHCO3+HCl===NaCl+H2O+CO2↑。
向84 g 10%的碳酸氢钠溶液中加入一定量的稀盐酸,恰好完全反应,反应后剩余溶液质量为117 g(假设生成的气体全部逸出)。
求:①生成氯化钠的质量;
②所得溶液中溶质的质量分数。
【提示】已知溶液的溶质质量分数,根据溶质质量=溶液质量×溶质质量分数,计算出溶质的质量,即为代入化学方程式计算的纯净物质量。
(1)8.4
(2)解:设生成NaCl的质量为x
NaHCO3+HCl=== NaCl+H2O+CO2↑
84 58.5
8.4 g x
x=5.85 g
所得溶液中溶质的质量分数为 ×100%=5%
答:①生成氯化钠的质量为5.85 g;②所得溶液中溶质的质量分数为5%。
2. 农业生产上常用一定溶质质量分数的氯化钠溶液进行选种。实验小组取该溶液36 g,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤、洗涤、干燥后,用电子秤称得沉淀质量为14.35 g。
(1)配制选种所用氯化钠溶液的步骤:计算、称量、________、溶解。
(2)计算该氯化钠溶液中溶质的质量分数(写出计算过程)。
【提示】分析反应过程,充分反应后生成物的质量(沉淀的质量),即为代入化学方程式计算的纯净物质量。
(1)量取
(2)解:设该氯化钠溶液中溶质的质量为x
NaCl+AgNO3=== AgCl↓+NaNO3
58.5 143.5
x 14.35 g
x=5.85 g
该氯化钠溶液中溶质的质量分数为 ×100%=16.25%
答:该氯化钠溶液中溶质的质量分数为16.25%。
3. 工业上采用离子交换膜电解槽电解饱和食盐水,可得到高浓度的烧碱溶液(含NaOH 35%~48%),某兴趣小组欲验证一化工厂生产的NaOH溶液是否达到了高浓度标准,进行了如下操作,请你参与计算:
(1)用37%的浓盐酸配制200 g 7.3%的盐酸,需要加水(密度为1 g·mL-1)
________mL。(计算结果保留一位小数)
(2)采集该化工厂电解槽中的NaOH溶液20 g,向其中滴入所配制的盐酸,当溶液的pH=7时,消耗盐酸100 g,判断电解槽中NaOH溶液是否达到高浓度标准。(写出计算过程)
(1)160.5
(2)解:设NaOH溶液中溶质质量为x
NaOH+HCl=== NaCl+H2O
40 36.5
x 100 g×7.3%
x=8 g
NaOH溶液中溶质的质量分数为 ×100%=40%,35%<40%<48%,所以该NaOH溶液达到高浓度标准
答:NaOH溶液中溶质质量分数为40%,达到高浓度标准。
4. (2021河南改编)某温室大棚需用到440 L CO2(按标准状况计算,CO2密度为1.964 g/L),用足量稀盐酸与石灰石反应制取。
(1)若用400 g质量分数为38%的浓盐酸可配制________g 10%的稀盐酸。
(2)需要含碳酸钙80%的石灰石的质量是多少?
【提示】已知气体的密度,根据质量=密度×体积,得出代入化学方程式计算的纯净物质量。
(1)1520
(2)解:设需要CaCO3的质量为x
CaCO3+2HCl=== CaCl2+H2O+CO2↑
100 44
x 440 L×1.964 g/L
x=1 964 g
需要含CaCO3 80%的石灰石的质量为1964 g÷80%=2455 g
答:需要含CaCO3 80%的石灰石的质量为2455 g。
5. 为测定某氮肥中硫酸铵的质量分数,小刚取15 g该氮肥样品完全溶于50 g水中配成溶液,加入氯化钡溶液至不再产生沉淀,用去氯化钡溶液208 g,过滤后称得滤液质量为249.7 g。请计算:
(1)反应后生成沉淀的质量是______g。
(2)该氮肥样品中硫酸铵的质量分数。
【已知: (NH4)2SO4+BaCl2=== BaSO4↓+2NH4Cl】
【提示】根据质量守恒定律,生成沉淀(或气体)的质量=反应前物质的总质量-反应后溶液(或剩余物质)的总质量,得出代入化学方程式计算的纯净物质量。
(1)23.3
(2)解:设该氮肥样品中硫酸铵的质量为x
(NH4)2SO4+BaCl2=== BaSO4↓+2NH4Cl
132 233
x 23.3 g
x=13.2 g
样品中硫酸铵的质量分数为 ×100%=88%
答:该氮肥样品中硫酸铵的质量分数为88%。
6. 铁矿石是钢铁生产企业的重要原材料,我国铁矿石储存量世界排名前五。某校科技小组同学为测定本地赤铁矿中氧化铁的质量分数,进行了以下实验:
(1)取10 g赤铁矿样品,与足量稀盐酸充分混合(杂质不溶于水,也不与酸反应),反应结束后过滤,经洗涤、干燥,称得固体质量为2 g。该样品中氧化铁的质量分数为________。
(2)为测定上述稀盐酸的质量分数,另一小组同学另取20 g赤铁矿样品研碎后,向其中不断滴加稀盐酸至装置内剩余固体质量不再变化,此时共消耗225 g稀盐酸。请计算该稀盐酸的溶质质量分数。(写出计算过程,结果精确到0.1%)
【提示】先计算出赤铁矿的纯度,纯度= ×100%=
×100%,再根据纯度计算纯净物的质量,即纯净物的质量=混合物的质量×纯度。
(1)80%
(2)解:设参加反应的HCl的质量为x
Fe2O3 +6HCl === 2FeCl3 + 3H2O
160 219
20 g×80% x
x=21.9 g
则该稀盐酸的溶质质量分数为 ×100%≈9.7%
答:该稀盐酸的溶质质量分数约为9.7%。
坐标曲线型断
7. 中和反应在工农业生产中应用广泛。现向40 g 10%的氢氧化钠溶液中不断滴加盐酸,同时测定溶液pH的变化(曲线如图)。请分析计算:
(1)40 g 10%的氢氧化钠溶液中含有___ g的氢氧化钠;当滴入36.5 g盐酸时,溶液的pH为____。
(2)所用盐酸的溶质质量分数(写出计算过程)。
【提示】根据溶质质量分数计算参加反应的溶质的质量。
分析图像,找出恰好完全反应时消耗盐酸的质量并进行
相关计算。
(1)4 7
(2)解:设36.5 g稀盐酸中溶质的质量为x
NaOH+HCl === NaCl+H2O
40 36.5
4 g x
x=3.65 g
所用盐酸的溶质质量分数为 ×100%=10%
答:所用稀盐酸的溶质质量分数为10%。
8. 实验室有一瓶含杂质的氯化镁样品,为探究其中镁元素的含量,化学兴趣小组取3 g样品于烧杯中,加足量的水溶解(烧杯中无不溶性固体),再向所得溶液中逐滴滴入200 g一定溶质质量分数的AgNO3溶液(杂质不含镁元素且不与AgNO3溶液反应)。实验过程中生成沉淀的质量与滴入AgNO3溶液的质量关系如图所示。试计算:
(1)恰好完全反应时生成沉淀质量为________g。
(2)样品中镁元素的质量分数是多少?
【提示】明确图像横纵坐标的意义,分析曲线起点、拐点含义。拐点对应的纵坐标值为生成沉淀的质量,可代入化学方程式计算。
(1)5.74
(2)解:设样品中含MgCl2的质量为x
MgCl2+2AgNO3=== 2AgCl↓+ Mg(NO3)2
95 287
x 5.74 g
x=1.9 g
MgCl2中Mg元素的质量分数为 ×100%≈25.26%
样品中镁元素的质量分数为1.9 g× ≈16%
答:样品中Mg元素的质量分数约为16%。
9. (2021黄石改编)某化学小组实验室进行一氧化碳还原氧化铜实验,实验结束后取固体残留物20 g,向其中加入稀硫酸,剩余固体质量与加入稀硫酸质量关系如图所示,请回答下列问题。
(1)所取固体残留物中铜的质量为______ g。
(2)所用稀硫酸的溶质质量分数(写出计算过程)。
【提示】图像的纵坐标为剩余固体的质量,质量
差(反应前的质量-剩余的质量)即为计算代入化
学方程式的纯净物的质量。
(1)17.5
(2)解:设稀硫酸的溶质质量分数为x
H2SO4 + CuO=== CuSO4+H2O
98 80
37.5 g×x 2.5 g
x≈0.08=8%
答:所用稀硫酸的溶质质量分数约为8%。
表格型
10. 有一份铜锌合金粉末样品(设只含铜、锌),为认识其组成,某学习小组进行了以下探究,请参与并完成有关计算:
(1)取样品20 g和足量稀硫酸充分混合,待反应完全后过滤,将滤渣洗涤、干燥后称得其质量为13.5 g。该样品中铜的质量分数为________。
(2)再取三份不同质量的样品,分别加入到三份100 g相同浓度的硫酸溶液中,充分反应后,测得的数据如下表:
实验序号 ① ② ③
样品的质量/g 10 20 30
生成气体的质量/g 0.1 0.2 0.25
试计算所用硫酸溶液的溶质质量分数(写出计算过程,结果精确到0.01%)。
【提示】分析给出的数据,成正比例关系的都是完全反应的,打破“比例”关系的数据存在过量问题,即未完全反应。找出反应物(稀硫酸)消耗完时生成气体的质量代入计算。
(2)解:设100 g硫酸溶液中硫酸的质量为x
Zn+H2SO4=== ZnSO4+H2↑
98 2
x 0.25 g
x=12.25 g
硫酸溶液中硫酸的质量分数为 ×100%=12.25%
答:所用硫酸溶液的溶质质量分数为12.25%。
(1)67.5%
11. 徐州地区石灰石资源丰富。某化学兴趣小组称取4.0 g石灰石样品,把40 g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),所得实验数据如下表。请计算:
稀盐酸的用量 剩余固体的质量
第一次加入10 g 3.0 g
第二次加入10 g 2.0 g
第三次加入10 g 1.0 g
第四次加入10 g 0.6 g
(1)4.0 g石灰石样品中碳酸钙的质量是______g。
(2)10 g稀盐酸能与____g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
【提示】根据剩余固体的质量计算出参与反应的物质的质量,再根据参与反应的物质之间的比例关系分析,选取一组符合比例关系即完全反应的数据代入进行相关计算。
(3)解:设盐酸中HCl的质量为x
CaCO3+2HCl=== CaCl2+H2O+CO2↑
100 73
1.0 g x
x=0.73 g
盐酸中溶质质量分数为 ×100%=7.3%
答:稀盐酸的溶质质量分数为7.3%。
(1)3.4 (2)1.0
12. 碳酸锶(SrCO3)可用于制造红色火焰、荧光玻璃等。小赵同学为测定某SrCO3和NaCl固体混合物中SrCO3的质量分数,在三个烧杯中进行相关实验,实验所用稀盐酸的溶质的质量分数相同。所得数据如下表所示:
烧杯编号 ① ② ③
稀盐酸质量/g 100 200 300
固体混合物质量/g 100 100 100
反应后烧杯中物质的质量/g 195.6 291.2 391.2
试求:(1)烧杯②中产生CO2的质量为_____g。
(2)原固体混合物中SrCO3的质量分数(计算结果精确到0.1%)。
【温馨提示:SrCO3+2HCl=== SrCl2+CO2↑+H2O,Sr的相对原子质量为88】
【提示】根据生成气体的质量=反应前物质的总质量-反应后物质的总质量,计算出代入化学方程式的纯净物的质量。
(2)解:设100 g固体混合物中SrCO3的质量为x
SrCO3+2HCl === SrCl2+CO2↑+H2O
148 44
x 8.8 g
x=29.6 g
原固体混合物中SrCO3的质量分数为 ×100%=29.6%
答:原固体混合物中SrCO3的质量分数为29.6%。
(1)8.8
13. (2021遂宁改编)某工厂生产的NaCl产品中含有杂质MgCl2,化学兴趣小组取一定量样品加水完全溶解,向该溶液中分5次加入一定浓度的氢氧化钠溶液,每次30 g,充分反应。测得实验数据如表所示(假设实验中所用溶液的密度为1 g/mL):
次数 1 2 3 4 5
加入氢氧化钠溶液的质量/g 30 30 30 30 30
累计生成沉淀的质量/g 2.9 5.8 8.7 11.6 11.6
(1)第____次恰好完全反应。
(2)计算所用氢氧化钠溶液的溶质质量分数。(写出计算过程,结果精确到0.1%)
【提示】累计生成沉淀的质量不再改变时,说明某一反应物恰好反应完,即选择该组数据代入化学方程式进行相关计算。
(2)解:设恰好完全反应时参加反应的氢氧化钠的质量为x
MgCl2+2NaOH === 2NaCl+Mg(OH)2↓
80 58
x 11.6 g
x=16 g
消耗氢氧化钠溶液的质量为30 g×4=120 g,质量分数为
×100%≈13.3%
答:所用氢氧化钠溶液的溶质质量分数约为13.3%。
(1)4
实物图型
14. (2021徐州市二模) 化学兴趣小组为测定某石灰石样品中碳酸钙的质量分数,进行如图所示实验。已知石灰石中所含杂质既不溶于水也不与酸反应。请计算:
(1)反应生成二氧化碳的质量是_____g。(假设二氧化碳气体全部逸出)
(2)稀盐酸中溶质HCl的质量分数(写出运算过程)。
【提示】先“读图”,反应前后物质的质量差即反应生成气体的质量,再代入化学方程式进行相关计算。
(2)解:设稀盐酸中HCl的质量分数为x
2HCl+CaCO3 === CaCl2+H2O+CO2↑
73 44
100 g×x 8.8 g
x=0.146=14.6%
即稀盐酸中HCl的质量分数为14.6%
答:稀盐酸中HCl的质量分数为14.6%。
(1)8.8
15. (2021江西节选)国家标准规定工业纯碱中碳酸钠的质量分数≥98.0%为合格品。为测定某工业纯碱是否为合格品,兴趣小组成员分别进行了下图的实验。(杂质不参与反应,过滤后滤渣损失忽略不计)
(1)溶解时玻璃棒的作用是_________________。
(2)实验中加入过量CaCl2溶液的目的是___________________________。
(3)通过计算判断该工业纯碱是否为合格品。(写出计算过程,结果精确到0.1%)。
【提示】分析图中实验过程,判断“滤渣”的成分,找出代入化学方程式计算的纯净物质量。
(3)解:设10.8 g样品中碳酸钠的质量为x
CaCl2+Na2CO3=== CaCO3↓+2NaCl
106 100
x 10.0 g
x=10.6 g
样品中碳酸钠的质量分数为 ×100%≈98.1%>98.0%
答:该工业纯碱为合格品。
(1)搅拌,加速溶解
(2)使样品中碳酸钠完全反应
拓展类型
16. [流程图型]元明粉又名无水硫酸钠,常用于制造玻璃、洗涤剂等。兴趣小组同学为测定某元明粉样品中硫酸钠的质量分数,设计实验流程如图所示(假设元明粉中只含有杂质氯化钠,忽略操作中的损耗)。
(1)40.0 g溶质质量分数为10.4%的氯化钡溶液中氯化钡的质量为____g;
(2)计算该样品中硫酸钠的质量分数。(写出计算过程,结果精确到0.1%)
(2)解:设样品中硫酸钠的质量为x
Na2SO4 + BaCl2 === BaSO4↓+2NaCl
142 208
x 4.16 g
x=2.84 g
样品中硫酸钠的质量分数为 ×100%≈94.7%
答:样品中硫酸钠的质量分数约为94.7%。
(1)4.16
17. [实物图与表格结合型]为测定某CuSO4溶液中溶质的质量分数,取150 g CuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 42.45 44.9 44.9
(1)50 g CuSO4溶液完全反应时,所得沉淀的质量为_____g。
(2)CuSO4溶液中溶质的质量分数。
(2)解:设50 g CuSO4溶液中溶质的质量为x
2NaOH+CuSO4 === Na2SO4+Cu(OH)2↓
160 98
x 4.9 g
x=8 g
则该CuSO4溶液中溶质的质量分数为 ×100%=16%
答:CuSO4溶液中溶质的质量分数为16%。
(1)4.9
同课章节目录
