2022年化学中考备考复习 《 化学计算题》精讲课件(二) (课件29页)
文档属性
| 名称 | 2022年化学中考备考复习 《 化学计算题》精讲课件(二) (课件29页) |  | |
| 格式 | zip | ||
| 文件大小 | 537.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 11:22:14 | ||
图片预览








文档简介
(共29张PPT)
2022年化学中考备考复习
《 化学计算题》精讲课件(二)
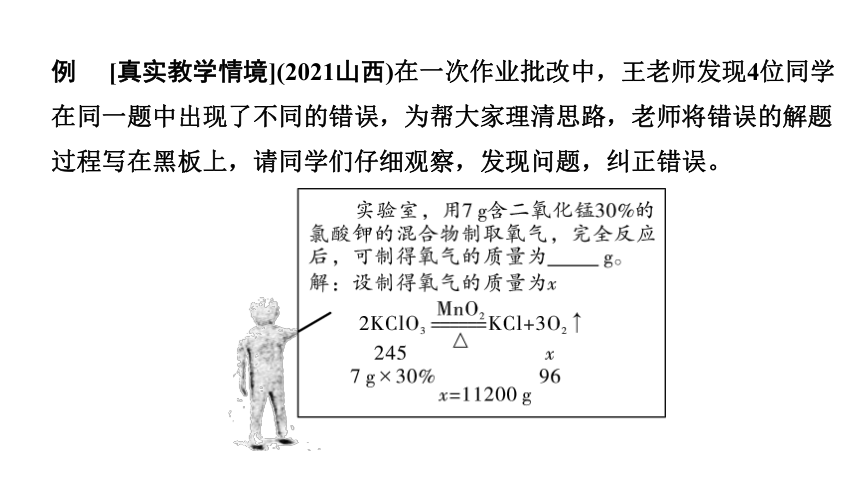
例 [真实教学情境](2021山西)在一次作业批改中,王老师发现4位同学在同一题中出现了不同的错误,为帮大家理清思路,老师将错误的解题过程写在黑板上,请同学们仔细观察,发现问题,纠正错误。
(1)仔细观察:你发现解题过程中的错误有___处。
(2)纠正错误:老师点拨后,请将正确的解题过程写在下面。
(1)6
(2)解:混合物中KClO3的质量为7g×(1-30%)=4.9 g
设制得氧气的质量为x
2KClO3 2KCl+3O2↑
245 96
4.9g x
x=1.92 g
答:制得氧气的质量为1.92 g。
文字叙述类
1. (2020黄冈) “人工固氮”每年能生产11.9亿吨氨(NH3),反应原理为:N2+3H2 2NH3根据化学方程式计算:“人工固氮”每年固定氮气的质量是多少?
解:设“人工固氮”每年固定氮气的质量是x
N2+3H2 ======== 2NH3
28 34
x 11.9(亿吨)
x=9.8 (亿吨)
答:“人工固氮”每年固定氮气的质量是9.8亿吨。
一定条件
2. (黄冈)为测定某石灰石矿中碳酸钙的含量,现称取12.5 g石灰石矿样品与足量的稀盐酸反应(杂质不溶于水,也不参与反应),得到二氧化碳气体4.4 g(假设生成的气体全部逸出)。请计算:该石灰石样品含CaCO3的质量分数?
解:设12.5 g石灰石样品中碳酸钙的质量为x
CaCO3+2HCl === CaCl2+CO2↑+H2O
100 44
x 4.4 g
x=10 g
石灰石样品中碳酸钙的质量分数为 ×100%=80%
答:石灰石样品中碳酸钙的质量分数为80%。
3. (2020孝感) 氯气可与氢氧化钠溶液反应。其反应的化学方程式为: 2NaOH+Cl2 === NaClO+NaCl+H2O,其中生成的次氯酸钠(NaClO)易溶于水,为84消毒液的有效成分。现向某100 g氢氧化钠溶液中通入一定量氯气,使之与氢氧化钠恰好完全反应,反应后的溶液质量为107.1 g。请计算:
(1)参加反应的氯气质量为____g。
(2)反应生成次氯酸钠的质量(请写出计算过程)。
(1)7.1
(2)解:设反应生成次氯酸钠的质量为x
2NaOH+Cl2 === NaClO+NaCl+H2O
71 74.5
7.1g x
x=7.45 g
答:反应生成次氯酸钠的质量为7.45 g。
4. 我国古代就有湿法炼铜的记载“曾青得铁则化为铜”。某同学为了模拟该过程,将5.8g生铁加入160g10%的硫酸铜溶液中,恰好完全反应。
(1)硫酸铜溶液中溶质的质量为____g。
(2)该生铁中铁的质量分数(写出计算过程,结果精确到0.1%)。
(1)16
(2)解:设5.8g该生铁中铁的质量为x
Fe+CuSO4 === FeSO4+Cu
56 160
x 16g
x=5.6 g
该生铁中铁的质量分数为 ×100% ≈ 96.6%
答:该生铁中铁的质量分数约为96.6%。
坐标曲线类
5. (孝感)向盛有一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图所示。请根据关系图分析并计算:
(1)铁粉反应完时,产生氢气的质量为_____g。
(2)原稀硫酸中溶质的质量分数(写出计算过程)。
(2)解:设原稀硫酸中溶质的质量为x
由图可知10 g硫酸对应生成0.04 g氢气
Fe+H2SO4 === FeSO4+H2↑
98 2
x 0.04 g
x=1.96 g
则原稀硫酸中溶质的质量分数为 ×100%=19.6%
答:原稀硫酸中溶质的质量分数为19.6%。
(1)0.08
6. (2020黄石)取20 g氢氧化钠溶液于烧杯中,将9.8%的稀硫酸逐滴加入烧杯,边加边搅拌,随着稀硫酸的不断加入,溶液pH的变化如图所示,回答下列问题:
(1)a点溶液中的溶质是Na2SO4和_______(填化学式)。
(2)计算该氢氧化钠溶液的溶质质量分数(写出计算过程)。
(1)NaOH
(2)解:设氢氧化钠溶液中含溶质质量为x
2NaOH+H2SO4 === Na2SO4+2H2O
80 98
x 40 g×9.8%
x=3.2 g
该氢氧化钠溶液中溶质质量分数为 ×100%=16%。
答:该氢氧化钠溶液中溶质质量分数为16%。
7. (咸宁)为了测定一瓶硫酸铜溶液的溶质质量分数,取出50克该溶液,向其中逐滴加入溶质质量分数为16%的氢氧化钠溶液,反应过程中生成沉淀的质量与所用氢氧化钠溶液质量的关系如图所示:
请你仔细分析此关系图,并进行计算。
(1)当滴入氢氧化钠溶液____克时,硫酸铜与
氢氧化钠恰好完全反应。
(2)计算此硫酸铜溶液中溶质的质量分数(写
出计算过程)。
(1)25
(2)解:设50g该硫酸铜溶液中含溶质的质量为x
CuSO4+2NaOH === Na2SO4+Cu(OH)2↓
160 80
x 25 g×16%
x=8 g
该硫酸铜溶液中溶质的质量分数为 ×100%=16%
答:该硫酸铜溶液中溶质的质量分数为16%。
8. (2021黄石)取一氧化碳还原氧化铜实验的固体残留物20 g,向其中加入稀硫酸,剩余固体质量与加入稀硫酸质量关系如图所示,请回答下列问题。
(1)所取固体残留物中铜的质量为_____g。
(2)求a点处溶液中溶质的质量分数(写出
计算过程)。
(2)解:设反应生成的硫酸铜的质量为x
CuO+H2SO4 === CuSO4+H2O
80 160
2.5g x
x=5 g
a点时溶液的总质量为37.5 g+(20 g-17.5 g)=40 g
则a点处溶液中溶质的质量分数为 ×100%=12.5%
答:a点处溶液中溶质的质量分数为12.5%。
(1)17.5
其他类
9. (咸宁)有镁和氯化镁固体混合物,取一定量的该混合物放入烧杯中,然后取稀盐酸200g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量/g 40 40 40 40 40
生成气体的总质量/g 0.16 m 0.48 0.5 0.5
(1)表中m的值为_____。
(2)所用稀盐酸的溶质质量分数为多少?
(2)解:设所用稀盐酸的溶质质量为x
Mg+2HCl === MgCl2+H2↑
73 2
x 0.16 g
x=5.84 g
所用稀盐酸的溶质质量分数为 ×100%=14.6%
答:所用稀盐酸的溶质质量分数为14.6%。
(1)0.32
10. (2021武汉)某兴趣小组利用氯酸钾和二氧化锰制取氧气并回收剩余固体,实验过程表示如下。
(1)上述制取氧气的反应属于________(填基本反应类型)。
(2)计算所用氯酸钾、二氧化锰混合物的总质量。
(1)分解反应
(2)解:设制取氧气消耗氯酸钾的质量为x
2KClO3 2KCl + 3O2↑
245 149
x 100.0 g×14.9%
x=24.5 g
加热前氯酸钾、二氧化锰混合物的总质量= 24.5 g+8.0 g=32.5 g
答:加热前氯酸钾、二氧化锰混合物的总质量为32.5 g。
11. (2021贵港节选)请根据所示的实验过程和提供的信息作答:
(1)实验结束后溶液中的溶质为______________。
(2)计算原混合液中CaCl2的质量分数(写出计算过程,精确至0.1%)。
(1)K2CO3、KCl
(2)解:设原混合液中CaCl2的质量为x
K2CO3+CaCl2 === 2KCl+CaCO3↓
111 100
x 10g
x=11.1 g
则原混合液中氯化钙的质量分数为 ×100%=11.1%
答:原混合液中CaCl2的质量分数为11.1%。
12. 工业盐酸中通常含少量FeCl3而呈黄色。小亮为测定某工业盐酸中HCl的含量进行如下实验,取某工业盐酸50 g,滴加溶质质量分数为20%的NaOH溶液。反应过程中,当加入的NaOH溶液质量至以下数值时,对充分反应后所得溶液的质量进行了测定,部分数据如下表。请根据表格和图像完成下列问题:
加入NaOH溶液的质量/g 25 50 75 100
所得溶液的质量/g 75 100 125 m
(1)开始没有产生沉淀的原因是____________。
(2)求m(写出计算过程)。
(1)氢氧化钠溶液先与盐酸反应
(2)解:根据图可知,与氯化铁反应的氢氧化钠溶液的质量为6g
设生成氢氧化铁的质量为x
3NaOH+FeCl3 === Fe(OH)3↓+3NaCl
120 107
6g×20% x
x=1.07 g
则反应后所得溶液的质量m=50 g+100 g-1.07 g=148.93 g
2022年化学中考备考复习
《 化学计算题》精讲课件(二)
例 [真实教学情境](2021山西)在一次作业批改中,王老师发现4位同学在同一题中出现了不同的错误,为帮大家理清思路,老师将错误的解题过程写在黑板上,请同学们仔细观察,发现问题,纠正错误。
(1)仔细观察:你发现解题过程中的错误有___处。
(2)纠正错误:老师点拨后,请将正确的解题过程写在下面。
(1)6
(2)解:混合物中KClO3的质量为7g×(1-30%)=4.9 g
设制得氧气的质量为x
2KClO3 2KCl+3O2↑
245 96
4.9g x
x=1.92 g
答:制得氧气的质量为1.92 g。
文字叙述类
1. (2020黄冈) “人工固氮”每年能生产11.9亿吨氨(NH3),反应原理为:N2+3H2 2NH3根据化学方程式计算:“人工固氮”每年固定氮气的质量是多少?
解:设“人工固氮”每年固定氮气的质量是x
N2+3H2 ======== 2NH3
28 34
x 11.9(亿吨)
x=9.8 (亿吨)
答:“人工固氮”每年固定氮气的质量是9.8亿吨。
一定条件
2. (黄冈)为测定某石灰石矿中碳酸钙的含量,现称取12.5 g石灰石矿样品与足量的稀盐酸反应(杂质不溶于水,也不参与反应),得到二氧化碳气体4.4 g(假设生成的气体全部逸出)。请计算:该石灰石样品含CaCO3的质量分数?
解:设12.5 g石灰石样品中碳酸钙的质量为x
CaCO3+2HCl === CaCl2+CO2↑+H2O
100 44
x 4.4 g
x=10 g
石灰石样品中碳酸钙的质量分数为 ×100%=80%
答:石灰石样品中碳酸钙的质量分数为80%。
3. (2020孝感) 氯气可与氢氧化钠溶液反应。其反应的化学方程式为: 2NaOH+Cl2 === NaClO+NaCl+H2O,其中生成的次氯酸钠(NaClO)易溶于水,为84消毒液的有效成分。现向某100 g氢氧化钠溶液中通入一定量氯气,使之与氢氧化钠恰好完全反应,反应后的溶液质量为107.1 g。请计算:
(1)参加反应的氯气质量为____g。
(2)反应生成次氯酸钠的质量(请写出计算过程)。
(1)7.1
(2)解:设反应生成次氯酸钠的质量为x
2NaOH+Cl2 === NaClO+NaCl+H2O
71 74.5
7.1g x
x=7.45 g
答:反应生成次氯酸钠的质量为7.45 g。
4. 我国古代就有湿法炼铜的记载“曾青得铁则化为铜”。某同学为了模拟该过程,将5.8g生铁加入160g10%的硫酸铜溶液中,恰好完全反应。
(1)硫酸铜溶液中溶质的质量为____g。
(2)该生铁中铁的质量分数(写出计算过程,结果精确到0.1%)。
(1)16
(2)解:设5.8g该生铁中铁的质量为x
Fe+CuSO4 === FeSO4+Cu
56 160
x 16g
x=5.6 g
该生铁中铁的质量分数为 ×100% ≈ 96.6%
答:该生铁中铁的质量分数约为96.6%。
坐标曲线类
5. (孝感)向盛有一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图所示。请根据关系图分析并计算:
(1)铁粉反应完时,产生氢气的质量为_____g。
(2)原稀硫酸中溶质的质量分数(写出计算过程)。
(2)解:设原稀硫酸中溶质的质量为x
由图可知10 g硫酸对应生成0.04 g氢气
Fe+H2SO4 === FeSO4+H2↑
98 2
x 0.04 g
x=1.96 g
则原稀硫酸中溶质的质量分数为 ×100%=19.6%
答:原稀硫酸中溶质的质量分数为19.6%。
(1)0.08
6. (2020黄石)取20 g氢氧化钠溶液于烧杯中,将9.8%的稀硫酸逐滴加入烧杯,边加边搅拌,随着稀硫酸的不断加入,溶液pH的变化如图所示,回答下列问题:
(1)a点溶液中的溶质是Na2SO4和_______(填化学式)。
(2)计算该氢氧化钠溶液的溶质质量分数(写出计算过程)。
(1)NaOH
(2)解:设氢氧化钠溶液中含溶质质量为x
2NaOH+H2SO4 === Na2SO4+2H2O
80 98
x 40 g×9.8%
x=3.2 g
该氢氧化钠溶液中溶质质量分数为 ×100%=16%。
答:该氢氧化钠溶液中溶质质量分数为16%。
7. (咸宁)为了测定一瓶硫酸铜溶液的溶质质量分数,取出50克该溶液,向其中逐滴加入溶质质量分数为16%的氢氧化钠溶液,反应过程中生成沉淀的质量与所用氢氧化钠溶液质量的关系如图所示:
请你仔细分析此关系图,并进行计算。
(1)当滴入氢氧化钠溶液____克时,硫酸铜与
氢氧化钠恰好完全反应。
(2)计算此硫酸铜溶液中溶质的质量分数(写
出计算过程)。
(1)25
(2)解:设50g该硫酸铜溶液中含溶质的质量为x
CuSO4+2NaOH === Na2SO4+Cu(OH)2↓
160 80
x 25 g×16%
x=8 g
该硫酸铜溶液中溶质的质量分数为 ×100%=16%
答:该硫酸铜溶液中溶质的质量分数为16%。
8. (2021黄石)取一氧化碳还原氧化铜实验的固体残留物20 g,向其中加入稀硫酸,剩余固体质量与加入稀硫酸质量关系如图所示,请回答下列问题。
(1)所取固体残留物中铜的质量为_____g。
(2)求a点处溶液中溶质的质量分数(写出
计算过程)。
(2)解:设反应生成的硫酸铜的质量为x
CuO+H2SO4 === CuSO4+H2O
80 160
2.5g x
x=5 g
a点时溶液的总质量为37.5 g+(20 g-17.5 g)=40 g
则a点处溶液中溶质的质量分数为 ×100%=12.5%
答:a点处溶液中溶质的质量分数为12.5%。
(1)17.5
其他类
9. (咸宁)有镁和氯化镁固体混合物,取一定量的该混合物放入烧杯中,然后取稀盐酸200g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量/g 40 40 40 40 40
生成气体的总质量/g 0.16 m 0.48 0.5 0.5
(1)表中m的值为_____。
(2)所用稀盐酸的溶质质量分数为多少?
(2)解:设所用稀盐酸的溶质质量为x
Mg+2HCl === MgCl2+H2↑
73 2
x 0.16 g
x=5.84 g
所用稀盐酸的溶质质量分数为 ×100%=14.6%
答:所用稀盐酸的溶质质量分数为14.6%。
(1)0.32
10. (2021武汉)某兴趣小组利用氯酸钾和二氧化锰制取氧气并回收剩余固体,实验过程表示如下。
(1)上述制取氧气的反应属于________(填基本反应类型)。
(2)计算所用氯酸钾、二氧化锰混合物的总质量。
(1)分解反应
(2)解:设制取氧气消耗氯酸钾的质量为x
2KClO3 2KCl + 3O2↑
245 149
x 100.0 g×14.9%
x=24.5 g
加热前氯酸钾、二氧化锰混合物的总质量= 24.5 g+8.0 g=32.5 g
答:加热前氯酸钾、二氧化锰混合物的总质量为32.5 g。
11. (2021贵港节选)请根据所示的实验过程和提供的信息作答:
(1)实验结束后溶液中的溶质为______________。
(2)计算原混合液中CaCl2的质量分数(写出计算过程,精确至0.1%)。
(1)K2CO3、KCl
(2)解:设原混合液中CaCl2的质量为x
K2CO3+CaCl2 === 2KCl+CaCO3↓
111 100
x 10g
x=11.1 g
则原混合液中氯化钙的质量分数为 ×100%=11.1%
答:原混合液中CaCl2的质量分数为11.1%。
12. 工业盐酸中通常含少量FeCl3而呈黄色。小亮为测定某工业盐酸中HCl的含量进行如下实验,取某工业盐酸50 g,滴加溶质质量分数为20%的NaOH溶液。反应过程中,当加入的NaOH溶液质量至以下数值时,对充分反应后所得溶液的质量进行了测定,部分数据如下表。请根据表格和图像完成下列问题:
加入NaOH溶液的质量/g 25 50 75 100
所得溶液的质量/g 75 100 125 m
(1)开始没有产生沉淀的原因是____________。
(2)求m(写出计算过程)。
(1)氢氧化钠溶液先与盐酸反应
(2)解:根据图可知,与氯化铁反应的氢氧化钠溶液的质量为6g
设生成氢氧化铁的质量为x
3NaOH+FeCl3 === Fe(OH)3↓+3NaCl
120 107
6g×20% x
x=1.07 g
则反应后所得溶液的质量m=50 g+100 g-1.07 g=148.93 g
同课章节目录
