2022年化学中考备考复习 《 化学计算题》精讲课件 (三) (课件37页)
文档属性
| 名称 | 2022年化学中考备考复习 《 化学计算题》精讲课件 (三) (课件37页) |

|
|
| 格式 | zip | ||
| 文件大小 | 542.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 00:00:00 | ||
图片预览









文档简介
(共37张PPT)
2022年化学中考备考复习
《 化学计算题》精讲课件 (三)
答题模板及公式
1
类型精讲练
2
题型综合训练
3
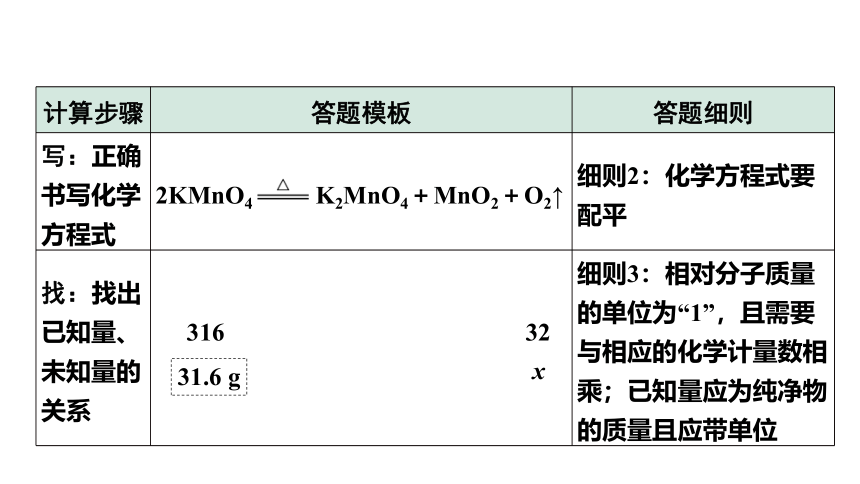
1.答题模板(以求31.6 g KMnO4分解可以得到O2的质量的计算为例)
计算步骤 答题模板 答题细则
设:根据题意设未知数 解:设31.6 g KMnO4分解可以得到O2的质量为 细则1:设未知数时不带单位
写:正确书写化学方程式 2KMnO4 K2MnO4+MnO2+O2↑ 细则2:化学方程式要配平
x
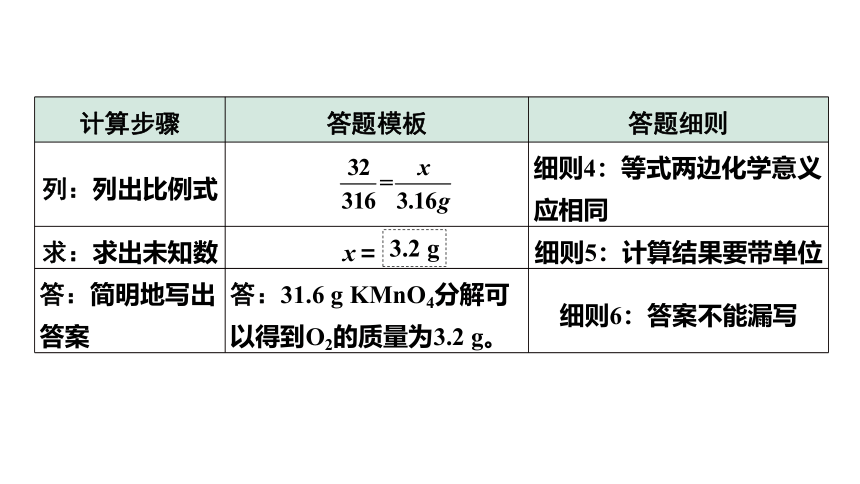
计算步骤 答题模板 答题细则
写:正确书写化学方程式 2KMnO4 K2MnO4+MnO2+O2↑ 细则2:化学方程式要配平
找:找出已知量、未知量的关系 316 32 x 细则3:相对分子质量的单位为“1”,且需要与相应的化学计量数相乘;已知量应为纯净物的质量且应带单位
31.6 g
计算步骤 答题模板 答题细则
列:列出比例式 细则4:等式两边化学意义应相同
求:求出未知数 x= 细则5:计算结果要带单位
答:简明地写出答案 答:31.6 g KMnO4分解可以得到O2的质量为3.2 g。 细则6:答案不能漏写
3.2 g
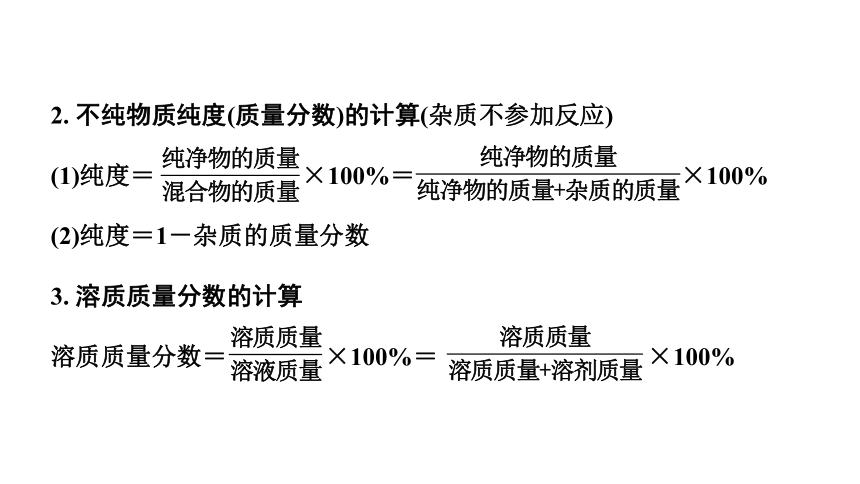
2. 不纯物质纯度(质量分数)的计算(杂质不参加反应)
(1)纯度= ×100%= ×100%
(2)纯度=1-杂质的质量分数
3. 溶质质量分数的计算
溶质质量分数= ×100%= ×100%
直接给出纯净物质量
例1 (安徽)侯德榜是我国著名的化学家,发明了侯氏制碱法,其反应原理如下:
NaCl+CO2+NH3+H2O=== NaHCO3+NH4Cl,请计算:
(1)氯化铵中氮元素的质量分数。
(2)生产8.4 t碳酸氢钠,理论上需要氯化钠的质量。
解:氯化铵中氮元素的质量分数为
答:氯化铵中氮元素的质量分数约为26.2%。
设生产8.4 t碳酸氢钠理论上需要氯化钠的质量为 x
NaCl+CO2+NH3+H2O=== NaHCO3+NH4Cl
58.5 84
x 8.4 t
x=5.85 t
答:生产8.4 t碳酸氢钠,理论上需要氯化钠的质量为5.85 t。
找出题干中纯净物(反应物、生成的沉淀或气体)的质量代入化学方程式。
根据反应前后质量差计算纯净物质量(反应完全)
例2 (2021云南改编)实验室中制备KClO3的化学反应方程式为3Cl2+6KOH 5KCl+KClO3+3H2O。若用Cl2与200 g的KOH溶液恰好完全反应,反应后溶液质量为 221.3 g。
(1)参加反应的氯气的质量为____g。
(2)所用KOH溶液中溶质的质量分数是多少?
(1)21.3
(2)解:设参加反应的KOH的质量为 x
3Cl2+ 6KOH 5KCl + KClO3 + 3H2O
213 336
21.3 g x
x=33.6 g
所用KOH溶液中溶质的质量分数为 ×100%=16.8%
答:所用KOH溶液中溶质的质量分数为16.8%。
根据题干给出的反应前后物质的质量,利用质量差计算出相关的量(常为气体或沉淀的质量),再代入化学方程式计算。
根据溶质质量分数计算纯净物质量
例3 (2021永州改编)取溶质质量分数为5%的过氧化氢溶液60.0 g于锥形瓶中,加入一定量的二氧化锰,过氧化氢完全分解。请分析并计算:
(1)反应后,产生氧气的质量是多少? (写出计算过程,保留小数点后一位)
(2)若测得上述反应后锥形瓶内物质的质量为59.8 g,可知加入二氧化锰的质量应为___g。
(1)解:设过氧化氢完全分解后,产生氧气的质量是 x
2H2O2 2H2O+O2↑
68 32
60.0 g×5% x
x ≈ 1.4 g
答:产生氧气的质量约为1.4 g。
(2)1.2
根据“溶质质量=溶液质量 ×溶质质量分数”计算出纯净物的质量,再代入化学方程式计算。
根据不纯物质计算纯净物质量
例4 工厂的烟气脱硫工艺能将二氧化硫转化为硫酸钙等产品。反应的化学方程式为2CaCO3+O2+2SO2 2CaSO4+2CO2。现有12.5 t含碳酸钙80%的石灰石可用于吸收烟气中的二氧化硫。请计算:
(1)12.5 t该石灰石中碳酸钙的质量为___t。
(2)求样品中金的质量分数。
(1)10
(2)解:设用12.5 t该石灰石制得硫酸钙的质量为x
2CaCO3+O2+2SO2 2CaSO4+2CO2
200 272
10 t x
x=13.6 t
处理烟气得到的硫酸钙价值是13.6 t×1000元/t=13600元
答:用12.5 t该石灰石处理烟气得到的硫酸钙价值是13600元。
根据“纯净物的质量=混合物的质量×纯度”计算出纯净物的质量,再代入化学方程式计算。
根据是否反应判断纯净物质量
例5 (安徽)非物质文化遗产“芜湖铁画”(镀金)含有金、铁(其他成分忽略不计)。某同学取一定质量的铁画边角料,加入足量稀盐酸,充分反应后,放出0.3 g H2,剩余固体质量为0.1 g。
(1)求样品中铁的质量。
(2)求样品中金的质量分数。
(1)解:设样品中铁的质量为 x
Fe+2HCl=== FeCl2+H2↑
56 2
x 0.3 g
x=8.4 g
答:样品中铁的质量为8.4 g。
(2)剩余固体即为样品中的金,其质量为0.1 g,则样品中金的质量分数为 ×100% ≈ 1.2%
答:样品中金的质量分数约为1.2%。
先判断参加反应的物质,再根据已知条件求出参加反应的纯净物的质量,代入化学方程式计算。
1. (2021安徽)某简易制氧装置的示意图如下,其原理是通过撞击火帽触发启动装置产生热量,使产氧药块分解而持续释放氧气。
(1)装置中过滤层的作用是_________。
(2)若产氧药块由氯酸钾(KClO3)和二氧化锰等
组成,为得到一个人呼吸2小时所需氧气的量
(折算后质量为48 g) ,计算产氧药块中至少含
氯酸钾的质量(写出计算过程)。
(1)净化氧气
(2)解:设需要氯酸钾的质量为 x
2KClO3 2KCl+3O2↑
245 96
x 48 g
x=122.5 g
答:产氧药块中至少含氯酸钾的质量为122.5 g。
2. 打火机给人们生活带来了方便,如图为打火机的示意图,请回答有关问题。
(1)打火机挡风罩上的通风孔能使空气流通,据此
说明燃烧的条件之一是______________________。
(2)点火时丁烷完全燃烧的化学方程式是2C4H10+
13O2 8CO2 +10H2O,则2 g丁烷完全燃烧,
需要消耗氧气的质量是多少?(写出计算过程)
(1)需要与空气(或氧气)接触
解:设需要消耗氧气的质量为 x
2C4H10+13O2 8CO2 +10H2O
116 416
2 g x
x ≈7.2 g
答:需要消耗氧气的质量约为7.2 g。
3. (2012安徽)在科学家眼里,二氧化碳是可以利用的重要资源。在一定条件下,二氧化碳和金属钠反应可以制金刚石[CO2+4Na C(金刚石)+2Na2O]。请计算92 g金属钠理论上可制得含碳96%的金刚石的质量。
解:设92 g金属钠理论上可制得纯金刚石的质量为 x
CO2+4Na C+2Na2O
92 12
92 g x
x=12 g
折合为含碳96%的金刚石的质量为 =12.5 g
答:92 g金属钠理论上可制得含碳96%的金刚石的质量为12.5 g。
4. 已知铝粉和氢氧化钠溶液发生化学反应: 2Al+2NaOH+2X=== 2NaAlO2+3H2↑,现有30 g含铝90%的铝粉样品,加入足量氢氧化钠溶液中充分反应(样品中其他成分不反应)。
则: (1) X的化学式为_____。
(2)求反应产生氢气的质量。
(1)H2O
(2)解:铝粉样品中铝的质量为30 g×90%=27 g
设反应产生氢气的质量为x
2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑
54 6
27 g x
x=3 g
答:反应产生氢气的质量为3 g。
5. 某石灰厂需要测定产品生石灰中杂质(杂质只含CaCO3)的
质量分数。小刚进行了如图实验。请计算:
(1)生成CO2气体的质量。
(2)样品中CaCO3的质量分数。
(1)解:生成CO2的质量为10 g+500 g+100 g-609.78 g=0.22 g。
答:生成CO2气体的质量为0.22 g。
(2)设样品中CaCO3的质量为 x
CaCO3+2HCl=== CO2↑+CaCl2+H2O
100 44
x 0.22 g
x=0.5 g
则样品中CaCO3的质量分数为 ×100%=5%
答:(1)生成CO2气体的质量为0.22 g。(2)样品中碳酸钙的质量分数为5%。
6. (2021黄石)取一氧化碳还原氧化铜实验的固体残留物20 g,向其中加入稀硫酸,剩余固体质量与加入稀硫酸质量关系如图所示,请回答下列问题。
(1)所取固体残留物中铜的质量为____g。
(2)求a点处溶液中溶质的质量分数(写出计算过程)。
(1)17.5
(2)解:参加反应的氧化铜的质量为20 g-17.5 g=2.5 g
设反应生成的硫酸铜的质量为 x
CuO+H2SO4=== CuSO4+H2O
80 160
2.5 g x
x=5 g
a点处溶液的总质量为37.5 g+2.5 g=40 g
则a点处溶液中溶质的质量分数为 ×100%=12.5%
答:a点处溶液中溶质的质量分数为12.5%。
7. 造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。同学们取一定量该废水样品于锥形瓶中,滴入几滴酚酞试液,然后逐滴滴加9.8%的稀硫酸,溶液红色褪去时停止滴加,共消耗稀硫酸的质量为50 g。
(1)计算该一定量废水中NaOH的质量(写出计算过程)。
(2)实验结束后,小华同学测得溶液的pH=6,分析同学们计算得出的氢氧化钠的质量_____(填“偏大”“偏小”或“不变”),造成这一偏差的原因是_____________________________________________________。
(1)解:参加反应的H2SO4的质量为50 g×9.8%=4.9 g
设该一定量废水中NaOH的质量为 x
H2SO4+2NaOH=== Na2SO4+2H2O
98 80
4.9 g x
x=4 g
答:该一定量废水中NaOH的质量为4 g。
(2)偏大
反应后的溶液显酸性,溶液变为无色时,滴加的硫酸已过量
8. 将80 g氯化钡溶液分为四等份,依次加入到盛有100 g硫酸钠溶液的烧杯中,每次加入氯化钡溶液完全反应后烧杯中沉淀的总质量如下表所示,发生反应的原理为 Na2SO4+BaCl2=== BaSO4↓+2NaCl。
加入氯化钡溶液次数 第一次 第二次 第三次 第四次
烧杯中沉淀总质量/g 2 m 4.66 4.66
(1)上表中m的数值是__,第三次加入氯化钡溶液充分反应后,溶液中溶质成分为____________。
(2)计算该硫酸钠溶液中溶质的质量分数。
(1)4 BaCl2、NaCl
(2)解:设该硫酸钠溶液中溶质的质量为 x
Na2SO4+BaCl2=== BaSO4↓+2NaCl
142 233
x 4.66 g
x=2.84 g
硫酸钠溶液中溶质的质量分数为 ×100%=2.84%
答:该硫酸钠溶液中溶质的质量分数为2.84%。
2022年化学中考备考复习
《 化学计算题》精讲课件 (三)
答题模板及公式
1
类型精讲练
2
题型综合训练
3
1.答题模板(以求31.6 g KMnO4分解可以得到O2的质量的计算为例)
计算步骤 答题模板 答题细则
设:根据题意设未知数 解:设31.6 g KMnO4分解可以得到O2的质量为 细则1:设未知数时不带单位
写:正确书写化学方程式 2KMnO4 K2MnO4+MnO2+O2↑ 细则2:化学方程式要配平
x
计算步骤 答题模板 答题细则
写:正确书写化学方程式 2KMnO4 K2MnO4+MnO2+O2↑ 细则2:化学方程式要配平
找:找出已知量、未知量的关系 316 32 x 细则3:相对分子质量的单位为“1”,且需要与相应的化学计量数相乘;已知量应为纯净物的质量且应带单位
31.6 g
计算步骤 答题模板 答题细则
列:列出比例式 细则4:等式两边化学意义应相同
求:求出未知数 x= 细则5:计算结果要带单位
答:简明地写出答案 答:31.6 g KMnO4分解可以得到O2的质量为3.2 g。 细则6:答案不能漏写
3.2 g
2. 不纯物质纯度(质量分数)的计算(杂质不参加反应)
(1)纯度= ×100%= ×100%
(2)纯度=1-杂质的质量分数
3. 溶质质量分数的计算
溶质质量分数= ×100%= ×100%
直接给出纯净物质量
例1 (安徽)侯德榜是我国著名的化学家,发明了侯氏制碱法,其反应原理如下:
NaCl+CO2+NH3+H2O=== NaHCO3+NH4Cl,请计算:
(1)氯化铵中氮元素的质量分数。
(2)生产8.4 t碳酸氢钠,理论上需要氯化钠的质量。
解:氯化铵中氮元素的质量分数为
答:氯化铵中氮元素的质量分数约为26.2%。
设生产8.4 t碳酸氢钠理论上需要氯化钠的质量为 x
NaCl+CO2+NH3+H2O=== NaHCO3+NH4Cl
58.5 84
x 8.4 t
x=5.85 t
答:生产8.4 t碳酸氢钠,理论上需要氯化钠的质量为5.85 t。
找出题干中纯净物(反应物、生成的沉淀或气体)的质量代入化学方程式。
根据反应前后质量差计算纯净物质量(反应完全)
例2 (2021云南改编)实验室中制备KClO3的化学反应方程式为3Cl2+6KOH 5KCl+KClO3+3H2O。若用Cl2与200 g的KOH溶液恰好完全反应,反应后溶液质量为 221.3 g。
(1)参加反应的氯气的质量为____g。
(2)所用KOH溶液中溶质的质量分数是多少?
(1)21.3
(2)解:设参加反应的KOH的质量为 x
3Cl2+ 6KOH 5KCl + KClO3 + 3H2O
213 336
21.3 g x
x=33.6 g
所用KOH溶液中溶质的质量分数为 ×100%=16.8%
答:所用KOH溶液中溶质的质量分数为16.8%。
根据题干给出的反应前后物质的质量,利用质量差计算出相关的量(常为气体或沉淀的质量),再代入化学方程式计算。
根据溶质质量分数计算纯净物质量
例3 (2021永州改编)取溶质质量分数为5%的过氧化氢溶液60.0 g于锥形瓶中,加入一定量的二氧化锰,过氧化氢完全分解。请分析并计算:
(1)反应后,产生氧气的质量是多少? (写出计算过程,保留小数点后一位)
(2)若测得上述反应后锥形瓶内物质的质量为59.8 g,可知加入二氧化锰的质量应为___g。
(1)解:设过氧化氢完全分解后,产生氧气的质量是 x
2H2O2 2H2O+O2↑
68 32
60.0 g×5% x
x ≈ 1.4 g
答:产生氧气的质量约为1.4 g。
(2)1.2
根据“溶质质量=溶液质量 ×溶质质量分数”计算出纯净物的质量,再代入化学方程式计算。
根据不纯物质计算纯净物质量
例4 工厂的烟气脱硫工艺能将二氧化硫转化为硫酸钙等产品。反应的化学方程式为2CaCO3+O2+2SO2 2CaSO4+2CO2。现有12.5 t含碳酸钙80%的石灰石可用于吸收烟气中的二氧化硫。请计算:
(1)12.5 t该石灰石中碳酸钙的质量为___t。
(2)求样品中金的质量分数。
(1)10
(2)解:设用12.5 t该石灰石制得硫酸钙的质量为x
2CaCO3+O2+2SO2 2CaSO4+2CO2
200 272
10 t x
x=13.6 t
处理烟气得到的硫酸钙价值是13.6 t×1000元/t=13600元
答:用12.5 t该石灰石处理烟气得到的硫酸钙价值是13600元。
根据“纯净物的质量=混合物的质量×纯度”计算出纯净物的质量,再代入化学方程式计算。
根据是否反应判断纯净物质量
例5 (安徽)非物质文化遗产“芜湖铁画”(镀金)含有金、铁(其他成分忽略不计)。某同学取一定质量的铁画边角料,加入足量稀盐酸,充分反应后,放出0.3 g H2,剩余固体质量为0.1 g。
(1)求样品中铁的质量。
(2)求样品中金的质量分数。
(1)解:设样品中铁的质量为 x
Fe+2HCl=== FeCl2+H2↑
56 2
x 0.3 g
x=8.4 g
答:样品中铁的质量为8.4 g。
(2)剩余固体即为样品中的金,其质量为0.1 g,则样品中金的质量分数为 ×100% ≈ 1.2%
答:样品中金的质量分数约为1.2%。
先判断参加反应的物质,再根据已知条件求出参加反应的纯净物的质量,代入化学方程式计算。
1. (2021安徽)某简易制氧装置的示意图如下,其原理是通过撞击火帽触发启动装置产生热量,使产氧药块分解而持续释放氧气。
(1)装置中过滤层的作用是_________。
(2)若产氧药块由氯酸钾(KClO3)和二氧化锰等
组成,为得到一个人呼吸2小时所需氧气的量
(折算后质量为48 g) ,计算产氧药块中至少含
氯酸钾的质量(写出计算过程)。
(1)净化氧气
(2)解:设需要氯酸钾的质量为 x
2KClO3 2KCl+3O2↑
245 96
x 48 g
x=122.5 g
答:产氧药块中至少含氯酸钾的质量为122.5 g。
2. 打火机给人们生活带来了方便,如图为打火机的示意图,请回答有关问题。
(1)打火机挡风罩上的通风孔能使空气流通,据此
说明燃烧的条件之一是______________________。
(2)点火时丁烷完全燃烧的化学方程式是2C4H10+
13O2 8CO2 +10H2O,则2 g丁烷完全燃烧,
需要消耗氧气的质量是多少?(写出计算过程)
(1)需要与空气(或氧气)接触
解:设需要消耗氧气的质量为 x
2C4H10+13O2 8CO2 +10H2O
116 416
2 g x
x ≈7.2 g
答:需要消耗氧气的质量约为7.2 g。
3. (2012安徽)在科学家眼里,二氧化碳是可以利用的重要资源。在一定条件下,二氧化碳和金属钠反应可以制金刚石[CO2+4Na C(金刚石)+2Na2O]。请计算92 g金属钠理论上可制得含碳96%的金刚石的质量。
解:设92 g金属钠理论上可制得纯金刚石的质量为 x
CO2+4Na C+2Na2O
92 12
92 g x
x=12 g
折合为含碳96%的金刚石的质量为 =12.5 g
答:92 g金属钠理论上可制得含碳96%的金刚石的质量为12.5 g。
4. 已知铝粉和氢氧化钠溶液发生化学反应: 2Al+2NaOH+2X=== 2NaAlO2+3H2↑,现有30 g含铝90%的铝粉样品,加入足量氢氧化钠溶液中充分反应(样品中其他成分不反应)。
则: (1) X的化学式为_____。
(2)求反应产生氢气的质量。
(1)H2O
(2)解:铝粉样品中铝的质量为30 g×90%=27 g
设反应产生氢气的质量为x
2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑
54 6
27 g x
x=3 g
答:反应产生氢气的质量为3 g。
5. 某石灰厂需要测定产品生石灰中杂质(杂质只含CaCO3)的
质量分数。小刚进行了如图实验。请计算:
(1)生成CO2气体的质量。
(2)样品中CaCO3的质量分数。
(1)解:生成CO2的质量为10 g+500 g+100 g-609.78 g=0.22 g。
答:生成CO2气体的质量为0.22 g。
(2)设样品中CaCO3的质量为 x
CaCO3+2HCl=== CO2↑+CaCl2+H2O
100 44
x 0.22 g
x=0.5 g
则样品中CaCO3的质量分数为 ×100%=5%
答:(1)生成CO2气体的质量为0.22 g。(2)样品中碳酸钙的质量分数为5%。
6. (2021黄石)取一氧化碳还原氧化铜实验的固体残留物20 g,向其中加入稀硫酸,剩余固体质量与加入稀硫酸质量关系如图所示,请回答下列问题。
(1)所取固体残留物中铜的质量为____g。
(2)求a点处溶液中溶质的质量分数(写出计算过程)。
(1)17.5
(2)解:参加反应的氧化铜的质量为20 g-17.5 g=2.5 g
设反应生成的硫酸铜的质量为 x
CuO+H2SO4=== CuSO4+H2O
80 160
2.5 g x
x=5 g
a点处溶液的总质量为37.5 g+2.5 g=40 g
则a点处溶液中溶质的质量分数为 ×100%=12.5%
答:a点处溶液中溶质的质量分数为12.5%。
7. 造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。同学们取一定量该废水样品于锥形瓶中,滴入几滴酚酞试液,然后逐滴滴加9.8%的稀硫酸,溶液红色褪去时停止滴加,共消耗稀硫酸的质量为50 g。
(1)计算该一定量废水中NaOH的质量(写出计算过程)。
(2)实验结束后,小华同学测得溶液的pH=6,分析同学们计算得出的氢氧化钠的质量_____(填“偏大”“偏小”或“不变”),造成这一偏差的原因是_____________________________________________________。
(1)解:参加反应的H2SO4的质量为50 g×9.8%=4.9 g
设该一定量废水中NaOH的质量为 x
H2SO4+2NaOH=== Na2SO4+2H2O
98 80
4.9 g x
x=4 g
答:该一定量废水中NaOH的质量为4 g。
(2)偏大
反应后的溶液显酸性,溶液变为无色时,滴加的硫酸已过量
8. 将80 g氯化钡溶液分为四等份,依次加入到盛有100 g硫酸钠溶液的烧杯中,每次加入氯化钡溶液完全反应后烧杯中沉淀的总质量如下表所示,发生反应的原理为 Na2SO4+BaCl2=== BaSO4↓+2NaCl。
加入氯化钡溶液次数 第一次 第二次 第三次 第四次
烧杯中沉淀总质量/g 2 m 4.66 4.66
(1)上表中m的数值是__,第三次加入氯化钡溶液充分反应后,溶液中溶质成分为____________。
(2)计算该硫酸钠溶液中溶质的质量分数。
(1)4 BaCl2、NaCl
(2)解:设该硫酸钠溶液中溶质的质量为 x
Na2SO4+BaCl2=== BaSO4↓+2NaCl
142 233
x 4.66 g
x=2.84 g
硫酸钠溶液中溶质的质量分数为 ×100%=2.84%
答:该硫酸钠溶液中溶质的质量分数为2.84%。
同课章节目录
