2022年化学中考备考复习 《 化学计算题》精讲课件 (四)(课件37页)
文档属性
| 名称 | 2022年化学中考备考复习 《 化学计算题》精讲课件 (四)(课件37页) |  | |
| 格式 | zip | ||
| 文件大小 | 579.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 11:30:52 | ||
图片预览










文档简介
(共34张PPT)
2022年化学中考备考复习
《 化学计算题》精讲课件 (四)
1
计算技能突破
题型分类训练
2
涉及的形式有文字叙述、实物图操作和坐标曲线等,形式多变。一般会涉及质量分数的计算,要求掌握的化学方程式也是初中常见的化学方程式,难度不高。
考向1 题干已给纯净物的质量
例 1 为测定某盐酸中溶质的质量分数,小荣同学取该盐酸样品50 g,向其中加入过量锌粒,完全反应后收集到0.3 g氢气,计算盐酸中溶质质量分数时代入化学方程式中的纯净物为_____(填化学式,后同),其质量为_______。
寻找代入化学方程式中纯净物的质量
H2
0.3 g
考向2 利用质量差计算纯净物的质量
根据题干给出反应前后物质的质量,利用质量差计算纯净物的质量,常为生成气体或沉淀的质量。计算公式如下:
①生成沉淀的质量=反应前物质的总质量-反应后溶液的质量
②生成气体的质量=反应前物质的总质量-反应后称量的物质总质量
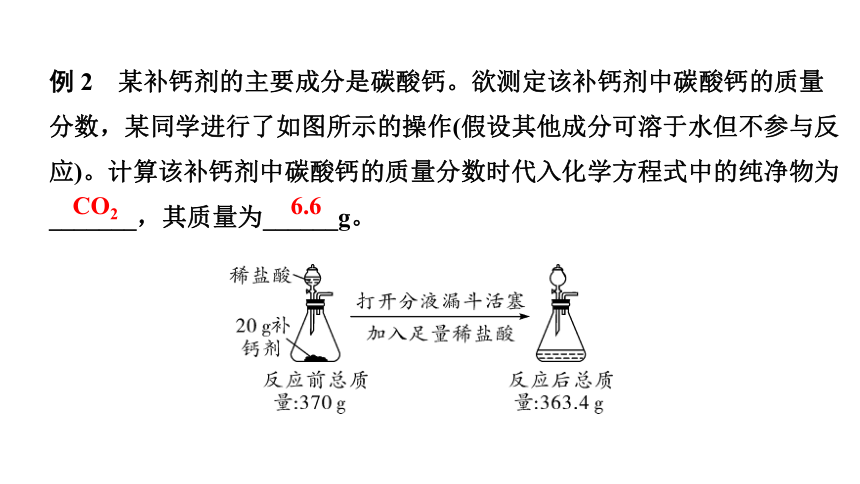
例 2 某补钙剂的主要成分是碳酸钙。欲测定该补钙剂中碳酸钙的质量分数,某同学进行了如图所示的操作(假设其他成分可溶于水但不参与反应)。计算该补钙剂中碳酸钙的质量分数时代入化学方程式中的纯净物为_______,其质量为______g。
CO2
6.6
考向3 利用固体(或溶液)的质量分数计算纯净物的质量
纯净物的质量=固体(或溶液)的质量×质量分数
例3 (2021青海改编)某化验室为了测定工厂废液中残余硫酸的含量,取该废液产品100 g,向其中滴加10%的氢氧化钠溶液40 g后,溶液恰好呈中性(废液中除硫酸外其它成分不与氢氧化钠反应)。计算该废液中残余硫酸的质量时代入化学方程式中的纯净物为_______,其质量为____g。
NaOH
4
计算混合物(A和B)中相关量:
①先寻找参与反应的纯净物A(或B),然后根据化学方程式直接计算出混合物中A(或B)的质量;
②混合物中A(或B)的质量分数= ×100%。
固体混合物中某物质的质量分数的计算
A的质量(或B的质量)
混合物的质量
例4 化学兴趣小组按下图实验测定部分变质的NaOH固体中Na2CO3的质量分数。
(1)根据题中信息______(填“能”或“不能”)计算Ca(OH)2溶液的溶质质量分数。
(2)计算固体混合物中Na2CO3的质量分数。
(1)不能
(2)解:设10.0 g固体混合物中Na2CO3的质量为x
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
106 100
x 2.0 g
x=2.12 g
固体混合物中Na2CO3的质量分数为 ×100%=21.2%
答:固体混合物中Na2CO3的质量分数为21.2%。
溶质质量分数的计算
1. (2021广安)某氯化钠溶液中含有氯化镁(MgCl2),学习小组为测定其中氯化镁的质量分数,在50.0 g该溶液中加入50.0 g氢氧化钠溶液恰好完全反应,经测定生成沉淀的质量为2.9 g。请回答下列问题:
(1)反应后溶液的质量为______g。
(2)求原氯化钠溶液中氯化镁的质量分数(写出计算过程)。
文字叙述型
(1)97.1
(2)解:设原氯化钠溶液中含有氯化镁质量为x
MgCl2+2NaOH === Mg(OH)2↓+2NaCl
95 58
x 2.9 g
x=4.75 g
则原氯化钠溶液中含有氯化镁的质量分数为 ×100%=9.5%
答:原氯化钠溶液中氯化镁的质量分数为9.5%。
2. 某同学向盛有100 g过氧化氢溶液的烧杯中加入3 g二氧化锰,充分反应后,称得烧杯内剩余物质的总质量为101.4 g。
(1)实验结束后,该同学过滤出烧杯内的固体,并对其进行洗涤、干燥、称量,得到固体的质量应为_____g。
(2)计算过氧化氢溶液中溶质质量分数。
(1)3
(2)解:由题意可知,生成氧气的质量为100 g+3 g-101.4 g=1.6 g
设100 g过氧化氢溶液中溶质的质量为x
2H2O2 2H2O+O2↑
68 32
x 1.6 g
x=3.4 g
过氧化氢溶液中溶质质量分数为 ×100%=3.4%
答:过氧化氢溶液中溶质质量分数为3.4%。
3. 为测定某工厂废水中CuSO4的含量,取废水样品400 g,滴加质量分数为10%的NaOH溶液至不再产生沉淀时,消耗NaOH溶液的质量是10 g。(废水中其它杂质易溶于水,但不与NaOH反应)
请完成下列分析及计算:
(1)若想通过沉淀的质量计算CuSO4的质量,应对过滤后的沉淀进行_____、干燥后再称量。
(2)计算废水中CuSO4的质量分数。
(1)洗涤
(2)解:设400 g废水中CuSO4的质量为x
2NaOH + CuSO4 === Cu(OH)2↓+Na2SO4
80 160
10 g×10% x
x=2 g
废水中CuSO4的质量分数为 ×100%=0.5%
答:废水中CuSO4的质量分数为0.5%。
4. 现有碳酸钾和氯化钾的固体混合物15.8 g,将100 g稀盐酸加入到固体混合物中,恰好完全反应,得到111.4 g溶液。请完成下列分析及计算:
(1)反应生成的气体的质量为______。
(2)计算所加稀盐酸中溶质的质量分数。
(1)4.4 g
(2)解:设参加反应的HCl的质量为x
K2CO3+2HCl === 2KCl+H2O+CO2↑
73 44
x 4.4 g
x=7.3 g
所加稀盐酸中溶质的质量分数为 ×100%=7.3%
答:所加稀盐酸中溶质质量分数为7.3%。
5. 为了测定某盐酸的溶质质量分数,某同学进行了如图所示的实验。请完成下列计算及分析:
(1)实验前用砂纸打磨铁片的目的是____________________________。
(2)计算该盐酸的溶质质量分数。
实验操作示意图型
(1)除去铁片表面的氧化物和污物
(2)解:根据质量守恒定律,产生氢气的质量为10 g+50 g-59.8 g=0.2 g
设50 g稀盐酸中溶质的质量为x
Fe+2HCl === FeCl2+H2↑
73 2
x 0.2 g
x=7.3 g
该盐酸的溶质质量分数为 ×100%=14.6%
答:该盐酸的溶质质量分数为14.6%。
6. 某化学兴趣小组为测定硫酸钾溶液(含杂质硝酸钾)的溶质质量分数,进行了如图所示实验。请回答:
(1)根据题中信息______(填“能”或“不能”)计算出氯化钡溶液的溶质质量分数。
(2)计算硫酸钾溶液的溶质质量分数。
(1)不能
(2)解:设硫酸钾溶液中溶质的质量为x
K2SO4+BaCl2 === BaSO4↓+2KCl
174 233
x 2.33 g
x=1.74 g
硫酸钾溶液的溶质质量分数为 ×100%=17.4%
答:所用硫酸钾溶液的溶质质量分数为17.4%。
7. 实验室有一瓶混有氯化钾的氯化钙样品,某同学为测定该样品中氯化钙的质量分数,进行了如下实验,实验过程和相关数据如图所示。请计算:
(1)反应生成沉淀的质量为_____g。
(2)求该样品中氯化钙的质量分数。
(1)10
(2)解:设该样品中氯化钙的质量为x
CaCl2+K2CO3 === 2KCl+CaCO3↓
111 100
x 10 g
x=11.1 g
该样品中氯化钙的质量分数为 ×100%=92.5%
答:该样品中氯化钙的质量分数为92.5%。
8. 小王同学想测定某Cu-Zn合金中铜的质量分数,取合金粉末13 g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示。请完成下列分析及计算:
(1)反应生成氢气的总质量为________g。
(2)计算合金中铜的质量分数。
坐标曲线型
(1)0.1
(2)解:设13 g Cu-Zn合金中Zn的质量为x
Zn+H2SO4 === ZnSO4+H2↑
65 2
x 0.1 g
x=3.25 g
合金中铜的质量分数为 ×100%=75%
答:合金中铜的质量分数为75%。
9. (2021西工大附中八模)欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取50 g稀硫酸样品于烧杯中,将10%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示,回答下列问题:
(1)a点溶液中的溶质是____________(填化学式)。
(2)计算该稀硫酸的溶质质量分数。
(1)H2SO4、Na2SO4
(2)解:设50 g该稀硫酸中溶质的质量为x
H2SO4+2NaOH === Na2SO4+2H2O
98 80
x 40 g×10%
x=4.9 g
则该稀硫酸中溶质的质量分数为 ×100%=9.8%
答:该稀硫酸的溶质质量分数为9.8%。
拓展类
10. 小王同学用高锰酸钾制取氧气,取10 g高锰酸钾样品加热,每隔一定时间后冷却、称量剩余固体质量。记录数据如下表,制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到100 g锰酸钾溶液。请计算:
(1)共制得氧气的质量为________g。
(2)计算所得锰酸钾溶液的溶质质量分数。
加热时间/min t1 t2 t3 t4
剩余固体质量/g 9.68 9.36 9.04 9.04
(1)0.96
(2)解:设生成锰酸钾的质量为x
2KMnO4 K2MnO4+MnO2+O2↑
197 32
x 0.96 g
x=5.91 g
所得锰酸钾溶液的溶质质量分数为 ×100%=5.91%
答:所得锰酸钾溶液的溶质质量分数为5.91%。
11. 某胃酸过多症患者,需要服用胃舒平胶囊来消耗胃中的盐酸。如图所示为胃舒平胶囊说明书,若该患者一个疗程服用12粒胃舒平胶囊,病情有所好转。请计算:
胃舒平胶囊
功能:缓解胃酸过多引起的胃病
规格:每粒含氢氧化铝0.25 g
用法用量:每天两次,每次两粒
(1)该患者一个疗程服用氢氧化铝_____g。
(2)患者一个疗程中和HCl的质量。(计算结果精确到0.1 g)
(1)3
(2)解:设一个疗程中和HCl的质量为x
Al(OH)3+ 3HCl === AlCl3+3H2O
78 109.5
3 g x
x≈4.2 g
答:患者一个疗程中和HCl的质量约为4.2 g。
12. 某兴趣小组为测定某瓶NaOH溶液的溶质质量分数,进行了如下实验。请完成下列分析及计算:
(1)第二次加入NaOH溶液后,氢氧化钠_____(填“是”或“不是”)恰好完全反应。
(2)计算所用NaOH溶液的溶质质量分数。
(1)不是
(2)解:第一次反应生成的氢氧化铜的质量为50 g+40 g-85.1 g=4.9 g
设40 g NaOH溶液中溶质的质量为x
CuSO4+2NaOH === Na2SO4+Cu(OH)2↓
80 98
x 4.9 g
x=4 g
所用NaOH溶液的溶质质量分数为 ×100%=10%
答:所用NaOH溶液的溶质质量分数为10%。
2022年化学中考备考复习
《 化学计算题》精讲课件 (四)
1
计算技能突破
题型分类训练
2
涉及的形式有文字叙述、实物图操作和坐标曲线等,形式多变。一般会涉及质量分数的计算,要求掌握的化学方程式也是初中常见的化学方程式,难度不高。
考向1 题干已给纯净物的质量
例 1 为测定某盐酸中溶质的质量分数,小荣同学取该盐酸样品50 g,向其中加入过量锌粒,完全反应后收集到0.3 g氢气,计算盐酸中溶质质量分数时代入化学方程式中的纯净物为_____(填化学式,后同),其质量为_______。
寻找代入化学方程式中纯净物的质量
H2
0.3 g
考向2 利用质量差计算纯净物的质量
根据题干给出反应前后物质的质量,利用质量差计算纯净物的质量,常为生成气体或沉淀的质量。计算公式如下:
①生成沉淀的质量=反应前物质的总质量-反应后溶液的质量
②生成气体的质量=反应前物质的总质量-反应后称量的物质总质量
例 2 某补钙剂的主要成分是碳酸钙。欲测定该补钙剂中碳酸钙的质量分数,某同学进行了如图所示的操作(假设其他成分可溶于水但不参与反应)。计算该补钙剂中碳酸钙的质量分数时代入化学方程式中的纯净物为_______,其质量为______g。
CO2
6.6
考向3 利用固体(或溶液)的质量分数计算纯净物的质量
纯净物的质量=固体(或溶液)的质量×质量分数
例3 (2021青海改编)某化验室为了测定工厂废液中残余硫酸的含量,取该废液产品100 g,向其中滴加10%的氢氧化钠溶液40 g后,溶液恰好呈中性(废液中除硫酸外其它成分不与氢氧化钠反应)。计算该废液中残余硫酸的质量时代入化学方程式中的纯净物为_______,其质量为____g。
NaOH
4
计算混合物(A和B)中相关量:
①先寻找参与反应的纯净物A(或B),然后根据化学方程式直接计算出混合物中A(或B)的质量;
②混合物中A(或B)的质量分数= ×100%。
固体混合物中某物质的质量分数的计算
A的质量(或B的质量)
混合物的质量
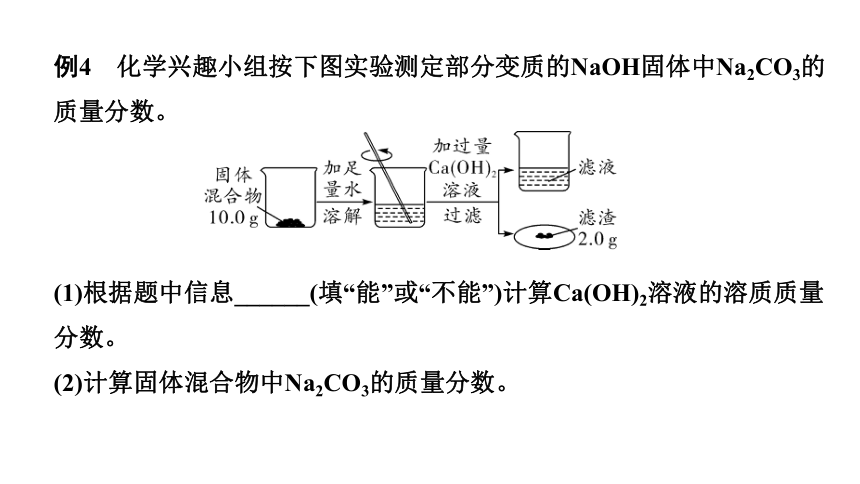
例4 化学兴趣小组按下图实验测定部分变质的NaOH固体中Na2CO3的质量分数。
(1)根据题中信息______(填“能”或“不能”)计算Ca(OH)2溶液的溶质质量分数。
(2)计算固体混合物中Na2CO3的质量分数。
(1)不能
(2)解:设10.0 g固体混合物中Na2CO3的质量为x
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
106 100
x 2.0 g
x=2.12 g
固体混合物中Na2CO3的质量分数为 ×100%=21.2%
答:固体混合物中Na2CO3的质量分数为21.2%。
溶质质量分数的计算
1. (2021广安)某氯化钠溶液中含有氯化镁(MgCl2),学习小组为测定其中氯化镁的质量分数,在50.0 g该溶液中加入50.0 g氢氧化钠溶液恰好完全反应,经测定生成沉淀的质量为2.9 g。请回答下列问题:
(1)反应后溶液的质量为______g。
(2)求原氯化钠溶液中氯化镁的质量分数(写出计算过程)。
文字叙述型
(1)97.1
(2)解:设原氯化钠溶液中含有氯化镁质量为x
MgCl2+2NaOH === Mg(OH)2↓+2NaCl
95 58
x 2.9 g
x=4.75 g
则原氯化钠溶液中含有氯化镁的质量分数为 ×100%=9.5%
答:原氯化钠溶液中氯化镁的质量分数为9.5%。
2. 某同学向盛有100 g过氧化氢溶液的烧杯中加入3 g二氧化锰,充分反应后,称得烧杯内剩余物质的总质量为101.4 g。
(1)实验结束后,该同学过滤出烧杯内的固体,并对其进行洗涤、干燥、称量,得到固体的质量应为_____g。
(2)计算过氧化氢溶液中溶质质量分数。
(1)3
(2)解:由题意可知,生成氧气的质量为100 g+3 g-101.4 g=1.6 g
设100 g过氧化氢溶液中溶质的质量为x
2H2O2 2H2O+O2↑
68 32
x 1.6 g
x=3.4 g
过氧化氢溶液中溶质质量分数为 ×100%=3.4%
答:过氧化氢溶液中溶质质量分数为3.4%。
3. 为测定某工厂废水中CuSO4的含量,取废水样品400 g,滴加质量分数为10%的NaOH溶液至不再产生沉淀时,消耗NaOH溶液的质量是10 g。(废水中其它杂质易溶于水,但不与NaOH反应)
请完成下列分析及计算:
(1)若想通过沉淀的质量计算CuSO4的质量,应对过滤后的沉淀进行_____、干燥后再称量。
(2)计算废水中CuSO4的质量分数。
(1)洗涤
(2)解:设400 g废水中CuSO4的质量为x
2NaOH + CuSO4 === Cu(OH)2↓+Na2SO4
80 160
10 g×10% x
x=2 g
废水中CuSO4的质量分数为 ×100%=0.5%
答:废水中CuSO4的质量分数为0.5%。
4. 现有碳酸钾和氯化钾的固体混合物15.8 g,将100 g稀盐酸加入到固体混合物中,恰好完全反应,得到111.4 g溶液。请完成下列分析及计算:
(1)反应生成的气体的质量为______。
(2)计算所加稀盐酸中溶质的质量分数。
(1)4.4 g
(2)解:设参加反应的HCl的质量为x
K2CO3+2HCl === 2KCl+H2O+CO2↑
73 44
x 4.4 g
x=7.3 g
所加稀盐酸中溶质的质量分数为 ×100%=7.3%
答:所加稀盐酸中溶质质量分数为7.3%。
5. 为了测定某盐酸的溶质质量分数,某同学进行了如图所示的实验。请完成下列计算及分析:
(1)实验前用砂纸打磨铁片的目的是____________________________。
(2)计算该盐酸的溶质质量分数。
实验操作示意图型
(1)除去铁片表面的氧化物和污物
(2)解:根据质量守恒定律,产生氢气的质量为10 g+50 g-59.8 g=0.2 g
设50 g稀盐酸中溶质的质量为x
Fe+2HCl === FeCl2+H2↑
73 2
x 0.2 g
x=7.3 g
该盐酸的溶质质量分数为 ×100%=14.6%
答:该盐酸的溶质质量分数为14.6%。
6. 某化学兴趣小组为测定硫酸钾溶液(含杂质硝酸钾)的溶质质量分数,进行了如图所示实验。请回答:
(1)根据题中信息______(填“能”或“不能”)计算出氯化钡溶液的溶质质量分数。
(2)计算硫酸钾溶液的溶质质量分数。
(1)不能
(2)解:设硫酸钾溶液中溶质的质量为x
K2SO4+BaCl2 === BaSO4↓+2KCl
174 233
x 2.33 g
x=1.74 g
硫酸钾溶液的溶质质量分数为 ×100%=17.4%
答:所用硫酸钾溶液的溶质质量分数为17.4%。
7. 实验室有一瓶混有氯化钾的氯化钙样品,某同学为测定该样品中氯化钙的质量分数,进行了如下实验,实验过程和相关数据如图所示。请计算:
(1)反应生成沉淀的质量为_____g。
(2)求该样品中氯化钙的质量分数。
(1)10
(2)解:设该样品中氯化钙的质量为x
CaCl2+K2CO3 === 2KCl+CaCO3↓
111 100
x 10 g
x=11.1 g
该样品中氯化钙的质量分数为 ×100%=92.5%
答:该样品中氯化钙的质量分数为92.5%。
8. 小王同学想测定某Cu-Zn合金中铜的质量分数,取合金粉末13 g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示。请完成下列分析及计算:
(1)反应生成氢气的总质量为________g。
(2)计算合金中铜的质量分数。
坐标曲线型
(1)0.1
(2)解:设13 g Cu-Zn合金中Zn的质量为x
Zn+H2SO4 === ZnSO4+H2↑
65 2
x 0.1 g
x=3.25 g
合金中铜的质量分数为 ×100%=75%
答:合金中铜的质量分数为75%。
9. (2021西工大附中八模)欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取50 g稀硫酸样品于烧杯中,将10%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示,回答下列问题:
(1)a点溶液中的溶质是____________(填化学式)。
(2)计算该稀硫酸的溶质质量分数。
(1)H2SO4、Na2SO4
(2)解:设50 g该稀硫酸中溶质的质量为x
H2SO4+2NaOH === Na2SO4+2H2O
98 80
x 40 g×10%
x=4.9 g
则该稀硫酸中溶质的质量分数为 ×100%=9.8%
答:该稀硫酸的溶质质量分数为9.8%。
拓展类
10. 小王同学用高锰酸钾制取氧气,取10 g高锰酸钾样品加热,每隔一定时间后冷却、称量剩余固体质量。记录数据如下表,制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到100 g锰酸钾溶液。请计算:
(1)共制得氧气的质量为________g。
(2)计算所得锰酸钾溶液的溶质质量分数。
加热时间/min t1 t2 t3 t4
剩余固体质量/g 9.68 9.36 9.04 9.04
(1)0.96
(2)解:设生成锰酸钾的质量为x
2KMnO4 K2MnO4+MnO2+O2↑
197 32
x 0.96 g
x=5.91 g
所得锰酸钾溶液的溶质质量分数为 ×100%=5.91%
答:所得锰酸钾溶液的溶质质量分数为5.91%。
11. 某胃酸过多症患者,需要服用胃舒平胶囊来消耗胃中的盐酸。如图所示为胃舒平胶囊说明书,若该患者一个疗程服用12粒胃舒平胶囊,病情有所好转。请计算:
胃舒平胶囊
功能:缓解胃酸过多引起的胃病
规格:每粒含氢氧化铝0.25 g
用法用量:每天两次,每次两粒
(1)该患者一个疗程服用氢氧化铝_____g。
(2)患者一个疗程中和HCl的质量。(计算结果精确到0.1 g)
(1)3
(2)解:设一个疗程中和HCl的质量为x
Al(OH)3+ 3HCl === AlCl3+3H2O
78 109.5
3 g x
x≈4.2 g
答:患者一个疗程中和HCl的质量约为4.2 g。
12. 某兴趣小组为测定某瓶NaOH溶液的溶质质量分数,进行了如下实验。请完成下列分析及计算:
(1)第二次加入NaOH溶液后,氢氧化钠_____(填“是”或“不是”)恰好完全反应。
(2)计算所用NaOH溶液的溶质质量分数。
(1)不是
(2)解:第一次反应生成的氢氧化铜的质量为50 g+40 g-85.1 g=4.9 g
设40 g NaOH溶液中溶质的质量为x
CuSO4+2NaOH === Na2SO4+Cu(OH)2↓
80 98
x 4.9 g
x=4 g
所用NaOH溶液的溶质质量分数为 ×100%=10%
答:所用NaOH溶液的溶质质量分数为10%。
同课章节目录
