人教版化学九年级下册 11.1生活中常见的盐(2)课件(14张PPT)
文档属性
| 名称 | 人教版化学九年级下册 11.1生活中常见的盐(2)课件(14张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 08:45:49 | ||
图片预览




文档简介
(共14张PPT)
人教版义务教育教科书九年级下册
第十一单元
课题一 生活中常见的盐
(第二课时)
一、碳酸钠、碳酸氢钠、碳酸钙的物理性质
氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
颜色、状态
溶解性
溶液的酸碱性
Na2CO3
NaCl
NaHCO3
CaCO3
白色固体
易溶于水
中性
白色固体
易溶于水
碱性
白色固体
易溶于水
碱性
白色固体
不溶于水
不溶于水
注意:纯碱不
是碱
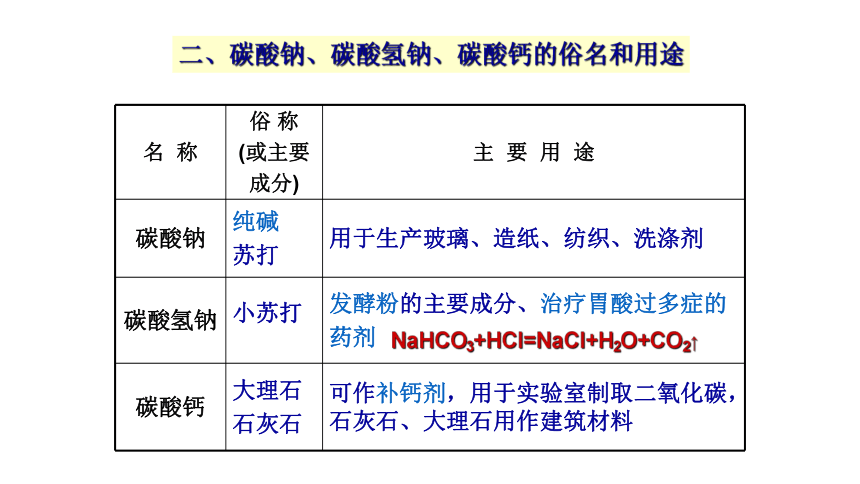
名 称 俗 称 (或主要 成分) 主 要 用 途
碳酸钠 纯碱 苏打 用于生产玻璃、造纸、纺织、洗涤剂
碳酸氢钠 小苏打 发酵粉的主要成分、治疗胃酸过多症的
药剂
碳酸钙 大理石 石灰石 可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料
NaHCO3+HCl=NaCl+H2O+CO2↑
二、碳酸钠、碳酸氢钠、碳酸钙的俗名和用途
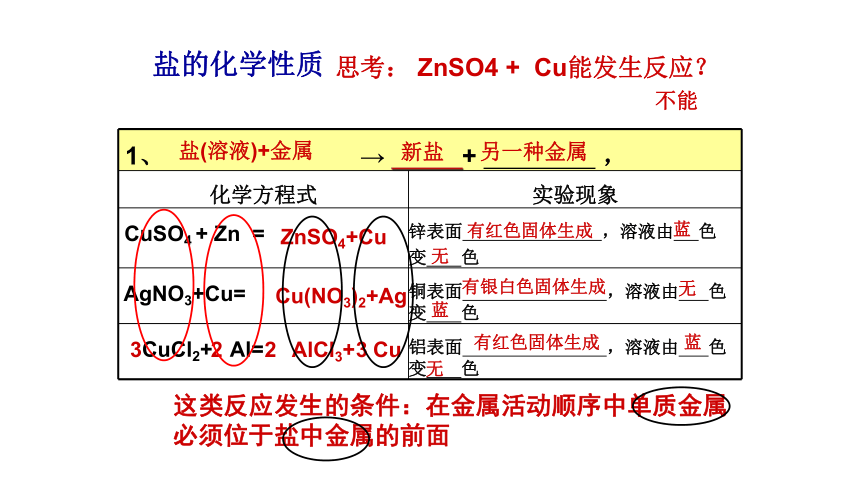
1、 → + ,
化学方程式 实验现象
CuSO4 + Zn = 锌表面 ,溶液由 色
变 色
AgNO3+Cu= 铜表面 ,溶液由 色变 色
CuCl2+ Al= 铝表面 ,溶液由 色变 色
ZnSO4+Cu
有红色固体生成
Cu(NO3)2+Ag
有银白色固体生成
无
蓝
AlCl3+ Cu
2
3
2
3
有红色固体生成
无
盐的化学性质
盐(溶液)+金属
蓝
蓝
无
新盐 另一种金属
思考: ZnSO4 + Cu能发生反应?
不能
这类反应发生的条件:在金属活动顺序中单质金属必须位于盐中金属的前面
【回顾】 请书写出实验室制取CO2的方程式。
CaCO3 + 2 HCl = CaCl2+CO2↑+H2O
【讨论】
根据上述反应,请问Na2CO3
和NaHCO3能否与稀盐酸反应?
如果能反应,请问它们又会生成
什么物质?
盐酸腐蚀含CaCO3的建材
【演示实验11-1】
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现 象
分 析
白色固体溶解,放出使澄清石灰水变浑浊的无色气体
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
【练习】请同学们写出上述有关化学方程式。
见书中73页
Na2CO3 + 2HCl === 2NaCl + CO2 ↑+H2O
NaHCO3 + 2HCl === 2NaCl + CO2 ↑+H2O
结论2:盐 + 酸 → 新盐 + 新酸
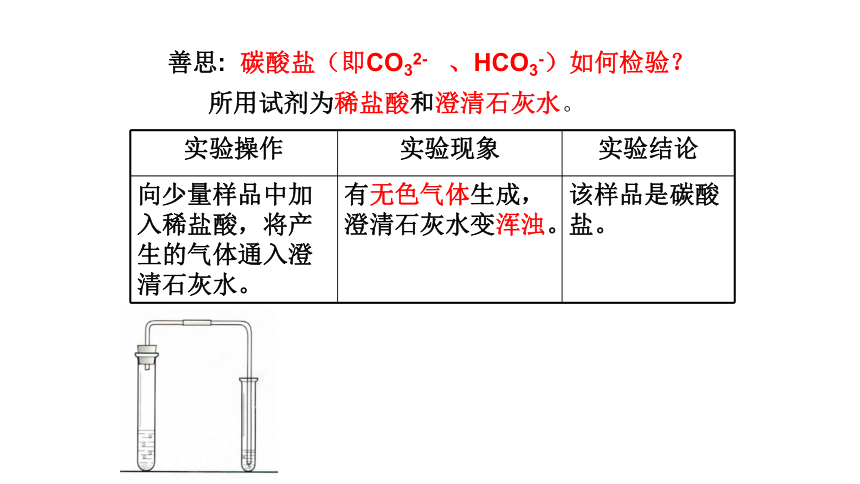
善思: 碳酸盐(即CO32- 、HCO3-)如何检验?
所用试剂为稀盐酸和澄清石灰水。
实验操作 实验现象 实验结论
向少量样品中加入稀盐酸,将产生的气体通入澄清石灰水。 有无色气体生成,澄清石灰水变浑浊。 该样品是碳酸盐。
碳酸根离子的检验:
①滴加稀盐酸,现象:
有气泡产生
②将产生的气体通入澄清石灰水,现象:
石灰水变浑浊
强调
碳酸钠溶液和石灰水的反应
实验11-2 碳酸钠溶液+澄清石灰水
现象
分析
Na2CO3 + Ca(OH)2 === CaCO3 + 2NaOH
出现白色沉淀
二者发生反应,生成一种难溶物
化学方程式
结论3:盐 + 碱 → 新盐 + 新碱
制造烧碱
4、 → 。
化学方程式 实验现象
NaCl + AgNO3 = 生成 。
Na2CO3 + BaCl2 = 生成 。
Na2SO4 + BaCl2 = 生成 。
NaNO3 + AgCl↓
白色沉淀
2NaCl + BaSO4 ↓
白色沉淀
2NaCl + BaCO3 ↓
白色沉淀
盐(溶液) +盐(溶液)
新盐 + 新盐
注意:盐与盐也都必须溶于水形成溶液才可以反应
盐的化学性质
盐的化学性质
盐 +金属 → 新盐 + 另一种金属
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新盐 + 新碱
盐 + 盐 → 新盐 + 新盐
是否发生反应必须用金属活动性顺序判断(前置换后)
是否发生必须满足:
1、反应物可溶
2、满足复分解反应的条件(生成物中有水或气体或沉淀)
1、下列物质属于同一种物质的是( )
A、纯碱与烧碱 B、石灰石与生石灰
C、苏打与纯碱 D、冰与干冰
2、用做鉴别碳酸根离子的试剂是( )
A.稀硫酸 B.食盐水
C.石灰水 D.稀盐酸和澄清石灰水
3、在改进制碱法方面,曾做出杰出贡献的科学家是( )
A.侯德榜 B.拉瓦锡 C.道尔顿 D.汤姆生
C
D
A
<
课堂检测
一、碳酸钠、碳酸氢钠、碳酸钙的物理性质和用途
二、碳酸盐的检验(即CO32-或HCO3-的检验)
三、盐的化学性质
课堂小结
人教版义务教育教科书九年级下册
第十一单元
课题一 生活中常见的盐
(第二课时)
一、碳酸钠、碳酸氢钠、碳酸钙的物理性质
氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
颜色、状态
溶解性
溶液的酸碱性
Na2CO3
NaCl
NaHCO3
CaCO3
白色固体
易溶于水
中性
白色固体
易溶于水
碱性
白色固体
易溶于水
碱性
白色固体
不溶于水
不溶于水
注意:纯碱不
是碱
名 称 俗 称 (或主要 成分) 主 要 用 途
碳酸钠 纯碱 苏打 用于生产玻璃、造纸、纺织、洗涤剂
碳酸氢钠 小苏打 发酵粉的主要成分、治疗胃酸过多症的
药剂
碳酸钙 大理石 石灰石 可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料
NaHCO3+HCl=NaCl+H2O+CO2↑
二、碳酸钠、碳酸氢钠、碳酸钙的俗名和用途
1、 → + ,
化学方程式 实验现象
CuSO4 + Zn = 锌表面 ,溶液由 色
变 色
AgNO3+Cu= 铜表面 ,溶液由 色变 色
CuCl2+ Al= 铝表面 ,溶液由 色变 色
ZnSO4+Cu
有红色固体生成
Cu(NO3)2+Ag
有银白色固体生成
无
蓝
AlCl3+ Cu
2
3
2
3
有红色固体生成
无
盐的化学性质
盐(溶液)+金属
蓝
蓝
无
新盐 另一种金属
思考: ZnSO4 + Cu能发生反应?
不能
这类反应发生的条件:在金属活动顺序中单质金属必须位于盐中金属的前面
【回顾】 请书写出实验室制取CO2的方程式。
CaCO3 + 2 HCl = CaCl2+CO2↑+H2O
【讨论】
根据上述反应,请问Na2CO3
和NaHCO3能否与稀盐酸反应?
如果能反应,请问它们又会生成
什么物质?
盐酸腐蚀含CaCO3的建材
【演示实验11-1】
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现 象
分 析
白色固体溶解,放出使澄清石灰水变浑浊的无色气体
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
【练习】请同学们写出上述有关化学方程式。
见书中73页
Na2CO3 + 2HCl === 2NaCl + CO2 ↑+H2O
NaHCO3 + 2HCl === 2NaCl + CO2 ↑+H2O
结论2:盐 + 酸 → 新盐 + 新酸
善思: 碳酸盐(即CO32- 、HCO3-)如何检验?
所用试剂为稀盐酸和澄清石灰水。
实验操作 实验现象 实验结论
向少量样品中加入稀盐酸,将产生的气体通入澄清石灰水。 有无色气体生成,澄清石灰水变浑浊。 该样品是碳酸盐。
碳酸根离子的检验:
①滴加稀盐酸,现象:
有气泡产生
②将产生的气体通入澄清石灰水,现象:
石灰水变浑浊
强调
碳酸钠溶液和石灰水的反应
实验11-2 碳酸钠溶液+澄清石灰水
现象
分析
Na2CO3 + Ca(OH)2 === CaCO3 + 2NaOH
出现白色沉淀
二者发生反应,生成一种难溶物
化学方程式
结论3:盐 + 碱 → 新盐 + 新碱
制造烧碱
4、 → 。
化学方程式 实验现象
NaCl + AgNO3 = 生成 。
Na2CO3 + BaCl2 = 生成 。
Na2SO4 + BaCl2 = 生成 。
NaNO3 + AgCl↓
白色沉淀
2NaCl + BaSO4 ↓
白色沉淀
2NaCl + BaCO3 ↓
白色沉淀
盐(溶液) +盐(溶液)
新盐 + 新盐
注意:盐与盐也都必须溶于水形成溶液才可以反应
盐的化学性质
盐的化学性质
盐 +金属 → 新盐 + 另一种金属
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新盐 + 新碱
盐 + 盐 → 新盐 + 新盐
是否发生反应必须用金属活动性顺序判断(前置换后)
是否发生必须满足:
1、反应物可溶
2、满足复分解反应的条件(生成物中有水或气体或沉淀)
1、下列物质属于同一种物质的是( )
A、纯碱与烧碱 B、石灰石与生石灰
C、苏打与纯碱 D、冰与干冰
2、用做鉴别碳酸根离子的试剂是( )
A.稀硫酸 B.食盐水
C.石灰水 D.稀盐酸和澄清石灰水
3、在改进制碱法方面,曾做出杰出贡献的科学家是( )
A.侯德榜 B.拉瓦锡 C.道尔顿 D.汤姆生
C
D
A
<
课堂检测
一、碳酸钠、碳酸氢钠、碳酸钙的物理性质和用途
二、碳酸盐的检验(即CO32-或HCO3-的检验)
三、盐的化学性质
课堂小结
同课章节目录
