化学人教版(2019)选择性必修2 3.3.2离子晶体(共13张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.3.2离子晶体(共13张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-26 00:00:00 | ||
图片预览




文档简介
(共13张PPT)
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
第2课时 离子晶体
【学习目标】1′
1.掌握离子晶体的结构特点。
2.能根据离子晶体的结构特点解释其物理性质。
【问题导学】8′
阅读课本87-89页的内容, 思考回答下列问题:
1.什么是离子晶体?
2.如何判断离子晶体?
3.离子晶体中只有离子微粒构成的吗?
萤石
重晶石
烧碱
CaF2
BaSO4
NaOH
以上这些晶体属于哪种类型的晶体?为什么?
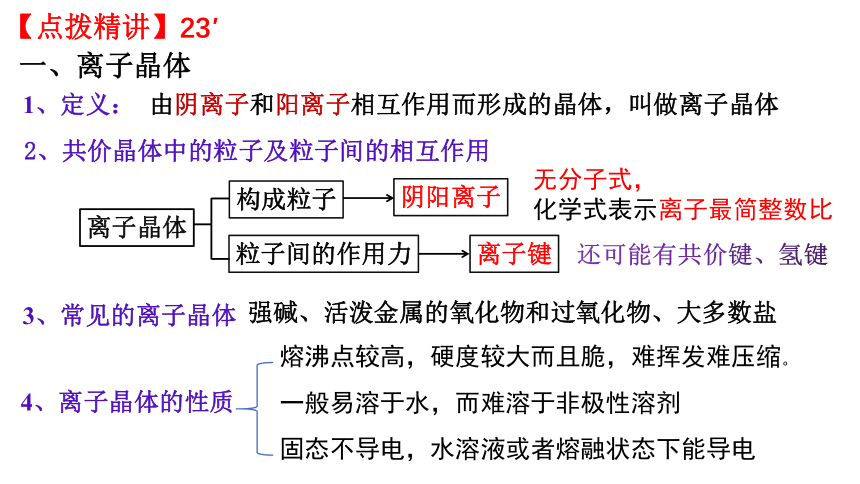
一、离子晶体
强碱、活泼金属的氧化物和过氧化物、大多数盐
1、定义:
3、常见的离子晶体
4、离子晶体的性质
构成粒子
离子晶体
阴阳离子
粒子间的作用力
离子键
2、共价晶体中的粒子及粒子间的相互作用
【点拨精讲】23′
无分子式,
化学式表示离子最简整数比
还可能有共价键、氢键
熔沸点较高,硬度较大而且脆,难挥发难压缩。
一般易溶于水,而难溶于非极性溶剂
固态不导电,水溶液或者熔融状态下能导电
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
成键粒子
键的本质
静电引力和斥力
离子键没有方向性和饱和性。
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高,硬度越大
二、离子键
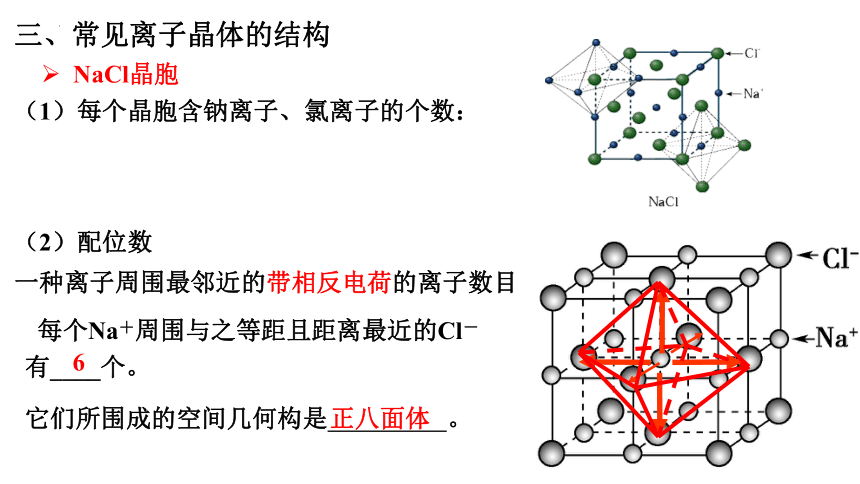
NaCl晶胞
(2)配位数
一种离子周围最邻近的带相反电荷的离子数目
每个Na+周围与之等距且距离最近的Cl-有____个。
6
它们所围成的空间几何构是 。
正八面体
三、常见离子晶体的结构
(1)每个晶胞含钠离子、氯离子的个数:
Na+:12×+1=4
Cl-:8×+6×=4
NaCl晶胞
(3)每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
Cl-
Na+
6
12
6
12
三、常见离子晶体的结构
CsCl晶胞
三、常见离子晶体的结构
(2)阳离子配位数 ,
它们所围成的空间几何构型
是 。
1
(1)每个晶胞中,Cl—有 个,
Cs +有 个
阴离子配位数 。
8
8
1
正六面体
CsCl晶胞
(3)每个Cs+周围与之等距且距离最近的Cl-有___个,Cs+有___个。
每个Cl-周围与之等距且距离最近的Cs+有____个,Cl-有____个。
8
6
8
6
三、常见离子晶体的结构
四、影响离子晶体配位数的因素
①几何因素:晶体中正负离子的半径比
②电荷因素:正负离子的电荷比
③键性因素:离子键的纯粹程度
离子晶体 共价晶体 分子晶体 金属晶体
存在 微粒
微粒间作用 离子键 共价键 分子间作用力 金属键
主要 性质 质地硬,熔沸点很高; 不溶于大多数溶剂;导电性差, 硬度小,溶沸点低; 水溶液能够导电, 金属光泽,是电和热的良导体,熔沸点高或低
实例 食盐晶体 金刚石 NH3、HCl 镁、铝
【课堂小结】1′
阴阳离子
原子
分子
金属离子、自由电子
硬而脆,熔沸点较高,难挥发难压缩。
一般易溶于水,而难溶于非极性溶剂
固态不导电,水溶液或者熔融状态下能导电
【当堂检测】12′
1.下列叙述正确的是( )A.离子化合物受热熔化破坏化学键,吸收热量,属于化学变化
B.非金属原子间不可能形成离子键C.金属元素与非金属元素化合时,一定形成离子键D.某元素的原子最外层只有一个电子,它跟卤素结合时形成的化学键不一定是离子键
D
C
4.下列说法正确的是( )A.MgF2晶体中存在共价键和离子键
B.任何晶体中,若含有阳离子也一定含有阴离子
C.离子晶体中一定存在离子键
D.离子晶体的结构中不可能存在电中性的分子
C
C
阴离子配位数
(2)阳离子配位数
4
8
5.萤石(CaF2)晶胞结构如图所示,晶胞边长为acm,
(1)小黑球代表的离子: 。
Ca2+
(3)每个Ca2+周围最近且等距离的Ca2+有 个
每个F-周围最近且等距离的F-有 个
12
6
(4)该晶胞中Ca2+与F-的最近距离为
acm
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
第2课时 离子晶体
【学习目标】1′
1.掌握离子晶体的结构特点。
2.能根据离子晶体的结构特点解释其物理性质。
【问题导学】8′
阅读课本87-89页的内容, 思考回答下列问题:
1.什么是离子晶体?
2.如何判断离子晶体?
3.离子晶体中只有离子微粒构成的吗?
萤石
重晶石
烧碱
CaF2
BaSO4
NaOH
以上这些晶体属于哪种类型的晶体?为什么?
一、离子晶体
强碱、活泼金属的氧化物和过氧化物、大多数盐
1、定义:
3、常见的离子晶体
4、离子晶体的性质
构成粒子
离子晶体
阴阳离子
粒子间的作用力
离子键
2、共价晶体中的粒子及粒子间的相互作用
【点拨精讲】23′
无分子式,
化学式表示离子最简整数比
还可能有共价键、氢键
熔沸点较高,硬度较大而且脆,难挥发难压缩。
一般易溶于水,而难溶于非极性溶剂
固态不导电,水溶液或者熔融状态下能导电
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
成键粒子
键的本质
静电引力和斥力
离子键没有方向性和饱和性。
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高,硬度越大
二、离子键
NaCl晶胞
(2)配位数
一种离子周围最邻近的带相反电荷的离子数目
每个Na+周围与之等距且距离最近的Cl-有____个。
6
它们所围成的空间几何构是 。
正八面体
三、常见离子晶体的结构
(1)每个晶胞含钠离子、氯离子的个数:
Na+:12×+1=4
Cl-:8×+6×=4
NaCl晶胞
(3)每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
Cl-
Na+
6
12
6
12
三、常见离子晶体的结构
CsCl晶胞
三、常见离子晶体的结构
(2)阳离子配位数 ,
它们所围成的空间几何构型
是 。
1
(1)每个晶胞中,Cl—有 个,
Cs +有 个
阴离子配位数 。
8
8
1
正六面体
CsCl晶胞
(3)每个Cs+周围与之等距且距离最近的Cl-有___个,Cs+有___个。
每个Cl-周围与之等距且距离最近的Cs+有____个,Cl-有____个。
8
6
8
6
三、常见离子晶体的结构
四、影响离子晶体配位数的因素
①几何因素:晶体中正负离子的半径比
②电荷因素:正负离子的电荷比
③键性因素:离子键的纯粹程度
离子晶体 共价晶体 分子晶体 金属晶体
存在 微粒
微粒间作用 离子键 共价键 分子间作用力 金属键
主要 性质 质地硬,熔沸点很高; 不溶于大多数溶剂;导电性差, 硬度小,溶沸点低; 水溶液能够导电, 金属光泽,是电和热的良导体,熔沸点高或低
实例 食盐晶体 金刚石 NH3、HCl 镁、铝
【课堂小结】1′
阴阳离子
原子
分子
金属离子、自由电子
硬而脆,熔沸点较高,难挥发难压缩。
一般易溶于水,而难溶于非极性溶剂
固态不导电,水溶液或者熔融状态下能导电
【当堂检测】12′
1.下列叙述正确的是( )A.离子化合物受热熔化破坏化学键,吸收热量,属于化学变化
B.非金属原子间不可能形成离子键C.金属元素与非金属元素化合时,一定形成离子键D.某元素的原子最外层只有一个电子,它跟卤素结合时形成的化学键不一定是离子键
D
C
4.下列说法正确的是( )A.MgF2晶体中存在共价键和离子键
B.任何晶体中,若含有阳离子也一定含有阴离子
C.离子晶体中一定存在离子键
D.离子晶体的结构中不可能存在电中性的分子
C
C
阴离子配位数
(2)阳离子配位数
4
8
5.萤石(CaF2)晶胞结构如图所示,晶胞边长为acm,
(1)小黑球代表的离子: 。
Ca2+
(3)每个Ca2+周围最近且等距离的Ca2+有 个
每个F-周围最近且等距离的F-有 个
12
6
(4)该晶胞中Ca2+与F-的最近距离为
acm
