化学人教版(2019)必修第二册7.3.1乙醇与乙酸第一课时乙醇(共39张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.1乙醇与乙酸第一课时乙醇(共39张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 121.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-26 07:35:35 | ||
图片预览









文档简介
(共39张PPT)
2022
第七章 有机化合物
第三节 乙醇和乙酸
第一课时 乙醇
下列有机物属于烃吗?为什么?
C2H6、CH3CH=CH2、CH3Cl、C6H6、 CH3CH2OH、 CH3COOH
拓展延伸
乙醇可以看成是乙烷中的一个氢原子被羟基取代以后的产物
C—C
H
H
H
H
H
乙醇的官能团
羟基
H
—
—O—H
一、烃的衍生物
1.定义:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。
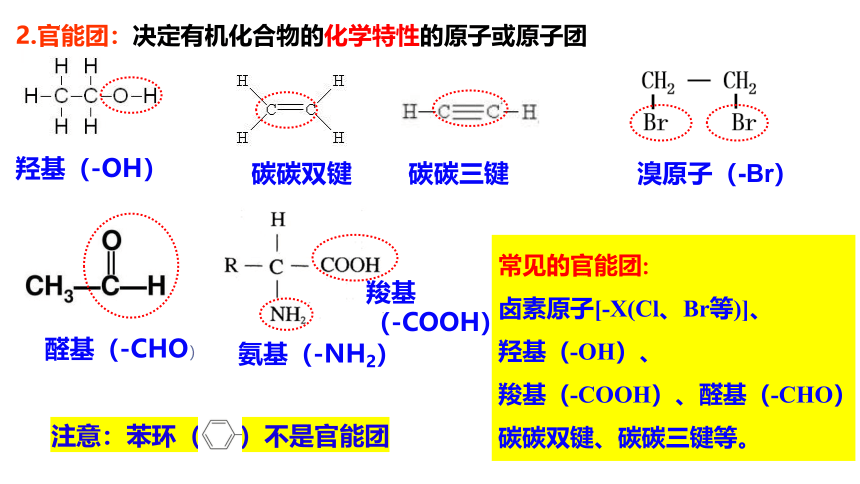
2.官能团:决定有机化合物的化学特性的原子或原子团
溴原子(-Br)
碳碳双键
氨基(-NH2)
羧基
(-COOH)
羟基(-OH)
醛基(-CHO)
注意:苯环( )不是官能团
常见的官能团:
卤素原子[-X(Cl、Br等)]、
羟基(-OH)、
羧基(-COOH)、醛基(-CHO)
碳碳双键、碳碳三键等。
碳碳三键
羟基(—OH)与氢氧根(OH-)一样吗?
名称 氢氧根(OH-) 羟基(—OH)
电子式 (10电子) (9电子)
电性 带负电的阴离子 电中性
稳定性 稳定 不稳定
能否独立存在 能独立存在于溶液或离子化合物中 不能独立存在,必须和其他基团或原子结合
1.白日放歌须纵___,青春作伴好还乡。
2.明月几时有,把___ 问青天。
3.借问_____何处有,牧童遥指杏花村。
4.何以解忧,唯有_____。
酒
酒
酒家
杜康
中国具有悠久的酒文化,请说出一些有关酒的著名诗句、谚语:
啤酒含酒精 3%~5%
葡萄酒含酒精 6%~20%
黄酒含酒精 8%~15%
白酒含酒精 50%~70%
(均为体积分数)
医用酒精含乙醇75%
工业酒精约含乙醇96%
无水酒精含乙醇99.5%以上
白酒
啤酒
绍兴黄酒
生活中有哪些地方有酒的影子?
消毒剂(75%
的乙醇溶液)
1.病人发烧通常用酒精擦拭全身,用此法降温。
2.衣服上沾上少许汽油用酒精可以去除。
3.酒香不怕巷子深
4.白酒的主要成分是乙醇和水
5.酒精灯用完后为什么要盖上灯帽
6.用酒泡中药(药酒)—如泡枸杞
(易挥发)
(良好的有机溶剂)
(易挥发、有特殊香味)
(乙醇易溶于水)
(易挥发)
(良好的有机溶剂)
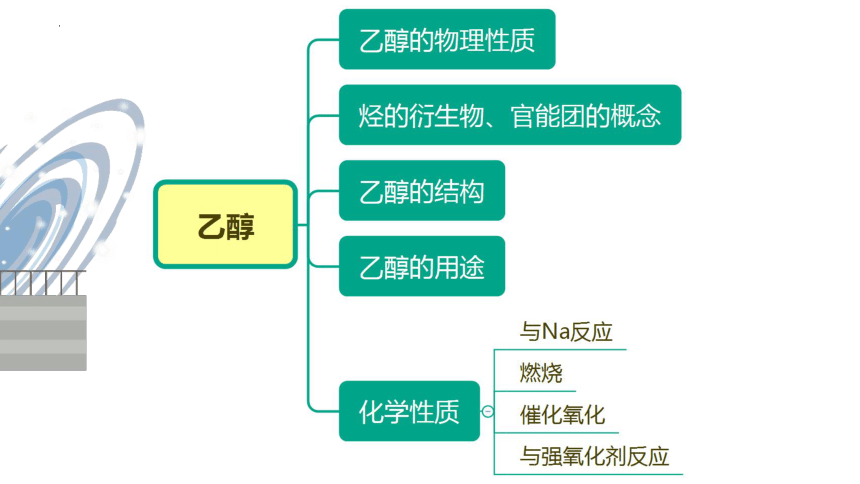
活动1:观察乙醇并联系生活归纳乙醇的物理性质
如何除去乙醇中的水?
加入生石灰,然后蒸馏,得到无水乙醇
如何检验酒精中是否含水?
通常加入无水硫酸铜固体
一、乙醇的物理性质
俗称 颜色 气味 沸点 状态 溶解性 密度
无色
特殊香味
液体
比水小
与水以任意比互溶,能溶解多种有机物和无机物
酒精
78.5℃
易挥发
如何比较?
二、乙醇的组成和结构
分子式 结构式 电子式 结构简式 官能团 球棍模型 空间充填模型
C2H6O
CH3CH2OH
或C2H5OH
-OH
(羟基)
结构分析
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O—H键和②C—O键的电子对都向氧原子偏移,因而,醇在起反应时, ①O—H键和②C—O键容易断裂。
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
(1)与活泼金属如Na的反应
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
断①号键
置换反应
现象:钠下沉,且不熔;有气泡,无响声;加酚酞,无色变红
三、乙醇的化学性质
Na置换了羟基中的氢,不是乙基上的氢原子
4. 乙醇的化学性质
(1)乙醇与钠反应
【实验7-4】在盛有少量无水乙醇的试管中,加入一小块新切的、用滤纸吸干表面煤油的钠,在试管口迅速塞上带尖嘴导管的橡胶塞,用小试管收集气体并检验其纯度,然后点燃,再将干燥的小烧杯罩在火焰上。待烧杯壁上出现液滴后,迅速倒转烧杯,向其中加入少量澄清石灰水。
水的存在会干扰乙醇和金属钠反应的现象
有水生成
①钠开始沉于试管底部,仍为块状,表面有气泡产生,慢慢消失;放出的气体可在空气中安静地燃烧,火焰呈淡蓝色
②烧杯内壁有水珠产生;
③烧杯中的澄清石灰水不变浑浊。
实验现象:
H2、CO、CH4
结论:(有氢气生成)
钠与水 钠与乙醇
实验现象
剧烈程度
化学方程式
反应实质
浮、熔、游、响、红
钠块开始沉于试管底部,未熔化,最终慢慢消失
剧烈
缓慢
2Na + 2H2O = 2NaOH + H2
2CH3CH2OH + 2Na 2CH3CH2ONa + H2
乙醇分子中羟基上的氢原子被置换
水中的氢原子被置换
三、乙醇的化学性质
钠与水、乙醇反应的实验现象:
[结论]乙醇羟基上的氢原子活泼性比弱于水中氢原子
每2mol 羟基与足量的Na反应生成1mol H2
三、乙醇的化学性质
1、乙醇与钠反应
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
[练习]其它活泼金属如钾、镁和铝等也可与乙醇反应,均可产生H2 ,请写出镁与乙醇反应的化学方程式。
H—C —C—O—H
H H
H H
①处O—H键断开
①
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
(置换反应)
2Na+2HOH=2NaOH+H2
虽然乙醇中羟基的氢原子能被置换出来,但是乙醇是非电解质,不能电离出H+,所以不能发生酸碱反应,即不能与NaOH溶液反应
2CO2 +3H2O
C2H5OH + 3O2
点燃
现象:产生淡蓝色火焰,同时放出大量热。
(1)燃烧反应(完全燃烧)
2、氧化反应
三、乙醇的化学性质
说明:乙醇分子中所有的化学键都断裂。
焊接铜/银器时,表面会生成发黑的氧化膜;
银匠都是先把银在火上烧热,马上蘸一下酒精,银会光亮如初!这是何原理?
铜丝红
Δ
变黑
有刺激性气味
插入乙醇溶液中
又变红
Cu
Δ
CuO
乙醛CH3CHO
插入乙醇溶液中
Cu
分析: 发生反应 2Cu+O2==2CuO
分析: 生成新的物质—乙醛 CuO+CH3CH2OH Cu +CH3CHO+H2O
Cu催化剂
现象及原因探究
中间产物
(2)催化氧化
①
②
①
②
①
②
反应实验中铜丝是否参与反应 铜丝的作用是什么
铜丝参与化学反应,铜丝先被氧气氧化成氧化铜,后又被乙醇还原为铜,反应前后的质量和化学性质没有变化,起催化剂的作用。
(2)氧化反应
③催化氧化:
断①③号键
2Cu + O2 2CuO 红色变为黑色
△
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
黑色变为红色,产生有刺激性气味的液体。
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
醇催化氧化的条件:羟基碳原子上必须有氢
氧化反应:去氢加氧
还原反应:加氢去氧
Cu
乙醇
乙醛
氧原子
水
动画演示:
H—C—C—O
H
H
H
H
H
H—C—C—O
H
H
H
氢原子
碳原子
1.下列醇在Cu或Ag的作用下将如何发生催化氧化反应
2 CH3-C-O-H + O2
CH3
H
Cu / Ag
O
=
2CH3-C-CH3 + 2H2O
丙酮
2 CH3-C-O-H + O2
CH3
CH3
Cu / Ag
不能发生催化氧化
H
H
2 CH3-CH2-C-O-H + O2
Cu / Ag
O
=
2CH3-CH2-C-H + 2H2O
丙醛
与-OH相连的C原子上有2个H原子的,氧化成醛。
与-OH相连的C原子上有1个H原子的,氧化成酮。
与-OH相连的C原子上没有H原子的,不能催化氧化。
2.下列醇中能催化氧化成醛的是( )
A.(CH3)2CHOH
B.(CH3)2C(C2H5)OH
C.(CH3)3CCH2OH
D.CH3C(C2H5)2OH
练习
C
3.已知维生素A的结构简式可写为 式中以线表示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )
A.维生素A的分子式为C20H28O
B.维生素A 是一种易溶于水的醇
C.维生素A的分子中有苯环结构,又能被酸性K2Cr2O7溶液氧化
D.1mol维生素A 在催化剂作用下最多可与 5molH2发生加成反应
D
H O
| ||
H— C — C —H
|
H 乙醛
CH3CHO的官能团是醛基(—CHO),在适当条件下乙醛可以被氧气进一步氧化,生成乙酸。
2 CH3CHO + O2 2CH3COOH
催化剂
乙醛
与强氧化剂反应:
醇能使酸性高锰酸钾褪色,但不与溴水反应。
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
重铬酸钾由橙色变为灰绿色检验酒驾
酸性高锰酸钾紫红色褪去
(2)氧化反应
KMnO4
(紫色)
MnSO4
(无色)
K2Cr2O7 Cr2(SO4)3
重铬酸钾(橙色) 硫酸铬 (绿色)
乙醇
乙醛
乙酸
CO2+H2O
Cu/Ag,加热
O2
O2
KMnO4(H+)/K2Cr2O4(H+)
O2(点燃)
小结:乙醇的氧化反应
条件控制在有机反应中的作用
(1)乙醇可用作酒精、火锅等的燃料;
(2)乙醇是重要的有机化工原料和溶剂,用于生产医药、香料、化妆品、涂料等;
(3)医疗上常用75%(体积分数)的乙醇溶液作消毒剂。
5. 乙醇的用途
1.乙醇的浓度越大,消毒能力越强吗?
2.无水乙醇真的无水吗?
3.乙醇的氧化反应一定生成乙醛吗?
4.乙醇有同分异构体吗?
重难点答疑
练习
1、能用来检验酒精中是否含有水的试剂是( )
A. I2
B.无水硫酸铜
C. 浓硫酸
D. 金属钠
B
2. 能证明乙醇分子中有一个羟基的事实是 ( )
A. 乙醇能溶于水
B. 乙醇能脱水
C. 0.1mol乙醇与足量钠反应,生成0.5mol氢气
D.乙醇完全燃烧生成二氧化碳和水
C
练习
【例9】化学兴趣小组的同学们设计了如图装置验证乙醇催化氧化的产物(加热仪器、夹持装置已略去)。
已知:乙醇的沸点为78℃,易溶于水;乙醛的沸点为20.8℃,易溶于水。
(1)乙醇催化氧化反应的化学方程式是
(2)实验时上述装置中需要加热的是_______(填序号,下同),其中应该先加热的是____,为使装置A中的乙醇成为蒸气,最简单的加热方法是________________。
(3)实验室制取氧气的化学方程式是_________________________________。
(1)2CH3CH2OH+O2 →2CH3CHO+2H2O
AB
B
水浴加热
(4)实验开始后,装置B中能观察到的现象是___________________ ;装置C中能观察到的现象是___________________, 由此得出的结论是__________________________。
(5)装置E的作用是___________________,能初步判定反应后有乙醛生成的依据是_______________________________________。
(6)装置D中的药品是______, 其作用_____________________________
铜丝由红变黑,再由黑变红
无水硫酸铜粉末变为蓝色
乙醇催化氧化反应的产物有水
吸收乙醛,防止倒吸
装置E中的物质有刺激性气味
碱石灰
防止外界的水蒸气进入C中使无水硫酸铜变蓝
与Na反应,断_____键
催化氧化,断______键
燃烧,断_________ _键
①
① ③
【课堂小结】
①② ③④⑤
2022
第七章 有机化合物
第三节 乙醇和乙酸
第一课时 乙醇
下列有机物属于烃吗?为什么?
C2H6、CH3CH=CH2、CH3Cl、C6H6、 CH3CH2OH、 CH3COOH
拓展延伸
乙醇可以看成是乙烷中的一个氢原子被羟基取代以后的产物
C—C
H
H
H
H
H
乙醇的官能团
羟基
H
—
—O—H
一、烃的衍生物
1.定义:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。
2.官能团:决定有机化合物的化学特性的原子或原子团
溴原子(-Br)
碳碳双键
氨基(-NH2)
羧基
(-COOH)
羟基(-OH)
醛基(-CHO)
注意:苯环( )不是官能团
常见的官能团:
卤素原子[-X(Cl、Br等)]、
羟基(-OH)、
羧基(-COOH)、醛基(-CHO)
碳碳双键、碳碳三键等。
碳碳三键
羟基(—OH)与氢氧根(OH-)一样吗?
名称 氢氧根(OH-) 羟基(—OH)
电子式 (10电子) (9电子)
电性 带负电的阴离子 电中性
稳定性 稳定 不稳定
能否独立存在 能独立存在于溶液或离子化合物中 不能独立存在,必须和其他基团或原子结合
1.白日放歌须纵___,青春作伴好还乡。
2.明月几时有,把___ 问青天。
3.借问_____何处有,牧童遥指杏花村。
4.何以解忧,唯有_____。
酒
酒
酒家
杜康
中国具有悠久的酒文化,请说出一些有关酒的著名诗句、谚语:
啤酒含酒精 3%~5%
葡萄酒含酒精 6%~20%
黄酒含酒精 8%~15%
白酒含酒精 50%~70%
(均为体积分数)
医用酒精含乙醇75%
工业酒精约含乙醇96%
无水酒精含乙醇99.5%以上
白酒
啤酒
绍兴黄酒
生活中有哪些地方有酒的影子?
消毒剂(75%
的乙醇溶液)
1.病人发烧通常用酒精擦拭全身,用此法降温。
2.衣服上沾上少许汽油用酒精可以去除。
3.酒香不怕巷子深
4.白酒的主要成分是乙醇和水
5.酒精灯用完后为什么要盖上灯帽
6.用酒泡中药(药酒)—如泡枸杞
(易挥发)
(良好的有机溶剂)
(易挥发、有特殊香味)
(乙醇易溶于水)
(易挥发)
(良好的有机溶剂)
活动1:观察乙醇并联系生活归纳乙醇的物理性质
如何除去乙醇中的水?
加入生石灰,然后蒸馏,得到无水乙醇
如何检验酒精中是否含水?
通常加入无水硫酸铜固体
一、乙醇的物理性质
俗称 颜色 气味 沸点 状态 溶解性 密度
无色
特殊香味
液体
比水小
与水以任意比互溶,能溶解多种有机物和无机物
酒精
78.5℃
易挥发
如何比较?
二、乙醇的组成和结构
分子式 结构式 电子式 结构简式 官能团 球棍模型 空间充填模型
C2H6O
CH3CH2OH
或C2H5OH
-OH
(羟基)
结构分析
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O—H键和②C—O键的电子对都向氧原子偏移,因而,醇在起反应时, ①O—H键和②C—O键容易断裂。
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
(1)与活泼金属如Na的反应
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
断①号键
置换反应
现象:钠下沉,且不熔;有气泡,无响声;加酚酞,无色变红
三、乙醇的化学性质
Na置换了羟基中的氢,不是乙基上的氢原子
4. 乙醇的化学性质
(1)乙醇与钠反应
【实验7-4】在盛有少量无水乙醇的试管中,加入一小块新切的、用滤纸吸干表面煤油的钠,在试管口迅速塞上带尖嘴导管的橡胶塞,用小试管收集气体并检验其纯度,然后点燃,再将干燥的小烧杯罩在火焰上。待烧杯壁上出现液滴后,迅速倒转烧杯,向其中加入少量澄清石灰水。
水的存在会干扰乙醇和金属钠反应的现象
有水生成
①钠开始沉于试管底部,仍为块状,表面有气泡产生,慢慢消失;放出的气体可在空气中安静地燃烧,火焰呈淡蓝色
②烧杯内壁有水珠产生;
③烧杯中的澄清石灰水不变浑浊。
实验现象:
H2、CO、CH4
结论:(有氢气生成)
钠与水 钠与乙醇
实验现象
剧烈程度
化学方程式
反应实质
浮、熔、游、响、红
钠块开始沉于试管底部,未熔化,最终慢慢消失
剧烈
缓慢
2Na + 2H2O = 2NaOH + H2
2CH3CH2OH + 2Na 2CH3CH2ONa + H2
乙醇分子中羟基上的氢原子被置换
水中的氢原子被置换
三、乙醇的化学性质
钠与水、乙醇反应的实验现象:
[结论]乙醇羟基上的氢原子活泼性比弱于水中氢原子
每2mol 羟基与足量的Na反应生成1mol H2
三、乙醇的化学性质
1、乙醇与钠反应
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
[练习]其它活泼金属如钾、镁和铝等也可与乙醇反应,均可产生H2 ,请写出镁与乙醇反应的化学方程式。
H—C —C—O—H
H H
H H
①处O—H键断开
①
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
(置换反应)
2Na+2HOH=2NaOH+H2
虽然乙醇中羟基的氢原子能被置换出来,但是乙醇是非电解质,不能电离出H+,所以不能发生酸碱反应,即不能与NaOH溶液反应
2CO2 +3H2O
C2H5OH + 3O2
点燃
现象:产生淡蓝色火焰,同时放出大量热。
(1)燃烧反应(完全燃烧)
2、氧化反应
三、乙醇的化学性质
说明:乙醇分子中所有的化学键都断裂。
焊接铜/银器时,表面会生成发黑的氧化膜;
银匠都是先把银在火上烧热,马上蘸一下酒精,银会光亮如初!这是何原理?
铜丝红
Δ
变黑
有刺激性气味
插入乙醇溶液中
又变红
Cu
Δ
CuO
乙醛CH3CHO
插入乙醇溶液中
Cu
分析: 发生反应 2Cu+O2==2CuO
分析: 生成新的物质—乙醛 CuO+CH3CH2OH Cu +CH3CHO+H2O
Cu催化剂
现象及原因探究
中间产物
(2)催化氧化
①
②
①
②
①
②
反应实验中铜丝是否参与反应 铜丝的作用是什么
铜丝参与化学反应,铜丝先被氧气氧化成氧化铜,后又被乙醇还原为铜,反应前后的质量和化学性质没有变化,起催化剂的作用。
(2)氧化反应
③催化氧化:
断①③号键
2Cu + O2 2CuO 红色变为黑色
△
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
黑色变为红色,产生有刺激性气味的液体。
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
醇催化氧化的条件:羟基碳原子上必须有氢
氧化反应:去氢加氧
还原反应:加氢去氧
Cu
乙醇
乙醛
氧原子
水
动画演示:
H—C—C—O
H
H
H
H
H
H—C—C—O
H
H
H
氢原子
碳原子
1.下列醇在Cu或Ag的作用下将如何发生催化氧化反应
2 CH3-C-O-H + O2
CH3
H
Cu / Ag
O
=
2CH3-C-CH3 + 2H2O
丙酮
2 CH3-C-O-H + O2
CH3
CH3
Cu / Ag
不能发生催化氧化
H
H
2 CH3-CH2-C-O-H + O2
Cu / Ag
O
=
2CH3-CH2-C-H + 2H2O
丙醛
与-OH相连的C原子上有2个H原子的,氧化成醛。
与-OH相连的C原子上有1个H原子的,氧化成酮。
与-OH相连的C原子上没有H原子的,不能催化氧化。
2.下列醇中能催化氧化成醛的是( )
A.(CH3)2CHOH
B.(CH3)2C(C2H5)OH
C.(CH3)3CCH2OH
D.CH3C(C2H5)2OH
练习
C
3.已知维生素A的结构简式可写为 式中以线表示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )
A.维生素A的分子式为C20H28O
B.维生素A 是一种易溶于水的醇
C.维生素A的分子中有苯环结构,又能被酸性K2Cr2O7溶液氧化
D.1mol维生素A 在催化剂作用下最多可与 5molH2发生加成反应
D
H O
| ||
H— C — C —H
|
H 乙醛
CH3CHO的官能团是醛基(—CHO),在适当条件下乙醛可以被氧气进一步氧化,生成乙酸。
2 CH3CHO + O2 2CH3COOH
催化剂
乙醛
与强氧化剂反应:
醇能使酸性高锰酸钾褪色,但不与溴水反应。
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
重铬酸钾由橙色变为灰绿色检验酒驾
酸性高锰酸钾紫红色褪去
(2)氧化反应
KMnO4
(紫色)
MnSO4
(无色)
K2Cr2O7 Cr2(SO4)3
重铬酸钾(橙色) 硫酸铬 (绿色)
乙醇
乙醛
乙酸
CO2+H2O
Cu/Ag,加热
O2
O2
KMnO4(H+)/K2Cr2O4(H+)
O2(点燃)
小结:乙醇的氧化反应
条件控制在有机反应中的作用
(1)乙醇可用作酒精、火锅等的燃料;
(2)乙醇是重要的有机化工原料和溶剂,用于生产医药、香料、化妆品、涂料等;
(3)医疗上常用75%(体积分数)的乙醇溶液作消毒剂。
5. 乙醇的用途
1.乙醇的浓度越大,消毒能力越强吗?
2.无水乙醇真的无水吗?
3.乙醇的氧化反应一定生成乙醛吗?
4.乙醇有同分异构体吗?
重难点答疑
练习
1、能用来检验酒精中是否含有水的试剂是( )
A. I2
B.无水硫酸铜
C. 浓硫酸
D. 金属钠
B
2. 能证明乙醇分子中有一个羟基的事实是 ( )
A. 乙醇能溶于水
B. 乙醇能脱水
C. 0.1mol乙醇与足量钠反应,生成0.5mol氢气
D.乙醇完全燃烧生成二氧化碳和水
C
练习
【例9】化学兴趣小组的同学们设计了如图装置验证乙醇催化氧化的产物(加热仪器、夹持装置已略去)。
已知:乙醇的沸点为78℃,易溶于水;乙醛的沸点为20.8℃,易溶于水。
(1)乙醇催化氧化反应的化学方程式是
(2)实验时上述装置中需要加热的是_______(填序号,下同),其中应该先加热的是____,为使装置A中的乙醇成为蒸气,最简单的加热方法是________________。
(3)实验室制取氧气的化学方程式是_________________________________。
(1)2CH3CH2OH+O2 →2CH3CHO+2H2O
AB
B
水浴加热
(4)实验开始后,装置B中能观察到的现象是___________________ ;装置C中能观察到的现象是___________________, 由此得出的结论是__________________________。
(5)装置E的作用是___________________,能初步判定反应后有乙醛生成的依据是_______________________________________。
(6)装置D中的药品是______, 其作用_____________________________
铜丝由红变黑,再由黑变红
无水硫酸铜粉末变为蓝色
乙醇催化氧化反应的产物有水
吸收乙醛,防止倒吸
装置E中的物质有刺激性气味
碱石灰
防止外界的水蒸气进入C中使无水硫酸铜变蓝
与Na反应,断_____键
催化氧化,断______键
燃烧,断_________ _键
①
① ③
【课堂小结】
①② ③④⑤
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
