3.2分子晶体与共价晶体—基础训练(word版 含解析)
文档属性
| 名称 | 3.2分子晶体与共价晶体—基础训练(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 979.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 17:26:09 | ||
图片预览


文档简介
3.2分子晶体与共价晶体
一、选择题(共16题)
1.下列说法中,正确的是
A.共价晶体中,共价键的键长越短,键能越大,熔点就越高
B.碘单质升华时,分子中键发生断裂
C.分子晶体中,共价键的键能越大,该物质的熔、沸点就越高
D.分子晶体中,分子间作用力越大,则分子越稳定
2.下列说法中正确的是
A.分子间作用力越大,分子越稳定
B.分子间作用力越大,物质的熔、沸点越高
C.相对分子质量越大,其分子间作用力越大
D.分子间只存在范德华力,不存在化学键
3.CrSi、Ge—GaAs、ZnGeAs2和碳化硅都是重要的半导体化合物,下列说法错误的是
A.基态铬原子的价电子排布式为3d54s1
B.Ge—GaAs中元素Ge、Ga、As的第一电离能由大到小的顺序为As>Ga>Ge
C.ZnGeAs2中元素Zn、Ge、As的电负性由大到小的顺序为As>Ge>Zn
D.碳化硅属于原子晶体,其熔沸点均大于晶体硅
4.科学家们合成了具有半导体特性的环状C18分子,其合成方法的示意图如图:
下列说法不正确的是
A.键长:C≡C>C—C B.键能:C—O>C—C
C.C20O2为极性分子 D.C18晶体为分子晶体
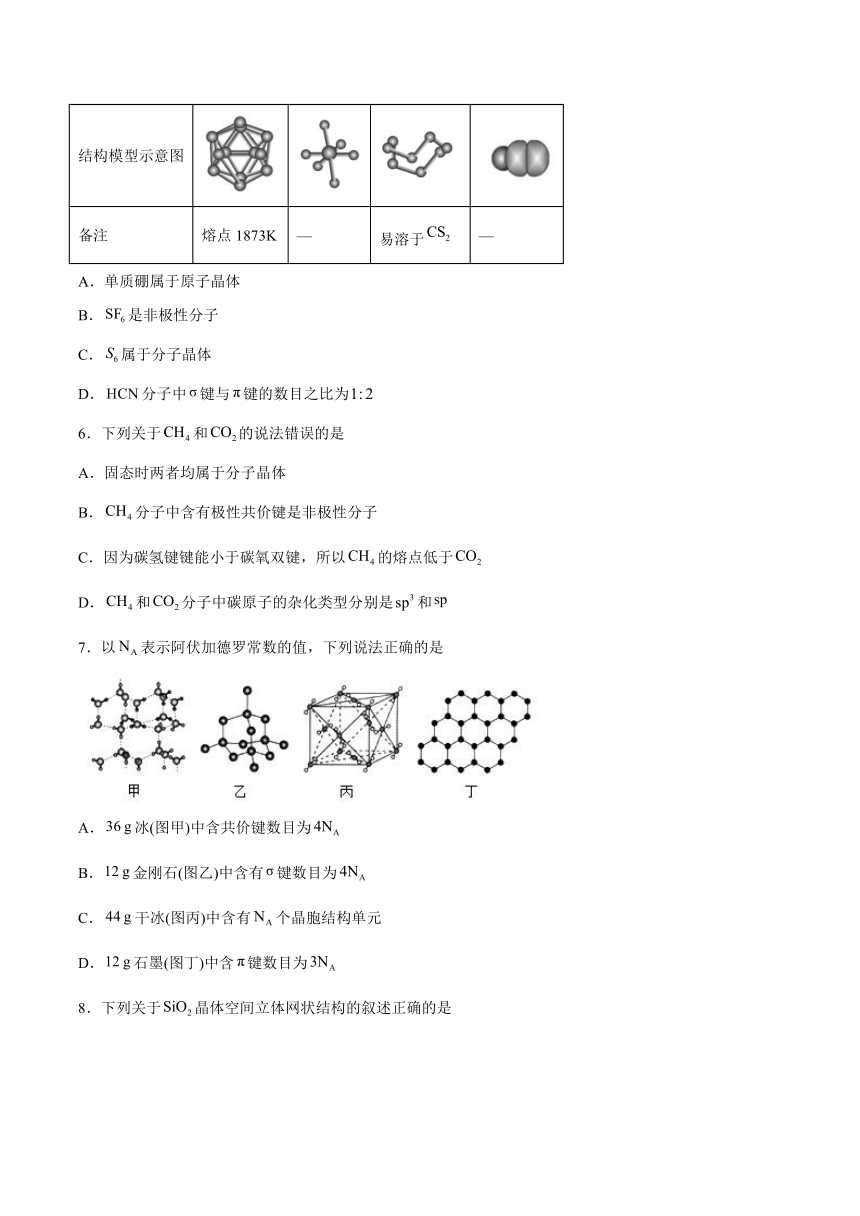
5.观察下列模型并结合有关信息,判断下列说法错误的是
物质或结构单元
结构模型示意图
备注 熔点1873K — 易溶于 —
A.单质硼属于原子晶体
B.是非极性分子
C.属于分子晶体
D.分子中键与键的数目之比为
6.下列关于和的说法错误的是
A.固态时两者均属于分子晶体
B.分子中含有极性共价键是非极性分子
C.因为碳氢键键能小于碳氧双键,所以的熔点低于
D.和分子中碳原子的杂化类型分别是和
7.以表示阿伏加德罗常数的值,下列说法正确的是
A.冰(图甲)中含共价键数目为
B.金刚石(图乙)中含有键数目为
C.干冰(图丙)中含有个晶胞结构单元
D.石墨(图丁)中含键数目为
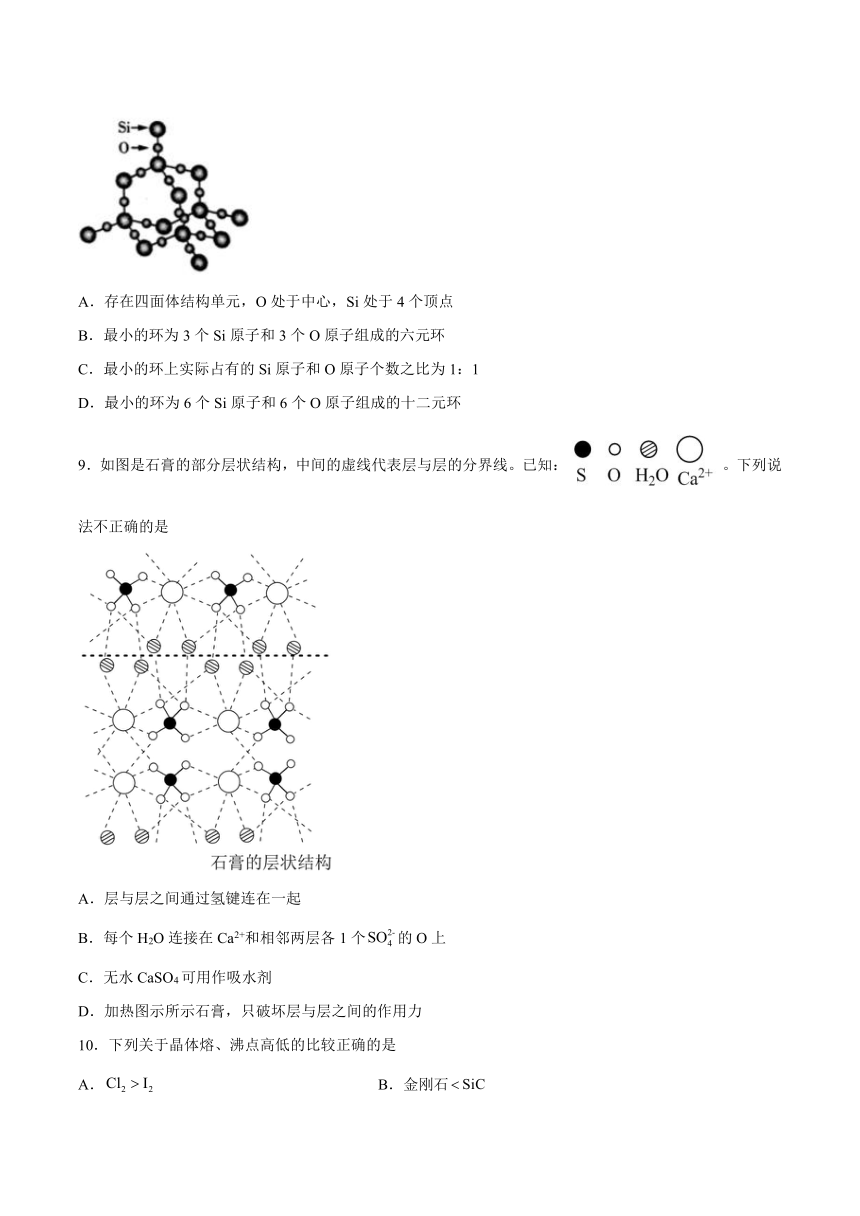
8.下列关于晶体空间立体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶点
B.最小的环为3个Si原子和3个O原子组成的六元环
C.最小的环上实际占有的Si原子和O原子个数之比为1:1
D.最小的环为6个Si原子和6个O原子组成的十二元环
9.如图是石膏的部分层状结构,中间的虚线代表层与层的分界线。已知:。下列说法不正确的是
A.层与层之间通过氢键连在一起
B.每个H2O连接在Ca2+和相邻两层各1个的O上
C.无水CaSO4可用作吸水剂
D.加热图示所示石膏,只破坏层与层之间的作用力
10.下列关于晶体熔、沸点高低的比较正确的是
A. B.金刚石
C. D.
11.已知:发生水解反应的机理如图:
下列叙述正确的是
A.的键角与白磷()的键角相同
B.脱水后加热分解得到的晶体中每个可构成12个12元环
C.属于原子晶体(共价晶体)
D.不能按照上述机理发生水解反应,原因是的原子半径小
12.下列关于共价晶体、分子晶体的叙述中,正确的是
A.在SiO2晶体中,1个硅原子和4 个氧原子形成4条共价键
B.晶体中分子间作用力越大,分子越稳定
C.HI 的相对分子质量大于HF,所以HI 的沸点高于HF
D.金刚石由共价键形成的碳原子环中,最小环上有12个碳原子
13.石墨烯是单层碳原子排列成的蜂窝状六角平面晶体,具有重要的应用前景。可利用碳化硅制备高品质石墨烯材料。下列说法正确的是
A.24 g石墨烯约含1 mol六元碳环
B.碳化硅晶胞与金刚石晶胞结构相似
C.石墨烯的熔点低于碳化硅
D.利用碳化硅制备石墨烯的过程属于物理剥离
14.设NA为阿伏加德罗常数的值。下列说法中正确的是
A.12g金刚石中含有C-C的个数为4NA
B.124g白磷(P4)晶体中含有P-P的个数为6NA
C.28g晶体硅中含有Si-Si的个数为2NA
D.SiO2晶体中1mol硅原子可与氧原子形成2NA个共价键(Si-O)
15.硫和氮是两种常见的“明星元素”,其化合物是现代无机化学研究的最为活跃的领域之一.如图是已经合成的某硫氮化合物的分子结构,下列说法错误的是
A.该物质的分子式为SN B.该物质的熔沸点较低
C.该物质的分子中不含非极性键 D.N的电负性比S的电负性强
16.美国加州Livermore国家实验室物理学家Choong—Shik和他的同事们,在40Gpa的高压容器中,用Nd:YbLiF4激光器将液态二氧化碳加热到1800K,二氧化碳转化为与石英具有相似结构的晶体。估计该晶体可能具有的结构或性质是
A.该晶体属于共价晶体 B.硬度与金刚石相近
C.熔点较低 D.硬度较小
二、综合题
17.碳、硅及其化合物是一类重要物质。自然界的矿物.岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000-3000kPa,在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ
根据题意完成下列填空:
(1)在地壳深处容易有________气体逸出,SiO2易在地壳________(填“深”、“浅”)处沉积。
(2)如果上述反应的平衡常数K值变大,该反应____________(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______(选填编号)。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间80min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为________。
(5)合成氮化碳是一种与金刚石类似的晶体,该晶体中微粒间的作用力是_______,预测氮化碳的硬度比金刚石的_________(选填“大”、“小”、“不确定”)。
(6)SiH4是________(极性或非极性)分子,与CH4相比,沸点高的是________(化学式),用有关化学原理解释该事实:__________。
18.工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2) 2],反应的化学方程式为 2NH3(g)+ CO2 (g) CO(NH2) 2(l)+ H2O(l)+Q(Q>0)。该反应分两步进行:① 2NH3(g)+ CO2 (g) NH4COONH2 (s)+ Q1(Q1>0),② NH4COONH2 (s) CO(NH2) 2(l)+ H2O(l)+Q2 (Q2<0).
(1)固体CO2称干冰,属于___________晶体。氮原子最外层电子排布式是___________。
(2)氧元素的非金属性比碳强,用原子结构的知识说明理由_________________
(3)下列示意图中,能正确表示合成尿素过程中能量变化的是____________。
A、B、
C、D、
(4)写出合成尿素第一步反应的平衡常数表达式K=_________________________________。
(5)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图所示。
① 在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为___________。
② 为提高合成尿素的产率,下列可以采取的措施有____________。
a. 缩小反应容器的容积 b. 升高温度
c. 增加反应物的量 d. 使用合适的催化剂
③ 若保持平衡的温度和体积不变,25min 时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在下图中画出25~50min内氨气的浓度变化曲线____________。
19.碳及其化合物的价值型转化在工业生产方面具有重要的研究价值。回答下列问题:
(1)下列物质的晶体中熔点由高到低的顺序为______(填序号,下同);晶胞结构中每个粒子周围等距离紧邻的粒子数为12的有______。
① ② ③ ④金刚石
(2)已知CO分子中化学键为O≡C.相关的化学键键能数据如下:
化学键
463 1075 803 436
则 ______。
(3)正反应的平衡常数和逆反应的平衡常数随温度变化曲线如图。
①表示曲线的是_______(填“I”或“II”")。
②T1时,向体积为10L的固定容积的容器中充入、,则的平衡转化率为_______。
③T2时,A点_______(填“>”、“<”或“=”)。
(4)某温度下,向体积恒定的密闭容器中充入等物质的量的CO和,发生反应:。容器内起始总压强为,平衡时总压减小了10%,则用分压表示该反应的平衡常数Kp=_____。(分压=总压×物质的量分数)
20.氧、碳等非金属元素形成的物质种类繁多、性状各异。
(1)氧、氟、氮三种元素都可形成简单离子,它们的离子半径最小的是___________(填离子符号),硅元素在元素周期表中的位置是___________。CO2和SiO2是同一主族元素的最高正价氧化物,常温下CO2为气体,SiO2为高熔点固体。请分析原因:___________。
(2)比较硫和氯性质的强弱。热稳定性H2S___________HCl(选填“<”、“>”或“=”,下同);酸性:HClO4___________H2SO4。用一个离子方程式说明氯元素和硫元素非金属性的相对强弱:___________。
(3)红酒中添加一定量的SO2 可以防止酒液氧化,这利用了SO2 的___________性。若将SO2气体通入H2S水溶液中直至过量,下列表示溶液的pH随通入SO2气体体积变化的示意图正确的是___________(填序号)。
已知NaHSO3溶液呈酸性,而HSO既能电离又能水解。则在NaHSO3溶液中c(H2SO3)___________c(SO)(选填“<”、“>”或“=”) 。
(4)亚硫酸钠和碘酸钾在酸性条件下反应生成硫酸钠、硫酸钾、碘和水,写该反应方程式________________。
21.据《科学》报道,中国科学家首次实现超导体(Bi2Te3/NBSe2)中分段费米面。回答下列问题:
(1)Bi与P位于同主族,基态P原子的价层电子排布式为___________。基态Se原子核外电子云轮廓图呈哑铃形的能级上共有___________ 个电子。
(2)二氯二茂铌的组成为(C5H5)2NbCl2.环戊二烯阴离子()的平面结构简式如图所示:
①C、H、Cl的电负性由大到小的顺序为___________。
②中C原子的杂化类型是___________。
③已知分子中的大π键可以用表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则中大π键可以表示为___________。
(3)的空间构型为___________。
(4)四氟化铌(NbF4)的熔点为72℃,它的晶体类型为___________。
22.(1)CH3COONa溶液呈碱性,用离子方程式表示其原因___。
(2)KSCN是离子化合物,各原子都达到8电子稳定结构,则其电子式为____。
(3)石英比干冰熔点高的主要原因是____。
23.C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构)。
(1)C60、金刚石和石墨三者的关系互为________。
A.同分异构体 B.同素异形体
C.同系物 D.同位素
(2)固态时,C60属于________晶体(填“离子”、“原子”或“分子”),C60分子中含有双键的数目是________个。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是________NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子,二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是________个。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是________个。
24.元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为__________。
(2)C60属于_________晶体,石墨属于________晶体。
(3)石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm。其原因是金刚石中只存在C-C间的_____共价键(填σ或π,下同),而石墨层内的C—C间不仅存在____共价键,还有____键。
(4)金刚石晶胞含有_______个碳原子。
参考答案:
1.A
【详解】
A.共价晶体是由原子通过共价键形成的具有空间网状结构晶体,共价键的键长越短,键能越大,熔点就越高,A正确;
B.碘单质升华时,只发生物质状态的改变,是物理变化,而分子没有变化、所以分子中键不发生断裂,B错误;
C.分子晶体是由分子通过分子间作用力形成的晶体,分子间作用力越大,该物质的熔、沸点就越高,与分子内的共价键无关,C错误;
D.分子的稳定性与分子内的共价键有关,与分子间作用力无关,D错误;
答案选A。
2.B
【详解】
A.分子间作用力越大,分子晶体的熔沸点越高,分子稳定性与分子间作用力无关,故A错误;
B.影响分子晶体熔沸点高低的因素为分子间作用力,分子间作用力越大,分子晶体的熔沸点越高,故B正确;
C.不含有氢键的分子晶体,相对分子质量越大,其分子间作用力越大,故C错误;
D.分子间存在范德华力,也可能存在氢键,如水中分子间存在范德华力和氢键,故D错误;
故选B。
3.B
【详解】
A.铬元素的原子序数24,基态铬原子的价电子排布式为3d54s1,故A正确;
B.同周期元素,从左到右第一电离能呈增大趋势,则第一电离能As>Ge>Ga,故B错误;
C.非金属元素的电负性强于金属元素,金属元素的金属性越强,电负性越小,砷为非金属元素,锌的金属性强于锗元素,则电负性由大到小的顺序为As>Ge>Zn,故C正确;
D.原子晶体的熔沸点取决于共价键的强弱,碳化硅、晶体硅均属于原子晶体,碳硅键的键能大于硅硅键、键长小于硅硅键,则熔沸点碳化硅均大于晶体硅,故D正确;
故选B。
4.A
【详解】
A.一般单键的键长>双键>三键,故键长:C≡C<C—C,A错误;
B.由于C原子半径大于O,故C-C键的键长大于C-O键的键长,其C-O为极性键,C-C为非极性键,故键能:C—O>C—C,B正确;
C.由图可知,C20O2不是中心对称结构,正、负电荷的中心不重合,故其为极性分子,C正确;
D.由图示可知,C18为一个独立的分子,故C18晶体为分子晶体,D正确;
故答案为:A。
5.D
【详解】
A.单质硼熔点1873K,熔点很高,属于原子晶体,故A正确;
B.是正八面体形分子,正负电荷中心重合,是非极性分子,故B正确;
C.易溶于非极性溶剂,属于分子晶体,故C正确;
D.是sp杂化的直线形分子,键与键的数目之比为,故D错误;
故答案为D。
6.C
【详解】
A.非金属氧化物(不包括SiO2)、非金属氢化物、酸、NH3 H2O、烃类及烃类衍生物(不包括有机盐类)这些基本微粒由分子构成的物质,固态时均为分子晶体,描述正确,不符题意;
B.CH4中C—H键成键原子不同,是极性共价键,但是CH4分子空间构型是正四面体形,呈中心对称,分子正电中心与负电中心重合,所以分子为非极性分子,描述正确,不符题意;
C.分子熔沸由分子质量大小为主决定,与化学键键能无关,描述错误,符合题意;
D.C原子以四条单键连接其它原子,C原子杂化类型是sp3;C原子有一条双键连接其它原子,C原子杂化类型是sp2,C原子以两条双键或者以一条三键连接其它原子,C原子杂化类型是是sp,所以本选项描述正确,不符题意;
综上,本题选C。
7.A
【详解】
A.1个水分子中含有2个共价键,所以冰中含共价键数目为,A正确;
B.金刚石晶胞中,1个C原子形成4个共价键,一个共价键连有2个C原子,平均每个C原子形成2个共价键,所以金刚石中含有键数目为,B错误;
C.1个干冰晶胞中,含有个分子,所以干冰中含有个晶胞结构单元,C错误;
D.石墨晶体中,1个碳原子形成3个C-C键,所以每个碳原子实际占1.5个化学键,石墨烯,含碳碳键数目为,每一层只形成1个键,故键数目不是,D错误。
故答案为:A
8.D
【详解】
A.晶体中存在四面体结构单元,每个原子能形成4个共价键,每个O原子能形成2个共价键,处于中心,O处于4个顶点,故A错误;
B.最小的环为6个原子和6个O原子组成的十二元环,故B错误;
C.每个环实际占有的原子数为,O原子数为,故最小的环上实际占有的原子和O原子个数之比为1:2,故C错误;
D.最小的环为6个原子和6个O原子组成的十二元环,故D正确;
故选D。
9.D
【详解】
A.由图可知,层与层之间由水分子通过氢键连在一起,A正确;
B.由图可知,每个H2O连接在Ca2+和相邻两层各1个的O上,B正确;
C.CaSO4+2H2O=CaSO4·2H2O,故无水CaSO4可用作吸水剂,C正确;
D.加热图示所示石膏,将失去结晶水而发生化学变化,故有化学键的断裂和形成,而不仅仅破坏层与层之间的作用力,D错误;
故答案为:D。
10.C
【详解】
A.属于无氢键存在的分子结构相似的情况,即相对分子质量大的熔、沸点高,熔沸点:,故A错误;
B.键长:,键能:,因此熔、沸点:金刚石,故B错误;
C.属于分子结构相似的情况,但分子间存在氢键,故的熔、沸点高,故C正确;
D.属于相对分子质量相同,但分子结构不同的情况,支链多的熔、沸点低,即,故D错误。
故选C。
11.B
【详解】
A.是和甲烷相似的结构,正四面体中心与顶点夹角为109°28`,为中空的正四面体结构,键角为60°,故A错误;
B.脱水后加热分解得到二氧化硅,一个被12个12元环共用,故B正确;
C.属于分子晶体,由分子构成,故C错误;
D.不能按照上述机理发生水解反应,是因为C原子只有两个电子层,没有d轨道,难以形成sp3d杂化,故D错误;
答案选B。
12.A
【详解】
A.二氧化硅是共价晶体,在SiO2晶体中1个硅原子和4个氧原子形成4个共价键,故A选项正确;
B. 分子的稳定性属于化学性质,只与分子内的化学键强度有关,分子间作用力与稳定性无关,故B选项错误;
C.虽然HI的相对分子质量大于HF,但是由于HF分子之间可以形成氢键,所以HF的沸点高于HI,故C选项错误;
D.金刚石为网状结构,每个碳原子能形成4个共价键,由共价键形成的最小碳环上有6个碳原子,故D选项错误。
故选A选项。
13.AB
【详解】
A.石墨烯是单层碳原子排列成的蜂窝状六角平面晶体,每个六元环具有的碳原子数为,即1mol六元环需要2mol碳原子,24 g石墨烯为2 mol,可形成1 mol六元碳环,A正确;
B.碳化硅晶胞与金刚石晶胞一样,是原子晶体,都是空间网状结构,结构相似,B正确;
C.石墨烯中的键长小于碳化硅的键长,键能更大,更稳定,石墨烯的熔点高于碳化硅,C错误;
D.从碳化硅制备石墨烯的过程产生了新的物质,属于化学变化,不属于物理剥离,D错误;
故选:AB。
14.BC
【详解】
A.金刚石中每个C原子形成4个C-C键,每个C-C键被两个C原子共用,则每个C具有=2个C-C键,12g金刚石含有1mol碳原子,含有C-C的个数为2NA,A错误;
B.1 mol白磷含有6 mol P—P键,124 g白磷(P4)物质的量为1 mol,因此124 g白磷晶体中含有P—P键的个数为6NA,B正确;
C.与金刚石类似,晶体硅中每个Si原子形成Si-Si键,28 g晶体硅物质的量为1 mol,因此中含有Si—Si键的个数为2NA,C正确;
D.SiO2晶体中每个Si与周围4个O原子结合形成4个Si—O键,因此SiO2晶体中每摩尔硅原子可与氧原子形成4NA个共价键(Si—O键),D错误;
综上所述答案为BC。
15.AC
【详解】
A.由图可知,分子中含4个N原子、4个S原子,则该物质的分子式为S4N4,故A错误;
B.该化合物为分子晶体,熔沸点较低,故B正确;
C.分子中含有的S-S键为非极性键,故C错误;
D.N的非金属性比S强,则N的电负性比S的电负性强,故D正确;
故答案为AC。
16.AB
【详解】
A.由分析可知,该晶体结构与石英晶体即SiO2晶体相似,属于共价晶体,A正确;
B.由分析可知,该晶体属于共价晶体,故硬度与金刚石相近,B正确;
C.由分析可知,该晶体为原子晶体(或共价晶体),具有较高的熔点,C错误;
D.由分析可知,该晶体为原子晶体(或共价晶体),硬度较大,D错误;
故答案为:AB。
17. SiF4 浅 ad bc 0.0001mol/(L min) 共价键 大 非极性 SiH4 这两种化合物的晶体类型都是分子晶体,分子晶体的沸点随相对分子质量的增大而增大,SiH4的相对分子质量大于CH4
【详解】
(1) 由热化学方程式SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ可知,该反应的正反应是气体减少的放热反应,在地壳深处压强大,平衡正向移动,容易有SiF4气体逸出,在地壳浅处压强小,平衡逆向移动,所以SiO2易在地壳浅处沉积;
(2) SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ为放热反应,如果上述反应的平衡常数K值变大,则一定是降低温度,降低温度时,该反应向正反应方向移动,随着反应的正向进行,逆反应速率先减小后增大,所以ad正确;
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时:
a.反应达到平衡时,正逆反应速率相等,满足 v正(HF)= 2v逆(H2O)关系,a错误;
b.反应达到平衡时,正逆反应速率相等,则无论是正反应速率还是逆反应速率,一定有v(H2O)=2v(SiF4),b正确;
c.反应达到平衡时,各组分的质量保持不变,则达到平衡时,SiO2的质量保持不变,c正确;
d.化学平衡状态为动态平衡,正逆反应速率均不为0,d错误;
答案选bc;
(4)若反应的容器容积为2.0L,反应时间80min,容器内气体的密度增大了0.12g/L,则容器内气体质量增加0.12g/L×2.0L=0.24g,根据质量守恒定律可知,0.24g为SiO2的质量,SiO2的物质的量为:=0.004mol,同一时间段内消耗HF的物质的量为0.004mol×4=0.016mol,在这段时间内HF的平均反应速率为v(HF)== 0.0001mol/(L min);
(5)合成氮化碳是一种与金刚石类似的晶体,金刚石是原子晶体,则合成氮化碳晶体也是原子晶体,该晶体中微粒间的作用力是共价键,因氮原子的半径小于碳原子的半径,氮元素的非金属性大于碳元素的非金属性,所以N-C键的键能大于C-C键的键能,则氮化碳的硬度比金刚石的大;
(6)SiH4是中Si原子价层电子对数为4,不含孤电子对,所以SiH4是非极性分子;SiH4与CH4这两种化合物的晶体类型都是分子晶体,分子晶体的沸点随相对分子质量的增大而增大,SiH4的相对分子质量大于CH4,则沸点高的是SiH4。
18. 分子 2s22p3 氧元素和碳元素同周期,电子层数相同,氧元素的核电荷数比碳元素多,吸引电子能力强,因此非金属性比碳强 C 1/[c2(NH3)c(CO2)] 0.01 mol/(L·min) a
【详解】
(1)固体CO2称干冰,属于熔、沸点较低的分子晶体;氮原子原子序数为7,位于周期表第二周期ⅤA族,最外层电子排布式是2s22p3,故答案为分子;2s22p3;
(2)氧元素和碳元素均为第二周期元素,同周期元素从左到右,随着核电荷数递增,原子半径减小,吸引电子能力依次增强,非金属性依次增强,故答案为氧元素和碳元素同周期,电子层数相同,氧元素的核电荷数比碳元素多,吸引电子能力强,因此非金属性比碳强;
(3)由题意可知,合成尿素的反应和反应①为放热反应,反应物的总能量高于生成物的总能量;反应②为吸热反应,反应物的总能量低于生成物的总能量。
A、合成尿素的反应为放热反应,2NH3(g)+ CO2 (g) 的总能量高于 CO(NH2)2(l)+H2O(l)的总能量,故错误;
B、反应②为吸热反应,NH4COONH2 (s) 的总能量低于 CO(NH2)2(l)+H2O(l)的总能量,故错误;
C、合成尿素的反应和反应①为放热反应,反应②为吸热反应,则2NH3(g)+ CO2 (g) 的总能量高于 CO(NH2)2(l)+H2O(l)的总能量,NH4COONH2 (s) 的总能量低于 CO(NH2)2(l)+H2O(l)的总能量,故正确;
D、合成尿素的反应为放热反应,2NH3(g)+ CO2 (g) 的总能量高于 CO(NH2)2(l)+H2O(l)的总能量,故错误;
故选C,故答案为C;
(4)反应①中为NH4COONH2固体,则化学平衡常数K=1/[c2(NH3)c(CO2)],故答案为1/[c2(NH3)c(CO2)];
(5)①从反应开始至20min时,二氧化碳浓度变化量△c(CO2)=(0.3mol/L—0.1mol/L)=0.2mol/L,则v c(CO2)= △c(CO2)/ △t=0.2mol/L/20min=0.01 mol/(L·min),故答案为0.01 mol/(L·min);
②该反应为气体体积减小的放热反应,缩小反应容器的容积,压强增大,平衡右移,尿素的产率增大;升高温度,平衡左移,尿素的产率减小;增加反应物的量,平衡右移,但尿素的产率不一定增大;使用合适的催化剂,平衡不移动,尿素的产率不变,故选a,故答案为a;
③25min 时再向容器中充入2mol氨气和1mol二氧化碳,体系中c(NH3)和c(CO2)分别变为0.4mol/L和0.2mol/L,40min时重新达到平衡,由于建立的是等效平衡,氨气的平衡浓度保持不变,故图示为:,故答案为。
19.(1) ④②①③ ②③
(2)-41
(3) Ⅱ 50% <
(4)
【详解】
(1)
下列物质的晶体中熔点由高到低的顺序为④②①③(填序号,下同),①属于分子晶体,分子间有氢键,常温下呈液态; ②属于分子晶体,常温下是固体 ;③属于分子晶体,常温下是气体 ;④金刚石,属于共价晶体,具有较高的熔沸点; ②③是分子晶体,分子位于立方体的顶点和面心上,以顶点上的分子为例,与它距离最近的分子分布在与该顶点相连的12个面的面心上,晶胞结构中每个粒子周围等距离紧邻的粒子数为12的有②③。故答案为:④②①③;②③;
(2)
△H=反应物总键能-生成物总键能,则(1075+2×463-2×803-436)kJ mol-1=-41kJ mol-1,故答案为:-41;
(3)
①是放热反应,升高温度,正反应平衡常数减小,表示曲线的是Ⅱ(填“I”或“II”")。故答案为:Ⅱ;
②T1时,向体积为10L的固定容积的容器中充入、, ,T1时,K==1,K= =1,解得x=1mol,则的平衡转化率为 =50%。故答案为:50%;
③T2时,A点Qc>K正,反应向逆向进行,<(填“>”、“<”或“=”)。故答案为:<;
(4)
某温度下,向体积恒定的密闭容器中充入等物质的量的CO和,发生反应:。 ,容器内起始总压强为,平衡时总压减小了10%, ,x=0.2,则用分压表示该反应的平衡常数=。(分压=总压×物质的量分数)故答案为:。
20. F- 第三周期第ⅣA族 CO2为分子晶体,SiO2为共价晶体,共价键的强度大于分子间作用力 < > Cl2+S2-=S↓+2Cl- 还原 ③ < 5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O
【详解】
(1)O2-、F-、N3-的核外电子数相同,F-的核电荷数最大,半径最小;Si为14号元素,位于第三周期第ⅣA族;CO2为分子晶体,SiO2为共价晶体,共价键的强度远大于分子间作用力,常温下CO2为气体,SiO2为高熔点固体;
(2)同周期主族元素自左至右非金属性增强,所以非金属性SH2SO4;非金属性越强,单质的氧化性更强,根据反应Cl2+S2-=S↓+2Cl-可知氧化性Cl2>S,则非金属性Cl>S;
(3)红酒中添加一定量的SO2 可以防止酒液氧化,利用了SO2的还原性;H2S水溶液中存在H2S的电离而显酸性,起始pH<7,将SO2气体通入H2S水溶液中时先发生2H2S+SO2= S↓+H2O,该过程中H2S的浓度不断减小,酸性减弱,pH增大,当完全反应发生SO2+H2O=H2SO3,H2SO3电离使溶液酸性增强,pH减小,当SO2不再溶解后,pH不变,H2SO3的酸性强于H2S的,所以最终pH要比初始小,所以图③符合;HSO的电离使溶液显酸性,HSO的水解使溶液显碱性,而NaHSO3溶液呈酸性,说明电离程度更大,H2SO3由水解产生,SO由水解产生,则c(H2SO3)(4)根据所给反应物和生成物可知该过程中Na2SO3被KIO3氧化生成Na2SO4,KIO3被还原生成I2,根据电子守恒可知Na2SO3和KIO3的系数比应为5:2,再结合元素守恒可得化学方程式为5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O。
21.(1) 3s23p3 16
(2) Cl>C>H sp2
(3)正四面体形
(4)分子晶体
【详解】
(1)
磷为第三周期第ⅤA族元素,基态P原子核外电子排布为3s23p3;Se是第四周期第ⅥA族元素,基态Se原子核外电子排布为1s22s22p63s23p63d104s24p4,电子云轮廓图呈哑铃形的能级为p能级,故其上共有16个电子。
(2)
①同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,下非金属性逐渐减弱,元素电负性减弱;C、H、Cl的电负性由大到小的顺序为Cl>C>H。
②中C原子的价层电子对数为,孤电子对数为1,杂化类型是sp2;
③中5个碳原子构成一个环,且每个碳原子的p轨道上1个电子和额外得到1个电子共6个电子参与大π键,故表示为;
(3)
中Se原子的价层电子对数为,孤电子对数为0,杂化类型是sp3,的空间构型为正四面体形;
(4)
四氟化铌(NbF4)的熔点为72℃,熔点较低,说明它的晶体类型为分子晶体。
22. CH3COO-+ H2O CH3COOH + OH- K+ 石英为原子晶体,干冰为分子晶体,共价键比分子间作用力强的多
【详解】
(1)CH3COONa溶于水后,CH3COO-发生水解反应CH3COO-+ H2O CH3COOH + OH-,故CH3COONa溶液呈碱性;
(2)KSCN是离子化合物,各原子都达到8电子稳定结构,则其电子式为;
(3)石英比干冰熔点高的主要原因是石英为原子晶体,干冰为分子晶体,共价键比分子间作用力强的多。
23. B 分子 30 2 6 2
【详解】
(1)同种元素的不同单质互称同素异形体,C60、金刚石和石墨三者的关系互为同素异形体,故选B。
(2)固态时,C60中构成微粒是分子,所以属于分子晶体;
分子中每一碳上有一个双键,一个碳碳双键两个碳原子共用,C60分子中含有双键的数目是=30个。
(3)硅晶体的结构跟金刚石相似,一个硅原子形成4个硅硅单键,每个键2个硅原子共用,1 mol硅晶体中含有硅硅单键的数目约是=2NA个。
金刚石最小的环为六元环,二氧化硅结构跟金刚石结构相似,Si、O原子形成的最小环上应有6个Si原子,硅晶体结构中每个硅与硅的化学键之间插入一个O原子,则Si、O原子形成的最小环上O原子的数目是6;
(4)石墨层状结构中,每个碳原子被三个正六边形共用,平均每个正六边形占有的碳原子数是6×=2个。
24. 同素异形体 分子 混合型 σ σ π 8
【详解】
(1)由同种元素组成的不同单质互称同素异形体,金刚石、石墨、C60、碳纳米管等都是碳元素的单质,属于同素异形体,故答案为:同素异形体;
(2)C60的构成微粒是分子,属于分子晶体;石墨的构成微粒是原子,且层与层之间存在分子间作用力,所以石墨属于混合型晶体,故答案为:分子;混合型;
(3)共价单键为σ键,共价双键中含有σ键和π键,金刚石中碳原子之间只存在σ键,石墨中碳原子之间存在σ键和π键,故答案为:σ;σ;π;
(4)晶胞中顶点微粒数为:8×=1,面心微粒数为:6×=3,体内微粒数为4,共含有8个碳原子,故答案为:8。
一、选择题(共16题)
1.下列说法中,正确的是
A.共价晶体中,共价键的键长越短,键能越大,熔点就越高
B.碘单质升华时,分子中键发生断裂
C.分子晶体中,共价键的键能越大,该物质的熔、沸点就越高
D.分子晶体中,分子间作用力越大,则分子越稳定
2.下列说法中正确的是
A.分子间作用力越大,分子越稳定
B.分子间作用力越大,物质的熔、沸点越高
C.相对分子质量越大,其分子间作用力越大
D.分子间只存在范德华力,不存在化学键
3.CrSi、Ge—GaAs、ZnGeAs2和碳化硅都是重要的半导体化合物,下列说法错误的是
A.基态铬原子的价电子排布式为3d54s1
B.Ge—GaAs中元素Ge、Ga、As的第一电离能由大到小的顺序为As>Ga>Ge
C.ZnGeAs2中元素Zn、Ge、As的电负性由大到小的顺序为As>Ge>Zn
D.碳化硅属于原子晶体,其熔沸点均大于晶体硅
4.科学家们合成了具有半导体特性的环状C18分子,其合成方法的示意图如图:
下列说法不正确的是
A.键长:C≡C>C—C B.键能:C—O>C—C
C.C20O2为极性分子 D.C18晶体为分子晶体
5.观察下列模型并结合有关信息,判断下列说法错误的是
物质或结构单元
结构模型示意图
备注 熔点1873K — 易溶于 —
A.单质硼属于原子晶体
B.是非极性分子
C.属于分子晶体
D.分子中键与键的数目之比为
6.下列关于和的说法错误的是
A.固态时两者均属于分子晶体
B.分子中含有极性共价键是非极性分子
C.因为碳氢键键能小于碳氧双键,所以的熔点低于
D.和分子中碳原子的杂化类型分别是和
7.以表示阿伏加德罗常数的值,下列说法正确的是
A.冰(图甲)中含共价键数目为
B.金刚石(图乙)中含有键数目为
C.干冰(图丙)中含有个晶胞结构单元
D.石墨(图丁)中含键数目为
8.下列关于晶体空间立体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶点
B.最小的环为3个Si原子和3个O原子组成的六元环
C.最小的环上实际占有的Si原子和O原子个数之比为1:1
D.最小的环为6个Si原子和6个O原子组成的十二元环
9.如图是石膏的部分层状结构,中间的虚线代表层与层的分界线。已知:。下列说法不正确的是
A.层与层之间通过氢键连在一起
B.每个H2O连接在Ca2+和相邻两层各1个的O上
C.无水CaSO4可用作吸水剂
D.加热图示所示石膏,只破坏层与层之间的作用力
10.下列关于晶体熔、沸点高低的比较正确的是
A. B.金刚石
C. D.
11.已知:发生水解反应的机理如图:
下列叙述正确的是
A.的键角与白磷()的键角相同
B.脱水后加热分解得到的晶体中每个可构成12个12元环
C.属于原子晶体(共价晶体)
D.不能按照上述机理发生水解反应,原因是的原子半径小
12.下列关于共价晶体、分子晶体的叙述中,正确的是
A.在SiO2晶体中,1个硅原子和4 个氧原子形成4条共价键
B.晶体中分子间作用力越大,分子越稳定
C.HI 的相对分子质量大于HF,所以HI 的沸点高于HF
D.金刚石由共价键形成的碳原子环中,最小环上有12个碳原子
13.石墨烯是单层碳原子排列成的蜂窝状六角平面晶体,具有重要的应用前景。可利用碳化硅制备高品质石墨烯材料。下列说法正确的是
A.24 g石墨烯约含1 mol六元碳环
B.碳化硅晶胞与金刚石晶胞结构相似
C.石墨烯的熔点低于碳化硅
D.利用碳化硅制备石墨烯的过程属于物理剥离
14.设NA为阿伏加德罗常数的值。下列说法中正确的是
A.12g金刚石中含有C-C的个数为4NA
B.124g白磷(P4)晶体中含有P-P的个数为6NA
C.28g晶体硅中含有Si-Si的个数为2NA
D.SiO2晶体中1mol硅原子可与氧原子形成2NA个共价键(Si-O)
15.硫和氮是两种常见的“明星元素”,其化合物是现代无机化学研究的最为活跃的领域之一.如图是已经合成的某硫氮化合物的分子结构,下列说法错误的是
A.该物质的分子式为SN B.该物质的熔沸点较低
C.该物质的分子中不含非极性键 D.N的电负性比S的电负性强
16.美国加州Livermore国家实验室物理学家Choong—Shik和他的同事们,在40Gpa的高压容器中,用Nd:YbLiF4激光器将液态二氧化碳加热到1800K,二氧化碳转化为与石英具有相似结构的晶体。估计该晶体可能具有的结构或性质是
A.该晶体属于共价晶体 B.硬度与金刚石相近
C.熔点较低 D.硬度较小
二、综合题
17.碳、硅及其化合物是一类重要物质。自然界的矿物.岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000-3000kPa,在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ
根据题意完成下列填空:
(1)在地壳深处容易有________气体逸出,SiO2易在地壳________(填“深”、“浅”)处沉积。
(2)如果上述反应的平衡常数K值变大,该反应____________(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______(选填编号)。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间80min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为________。
(5)合成氮化碳是一种与金刚石类似的晶体,该晶体中微粒间的作用力是_______,预测氮化碳的硬度比金刚石的_________(选填“大”、“小”、“不确定”)。
(6)SiH4是________(极性或非极性)分子,与CH4相比,沸点高的是________(化学式),用有关化学原理解释该事实:__________。
18.工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2) 2],反应的化学方程式为 2NH3(g)+ CO2 (g) CO(NH2) 2(l)+ H2O(l)+Q(Q>0)。该反应分两步进行:① 2NH3(g)+ CO2 (g) NH4COONH2 (s)+ Q1(Q1>0),② NH4COONH2 (s) CO(NH2) 2(l)+ H2O(l)+Q2 (Q2<0).
(1)固体CO2称干冰,属于___________晶体。氮原子最外层电子排布式是___________。
(2)氧元素的非金属性比碳强,用原子结构的知识说明理由_________________
(3)下列示意图中,能正确表示合成尿素过程中能量变化的是____________。
A、B、
C、D、
(4)写出合成尿素第一步反应的平衡常数表达式K=_________________________________。
(5)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图所示。
① 在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为___________。
② 为提高合成尿素的产率,下列可以采取的措施有____________。
a. 缩小反应容器的容积 b. 升高温度
c. 增加反应物的量 d. 使用合适的催化剂
③ 若保持平衡的温度和体积不变,25min 时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在下图中画出25~50min内氨气的浓度变化曲线____________。
19.碳及其化合物的价值型转化在工业生产方面具有重要的研究价值。回答下列问题:
(1)下列物质的晶体中熔点由高到低的顺序为______(填序号,下同);晶胞结构中每个粒子周围等距离紧邻的粒子数为12的有______。
① ② ③ ④金刚石
(2)已知CO分子中化学键为O≡C.相关的化学键键能数据如下:
化学键
463 1075 803 436
则 ______。
(3)正反应的平衡常数和逆反应的平衡常数随温度变化曲线如图。
①表示曲线的是_______(填“I”或“II”")。
②T1时,向体积为10L的固定容积的容器中充入、,则的平衡转化率为_______。
③T2时,A点_______(填“>”、“<”或“=”)。
(4)某温度下,向体积恒定的密闭容器中充入等物质的量的CO和,发生反应:。容器内起始总压强为,平衡时总压减小了10%,则用分压表示该反应的平衡常数Kp=_____。(分压=总压×物质的量分数)
20.氧、碳等非金属元素形成的物质种类繁多、性状各异。
(1)氧、氟、氮三种元素都可形成简单离子,它们的离子半径最小的是___________(填离子符号),硅元素在元素周期表中的位置是___________。CO2和SiO2是同一主族元素的最高正价氧化物,常温下CO2为气体,SiO2为高熔点固体。请分析原因:___________。
(2)比较硫和氯性质的强弱。热稳定性H2S___________HCl(选填“<”、“>”或“=”,下同);酸性:HClO4___________H2SO4。用一个离子方程式说明氯元素和硫元素非金属性的相对强弱:___________。
(3)红酒中添加一定量的SO2 可以防止酒液氧化,这利用了SO2 的___________性。若将SO2气体通入H2S水溶液中直至过量,下列表示溶液的pH随通入SO2气体体积变化的示意图正确的是___________(填序号)。
已知NaHSO3溶液呈酸性,而HSO既能电离又能水解。则在NaHSO3溶液中c(H2SO3)___________c(SO)(选填“<”、“>”或“=”) 。
(4)亚硫酸钠和碘酸钾在酸性条件下反应生成硫酸钠、硫酸钾、碘和水,写该反应方程式________________。
21.据《科学》报道,中国科学家首次实现超导体(Bi2Te3/NBSe2)中分段费米面。回答下列问题:
(1)Bi与P位于同主族,基态P原子的价层电子排布式为___________。基态Se原子核外电子云轮廓图呈哑铃形的能级上共有___________ 个电子。
(2)二氯二茂铌的组成为(C5H5)2NbCl2.环戊二烯阴离子()的平面结构简式如图所示:
①C、H、Cl的电负性由大到小的顺序为___________。
②中C原子的杂化类型是___________。
③已知分子中的大π键可以用表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则中大π键可以表示为___________。
(3)的空间构型为___________。
(4)四氟化铌(NbF4)的熔点为72℃,它的晶体类型为___________。
22.(1)CH3COONa溶液呈碱性,用离子方程式表示其原因___。
(2)KSCN是离子化合物,各原子都达到8电子稳定结构,则其电子式为____。
(3)石英比干冰熔点高的主要原因是____。
23.C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构)。
(1)C60、金刚石和石墨三者的关系互为________。
A.同分异构体 B.同素异形体
C.同系物 D.同位素
(2)固态时,C60属于________晶体(填“离子”、“原子”或“分子”),C60分子中含有双键的数目是________个。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是________NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子,二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是________个。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是________个。
24.元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为__________。
(2)C60属于_________晶体,石墨属于________晶体。
(3)石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm。其原因是金刚石中只存在C-C间的_____共价键(填σ或π,下同),而石墨层内的C—C间不仅存在____共价键,还有____键。
(4)金刚石晶胞含有_______个碳原子。
参考答案:
1.A
【详解】
A.共价晶体是由原子通过共价键形成的具有空间网状结构晶体,共价键的键长越短,键能越大,熔点就越高,A正确;
B.碘单质升华时,只发生物质状态的改变,是物理变化,而分子没有变化、所以分子中键不发生断裂,B错误;
C.分子晶体是由分子通过分子间作用力形成的晶体,分子间作用力越大,该物质的熔、沸点就越高,与分子内的共价键无关,C错误;
D.分子的稳定性与分子内的共价键有关,与分子间作用力无关,D错误;
答案选A。
2.B
【详解】
A.分子间作用力越大,分子晶体的熔沸点越高,分子稳定性与分子间作用力无关,故A错误;
B.影响分子晶体熔沸点高低的因素为分子间作用力,分子间作用力越大,分子晶体的熔沸点越高,故B正确;
C.不含有氢键的分子晶体,相对分子质量越大,其分子间作用力越大,故C错误;
D.分子间存在范德华力,也可能存在氢键,如水中分子间存在范德华力和氢键,故D错误;
故选B。
3.B
【详解】
A.铬元素的原子序数24,基态铬原子的价电子排布式为3d54s1,故A正确;
B.同周期元素,从左到右第一电离能呈增大趋势,则第一电离能As>Ge>Ga,故B错误;
C.非金属元素的电负性强于金属元素,金属元素的金属性越强,电负性越小,砷为非金属元素,锌的金属性强于锗元素,则电负性由大到小的顺序为As>Ge>Zn,故C正确;
D.原子晶体的熔沸点取决于共价键的强弱,碳化硅、晶体硅均属于原子晶体,碳硅键的键能大于硅硅键、键长小于硅硅键,则熔沸点碳化硅均大于晶体硅,故D正确;
故选B。
4.A
【详解】
A.一般单键的键长>双键>三键,故键长:C≡C<C—C,A错误;
B.由于C原子半径大于O,故C-C键的键长大于C-O键的键长,其C-O为极性键,C-C为非极性键,故键能:C—O>C—C,B正确;
C.由图可知,C20O2不是中心对称结构,正、负电荷的中心不重合,故其为极性分子,C正确;
D.由图示可知,C18为一个独立的分子,故C18晶体为分子晶体,D正确;
故答案为:A。
5.D
【详解】
A.单质硼熔点1873K,熔点很高,属于原子晶体,故A正确;
B.是正八面体形分子,正负电荷中心重合,是非极性分子,故B正确;
C.易溶于非极性溶剂,属于分子晶体,故C正确;
D.是sp杂化的直线形分子,键与键的数目之比为,故D错误;
故答案为D。
6.C
【详解】
A.非金属氧化物(不包括SiO2)、非金属氢化物、酸、NH3 H2O、烃类及烃类衍生物(不包括有机盐类)这些基本微粒由分子构成的物质,固态时均为分子晶体,描述正确,不符题意;
B.CH4中C—H键成键原子不同,是极性共价键,但是CH4分子空间构型是正四面体形,呈中心对称,分子正电中心与负电中心重合,所以分子为非极性分子,描述正确,不符题意;
C.分子熔沸由分子质量大小为主决定,与化学键键能无关,描述错误,符合题意;
D.C原子以四条单键连接其它原子,C原子杂化类型是sp3;C原子有一条双键连接其它原子,C原子杂化类型是sp2,C原子以两条双键或者以一条三键连接其它原子,C原子杂化类型是是sp,所以本选项描述正确,不符题意;
综上,本题选C。
7.A
【详解】
A.1个水分子中含有2个共价键,所以冰中含共价键数目为,A正确;
B.金刚石晶胞中,1个C原子形成4个共价键,一个共价键连有2个C原子,平均每个C原子形成2个共价键,所以金刚石中含有键数目为,B错误;
C.1个干冰晶胞中,含有个分子,所以干冰中含有个晶胞结构单元,C错误;
D.石墨晶体中,1个碳原子形成3个C-C键,所以每个碳原子实际占1.5个化学键,石墨烯,含碳碳键数目为,每一层只形成1个键,故键数目不是,D错误。
故答案为:A
8.D
【详解】
A.晶体中存在四面体结构单元,每个原子能形成4个共价键,每个O原子能形成2个共价键,处于中心,O处于4个顶点,故A错误;
B.最小的环为6个原子和6个O原子组成的十二元环,故B错误;
C.每个环实际占有的原子数为,O原子数为,故最小的环上实际占有的原子和O原子个数之比为1:2,故C错误;
D.最小的环为6个原子和6个O原子组成的十二元环,故D正确;
故选D。
9.D
【详解】
A.由图可知,层与层之间由水分子通过氢键连在一起,A正确;
B.由图可知,每个H2O连接在Ca2+和相邻两层各1个的O上,B正确;
C.CaSO4+2H2O=CaSO4·2H2O,故无水CaSO4可用作吸水剂,C正确;
D.加热图示所示石膏,将失去结晶水而发生化学变化,故有化学键的断裂和形成,而不仅仅破坏层与层之间的作用力,D错误;
故答案为:D。
10.C
【详解】
A.属于无氢键存在的分子结构相似的情况,即相对分子质量大的熔、沸点高,熔沸点:,故A错误;
B.键长:,键能:,因此熔、沸点:金刚石,故B错误;
C.属于分子结构相似的情况,但分子间存在氢键,故的熔、沸点高,故C正确;
D.属于相对分子质量相同,但分子结构不同的情况,支链多的熔、沸点低,即,故D错误。
故选C。
11.B
【详解】
A.是和甲烷相似的结构,正四面体中心与顶点夹角为109°28`,为中空的正四面体结构,键角为60°,故A错误;
B.脱水后加热分解得到二氧化硅,一个被12个12元环共用,故B正确;
C.属于分子晶体,由分子构成,故C错误;
D.不能按照上述机理发生水解反应,是因为C原子只有两个电子层,没有d轨道,难以形成sp3d杂化,故D错误;
答案选B。
12.A
【详解】
A.二氧化硅是共价晶体,在SiO2晶体中1个硅原子和4个氧原子形成4个共价键,故A选项正确;
B. 分子的稳定性属于化学性质,只与分子内的化学键强度有关,分子间作用力与稳定性无关,故B选项错误;
C.虽然HI的相对分子质量大于HF,但是由于HF分子之间可以形成氢键,所以HF的沸点高于HI,故C选项错误;
D.金刚石为网状结构,每个碳原子能形成4个共价键,由共价键形成的最小碳环上有6个碳原子,故D选项错误。
故选A选项。
13.AB
【详解】
A.石墨烯是单层碳原子排列成的蜂窝状六角平面晶体,每个六元环具有的碳原子数为,即1mol六元环需要2mol碳原子,24 g石墨烯为2 mol,可形成1 mol六元碳环,A正确;
B.碳化硅晶胞与金刚石晶胞一样,是原子晶体,都是空间网状结构,结构相似,B正确;
C.石墨烯中的键长小于碳化硅的键长,键能更大,更稳定,石墨烯的熔点高于碳化硅,C错误;
D.从碳化硅制备石墨烯的过程产生了新的物质,属于化学变化,不属于物理剥离,D错误;
故选:AB。
14.BC
【详解】
A.金刚石中每个C原子形成4个C-C键,每个C-C键被两个C原子共用,则每个C具有=2个C-C键,12g金刚石含有1mol碳原子,含有C-C的个数为2NA,A错误;
B.1 mol白磷含有6 mol P—P键,124 g白磷(P4)物质的量为1 mol,因此124 g白磷晶体中含有P—P键的个数为6NA,B正确;
C.与金刚石类似,晶体硅中每个Si原子形成Si-Si键,28 g晶体硅物质的量为1 mol,因此中含有Si—Si键的个数为2NA,C正确;
D.SiO2晶体中每个Si与周围4个O原子结合形成4个Si—O键,因此SiO2晶体中每摩尔硅原子可与氧原子形成4NA个共价键(Si—O键),D错误;
综上所述答案为BC。
15.AC
【详解】
A.由图可知,分子中含4个N原子、4个S原子,则该物质的分子式为S4N4,故A错误;
B.该化合物为分子晶体,熔沸点较低,故B正确;
C.分子中含有的S-S键为非极性键,故C错误;
D.N的非金属性比S强,则N的电负性比S的电负性强,故D正确;
故答案为AC。
16.AB
【详解】
A.由分析可知,该晶体结构与石英晶体即SiO2晶体相似,属于共价晶体,A正确;
B.由分析可知,该晶体属于共价晶体,故硬度与金刚石相近,B正确;
C.由分析可知,该晶体为原子晶体(或共价晶体),具有较高的熔点,C错误;
D.由分析可知,该晶体为原子晶体(或共价晶体),硬度较大,D错误;
故答案为:AB。
17. SiF4 浅 ad bc 0.0001mol/(L min) 共价键 大 非极性 SiH4 这两种化合物的晶体类型都是分子晶体,分子晶体的沸点随相对分子质量的增大而增大,SiH4的相对分子质量大于CH4
【详解】
(1) 由热化学方程式SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ可知,该反应的正反应是气体减少的放热反应,在地壳深处压强大,平衡正向移动,容易有SiF4气体逸出,在地壳浅处压强小,平衡逆向移动,所以SiO2易在地壳浅处沉积;
(2) SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ为放热反应,如果上述反应的平衡常数K值变大,则一定是降低温度,降低温度时,该反应向正反应方向移动,随着反应的正向进行,逆反应速率先减小后增大,所以ad正确;
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时:
a.反应达到平衡时,正逆反应速率相等,满足 v正(HF)= 2v逆(H2O)关系,a错误;
b.反应达到平衡时,正逆反应速率相等,则无论是正反应速率还是逆反应速率,一定有v(H2O)=2v(SiF4),b正确;
c.反应达到平衡时,各组分的质量保持不变,则达到平衡时,SiO2的质量保持不变,c正确;
d.化学平衡状态为动态平衡,正逆反应速率均不为0,d错误;
答案选bc;
(4)若反应的容器容积为2.0L,反应时间80min,容器内气体的密度增大了0.12g/L,则容器内气体质量增加0.12g/L×2.0L=0.24g,根据质量守恒定律可知,0.24g为SiO2的质量,SiO2的物质的量为:=0.004mol,同一时间段内消耗HF的物质的量为0.004mol×4=0.016mol,在这段时间内HF的平均反应速率为v(HF)== 0.0001mol/(L min);
(5)合成氮化碳是一种与金刚石类似的晶体,金刚石是原子晶体,则合成氮化碳晶体也是原子晶体,该晶体中微粒间的作用力是共价键,因氮原子的半径小于碳原子的半径,氮元素的非金属性大于碳元素的非金属性,所以N-C键的键能大于C-C键的键能,则氮化碳的硬度比金刚石的大;
(6)SiH4是中Si原子价层电子对数为4,不含孤电子对,所以SiH4是非极性分子;SiH4与CH4这两种化合物的晶体类型都是分子晶体,分子晶体的沸点随相对分子质量的增大而增大,SiH4的相对分子质量大于CH4,则沸点高的是SiH4。
18. 分子 2s22p3 氧元素和碳元素同周期,电子层数相同,氧元素的核电荷数比碳元素多,吸引电子能力强,因此非金属性比碳强 C 1/[c2(NH3)c(CO2)] 0.01 mol/(L·min) a
【详解】
(1)固体CO2称干冰,属于熔、沸点较低的分子晶体;氮原子原子序数为7,位于周期表第二周期ⅤA族,最外层电子排布式是2s22p3,故答案为分子;2s22p3;
(2)氧元素和碳元素均为第二周期元素,同周期元素从左到右,随着核电荷数递增,原子半径减小,吸引电子能力依次增强,非金属性依次增强,故答案为氧元素和碳元素同周期,电子层数相同,氧元素的核电荷数比碳元素多,吸引电子能力强,因此非金属性比碳强;
(3)由题意可知,合成尿素的反应和反应①为放热反应,反应物的总能量高于生成物的总能量;反应②为吸热反应,反应物的总能量低于生成物的总能量。
A、合成尿素的反应为放热反应,2NH3(g)+ CO2 (g) 的总能量高于 CO(NH2)2(l)+H2O(l)的总能量,故错误;
B、反应②为吸热反应,NH4COONH2 (s) 的总能量低于 CO(NH2)2(l)+H2O(l)的总能量,故错误;
C、合成尿素的反应和反应①为放热反应,反应②为吸热反应,则2NH3(g)+ CO2 (g) 的总能量高于 CO(NH2)2(l)+H2O(l)的总能量,NH4COONH2 (s) 的总能量低于 CO(NH2)2(l)+H2O(l)的总能量,故正确;
D、合成尿素的反应为放热反应,2NH3(g)+ CO2 (g) 的总能量高于 CO(NH2)2(l)+H2O(l)的总能量,故错误;
故选C,故答案为C;
(4)反应①中为NH4COONH2固体,则化学平衡常数K=1/[c2(NH3)c(CO2)],故答案为1/[c2(NH3)c(CO2)];
(5)①从反应开始至20min时,二氧化碳浓度变化量△c(CO2)=(0.3mol/L—0.1mol/L)=0.2mol/L,则v c(CO2)= △c(CO2)/ △t=0.2mol/L/20min=0.01 mol/(L·min),故答案为0.01 mol/(L·min);
②该反应为气体体积减小的放热反应,缩小反应容器的容积,压强增大,平衡右移,尿素的产率增大;升高温度,平衡左移,尿素的产率减小;增加反应物的量,平衡右移,但尿素的产率不一定增大;使用合适的催化剂,平衡不移动,尿素的产率不变,故选a,故答案为a;
③25min 时再向容器中充入2mol氨气和1mol二氧化碳,体系中c(NH3)和c(CO2)分别变为0.4mol/L和0.2mol/L,40min时重新达到平衡,由于建立的是等效平衡,氨气的平衡浓度保持不变,故图示为:,故答案为。
19.(1) ④②①③ ②③
(2)-41
(3) Ⅱ 50% <
(4)
【详解】
(1)
下列物质的晶体中熔点由高到低的顺序为④②①③(填序号,下同),①属于分子晶体,分子间有氢键,常温下呈液态; ②属于分子晶体,常温下是固体 ;③属于分子晶体,常温下是气体 ;④金刚石,属于共价晶体,具有较高的熔沸点; ②③是分子晶体,分子位于立方体的顶点和面心上,以顶点上的分子为例,与它距离最近的分子分布在与该顶点相连的12个面的面心上,晶胞结构中每个粒子周围等距离紧邻的粒子数为12的有②③。故答案为:④②①③;②③;
(2)
△H=反应物总键能-生成物总键能,则(1075+2×463-2×803-436)kJ mol-1=-41kJ mol-1,故答案为:-41;
(3)
①是放热反应,升高温度,正反应平衡常数减小,表示曲线的是Ⅱ(填“I”或“II”")。故答案为:Ⅱ;
②T1时,向体积为10L的固定容积的容器中充入、, ,T1时,K==1,K= =1,解得x=1mol,则的平衡转化率为 =50%。故答案为:50%;
③T2时,A点Qc>K正,反应向逆向进行,<(填“>”、“<”或“=”)。故答案为:<;
(4)
某温度下,向体积恒定的密闭容器中充入等物质的量的CO和,发生反应:。 ,容器内起始总压强为,平衡时总压减小了10%, ,x=0.2,则用分压表示该反应的平衡常数=。(分压=总压×物质的量分数)故答案为:。
20. F- 第三周期第ⅣA族 CO2为分子晶体,SiO2为共价晶体,共价键的强度大于分子间作用力 < > Cl2+S2-=S↓+2Cl- 还原 ③ < 5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O
【详解】
(1)O2-、F-、N3-的核外电子数相同,F-的核电荷数最大,半径最小;Si为14号元素,位于第三周期第ⅣA族;CO2为分子晶体,SiO2为共价晶体,共价键的强度远大于分子间作用力,常温下CO2为气体,SiO2为高熔点固体;
(2)同周期主族元素自左至右非金属性增强,所以非金属性S
(3)红酒中添加一定量的SO2 可以防止酒液氧化,利用了SO2的还原性;H2S水溶液中存在H2S的电离而显酸性,起始pH<7,将SO2气体通入H2S水溶液中时先发生2H2S+SO2= S↓+H2O,该过程中H2S的浓度不断减小,酸性减弱,pH增大,当完全反应发生SO2+H2O=H2SO3,H2SO3电离使溶液酸性增强,pH减小,当SO2不再溶解后,pH不变,H2SO3的酸性强于H2S的,所以最终pH要比初始小,所以图③符合;HSO的电离使溶液显酸性,HSO的水解使溶液显碱性,而NaHSO3溶液呈酸性,说明电离程度更大,H2SO3由水解产生,SO由水解产生,则c(H2SO3)
21.(1) 3s23p3 16
(2) Cl>C>H sp2
(3)正四面体形
(4)分子晶体
【详解】
(1)
磷为第三周期第ⅤA族元素,基态P原子核外电子排布为3s23p3;Se是第四周期第ⅥA族元素,基态Se原子核外电子排布为1s22s22p63s23p63d104s24p4,电子云轮廓图呈哑铃形的能级为p能级,故其上共有16个电子。
(2)
①同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,下非金属性逐渐减弱,元素电负性减弱;C、H、Cl的电负性由大到小的顺序为Cl>C>H。
②中C原子的价层电子对数为,孤电子对数为1,杂化类型是sp2;
③中5个碳原子构成一个环,且每个碳原子的p轨道上1个电子和额外得到1个电子共6个电子参与大π键,故表示为;
(3)
中Se原子的价层电子对数为,孤电子对数为0,杂化类型是sp3,的空间构型为正四面体形;
(4)
四氟化铌(NbF4)的熔点为72℃,熔点较低,说明它的晶体类型为分子晶体。
22. CH3COO-+ H2O CH3COOH + OH- K+ 石英为原子晶体,干冰为分子晶体,共价键比分子间作用力强的多
【详解】
(1)CH3COONa溶于水后,CH3COO-发生水解反应CH3COO-+ H2O CH3COOH + OH-,故CH3COONa溶液呈碱性;
(2)KSCN是离子化合物,各原子都达到8电子稳定结构,则其电子式为;
(3)石英比干冰熔点高的主要原因是石英为原子晶体,干冰为分子晶体,共价键比分子间作用力强的多。
23. B 分子 30 2 6 2
【详解】
(1)同种元素的不同单质互称同素异形体,C60、金刚石和石墨三者的关系互为同素异形体,故选B。
(2)固态时,C60中构成微粒是分子,所以属于分子晶体;
分子中每一碳上有一个双键,一个碳碳双键两个碳原子共用,C60分子中含有双键的数目是=30个。
(3)硅晶体的结构跟金刚石相似,一个硅原子形成4个硅硅单键,每个键2个硅原子共用,1 mol硅晶体中含有硅硅单键的数目约是=2NA个。
金刚石最小的环为六元环,二氧化硅结构跟金刚石结构相似,Si、O原子形成的最小环上应有6个Si原子,硅晶体结构中每个硅与硅的化学键之间插入一个O原子,则Si、O原子形成的最小环上O原子的数目是6;
(4)石墨层状结构中,每个碳原子被三个正六边形共用,平均每个正六边形占有的碳原子数是6×=2个。
24. 同素异形体 分子 混合型 σ σ π 8
【详解】
(1)由同种元素组成的不同单质互称同素异形体,金刚石、石墨、C60、碳纳米管等都是碳元素的单质,属于同素异形体,故答案为:同素异形体;
(2)C60的构成微粒是分子,属于分子晶体;石墨的构成微粒是原子,且层与层之间存在分子间作用力,所以石墨属于混合型晶体,故答案为:分子;混合型;
(3)共价单键为σ键,共价双键中含有σ键和π键,金刚石中碳原子之间只存在σ键,石墨中碳原子之间存在σ键和π键,故答案为:σ;σ;π;
(4)晶胞中顶点微粒数为:8×=1,面心微粒数为:6×=3,体内微粒数为4,共含有8个碳原子,故答案为:8。
