3.3金属晶体与离子晶体—基础训练(word版 含解析)
文档属性
| 名称 | 3.3金属晶体与离子晶体—基础训练(word版 含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 734.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 00:00:00 | ||
图片预览




文档简介
3.3金属晶体与离子晶体
一、选择题(共16题)
1.下列说法正确的组合是
①晶体在不同方向上的硬度、导热性、导电性相同
②离子晶体都是化合物
③共价晶体中,共价键越强,熔点越高
④分子晶体中,分子间作用力越大,对应的物质越稳定
⑤金属晶体能导电的原因是在外加电场作用下可失去电子
⑥分子识别是超分子的重要特征之一
A.①②③ B.①④⑤ C.②③⑥ D.②④⑥
2.下列说法中正确的是
A.冰融化时,分子中键发生断裂
B.共价晶体中,共价键越强,共价晶体的熔点越高
C.共价晶体中的相邻原子间只存在非极性共价键
D.稀有气体形成的晶体属于共价晶体
3.钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点为(,0,),下列说法中错误的是
A.配合物中Co2+价电子排布式为3d7
B.距离Co2+最近且等距的O2-的数目为6
C.C点的原子坐标参数为(,,)
D.该物质的化学式为TiCoO2
4.锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是
A.该晶体属于分子晶体
B.该晶胞中Zn2+和S2-数目不相等
C.阳离子的配位数为6
D.氧化锌的熔点高于硫化锌
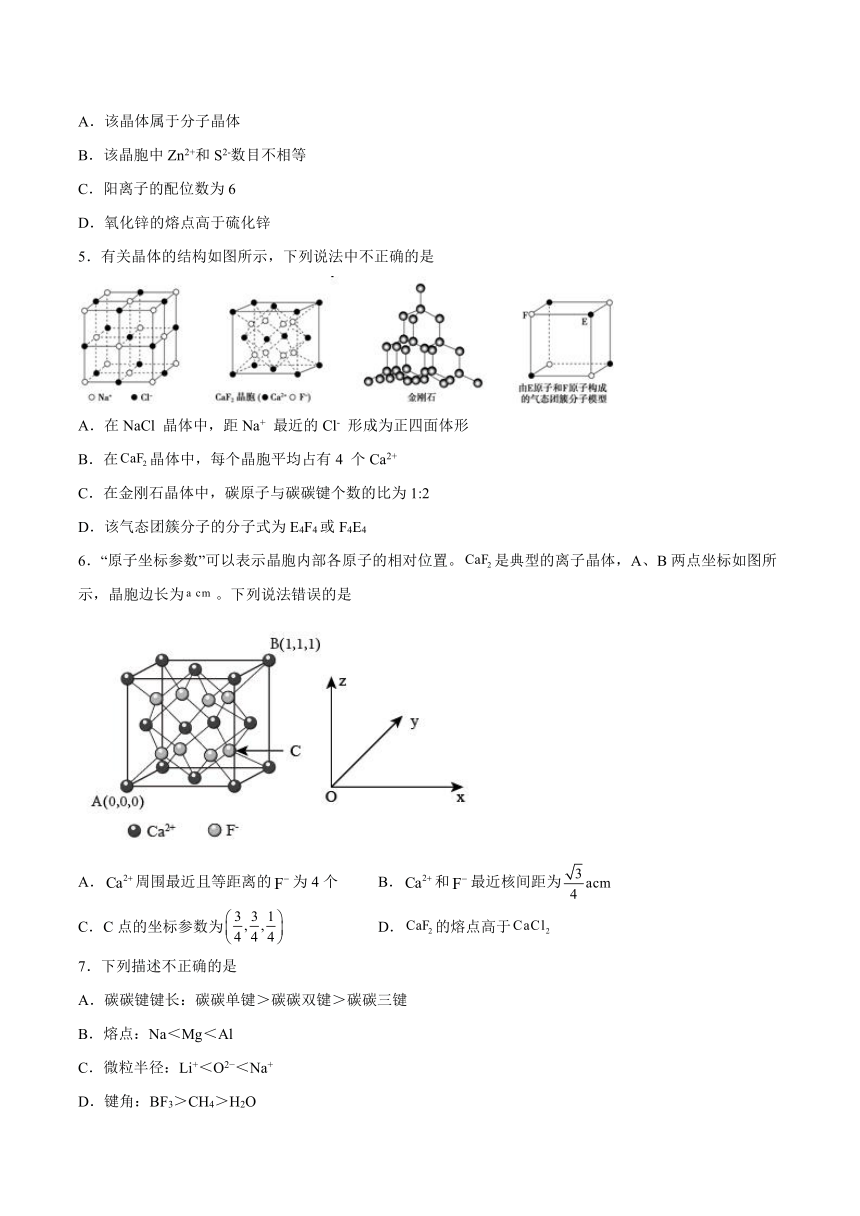
5.有关晶体的结构如图所示,下列说法中不正确的是
A.在NaCl 晶体中,距Na+ 最近的Cl- 形成为正四面体形
B.在晶体中,每个晶胞平均占有4 个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D.该气态团簇分子的分子式为E4F4或F4E4
6.“原子坐标参数”可以表示晶胞内部各原子的相对位置。是典型的离子晶体,A、B两点坐标如图所示,晶胞边长为。下列说法错误的是
A.周围最近且等距离的为4个 B.和最近核间距为
C.C点的坐标参数为 D.的熔点高于
7.下列描述不正确的是
A.碳碳键键长:碳碳单键>碳碳双键>碳碳三键
B.熔点:Na<Mg<Al
C.微粒半径:Li+<O2 <Na+
D.键角:BF3>CH4>H2O
8.下列说法不正确的是
A.熔点:NaF>MgF2>AlF3 B.沸点:PH3C.硬度:金刚石>碳化硅>晶体硅 D.晶格能:NaF>NaCl>NaBr
9.下列各组物质的晶体类型相同的是
A.SiO2和SO3 B.I2和NaCl C.Cu和Ag D.SiC和MgO
10.下列性质中,适合于离子晶体的是
A.熔点1070℃,易溶于水,水溶液能导电
B.熔点10.31℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点112.8℃,沸点444.6℃
D.熔点97.81℃,质软,导电,密度0.97g/cm3
11.下列晶体性质的比较中,正确的是
A.熔点: B.沸点:
C.熔点:单质硫>白磷>晶体硅 D.硬度:金刚石>硅>碳化硅
12.下列关于晶体的说法正确的组合是
①在晶体中只要有阴离子就一定有阳离子
②CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④分子晶体中分子间作用力越大,分子越稳定
⑤SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑥离子晶体熔化时晶格能越大,熔点越高
⑦晶体状态能导电的一定是金属晶体
A.①②③④ B.①②⑥⑦ C.②③④⑤ D.①②③⑥
13.X、Y、Z、W均为短周期元素且原子序数依次增大,X、Y形成的一种气体能使湿润的红色石蕊试纸变蓝,X与W、Y与Z的最高正化合价之和均为8。下列说法正确的是( )
A.X、Y两种元素可形成离子化合物
B.Y、W的氧化物对应水化物的酸性:WC.简单离子半径大小:W>Y>Z
D.Z的单质能与氨水反应
14.下列叙述不正确的是
A.KH为离子化合物
B.Na与N、O、Cl分别形成的化合物中只含有离子键
C.化合物和都只存在离子键
D.N和Cl可形成共价化合物
15.下列有关晶体结构或性质的描述中正确的是
A.与金属形成的卤化物,离子键键能越小,还原性越强
B.冰中存在非极性共价键、分子间作用力和氢键
C.金属性,但金属钾的熔点低于金属钠
D.物质的量均为的金刚石与石墨晶体所含的键的数目相同
16.常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们的晶胞具有相同的侧视图如图2所示。Cu2S的晶胞参数apm,阿伏加德罗常数的值为NA。
下列说法正确的是
A.S2-是面心立方最密堆积
B.Cu2S晶胞中,Cu+填充了晶胞中一半四面体空隙
C.CuS晶胞中,S2-配位数为8
D.Cu2S晶胞的密度为
二、综合题
17.砷()元素广泛的存在于自然界,在周期表中的位置如表。
完成下列填空:
(1)砷元素最外层电子的排布式为______________。
(2)砷化镓()和氮化硼()晶体都具有空间网状结构,硬度大。砷化镓熔点为1230℃,的熔点为3000℃,从物质结构角度解释两者熔点存在差异的原因__________。
(3)亚砷酸盐()在碱性条件下与碘单质反应生成砷酸盐(),完成反应的离子方程式: ____+I2+_____ ______。该反应是一个可逆反应,说明氧化还原反应的方向和______有关。
(4)工业上将含有砷酸盐()的废水转化为粗的工业流程如下:
①写出还原过程中砷酸转化为亚砷酸的化学方程式: ___________
②“沉砷”是将转化为沉淀,主要反应有:
i.Ca(OH)2(s) Ca2+(aq)+2OH—(aq)+Q
ii.5Ca2++OH—+3 Ca5(AsO4)3OH-Q
沉砷最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因___。
18.铁元素被称为“人类第一元素”,其化合物应用广泛。
Ⅰ.硫化亚铁(FeS)是一种常见的还原剂。用FeS处理模拟含铬废水的流程如下:
(1)“还原”过程发生反应的离子方程式为______。
(2)为测定模拟废水中铬元素的去除率,进行如下实验:将滤渣用蒸馏水洗净后,在低温条件下干燥,称得质量为2.2100g。将上述2.2100g固体在空气中加热,测得固体质量随温度的变化如图所示。
说明:780℃以上的残留固体为Fe2O3、Cr2O3的化合物
① A→B固体质量增加是由滤渣中______(填化学式)发生反应引起的。
② 在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是______。
③ 根据以上实验数据计算上述模拟废水中铬元素的去除率______ (写出计算过程)。
Ⅱ.铁元素是构成人体的必不可少的元素之一,补铁剂种类繁多,其中一种有效成分是琥珀酸亚铁(图1)。
(1) 琥珀酸亚铁中碳原子的杂化轨道类型为______,1mol琥珀酸亚铁中含σ键______mol。
(2) 用邻二氮菲(phen,如图2)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。[Fe(phen)3]2+中,Fe2+的配位数为______。用邻二氮菲测定Fe2+浓度时应控制pH在2~9适宜范围,原因是______。
19.合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其化学方程式为:CH3COO[Cu(NH3)2](aq)+CO(g)+NH3(aq)CH3COO[Cu(NH3)3(CO)](aq),完成下列填空:
(1)要提高铜液吸收CO的反应速率,可以采取的措施是_______(选填编号)。
a.减压b.增加NH3的浓度c.升温d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式________________________。
(3)吸收CO后的铜液经过适当处理又可再生,恢复其吸收CO的能力以循环使用,铜溶液再生的适宜条件是_________________________。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为____________。其中氮元素原子最外层电子排布的轨道表达式是____________________。通过比较______________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是______。
20.金属锂及其化合物因独特的性质而具有重要的应用价值。例如:Li是最轻的固体金属,可应用于生产电池;Li2O可用于特种玻璃、陶瓷、医药等领域;LiH、LiBH4、LiNH2为常见的储氢材料等。回答下列问题:
(1)基态Li原子核外电子共有 ___________种能量状态。
(2)LiH、LiBH4、LiNH2中所含非金属元素的电负性由小到大的顺序为 ___________(用元素符号表示);LiNH2中阴离子的空间构型为 ___________种与该阴离子互为等电子体的分子的化学式:___________。
(3)Li2O的熔点(1567℃)高于LiCl的熔点(605℃)的原因是 ___________。
(4)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图1所示的晶胞结构。晶胞中锂离子和碳原子的个数之比为 ___________;其中与一个Li+距离最近且相等的C原子数为___________。
(5)Li3N与H2在一定条件下反应生成LiNH2和LiH,写出该反应的化学方程式:___________。该反应还可能得到副产物Li2NH,通过对LiNH2和Li2NH的结构比较,发现两者均为反萤石结构,Li2NH的晶胞结构如图2所示。若Li+的半径为apm,NH2﹣的半径为bpm,Li2NH的摩尔质量为Mg/mol,NA表示阿伏加德罗常数的值,则LizNH的密度为 ___________g/cm3(用含a、b、M、NA的代数式表示,列出计算式即可)。
21.回答下列问题:
(1)写出乙苯的结构简式_______。
(2)用系统方法命名_______。
(3)四种晶体的熔点数据如下表:
物质
熔点/℃ -183 -90 -127 >1000
、、三者和熔点相差较大,原因是_______。
22.氮元素是重要的非金属元素,可形成卤化氮、氮化物、叠氮化物及配合物等多种化合物。
(1)NF3、NBr3、NCl3的沸点由高到低的顺序是___,原因是__。
(2)Mg3N2遇水发生剧烈反应,生成一种有刺激性气味的气体。该反应的化学方程式为___。
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N。请写出两种与N互为等电子体的分子的化学式:___。
(4)NaN3与KN3相比,NaN3的晶格能___(填“>”、“=”或“<”)KN3的晶格能。
(5)某元素X形成的离子X+中K、L、M三个电子层均充满了电子。它与N3-形成晶体的结构如图所示。X+的符号是___,晶体中距离每个N3-最近的X+有___个。
23.(1)将白色粉末溶于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配离子,请写出生成此配离子的离子方程式:______,蓝色溶液中的阳离子内存在的化学键类型有______。
(2)(胆矾)中含有水合铜离子因而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(将配位键表示出来):______。
(3)向溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入乙醇可以生成深蓝色的沉淀。下列说法不正确的是______(填序号)
a.的组成元素中电负性最大的是N元素
b.晶体及中S原子的杂化方式均为
c.中所含有的化学键类型有离子键、极性共价键和配位键
d.对于、分子来说,键角:
e.中,N原子给出孤电子对
f.分子中氮原子的轨道杂化方式为杂化
(4)配离子的中心离子是______,配体是______,配位数为______,其含有微粒间的作用力类型有______。
24.某离子晶体的晶胞如图所示,阳离子X(●)位于立方体的顶角,阴离子Y(○)位于立方体的体心,试回答下列问题:
(1)该晶体的化学式为______。
(2)在晶胞中,每个X周围与它最近且距离相等的X有______个。
参考答案:
1.C
【详解】
①晶体具有各向异性,所以晶体在不同方向上的硬度、导热性、导电性不同,①错误;
②离子晶体由常见的离子化合物形成的晶体,所以都是化合物,②正确;
③共价晶体熔化时需要破坏共价键,所以共价键越强,熔点越高,③正确;
④分子晶体中,分子间作用力越大,物质熔沸点越高,④错误;
⑤金属晶体能导电的原因是在外加电场作用下电子形成电子气,发生定向移动,⑤错误;
⑥分子识别是超分子的重要特征之一,⑥正确;
答案为:C。
2.B
【详解】
A.冰属于分子晶体,构成冰晶体的微粒间存在分子间作用力,所以冰融化时克服的是分子间作用力,共价键不变,A错误;
B.共价晶体中共价键的强弱决定其熔点的高低,所以共价晶体中共价键越强,共价晶体的熔点越高,B正确;
C.晶体中、O原子间形成极性键,C错误;
D.稀有气体分子是单原子分子,形成的晶体为分子晶体,D错误;
故选B。
3.D
【详解】
A.钴元素的原子序数为27,钴原子的价电子排布式为3d74s2,则配合物中Co2+离子的价电子排布式为3d7,故A正确;
B.由晶胞结构可知,距离Co2+最近且等距的O2-的数目为6,故B正确;
C.由A点的原子坐标参数为(0,0,0),B点为(,0,)可知,晶胞的边长为1,C点位于体心,则原子坐标参数为(,,),故C正确;
D.由晶胞结构可知,晶胞中位于顶点的Ti4+离子的个数为8×=1,位于体心上的Co2+离子的个数为1,位于面心上的O2—离子的个数为6×=3,则该物质的化学式为TiCoO3,故D错误;
故选D。
4.D
【详解】
A.该晶体由阴、阳离子构成,属于离子晶体,A项错误;
B.从晶胞图分析,含有Zn2+的数目为8×+6×=4,S2-位于立方体内,S2-的数目为4,所以该晶胞中Zn2+与S2-的数目相等,B项错误;
C.在ZnS晶胞中,1个S2-周围距离最近的Zn2+有4个,1个Zn2+周围距离最近的S2-有4个,则S2-的配位数为4,Zn2+的配位数也为4,C项错误;
D.ZnO和ZnS中,O2-的半径小于S2-的半径,离子所带的电荷数相等,所以ZnO中离子键强度大于ZnS中离子键强度,ZnO的熔点高于ZnS,D项正确;
答案选D。
5.A
【详解】
A.在NaCl晶体中,距Na+最近的Cl-有6个,距Cl-最近的Na+有6个,这6个离子构成一个正八面体,故A错误;
B.Ca2+位于晶胞的顶点和面心,晶胞中含有Ca2+的个数为:,故B正确;
C.在金刚石晶体中,每个碳原子形成4个共价键,每两个碳原子形成一个共价键,则每个碳原子形成的共价键平均为,所以在金刚石晶体中,碳原子与碳碳键数之比为1:2,故C正确;
D.气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,故D正确;
故选:A。
6.A
【详解】
A.由结构图可知Ca2+周围最近且等距离的为8个,A错误;
B.和最近核间距为,B正确;
C.观察A、B、C的相对位置,可知C点x轴坐标为,y轴坐标为,z轴坐标为,所以C点的坐标参数为,C正确;
D.由于和都是离子化合物,熔点高低与离子键强度有关,阳离子相同,F-比Cl-半径小,所以的离子键强,熔点高,D正确;
故选:A。
7.C
【详解】
A.共用电子对越多,键长越短,碳碳键键长:碳碳单键>碳碳双键>碳碳三键,故A正确;
B.同周期从左到右原子半径逐渐减小,金属键越强,熔点越高,因此熔点:Na<Mg<Al,故B正确;
C.同主族从上到下原子半径、离子半径逐渐减小,同电子层结构核多径小原则,因此微粒半径:Li+<Na+<O2 ,故C错误;
D.BF3是平面三角形,键角为120°,CH4是正四面体形,键角为109°28′,H2O是“V”形结构,键角为105°,因此键角:BF3>CH4>H2O,故D正确。
综上所述,答案为C。
8.A
【详解】
A.NaF、MgF2、AlF3均为离子晶体,离子所带电荷数Al3+>Mg2+>Na+,且离子半径Al3+<Mg2+<Na+,所以离子键的键能NaF<MgF2<AlF3,则熔点NaF<MgF2<AlF3,A错误;
B.常温下水为液体,NH3为气体,所以沸点NH3<H2O,NH3分子间存在氢键,所以沸点:PH3<NH3,B正确;
C.金刚石、碳化硅、晶体硅均为共价晶体,原子半径Si>C,则键长C-C<C-Si<Si-Si,所以键能:C-C>C-Si>Si-Si,硬度金刚石>碳化硅>晶体硅,C正确;
D.离子半径:F-<Cl-<Br-,所以晶格能:NaF>NaCl>NaBr,D正确;
综上所述答案为A。
9.C
【详解】
A.SiO2为原子晶体,SO3为分子晶体,晶体类型不同,故A错误;
B.I2为分子晶体,NaCl为离子晶体,晶体类型不同,故B错误;
C.Cu和Ag都为金属晶体,晶体类型相同,故C正确;
D.SiC为原子晶体,MgO为离子晶体,晶体类型不同,故D错误;
故选C。
10.A
【详解】
A.熔点1070℃,易溶于水,水溶液导电,属于离子晶体的特点,A正确;
B.熔点为10.31℃,熔点低,符合分子晶体的特点,液态不导电,是由于液态时,只存在分子,没有离子,水溶液能导电,溶于水后,分子在水分子的作用下,电离出自由移动的离子,B错误;
C.能溶于CS2、熔点112.8℃,沸点444.6℃,属于分子晶体的特点,C错误;
D.金属钠熔点为97.81℃,质软、导电、密度0.97g/cm3,这是金属Na的物理性质,为金属晶体的特点,D错误;
故合理选项是A。
11.A
【详解】
A.Al、Mg、Ca均为金属晶体,金属晶体中金属离子的半径越小,离子所带电荷数越多,金属键越强,晶体的熔沸点越高,离子半径:,则熔点:,故A正确;
B.水为液态沸点,三者中沸点最高,故B错误;
C.晶体硅为共价晶体,单质硫和白磷为分子晶体,共价晶体的熔点高于分子晶体,故C错误;
D.三者均为共价晶体,原子的电负性越强,原子半径越小形成共价键越强,晶体的硬度越大,电负性:C>Si,共价键强度:C-C>C-Si>Si-Si,硬度:金刚石>碳化硅>硅,故D错误;
故选:A。
12.D
【详解】
①晶体呈不带电,在晶体中只要有阴离子、就一定有阳离子,对应的晶体为离子晶体,说法正确;
②CaTiO3晶体中,过每个Ti4+且相互垂直的3个平面内各有4个O2-相紧邻,则每个Ti4+和12个O2-相紧邻, 说法正确;
③金刚石、SiC属于共价晶体、NaF、NaCl属于离子晶体、H2O、H2S晶体属于分子晶体,共价晶体受热熔化后,共价键被克服、共价晶体熔点高;离子晶体受热熔化后,离子键被克服、离子晶体熔点较高;受热熔化后化学键不发生变化的只有分子晶体、克服的是氢键或分子间作用力、分子晶体熔点低。碳碳键比碳硅键牢固,故金刚石的熔点比碳化硅的高,NaF的离子键比NaCl强, NaF熔点比NaCl高、水分子间的氢键比硫化氢分子间的作用力强些,故冰的熔点高些,则金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低, 说法正确;
④分子晶体中分子间作用力越大,熔沸点越高,分子内共价键越牢固则分子越稳定,说法错误;
⑤硅原子最外层有4个电子,SiO2晶体中每个硅原子与4个氧原子以共价键相结合,说法错误;
⑥离子晶体内金属键越强、熔化时晶格能越大,熔点越高, 说法正确;
⑦晶体状态能导电的除了金属晶体,还有石墨,说法错误;则说法正确的是①②③⑥;
则答案选D。
13.AC
【详解】
A.X、Y两种元素可形成叠氮化铵,是离子化合物,A正确;
B.元素的非金属性越强,对应的最高价氧化物的酸性越强,故Y、W的最高价氧化物对应水化物的酸性:W>Y,B错误;
C.离子结构示意图一样的离子,序数越大,半径越小,故简单离子半径大小:W>Y>Z,C正确;
D.铝能溶于强酸强碱,不能与氨水反应,D错误;
答案选AC。
14.BC
【详解】
A.、构成KH,含离子键,属于离子化合物,A项正确;
B.Na与N、O、Cl分别形成的、、NaCl中只含离子键,但形成的、中既含离子键又含共价键,B项错误;
C.中只存在离子键,中存在离子键和共价键,C项错误;
D.中只含共价键,属于共价化合物,D项正确;
故选BC。
15.AC
【详解】
A.随着卤离子半径增大,离子键能减小,离子还原性增强,A项正确;
B.冰中的共价键是O-H,是极性共价键,B项错误;
C.同主族,从上到下金属性增强,且K的熔点比Na低,C项正确;
D.1mol金刚石含有2molC-C键,1mol石墨含有1.5molC-C键,D项错误;
答案选AC。
16.AD
【详解】
A.据图可知S2-位于立方体的顶点和面心,为面心立方最密堆积,A正确;
B.晶胞中S2-的个数为=4,化学式为Cu2S,则Cu+的个数为8,所以占据了8个四面体空隙,即全部的四面体空隙,B错误;
C.CuS晶胞中Cu2+位于四面体空隙中,所以Cu2+的配位数为4,化学式为CuS,所以S2-配位数也为4,C错误;
D.Cu2S晶胞的质量为g=g,晶胞的体积为a3pm3=a3×10-30cm3,所以密度为=,D正确;
综上所述答案为AD。
17. 和都是原子晶体,原子半径:,,则共价键键长:键键,键能:键键,所以熔点低于BN 1 2OH— +2I—+H2O 溶液酸碱性 反应i为放热反应,高于85℃时,平衡向逆反应方向移动,减小;反应ii中减小是影响平衡移动的主要因素,所以反应ii平衡也向逆反应方向移动,沉淀率下降
【详解】
(1)As在周期表的第4周期第ⅤA族,最外层电子的排布式是4s24p3,故答案为:4s24p3;
(2)砷化镓()和氮化硼()晶体都具有空间网状结构,硬度大,砷化镓与氮化硼属于同种晶体类型,均属于原子晶体,原子半径N<As,B<Ga,故N-B键的键长比As-Ga键的键长短,N-B键的键能更大,更稳定,所以氮化硼的熔点较高,故答案为:GaAs和BN都是原子晶体,原子半径:Ga>B,As>N,则共价键键长:Ga-As键>B-N键,键能:Ga-As键<B-N键,所以熔点GaAs低于BN;
(3)碘单质将氧化成,As的化合价从+3升到+5,自身被还原为碘离子,碘的化合价从0降到-1,根据化合价升降守恒及溶液的碱性环境,离子方程式为+I2 +2OH— +2I—+H2O,该反应为可逆反应,说明氧化还原反应的方向和溶液酸碱性有关,故答案为:1;2OH—;+2I—+H2O;溶液酸碱性;
(4)①“还原”过程中二氧化硫将H3AsO4转化为H3AsO3,反应的化学方程式为:H3AsO4+H2O+SO2=H3AsO3+H2SO4,故答案为:H3AsO4+H2O+SO2=H3AsO3+H2SO4;
②“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反反应:i.Ca(OH)2(s) Ca2+(aq)+2OH—(aq)+Q,ii.5Ca2++OH—+3 Ca5(AsO4)3OH-Q,高于85℃后,温度升高,反应i平衡逆向移动,c(Ca2+)下降,反应ii平衡逆向移动,Ca5(AsO4)3OH沉淀率下降,故答案为:反应i为放热反应,高于85℃时,平衡向逆反应方向移动,c(Ca2+)减小;反应ii中c(Ca2+)减小是影响平衡移动的主要因素,所以反应ii平衡也向逆反应方向移动,沉淀率下降。
18. FeS + 3CrO+ 7H2O = FeOOH + 3Cr(OH)3 + SO+ OH- FeS Fe2+中3d轨道没有达到半满的稳定结构,而Fe3+中3d轨道达到半满的稳定结构 50% sp2、sp3 13 6 当pH<2时,H+浓度大,邻二氮菲中的N优先与H+形成配位键,导致与Fe2+配位能力减弱;pH>9,OH-浓度大与Fe2+反应,影响Fe2+与邻二氮菲配位。
【详解】
(1)由流程图知,铬酸钾与硫化亚铁反应生成SO,FeOOH和Cr(OH)3,铁元素从+2价升高到+3价,硫元素从-2价升高到+6价,硫化亚铁完全反应化合价升高9价,铬酸钾完全反应化合价降低3价,根据化合价升降相等及电子守恒,质量守恒配平方程式为FeS + 3CrO+ 7H2O = FeOOH + 3Cr(OH)3 + SO+ OH-,答案为FeS + 3CrO+ 7H2O = FeOOH + 3Cr(OH)3 + SO+ OH-
(2) ① 滤渣为FeS 、FeOOH、Cr(OH)3 的混合物,已知780℃以上的残留固体为Fe2O3、Cr2O3的化合物,FeOOH、Cr(OH)3 加热分解生成Fe2O3、Cr2O3的过程是质量减小的过程,FeS加热先变成硫酸铁,硫酸铁加强热分解变为氧化铁,该过程固体中先增大后减小,所以A→B固体质量增加是由滤渣中FeS 引起的。故答案为FeS;
② 在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是Fe2+中3d轨道没有达到半满的稳定结构,而Fe3+中3d轨道达到半满的稳定结构,故答案为Fe2+中3d轨道没有达到半满的稳定结构,而Fe3+中3d轨道达到半满的稳定结构;
③ 根据以上实验数据计算上述模拟废水中铬元素的去除率,1L模拟废水中含铬酸钾的物质的量为5.82g/L×1L÷194g/mol=0.03mol。
设2.2100g固体中含FeS 为xmol,FeOOH为ymol,根据反应FeS + 3CrO+ 7H2O = FeOOH + 3Cr(OH)3 + SO+ OH-可知,Cr(OH)3 为3ymol,结合Fe、Cr元素守恒可知,灼烧所得的固体质量为1.74g固体中Fe2O3的物质的量为mol, Cr2O3的物质的量为1.5mol,则xmol×88g/mol+ymol×89g/mol+3ymol×103g/mol=2.2100g, mol×160g/mol+1.5y×152g/mol=1.7400g,联立解得,x=0.0025mol,y=0.005mol,滤渣中Cr(OH)3
的物质的量为3y=3×0.005mol=0.015mol,废水中+6价的去除率为。故答案为50%.
Ⅱ.(1) 琥珀酸亚铁中碳原子的杂化轨道类型为sp2、sp3,1mol琥珀酸亚铁中含σ键13mol,故答案为sp2、sp3,13
(2) 用邻二氮菲(phen,如图2)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。因为邻二氮菲中有两个氮原子,与每一个氮原子都能形成配位,所以在[Fe(phen)3]2+中,Fe2+的配位数为6。用邻二氮菲测定Fe2+浓度时应控制pH在2~9适宜范围,原因是当pH<2时,H+浓度大,邻二氮菲中的N优先与H+形成配位键,导致与Fe2+配位能力减弱;pH>9,OH-浓度大与Fe2+反应,影响Fe2+与邻二氮菲配位;故答案为6;当pH<2时,H+浓度大,邻二氮菲中的N优先与H+形成配位键,导致与Fe2+配位能力减弱;pH>9,OH-浓度大与Fe2+反应,影响Fe2+与邻二氮菲配位;
19. bc 2NH3+CO2+H2O=(NH4)2CO3 高温低压 C>N>O>H HNO3和H3PO4酸性强弱或NH3和PH3热稳定性强弱 CO2和CS2均为分子晶体且结构与组成相似,其熔点高低与分子量有关;分子量越大,熔点越高;由于CS2的分子量大于CO2的分子量,所以CS2熔点更高
【详解】
(1)a.减小压强,铜液吸收CO的反应速率减小,故错误;
b.增加NH3的浓度,反应物的浓度增大,铜液吸收CO的反应速率增大,故正确;
c.升高温度,铜液吸收CO的反应速率增大,故正确;
d.及时移走产物,生成物的浓度减小,铜液吸收CO的反应速率减小,故错误;
bc正确,故答案为:bc;
(2)铜液中的氨可与二氧化碳反应生成碳酸铵,反应的化学方程式为2NH3+CO2+H2O=(NH4)2CO3,故答案为:2NH3+CO2+H2O=(NH4)2CO3;
(3)铜溶液再生的反应是气体体积增大的吸热反应,则再生的适宜条件是高温低压,故答案为:高温低压;
(4)铜液的组成元素中,短周期元素为C、N、O、H,H原子的原子半径在周期表中最小,同周期元素,从左到右原子半径依次减小,则C、N、O、H原子半径从大到小的排列顺序为C>N>O>H;氮元素原子最外层有5个电子,电子排布式为2s22p3,则轨道表达式为;元素的非金属性越强,最高价氧化物对应水化物的酸性越强、气态氢化物的稳定性越强,则可以比较HNO3和H3PO4酸性强弱或NH3和PH3热稳定性强弱可判断氮、磷两种非金属元素的非金属性强弱,故答案为:C>N>O>H;;HNO3和H3PO4酸性强弱或NH3和PH3热稳定性强弱;
(4)CO2和CS2均为分子晶体且结构与组成相似,则CS2的电子式是;结构相似的分子晶体随着相对分子质量的增大,分子间作用力增大,熔沸点越高,CS2的分子量大于CO2的分子量,所以CS2熔点更高,故答案为:;CO2和CS2均为分子晶体且结构与组成相似,其熔点高低与分子量有关;分子量越大,熔点越高;由于CS2的分子量大于CO2的分子量,所以CS2熔点更高。
20.(1)2
(2) B(3)由于O2-半行小于Cl-,Li2O的晶格能大于LiCl;
(4) 1:6 8
(5) Li3N+2H2 =LiNH2 + 2LiH ×1030gcm-3
【分析】
(1)
基态Li核外电子排布为1s22s1,一种能级代表一种前量状态,故共有2种能量状态;
(2)
这三种化合物合的非金属元素分别为H、B、N,由鲍林电负性、可知,H、B、N鲍林电负性分别为2.1、2.04、3.04,故电负性B(3)
离半经越小将项离子分开越难,晶格能就元越大熔点越高,由于O2-半行小于Cl-,Li2O的晶格能大于LiCl;
(4)
由图一知, C中除中心2个C处于体心,其他每个C都在面心,每个面2个,共4个面,所以处于面心的C总共8个,所以一个晶胞中的碳数C=2+8×=6,而Li+处于立方体的8个顶点,所以一个晶胞中的Li+数为8×=1,因此 晶胞中锂离子和碳原子的个数之比为 1:6,图中最底部红色代表一个Li+,两个蓝色代表碳,且距离是最近的2个,一个品平面可以堆积上下八个同样的立方体,所以距离最近的为8×2但是碳位于面心,被两个面所共用,所以8×2×=8;
(5)
Li3N与H2在一定条件下反应生成LiNH2和LiH,根据氧化还原反应配平规则配平方程式得:Li3N+2H2 =LiNH2 + 2LiH;根据Li2NH晶胞结构图,可知一个晶胞中Li+为8个,NH2-数为:8×+6×=4,设晶胞的边长为cpm,利用切割法将晶胞分割成八个小方体,而Li+位于小立方体的体心,NH2-位于小立方体的顶点,四个NH2-构成了小正四面体,体心到顶点的距离恰好是为a+b,晶胞的体对角线为=4(a+b),故c=4(a+b),c=(a+b),由ρ====×1030gcm-3= ×1030gcm-3 =×1030gcm-3。
21.(1)
(2)3,3,6-三甲基辛烷
(3)、、都是分子晶体,结构相似,分子间作用力相差较小,所以熔点相差较小;AlF3通过离子键形成离子晶体,破坏离子键需要能量多得多,所以熔点相差较大
【详解】
(1)
乙苯的结构简式。
(2)
根据烷烃的命名规则, 的最长主链含有8个碳原子,为辛烷,在3号碳原子上含有2个甲基,6号碳原子上含有1个甲基,名称为3,3, 6-三甲基辛烷。
(3)
、、都是分子晶体,结构相似,分子间作用力相差较小,所以熔点相差较小;AlF3通过离子键形成离子晶体,破坏离子键需要能量多得多,所以熔点相差较大。
22. NBr3>NCl3>NF3 三种物质的晶体均为分子晶体,相对分子质量大则分子间的作用力大,沸点高,因此沸点由高到低的顺序为NBr3>NCl3>NF3 Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ N2O、CO2 > Cu+ 6
【详解】
(1)NF3,NBr3、NCl3都是分子晶体,且结构相似,它们相对分子质量大小关系为:NBr3>NCl3>NF3,相对分子质量大则分子间的作用力大,沸点高,所以它们的沸点由高到低的顺序是:NBr3>NCl3>NF3;
(2)Mg2N2遇水发生剧烈反应,生成一种有刺激性气味的气体为氨气,根据元素守恒,可写出化学方程式:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;
(3)N3-中有三个原子,价电子数为16,根据等电子原理可知,与它互为等电子体的分子有:N2O、CO2、CS2、BeCl2等;
(4)因为钠离子的半径比钾离子的半径小,所以NaN3的晶格比KN3的晶格能大;
(5)X+中K、L、M三个电子层均充满了电子,所以X+核外有28个电子,即X的核电荷数为29,所以X为铜元素,X+为Cu+,根据晶体结构图可知,每个与其距离最近的Cu+有6个;
23. 极性共价键、配位键 af 、 4 配位键、极性共价键
【详解】
(1)将白色粉末溶于水中,溶液呈蓝色,是因为铜离子和水分子结合生成了一种呈蓝色的配位数是4的配离子,此配离子的离子方程式为:,蓝色溶液中的阳离子内铜离子和水分子之间存在的是配位键,水分子之间O和H之间形成的是极性共价键。故答案:;极性共价键、配位键。
(2)中的O原子提供孤电子对,提供空轨道,所以水合铜离子的结构简式为。故答案:。
(3)a.根据元素周期表可知电负性:,故a不正确;
b.S原子与4个O原子形成共价键,所以S原子采取杂化,故b正确;
c.中与以离子键结合,、中含有极性共价键,中含有配位键,故c正确;
d.分子内N原子有1个孤电子对,分子中O原子有2个孤电子对,分子中孤电子对共用电子对排斥作用大,所以键角:,故d正确;e.中N原子提供孤电子对,故e正确;
f.分子中N的价层电子对数为4,轨道杂化方式为杂化,故f错误。
故答案:af。
(4)由配离子可以看出其中心离子是,配体是、配位数为4,含有的微粒间作用力有配位键以及极性共价键。故答案:;、;4;配位键、极性共价键。
24. XY 6
【详解】
(1)Y位于立方体的体心,X位于立方体的8个顶角,根据均摊法可知,该晶体的化学式为XY;
(2)在晶胞中,每个X周围与它最近且距离相等的X有6个(上、下、左、右、前、后各1个)。
一、选择题(共16题)
1.下列说法正确的组合是
①晶体在不同方向上的硬度、导热性、导电性相同
②离子晶体都是化合物
③共价晶体中,共价键越强,熔点越高
④分子晶体中,分子间作用力越大,对应的物质越稳定
⑤金属晶体能导电的原因是在外加电场作用下可失去电子
⑥分子识别是超分子的重要特征之一
A.①②③ B.①④⑤ C.②③⑥ D.②④⑥
2.下列说法中正确的是
A.冰融化时,分子中键发生断裂
B.共价晶体中,共价键越强,共价晶体的熔点越高
C.共价晶体中的相邻原子间只存在非极性共价键
D.稀有气体形成的晶体属于共价晶体
3.钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点为(,0,),下列说法中错误的是
A.配合物中Co2+价电子排布式为3d7
B.距离Co2+最近且等距的O2-的数目为6
C.C点的原子坐标参数为(,,)
D.该物质的化学式为TiCoO2
4.锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是
A.该晶体属于分子晶体
B.该晶胞中Zn2+和S2-数目不相等
C.阳离子的配位数为6
D.氧化锌的熔点高于硫化锌
5.有关晶体的结构如图所示,下列说法中不正确的是
A.在NaCl 晶体中,距Na+ 最近的Cl- 形成为正四面体形
B.在晶体中,每个晶胞平均占有4 个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D.该气态团簇分子的分子式为E4F4或F4E4
6.“原子坐标参数”可以表示晶胞内部各原子的相对位置。是典型的离子晶体,A、B两点坐标如图所示,晶胞边长为。下列说法错误的是
A.周围最近且等距离的为4个 B.和最近核间距为
C.C点的坐标参数为 D.的熔点高于
7.下列描述不正确的是
A.碳碳键键长:碳碳单键>碳碳双键>碳碳三键
B.熔点:Na<Mg<Al
C.微粒半径:Li+<O2 <Na+
D.键角:BF3>CH4>H2O
8.下列说法不正确的是
A.熔点:NaF>MgF2>AlF3 B.沸点:PH3
9.下列各组物质的晶体类型相同的是
A.SiO2和SO3 B.I2和NaCl C.Cu和Ag D.SiC和MgO
10.下列性质中,适合于离子晶体的是
A.熔点1070℃,易溶于水,水溶液能导电
B.熔点10.31℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点112.8℃,沸点444.6℃
D.熔点97.81℃,质软,导电,密度0.97g/cm3
11.下列晶体性质的比较中,正确的是
A.熔点: B.沸点:
C.熔点:单质硫>白磷>晶体硅 D.硬度:金刚石>硅>碳化硅
12.下列关于晶体的说法正确的组合是
①在晶体中只要有阴离子就一定有阳离子
②CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④分子晶体中分子间作用力越大,分子越稳定
⑤SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑥离子晶体熔化时晶格能越大,熔点越高
⑦晶体状态能导电的一定是金属晶体
A.①②③④ B.①②⑥⑦ C.②③④⑤ D.①②③⑥
13.X、Y、Z、W均为短周期元素且原子序数依次增大,X、Y形成的一种气体能使湿润的红色石蕊试纸变蓝,X与W、Y与Z的最高正化合价之和均为8。下列说法正确的是( )
A.X、Y两种元素可形成离子化合物
B.Y、W的氧化物对应水化物的酸性:W
D.Z的单质能与氨水反应
14.下列叙述不正确的是
A.KH为离子化合物
B.Na与N、O、Cl分别形成的化合物中只含有离子键
C.化合物和都只存在离子键
D.N和Cl可形成共价化合物
15.下列有关晶体结构或性质的描述中正确的是
A.与金属形成的卤化物,离子键键能越小,还原性越强
B.冰中存在非极性共价键、分子间作用力和氢键
C.金属性,但金属钾的熔点低于金属钠
D.物质的量均为的金刚石与石墨晶体所含的键的数目相同
16.常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们的晶胞具有相同的侧视图如图2所示。Cu2S的晶胞参数apm,阿伏加德罗常数的值为NA。
下列说法正确的是
A.S2-是面心立方最密堆积
B.Cu2S晶胞中,Cu+填充了晶胞中一半四面体空隙
C.CuS晶胞中,S2-配位数为8
D.Cu2S晶胞的密度为
二、综合题
17.砷()元素广泛的存在于自然界,在周期表中的位置如表。
完成下列填空:
(1)砷元素最外层电子的排布式为______________。
(2)砷化镓()和氮化硼()晶体都具有空间网状结构,硬度大。砷化镓熔点为1230℃,的熔点为3000℃,从物质结构角度解释两者熔点存在差异的原因__________。
(3)亚砷酸盐()在碱性条件下与碘单质反应生成砷酸盐(),完成反应的离子方程式: ____+I2+_____ ______。该反应是一个可逆反应,说明氧化还原反应的方向和______有关。
(4)工业上将含有砷酸盐()的废水转化为粗的工业流程如下:
①写出还原过程中砷酸转化为亚砷酸的化学方程式: ___________
②“沉砷”是将转化为沉淀,主要反应有:
i.Ca(OH)2(s) Ca2+(aq)+2OH—(aq)+Q
ii.5Ca2++OH—+3 Ca5(AsO4)3OH-Q
沉砷最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因___。
18.铁元素被称为“人类第一元素”,其化合物应用广泛。
Ⅰ.硫化亚铁(FeS)是一种常见的还原剂。用FeS处理模拟含铬废水的流程如下:
(1)“还原”过程发生反应的离子方程式为______。
(2)为测定模拟废水中铬元素的去除率,进行如下实验:将滤渣用蒸馏水洗净后,在低温条件下干燥,称得质量为2.2100g。将上述2.2100g固体在空气中加热,测得固体质量随温度的变化如图所示。
说明:780℃以上的残留固体为Fe2O3、Cr2O3的化合物
① A→B固体质量增加是由滤渣中______(填化学式)发生反应引起的。
② 在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是______。
③ 根据以上实验数据计算上述模拟废水中铬元素的去除率______ (写出计算过程)。
Ⅱ.铁元素是构成人体的必不可少的元素之一,补铁剂种类繁多,其中一种有效成分是琥珀酸亚铁(图1)。
(1) 琥珀酸亚铁中碳原子的杂化轨道类型为______,1mol琥珀酸亚铁中含σ键______mol。
(2) 用邻二氮菲(phen,如图2)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。[Fe(phen)3]2+中,Fe2+的配位数为______。用邻二氮菲测定Fe2+浓度时应控制pH在2~9适宜范围,原因是______。
19.合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其化学方程式为:CH3COO[Cu(NH3)2](aq)+CO(g)+NH3(aq)CH3COO[Cu(NH3)3(CO)](aq),完成下列填空:
(1)要提高铜液吸收CO的反应速率,可以采取的措施是_______(选填编号)。
a.减压b.增加NH3的浓度c.升温d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式________________________。
(3)吸收CO后的铜液经过适当处理又可再生,恢复其吸收CO的能力以循环使用,铜溶液再生的适宜条件是_________________________。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为____________。其中氮元素原子最外层电子排布的轨道表达式是____________________。通过比较______________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是______。
20.金属锂及其化合物因独特的性质而具有重要的应用价值。例如:Li是最轻的固体金属,可应用于生产电池;Li2O可用于特种玻璃、陶瓷、医药等领域;LiH、LiBH4、LiNH2为常见的储氢材料等。回答下列问题:
(1)基态Li原子核外电子共有 ___________种能量状态。
(2)LiH、LiBH4、LiNH2中所含非金属元素的电负性由小到大的顺序为 ___________(用元素符号表示);LiNH2中阴离子的空间构型为 ___________种与该阴离子互为等电子体的分子的化学式:___________。
(3)Li2O的熔点(1567℃)高于LiCl的熔点(605℃)的原因是 ___________。
(4)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图1所示的晶胞结构。晶胞中锂离子和碳原子的个数之比为 ___________;其中与一个Li+距离最近且相等的C原子数为___________。
(5)Li3N与H2在一定条件下反应生成LiNH2和LiH,写出该反应的化学方程式:___________。该反应还可能得到副产物Li2NH,通过对LiNH2和Li2NH的结构比较,发现两者均为反萤石结构,Li2NH的晶胞结构如图2所示。若Li+的半径为apm,NH2﹣的半径为bpm,Li2NH的摩尔质量为Mg/mol,NA表示阿伏加德罗常数的值,则LizNH的密度为 ___________g/cm3(用含a、b、M、NA的代数式表示,列出计算式即可)。
21.回答下列问题:
(1)写出乙苯的结构简式_______。
(2)用系统方法命名_______。
(3)四种晶体的熔点数据如下表:
物质
熔点/℃ -183 -90 -127 >1000
、、三者和熔点相差较大,原因是_______。
22.氮元素是重要的非金属元素,可形成卤化氮、氮化物、叠氮化物及配合物等多种化合物。
(1)NF3、NBr3、NCl3的沸点由高到低的顺序是___,原因是__。
(2)Mg3N2遇水发生剧烈反应,生成一种有刺激性气味的气体。该反应的化学方程式为___。
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N。请写出两种与N互为等电子体的分子的化学式:___。
(4)NaN3与KN3相比,NaN3的晶格能___(填“>”、“=”或“<”)KN3的晶格能。
(5)某元素X形成的离子X+中K、L、M三个电子层均充满了电子。它与N3-形成晶体的结构如图所示。X+的符号是___,晶体中距离每个N3-最近的X+有___个。
23.(1)将白色粉末溶于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配离子,请写出生成此配离子的离子方程式:______,蓝色溶液中的阳离子内存在的化学键类型有______。
(2)(胆矾)中含有水合铜离子因而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(将配位键表示出来):______。
(3)向溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入乙醇可以生成深蓝色的沉淀。下列说法不正确的是______(填序号)
a.的组成元素中电负性最大的是N元素
b.晶体及中S原子的杂化方式均为
c.中所含有的化学键类型有离子键、极性共价键和配位键
d.对于、分子来说,键角:
e.中,N原子给出孤电子对
f.分子中氮原子的轨道杂化方式为杂化
(4)配离子的中心离子是______,配体是______,配位数为______,其含有微粒间的作用力类型有______。
24.某离子晶体的晶胞如图所示,阳离子X(●)位于立方体的顶角,阴离子Y(○)位于立方体的体心,试回答下列问题:
(1)该晶体的化学式为______。
(2)在晶胞中,每个X周围与它最近且距离相等的X有______个。
参考答案:
1.C
【详解】
①晶体具有各向异性,所以晶体在不同方向上的硬度、导热性、导电性不同,①错误;
②离子晶体由常见的离子化合物形成的晶体,所以都是化合物,②正确;
③共价晶体熔化时需要破坏共价键,所以共价键越强,熔点越高,③正确;
④分子晶体中,分子间作用力越大,物质熔沸点越高,④错误;
⑤金属晶体能导电的原因是在外加电场作用下电子形成电子气,发生定向移动,⑤错误;
⑥分子识别是超分子的重要特征之一,⑥正确;
答案为:C。
2.B
【详解】
A.冰属于分子晶体,构成冰晶体的微粒间存在分子间作用力,所以冰融化时克服的是分子间作用力,共价键不变,A错误;
B.共价晶体中共价键的强弱决定其熔点的高低,所以共价晶体中共价键越强,共价晶体的熔点越高,B正确;
C.晶体中、O原子间形成极性键,C错误;
D.稀有气体分子是单原子分子,形成的晶体为分子晶体,D错误;
故选B。
3.D
【详解】
A.钴元素的原子序数为27,钴原子的价电子排布式为3d74s2,则配合物中Co2+离子的价电子排布式为3d7,故A正确;
B.由晶胞结构可知,距离Co2+最近且等距的O2-的数目为6,故B正确;
C.由A点的原子坐标参数为(0,0,0),B点为(,0,)可知,晶胞的边长为1,C点位于体心,则原子坐标参数为(,,),故C正确;
D.由晶胞结构可知,晶胞中位于顶点的Ti4+离子的个数为8×=1,位于体心上的Co2+离子的个数为1,位于面心上的O2—离子的个数为6×=3,则该物质的化学式为TiCoO3,故D错误;
故选D。
4.D
【详解】
A.该晶体由阴、阳离子构成,属于离子晶体,A项错误;
B.从晶胞图分析,含有Zn2+的数目为8×+6×=4,S2-位于立方体内,S2-的数目为4,所以该晶胞中Zn2+与S2-的数目相等,B项错误;
C.在ZnS晶胞中,1个S2-周围距离最近的Zn2+有4个,1个Zn2+周围距离最近的S2-有4个,则S2-的配位数为4,Zn2+的配位数也为4,C项错误;
D.ZnO和ZnS中,O2-的半径小于S2-的半径,离子所带的电荷数相等,所以ZnO中离子键强度大于ZnS中离子键强度,ZnO的熔点高于ZnS,D项正确;
答案选D。
5.A
【详解】
A.在NaCl晶体中,距Na+最近的Cl-有6个,距Cl-最近的Na+有6个,这6个离子构成一个正八面体,故A错误;
B.Ca2+位于晶胞的顶点和面心,晶胞中含有Ca2+的个数为:,故B正确;
C.在金刚石晶体中,每个碳原子形成4个共价键,每两个碳原子形成一个共价键,则每个碳原子形成的共价键平均为,所以在金刚石晶体中,碳原子与碳碳键数之比为1:2,故C正确;
D.气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,故D正确;
故选:A。
6.A
【详解】
A.由结构图可知Ca2+周围最近且等距离的为8个,A错误;
B.和最近核间距为,B正确;
C.观察A、B、C的相对位置,可知C点x轴坐标为,y轴坐标为,z轴坐标为,所以C点的坐标参数为,C正确;
D.由于和都是离子化合物,熔点高低与离子键强度有关,阳离子相同,F-比Cl-半径小,所以的离子键强,熔点高,D正确;
故选:A。
7.C
【详解】
A.共用电子对越多,键长越短,碳碳键键长:碳碳单键>碳碳双键>碳碳三键,故A正确;
B.同周期从左到右原子半径逐渐减小,金属键越强,熔点越高,因此熔点:Na<Mg<Al,故B正确;
C.同主族从上到下原子半径、离子半径逐渐减小,同电子层结构核多径小原则,因此微粒半径:Li+<Na+<O2 ,故C错误;
D.BF3是平面三角形,键角为120°,CH4是正四面体形,键角为109°28′,H2O是“V”形结构,键角为105°,因此键角:BF3>CH4>H2O,故D正确。
综上所述,答案为C。
8.A
【详解】
A.NaF、MgF2、AlF3均为离子晶体,离子所带电荷数Al3+>Mg2+>Na+,且离子半径Al3+<Mg2+<Na+,所以离子键的键能NaF<MgF2<AlF3,则熔点NaF<MgF2<AlF3,A错误;
B.常温下水为液体,NH3为气体,所以沸点NH3<H2O,NH3分子间存在氢键,所以沸点:PH3<NH3,B正确;
C.金刚石、碳化硅、晶体硅均为共价晶体,原子半径Si>C,则键长C-C<C-Si<Si-Si,所以键能:C-C>C-Si>Si-Si,硬度金刚石>碳化硅>晶体硅,C正确;
D.离子半径:F-<Cl-<Br-,所以晶格能:NaF>NaCl>NaBr,D正确;
综上所述答案为A。
9.C
【详解】
A.SiO2为原子晶体,SO3为分子晶体,晶体类型不同,故A错误;
B.I2为分子晶体,NaCl为离子晶体,晶体类型不同,故B错误;
C.Cu和Ag都为金属晶体,晶体类型相同,故C正确;
D.SiC为原子晶体,MgO为离子晶体,晶体类型不同,故D错误;
故选C。
10.A
【详解】
A.熔点1070℃,易溶于水,水溶液导电,属于离子晶体的特点,A正确;
B.熔点为10.31℃,熔点低,符合分子晶体的特点,液态不导电,是由于液态时,只存在分子,没有离子,水溶液能导电,溶于水后,分子在水分子的作用下,电离出自由移动的离子,B错误;
C.能溶于CS2、熔点112.8℃,沸点444.6℃,属于分子晶体的特点,C错误;
D.金属钠熔点为97.81℃,质软、导电、密度0.97g/cm3,这是金属Na的物理性质,为金属晶体的特点,D错误;
故合理选项是A。
11.A
【详解】
A.Al、Mg、Ca均为金属晶体,金属晶体中金属离子的半径越小,离子所带电荷数越多,金属键越强,晶体的熔沸点越高,离子半径:,则熔点:,故A正确;
B.水为液态沸点,三者中沸点最高,故B错误;
C.晶体硅为共价晶体,单质硫和白磷为分子晶体,共价晶体的熔点高于分子晶体,故C错误;
D.三者均为共价晶体,原子的电负性越强,原子半径越小形成共价键越强,晶体的硬度越大,电负性:C>Si,共价键强度:C-C>C-Si>Si-Si,硬度:金刚石>碳化硅>硅,故D错误;
故选:A。
12.D
【详解】
①晶体呈不带电,在晶体中只要有阴离子、就一定有阳离子,对应的晶体为离子晶体,说法正确;
②CaTiO3晶体中,过每个Ti4+且相互垂直的3个平面内各有4个O2-相紧邻,则每个Ti4+和12个O2-相紧邻, 说法正确;
③金刚石、SiC属于共价晶体、NaF、NaCl属于离子晶体、H2O、H2S晶体属于分子晶体,共价晶体受热熔化后,共价键被克服、共价晶体熔点高;离子晶体受热熔化后,离子键被克服、离子晶体熔点较高;受热熔化后化学键不发生变化的只有分子晶体、克服的是氢键或分子间作用力、分子晶体熔点低。碳碳键比碳硅键牢固,故金刚石的熔点比碳化硅的高,NaF的离子键比NaCl强, NaF熔点比NaCl高、水分子间的氢键比硫化氢分子间的作用力强些,故冰的熔点高些,则金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低, 说法正确;
④分子晶体中分子间作用力越大,熔沸点越高,分子内共价键越牢固则分子越稳定,说法错误;
⑤硅原子最外层有4个电子,SiO2晶体中每个硅原子与4个氧原子以共价键相结合,说法错误;
⑥离子晶体内金属键越强、熔化时晶格能越大,熔点越高, 说法正确;
⑦晶体状态能导电的除了金属晶体,还有石墨,说法错误;则说法正确的是①②③⑥;
则答案选D。
13.AC
【详解】
A.X、Y两种元素可形成叠氮化铵,是离子化合物,A正确;
B.元素的非金属性越强,对应的最高价氧化物的酸性越强,故Y、W的最高价氧化物对应水化物的酸性:W>Y,B错误;
C.离子结构示意图一样的离子,序数越大,半径越小,故简单离子半径大小:W>Y>Z,C正确;
D.铝能溶于强酸强碱,不能与氨水反应,D错误;
答案选AC。
14.BC
【详解】
A.、构成KH,含离子键,属于离子化合物,A项正确;
B.Na与N、O、Cl分别形成的、、NaCl中只含离子键,但形成的、中既含离子键又含共价键,B项错误;
C.中只存在离子键,中存在离子键和共价键,C项错误;
D.中只含共价键,属于共价化合物,D项正确;
故选BC。
15.AC
【详解】
A.随着卤离子半径增大,离子键能减小,离子还原性增强,A项正确;
B.冰中的共价键是O-H,是极性共价键,B项错误;
C.同主族,从上到下金属性增强,且K的熔点比Na低,C项正确;
D.1mol金刚石含有2molC-C键,1mol石墨含有1.5molC-C键,D项错误;
答案选AC。
16.AD
【详解】
A.据图可知S2-位于立方体的顶点和面心,为面心立方最密堆积,A正确;
B.晶胞中S2-的个数为=4,化学式为Cu2S,则Cu+的个数为8,所以占据了8个四面体空隙,即全部的四面体空隙,B错误;
C.CuS晶胞中Cu2+位于四面体空隙中,所以Cu2+的配位数为4,化学式为CuS,所以S2-配位数也为4,C错误;
D.Cu2S晶胞的质量为g=g,晶胞的体积为a3pm3=a3×10-30cm3,所以密度为=,D正确;
综上所述答案为AD。
17. 和都是原子晶体,原子半径:,,则共价键键长:键键,键能:键键,所以熔点低于BN 1 2OH— +2I—+H2O 溶液酸碱性 反应i为放热反应,高于85℃时,平衡向逆反应方向移动,减小;反应ii中减小是影响平衡移动的主要因素,所以反应ii平衡也向逆反应方向移动,沉淀率下降
【详解】
(1)As在周期表的第4周期第ⅤA族,最外层电子的排布式是4s24p3,故答案为:4s24p3;
(2)砷化镓()和氮化硼()晶体都具有空间网状结构,硬度大,砷化镓与氮化硼属于同种晶体类型,均属于原子晶体,原子半径N<As,B<Ga,故N-B键的键长比As-Ga键的键长短,N-B键的键能更大,更稳定,所以氮化硼的熔点较高,故答案为:GaAs和BN都是原子晶体,原子半径:Ga>B,As>N,则共价键键长:Ga-As键>B-N键,键能:Ga-As键<B-N键,所以熔点GaAs低于BN;
(3)碘单质将氧化成,As的化合价从+3升到+5,自身被还原为碘离子,碘的化合价从0降到-1,根据化合价升降守恒及溶液的碱性环境,离子方程式为+I2 +2OH— +2I—+H2O,该反应为可逆反应,说明氧化还原反应的方向和溶液酸碱性有关,故答案为:1;2OH—;+2I—+H2O;溶液酸碱性;
(4)①“还原”过程中二氧化硫将H3AsO4转化为H3AsO3,反应的化学方程式为:H3AsO4+H2O+SO2=H3AsO3+H2SO4,故答案为:H3AsO4+H2O+SO2=H3AsO3+H2SO4;
②“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反反应:i.Ca(OH)2(s) Ca2+(aq)+2OH—(aq)+Q,ii.5Ca2++OH—+3 Ca5(AsO4)3OH-Q,高于85℃后,温度升高,反应i平衡逆向移动,c(Ca2+)下降,反应ii平衡逆向移动,Ca5(AsO4)3OH沉淀率下降,故答案为:反应i为放热反应,高于85℃时,平衡向逆反应方向移动,c(Ca2+)减小;反应ii中c(Ca2+)减小是影响平衡移动的主要因素,所以反应ii平衡也向逆反应方向移动,沉淀率下降。
18. FeS + 3CrO+ 7H2O = FeOOH + 3Cr(OH)3 + SO+ OH- FeS Fe2+中3d轨道没有达到半满的稳定结构,而Fe3+中3d轨道达到半满的稳定结构 50% sp2、sp3 13 6 当pH<2时,H+浓度大,邻二氮菲中的N优先与H+形成配位键,导致与Fe2+配位能力减弱;pH>9,OH-浓度大与Fe2+反应,影响Fe2+与邻二氮菲配位。
【详解】
(1)由流程图知,铬酸钾与硫化亚铁反应生成SO,FeOOH和Cr(OH)3,铁元素从+2价升高到+3价,硫元素从-2价升高到+6价,硫化亚铁完全反应化合价升高9价,铬酸钾完全反应化合价降低3价,根据化合价升降相等及电子守恒,质量守恒配平方程式为FeS + 3CrO+ 7H2O = FeOOH + 3Cr(OH)3 + SO+ OH-,答案为FeS + 3CrO+ 7H2O = FeOOH + 3Cr(OH)3 + SO+ OH-
(2) ① 滤渣为FeS 、FeOOH、Cr(OH)3 的混合物,已知780℃以上的残留固体为Fe2O3、Cr2O3的化合物,FeOOH、Cr(OH)3 加热分解生成Fe2O3、Cr2O3的过程是质量减小的过程,FeS加热先变成硫酸铁,硫酸铁加强热分解变为氧化铁,该过程固体中先增大后减小,所以A→B固体质量增加是由滤渣中FeS 引起的。故答案为FeS;
② 在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是Fe2+中3d轨道没有达到半满的稳定结构,而Fe3+中3d轨道达到半满的稳定结构,故答案为Fe2+中3d轨道没有达到半满的稳定结构,而Fe3+中3d轨道达到半满的稳定结构;
③ 根据以上实验数据计算上述模拟废水中铬元素的去除率,1L模拟废水中含铬酸钾的物质的量为5.82g/L×1L÷194g/mol=0.03mol。
设2.2100g固体中含FeS 为xmol,FeOOH为ymol,根据反应FeS + 3CrO+ 7H2O = FeOOH + 3Cr(OH)3 + SO+ OH-可知,Cr(OH)3 为3ymol,结合Fe、Cr元素守恒可知,灼烧所得的固体质量为1.74g固体中Fe2O3的物质的量为mol, Cr2O3的物质的量为1.5mol,则xmol×88g/mol+ymol×89g/mol+3ymol×103g/mol=2.2100g, mol×160g/mol+1.5y×152g/mol=1.7400g,联立解得,x=0.0025mol,y=0.005mol,滤渣中Cr(OH)3
的物质的量为3y=3×0.005mol=0.015mol,废水中+6价的去除率为。故答案为50%.
Ⅱ.(1) 琥珀酸亚铁中碳原子的杂化轨道类型为sp2、sp3,1mol琥珀酸亚铁中含σ键13mol,故答案为sp2、sp3,13
(2) 用邻二氮菲(phen,如图2)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。因为邻二氮菲中有两个氮原子,与每一个氮原子都能形成配位,所以在[Fe(phen)3]2+中,Fe2+的配位数为6。用邻二氮菲测定Fe2+浓度时应控制pH在2~9适宜范围,原因是当pH<2时,H+浓度大,邻二氮菲中的N优先与H+形成配位键,导致与Fe2+配位能力减弱;pH>9,OH-浓度大与Fe2+反应,影响Fe2+与邻二氮菲配位;故答案为6;当pH<2时,H+浓度大,邻二氮菲中的N优先与H+形成配位键,导致与Fe2+配位能力减弱;pH>9,OH-浓度大与Fe2+反应,影响Fe2+与邻二氮菲配位;
19. bc 2NH3+CO2+H2O=(NH4)2CO3 高温低压 C>N>O>H HNO3和H3PO4酸性强弱或NH3和PH3热稳定性强弱 CO2和CS2均为分子晶体且结构与组成相似,其熔点高低与分子量有关;分子量越大,熔点越高;由于CS2的分子量大于CO2的分子量,所以CS2熔点更高
【详解】
(1)a.减小压强,铜液吸收CO的反应速率减小,故错误;
b.增加NH3的浓度,反应物的浓度增大,铜液吸收CO的反应速率增大,故正确;
c.升高温度,铜液吸收CO的反应速率增大,故正确;
d.及时移走产物,生成物的浓度减小,铜液吸收CO的反应速率减小,故错误;
bc正确,故答案为:bc;
(2)铜液中的氨可与二氧化碳反应生成碳酸铵,反应的化学方程式为2NH3+CO2+H2O=(NH4)2CO3,故答案为:2NH3+CO2+H2O=(NH4)2CO3;
(3)铜溶液再生的反应是气体体积增大的吸热反应,则再生的适宜条件是高温低压,故答案为:高温低压;
(4)铜液的组成元素中,短周期元素为C、N、O、H,H原子的原子半径在周期表中最小,同周期元素,从左到右原子半径依次减小,则C、N、O、H原子半径从大到小的排列顺序为C>N>O>H;氮元素原子最外层有5个电子,电子排布式为2s22p3,则轨道表达式为;元素的非金属性越强,最高价氧化物对应水化物的酸性越强、气态氢化物的稳定性越强,则可以比较HNO3和H3PO4酸性强弱或NH3和PH3热稳定性强弱可判断氮、磷两种非金属元素的非金属性强弱,故答案为:C>N>O>H;;HNO3和H3PO4酸性强弱或NH3和PH3热稳定性强弱;
(4)CO2和CS2均为分子晶体且结构与组成相似,则CS2的电子式是;结构相似的分子晶体随着相对分子质量的增大,分子间作用力增大,熔沸点越高,CS2的分子量大于CO2的分子量,所以CS2熔点更高,故答案为:;CO2和CS2均为分子晶体且结构与组成相似,其熔点高低与分子量有关;分子量越大,熔点越高;由于CS2的分子量大于CO2的分子量,所以CS2熔点更高。
20.(1)2
(2) B
(4) 1:6 8
(5) Li3N+2H2 =LiNH2 + 2LiH ×1030gcm-3
【分析】
(1)
基态Li核外电子排布为1s22s1,一种能级代表一种前量状态,故共有2种能量状态;
(2)
这三种化合物合的非金属元素分别为H、B、N,由鲍林电负性、可知,H、B、N鲍林电负性分别为2.1、2.04、3.04,故电负性B
离半经越小将项离子分开越难,晶格能就元越大熔点越高,由于O2-半行小于Cl-,Li2O的晶格能大于LiCl;
(4)
由图一知, C中除中心2个C处于体心,其他每个C都在面心,每个面2个,共4个面,所以处于面心的C总共8个,所以一个晶胞中的碳数C=2+8×=6,而Li+处于立方体的8个顶点,所以一个晶胞中的Li+数为8×=1,因此 晶胞中锂离子和碳原子的个数之比为 1:6,图中最底部红色代表一个Li+,两个蓝色代表碳,且距离是最近的2个,一个品平面可以堆积上下八个同样的立方体,所以距离最近的为8×2但是碳位于面心,被两个面所共用,所以8×2×=8;
(5)
Li3N与H2在一定条件下反应生成LiNH2和LiH,根据氧化还原反应配平规则配平方程式得:Li3N+2H2 =LiNH2 + 2LiH;根据Li2NH晶胞结构图,可知一个晶胞中Li+为8个,NH2-数为:8×+6×=4,设晶胞的边长为cpm,利用切割法将晶胞分割成八个小方体,而Li+位于小立方体的体心,NH2-位于小立方体的顶点,四个NH2-构成了小正四面体,体心到顶点的距离恰好是为a+b,晶胞的体对角线为=4(a+b),故c=4(a+b),c=(a+b),由ρ====×1030gcm-3= ×1030gcm-3 =×1030gcm-3。
21.(1)
(2)3,3,6-三甲基辛烷
(3)、、都是分子晶体,结构相似,分子间作用力相差较小,所以熔点相差较小;AlF3通过离子键形成离子晶体,破坏离子键需要能量多得多,所以熔点相差较大
【详解】
(1)
乙苯的结构简式。
(2)
根据烷烃的命名规则, 的最长主链含有8个碳原子,为辛烷,在3号碳原子上含有2个甲基,6号碳原子上含有1个甲基,名称为3,3, 6-三甲基辛烷。
(3)
、、都是分子晶体,结构相似,分子间作用力相差较小,所以熔点相差较小;AlF3通过离子键形成离子晶体,破坏离子键需要能量多得多,所以熔点相差较大。
22. NBr3>NCl3>NF3 三种物质的晶体均为分子晶体,相对分子质量大则分子间的作用力大,沸点高,因此沸点由高到低的顺序为NBr3>NCl3>NF3 Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ N2O、CO2 > Cu+ 6
【详解】
(1)NF3,NBr3、NCl3都是分子晶体,且结构相似,它们相对分子质量大小关系为:NBr3>NCl3>NF3,相对分子质量大则分子间的作用力大,沸点高,所以它们的沸点由高到低的顺序是:NBr3>NCl3>NF3;
(2)Mg2N2遇水发生剧烈反应,生成一种有刺激性气味的气体为氨气,根据元素守恒,可写出化学方程式:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;
(3)N3-中有三个原子,价电子数为16,根据等电子原理可知,与它互为等电子体的分子有:N2O、CO2、CS2、BeCl2等;
(4)因为钠离子的半径比钾离子的半径小,所以NaN3的晶格比KN3的晶格能大;
(5)X+中K、L、M三个电子层均充满了电子,所以X+核外有28个电子,即X的核电荷数为29,所以X为铜元素,X+为Cu+,根据晶体结构图可知,每个与其距离最近的Cu+有6个;
23. 极性共价键、配位键 af 、 4 配位键、极性共价键
【详解】
(1)将白色粉末溶于水中,溶液呈蓝色,是因为铜离子和水分子结合生成了一种呈蓝色的配位数是4的配离子,此配离子的离子方程式为:,蓝色溶液中的阳离子内铜离子和水分子之间存在的是配位键,水分子之间O和H之间形成的是极性共价键。故答案:;极性共价键、配位键。
(2)中的O原子提供孤电子对,提供空轨道,所以水合铜离子的结构简式为。故答案:。
(3)a.根据元素周期表可知电负性:,故a不正确;
b.S原子与4个O原子形成共价键,所以S原子采取杂化,故b正确;
c.中与以离子键结合,、中含有极性共价键,中含有配位键,故c正确;
d.分子内N原子有1个孤电子对,分子中O原子有2个孤电子对,分子中孤电子对共用电子对排斥作用大,所以键角:,故d正确;e.中N原子提供孤电子对,故e正确;
f.分子中N的价层电子对数为4,轨道杂化方式为杂化,故f错误。
故答案:af。
(4)由配离子可以看出其中心离子是,配体是、配位数为4,含有的微粒间作用力有配位键以及极性共价键。故答案:;、;4;配位键、极性共价键。
24. XY 6
【详解】
(1)Y位于立方体的体心,X位于立方体的8个顶角,根据均摊法可知,该晶体的化学式为XY;
(2)在晶胞中,每个X周围与它最近且距离相等的X有6个(上、下、左、右、前、后各1个)。
