第三章实验活动简单配合物的形成—基础训练(word版 含解析)
文档属性
| 名称 | 第三章实验活动简单配合物的形成—基础训练(word版 含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 00:00:00 | ||
图片预览


文档简介
实验活动简单配合物的形成
一、选择题(共16题)
1.下列各组分子中中心原子的杂化轨道类型相同的是
A.与 B.与 C.与 D.与
2.下列有关说法不正确的是
A.水分子间存在氢键,故水很稳定,1000 ℃以上才会部分分解
B.乳酸()分子中含有一个手性碳原子
C.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D.已知H3PO4()酸性强于H3BO3(),原因是H3PO4中非羟基氧原子数大于H3BO3中非羟基氧原子数
3.我国的激光技术在世界上处于领先地位,科学家用激光将置于铁室中石墨靶上的碳原子炸松,与此同时再用射频电火花喷射氮气,此时碳、氮原子结合成氮碳化合物薄膜,氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料,其中β一氮化碳的结构如图。下列有关氮化碳的说法错误的是
A.氮化碳属于共价晶体 B.氮化碳的化学式为
C.碳、氮原子均采取杂化 D.1mol氮化碳中含有4molN—C键
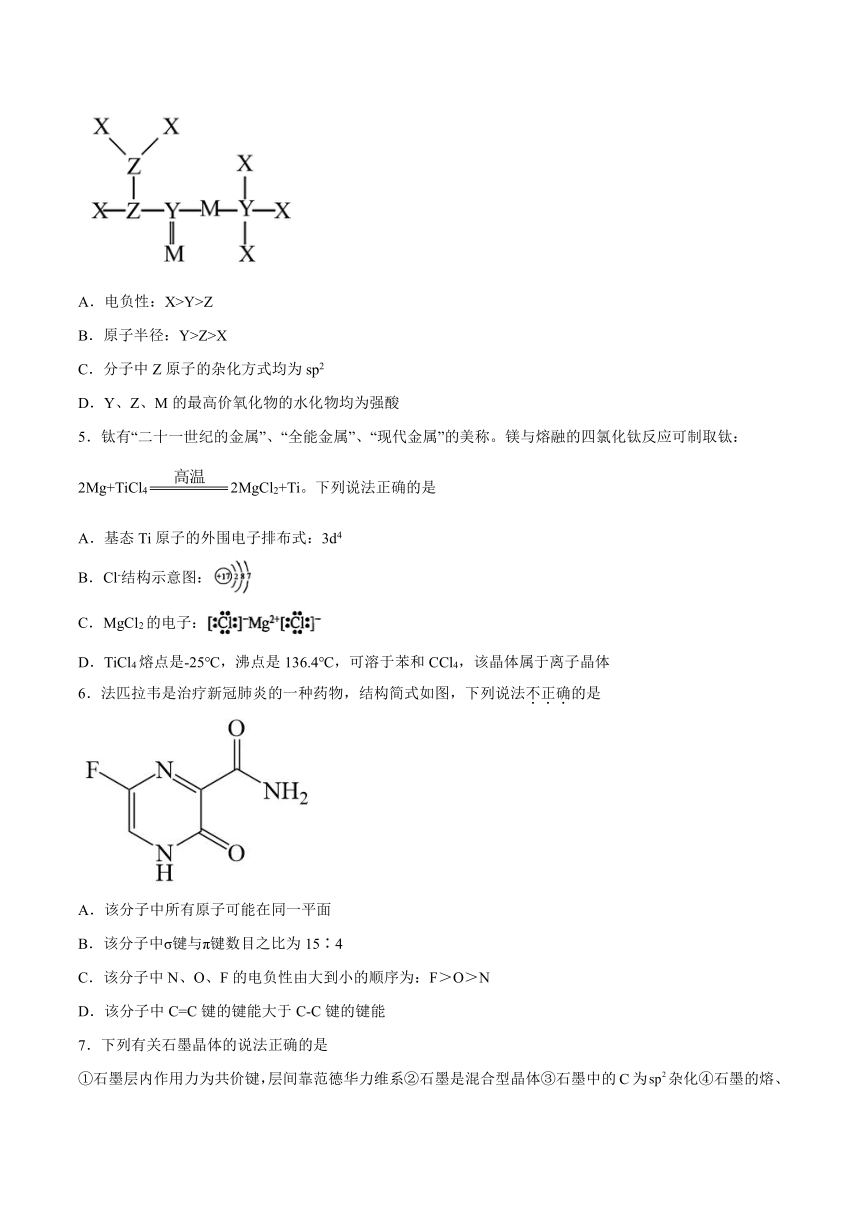
4.短周期元素X、 Y、Z、M原子序数依次增大,Z的基态原子2p轨道半充满,M的最高正价与最低负价绝对值之差为4,它们组成的一种分子结构如图。下列说法正确的是
A.电负性:X>Y>Z
B.原子半径:Y>Z>X
C.分子中Z原子的杂化方式均为sp2
D.Y、Z、M的最高价氧化物的水化物均为强酸
5.钛有“二十一世纪的金属”、“全能金属”、“现代金属”的美称。镁与熔融的四氯化钛反应可制取钛:2Mg+TiCl42MgCl2+Ti。下列说法正确的是
A.基态Ti原子的外围电子排布式:3d4
B.Cl-结构示意图:
C.MgCl2的电子:
D.TiCl4熔点是-25℃,沸点是136.4℃,可溶于苯和CCl4,该晶体属于离子晶体
6.法匹拉韦是治疗新冠肺炎的一种药物,结构简式如图,下列说法不正确的是
A.该分子中所有原子可能在同一平面
B.该分子中σ键与π键数目之比为15∶4
C.该分子中N、O、F的电负性由大到小的顺序为:F>O>N
D.该分子中C=C键的键能大于C-C键的键能
7.下列有关石墨晶体的说法正确的是
①石墨层内作用力为共价键,层间靠范德华力维系②石墨是混合型晶体③石墨中的C为杂化④石墨的熔、沸点都比金刚石的低⑤石墨中碳原子个数和键个数之比为1:3⑥石墨和金刚石的硬度相同⑦石墨的导电性只能沿石墨平面的方向
A.全部 B.①②③⑦ C.仅②③⑦ D.①②⑤⑦
8.短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y同族但不相邻,基态Z原子价电子排布。下列说法正确的是
A.简单离子半径:W>Z>Y>X
B.简单阴离子还原性:Z>W
C.电负性:Z>W
D.Z与W的简单气态氢化物互为等电子体
9.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列叙述错误的是
A.胆矾晶体不导电,胆矾属于电解质
B.胆矾晶体中存在离子键、极性键、氢键等化学键
C.“熬之则成胆矾”是浓缩结晶过程
D.铜所在周期第一电离能最小和电负性最小的元素都是钾
10.用高压釜施加高温高压并加入金属镍等催化剂,可实现如图所示的石墨转化为物质B的过程,下列有关说法错误的是
A.石墨的层状结构比物质B的结构更稳定
B.在该条件下,石墨转化为物质B的变化是化学变化
C.物质B的硬度比石墨的大,属于共价晶体
D.石墨和物质B中的C均采取杂化,键角均为120°
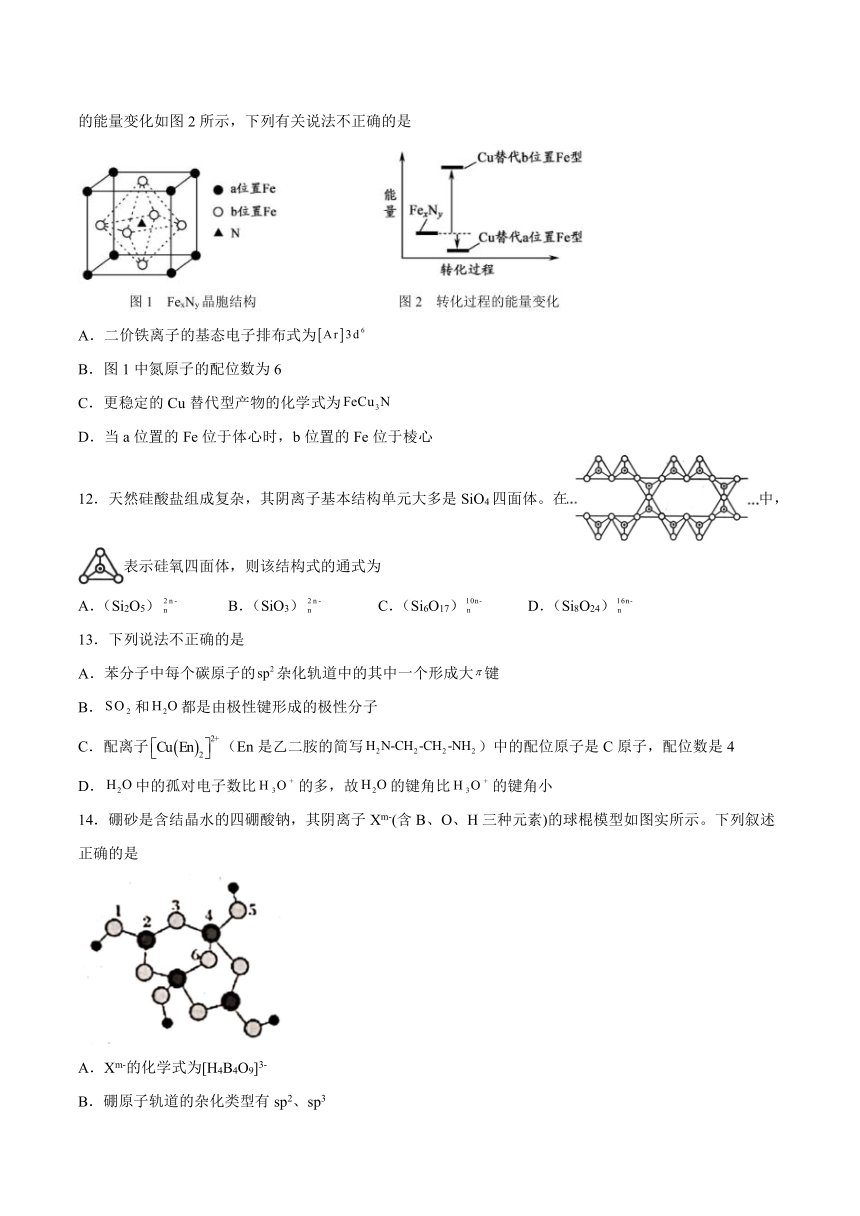
11.铁氮化合物()在磁记录材料领域有着广泛的应用前景。某的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物。转化为两种Cu替代型产物的能量变化如图2所示,下列有关说法不正确的是
A.二价铁离子的基态电子排布式为
B.图1中氮原子的配位数为6
C.更稳定的Cu替代型产物的化学式为
D.当a位置的Fe位于体心时,b位置的Fe位于棱心
12.天然硅酸盐组成复杂,其阴离子基本结构单元大多是SiO4四面体。在中,表示硅氧四面体,则该结构式的通式为
A.(Si2O5) B.(SiO3) C.(Si6O17) D.(Si8O24)
13.下列说法不正确的是
A.苯分子中每个碳原子的杂化轨道中的其中一个形成大键
B.和都是由极性键形成的极性分子
C.配离子(En是乙二胺的简写)中的配位原子是C原子,配位数是4
D.中的孤对电子数比的多,故的键角比的键角小
14.硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图实所示。下列叙述正确的是
A.Xm-的化学式为[H4B4O9]3-
B.硼原子轨道的杂化类型有sp2、sp3
C.配位键存在于4、6原子之间
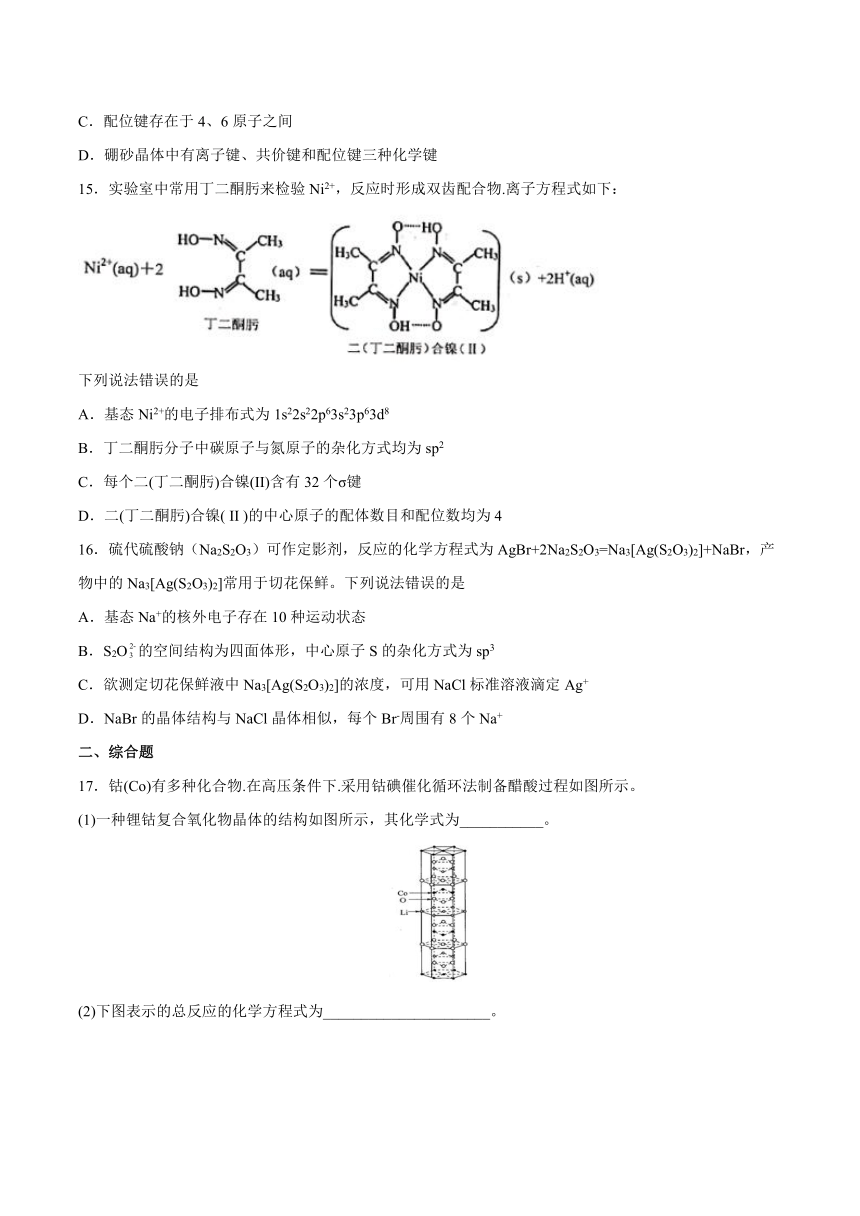
D.硼砂晶体中有离子键、共价键和配位键三种化学键
15.实验室中常用丁二酮肟来检验Ni2+,反应时形成双齿配合物.离子方程式如下:
下列说法错误的是
A.基态Ni2+的电子排布式为1s22s22p63s23p63d8
B.丁二酮肟分子中碳原子与氮原子的杂化方式均为sp2
C.每个二(丁二酮肟)合镍(II)含有32个σ键
D.二(丁二酮肟)合镍( II )的中心原子的配体数目和配位数均为4
16.硫代硫酸钠(Na2S2O3)可作定影剂,反应的化学方程式为AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr,产物中的Na3[Ag(S2O3)2]常用于切花保鲜。下列说法错误的是
A.基态Na+的核外电子存在10种运动状态
B.S2O的空间结构为四面体形,中心原子S的杂化方式为sp3
C.欲测定切花保鲜液中Na3[Ag(S2O3)2]的浓度,可用NaCl标准溶液滴定Ag+
D.NaBr的晶体结构与NaCl晶体相似,每个Br-周围有8个Na+
二、综合题
17.钴(Co)有多种化合物.在高压条件下.采用钴碘催化循环法制备醋酸过程如图所示。
(1)一种锂钴复合氧化物晶体的结构如图所示,其化学式为___________。
(2)下图表示的总反应的化学方程式为______________________。
(3)基态Co原子的价电子排布图为______________。
(4)1个CH3COCo(CO)4分子中含有键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。
(5)CH4、CO2是合成CH3OH的基本原料。一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。 CH4与H2O形成的水合物晶体.俗称“可燃冰”。为开采深海海底的“可燃冰’,有科学家提出用以CO2换CH4的设想。已知下图中笼状结构的空腔直径为0.586 nm.结合图表从物质结构及性质的角度分析,该设想的依据是___________。
18.惰性气体以性质稳定著称,但随着科学的发展,科学家们合成了一些氙的化合物。根据所学知识回答下列问题:
(1) Xe原子的核外电子排布式为________。稀有气体中只有氙能合成出多种化合物,其原因可能是_____ (填序号)。
A.氙含量比较丰富 B.氙原子半径大,电离能小 C.氙原子半径小,电离能大
(2) 研究报告指出:“关于XePtF6的化合价有[]、[]两种可能,经证实XePtF6不溶于CC14等非极性溶剂。”据此可确定Xe[PtF6]中化学键类型为_____________。
(3)金属Pt采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是__________ (填序号)。
(4)已知与铯同主族的前四周期(包括第四周期)的三种元素X、Y、Z的电离能如下表:
元素代号 X Y Z
第一电离能(kJ.mol-1) 520 496 419
那么三种元素X、Y、Z的元素符号分别为__________,形成其单质晶体的化学键类型是____________。
(5)氟元素与碘元素同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,两者分子中的中心原子Be和O的杂化方式分别是___________、__________________。
(6)与碘同主族的氯具有较高的活泼性,能够形成大量的含氯化合物,如金属氯化物、非金属氯化物等。BC13是一种非金属氯化物,该物质分子中B-Cl键的键角为_____________。
19.能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,基态镍原子M层上的未成对电子数为_______。
(2)大阪大学近日宣布,有机太阳能固体电池效率突破5.3%,而高纯度C60是其“秘密武器”。C60的结构如图1,分子中碳原子轨道的杂化类型为______;1 mol C60分子中π键的数目为________。
(3)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图2。该结构中,碳氮之间的共价键类型有_____(按原子轨道重叠方式填写共价键的类型),请在下图2中用箭头表示出配位键_____。
图1 图2 图3
(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As_____Se(填“>”、“<”或“=”)。
②硫化锌的晶胞中(结构如图3所示),硫离子的配位数是_____。
③二氧化硒分子的空间构型为______________。
④砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为__________。
20.现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
⑴请写出:D基态原子的价层电子排图: ______ ;F 基态原子的外围电子排布式: ______ .
⑵下列说法错误的是 ______ .
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.电负性顺序:B < C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O > H2S,水分子更稳定的原因是水分子间存在氢键
⑶F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点,向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成(F(X)4)2+,该离子的结构式为 ______ 用元素符号表示.
⑷某化合物与F(I)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有 ______ .
⑸B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为 ______ .
⑹D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率 ______ .
21.金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)铝原子核外电子云有___种不同的伸展方向,有___种不同运动状态的电子。
(2)镓(Ga)与铝同族。写出镓的氯化物和氨水反应的化学方程式___。
(3)硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成氧化物形式___。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式为___。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为___。
(4)用铝和金属氧化物反应制备金属单质是工业上常用的方法。如:2Al+4BaO3Ba↑+BaO Al2O3。常温下Al的金属性比Ba的金属性___(选填“强”“弱”)。利用上述方法可制取Ba的主要原因是___。
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaO Al2O3比Al2O3稳定 d.Ba的沸点比Al的低
22.周期表前四周期的元素a、b、c、d、e,f原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的外围电子排布式为3d64s2,f的最外层只有一个电子,但次外层有18个电子.回答下列问题:
(1)a、d、e、f各元素分别是_________、_______、_______、_______。
(2)b、c、d中第一电离能由大到小的顺序是:_______________(填元素符号),f的价层电子轨道示意图为_________________________________,f的焰色反应为亮绿色,请用原子结构的知识解释原因___________________,预测电离能I4(e)_______I4(f)的大小(填大于、小于、等于)。
(3)a和b、c、d形成的二元共价化合物有很多种,其中有一分子呈三角锥形,该分子的中心原子的杂化方式为__________;
(4)f2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[f(NH3)4]2+中存在的化学键类型有________(填序号)。
A.配位键B.极性共价键C.非极性共价键D.离子键
②写出[f(NH3)4]2+的结构式____________。(只标出配位键)
23.按要求回答下列问题。
(1)2019年,我国青年化学家雷晓光被遴选为“青年化学家元素周期表”氮元素的代言人。氮元素在周期表中的位置是________,N2的电子式是________,化合物Si3N4中N的化合价是_______价。
(2)2020年6月23日,长征系列运载大箭将北斗三号“收官之星”成功送入太空。火箭燃料燃烧的化学方程式为:2N2H4+N2O4=3N2+4H20。该反应中氧化剂与还原剂的物质的量之比为______,将封装有NO2和NO混合气体的圆底烧瓶浸入热水中,气体混合物颜色变_______(填“深”或“浅”)。
(3)我国拥有自主知识产权的铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第5周期IA族元素。Rb元素原子的失电子能力______填(“强”或“弱”)于K,请用原子结构的知识解释其原因:______。
24.A+、B+、C–、D、E五种粒子(分子和离子)中,每个粒子均有10个电子。已知:①A++C–=E+D②B++C–=2D
(1)C–离子的电子式是_________
(2)具有相同空间构型的粒子______和______,E分子的空间构型为_________,_______性分子。
(3)分别写出A+和D反应、B+和E反应的离子方程式_____________、_____________。
参考答案:
1.B
【详解】
A.价层电子对数为,为杂化;价层电子对数为,为杂化,故A错误;
B.价层电子对数为,为杂化;价层电子对数为,为杂化,故B正确;
C.价层电子对数为,为杂化;价层电子对数为,为杂化,故C错误;
D.与中每个碳原子连接的原子个数分别为2、3,每个C原子分别形成2个键、2个键和3个键、1个键,C原子杂化类型分别为杂化、杂化,故D错误;
故选B。
2.A
【详解】
A.水很稳定,是因为水分子内H、O原子间的共价键键能大,与水分子间的氢键无关,A不正确;
B.乳酸()分子中,与-OH相连的碳原子,分别连有-CH3、-OH、-H、-COOH,所以此碳原子为手性碳原子,B正确;
C.碘、甲烷、四氯化碳都为非极性分子,非极性分子组成的溶质易溶于非极性分子组成的溶剂,可用“相似相溶”原理解释,C正确;
D.在含氧酸分子中,非羟基氧原子数越多,酸性越强,H3PO4中非羟基氧原子数为1,H3BO3中非羟基氧原子数为0,所以H3PO4()酸性强于H3BO3(),D正确;
故选A。
3.D
【详解】
A.氮化碳为网状结构,硬度超过金刚石晶体,则氮化碳晶体为共价晶体,A项正确;
B.每个C和4个N形成共价键,每个N与3个C相连,所以氮化碳的化学式为,B项正确;
C.C、N原子均采取杂化,C项正确;
D.1mol氮化碳中含有12molN—C键,D项错误;
故选D。
4.B
【详解】
A.由上述分析可知,X为H元素,Y为C元素,Z为N元素,则电负性:N>C>H,A错误;
B.H原子核外有1个电子层,而C、N原子核外均有2个电子层,电子层数越多,半径越大,电子层数相同,核电荷数越大,半径越小,则原子半径:C>N>H,B正确;
C.分子中N原子均形成共价单键,为sp3杂化,C错误;
D.C元素的最高价氧化物的水化物为H2CO3,H2CO3为弱酸,D错误;
答案选B。
5.C
【详解】
A.钛是22号元素,根据构造原理知其基态原子核外电子排布式为1s22s22p63s23p63d24s2,则其基态原子的价电子排布式为3d24s2,故A错误;
B.Cl-结构示意图为,故B错误;
C.MgCl2是离子化合物,其电子式为:,故C正确;
D.TiCl4熔、沸点低,可溶于苯和CCl4,由此可判断TiCl4是由共价键结合形成的分子,晶体类型为分子晶体,故D错误;
答案选C。
6.A
【详解】
A. 分子中两个氮原子采用sp3杂化,是三角锥形结构,该分子中所有原子不可能在同一平面,故A错误;
B. 有机物含有1个C-H、1个C=C、1个C=N、2个C=O、3个N-H、4个C-N、1个C-F、2个C-C键,其中双键含有1个σ键、1个π键,该分子中σ键与π键数目之比为15∶4,故B正确;
C. 同周期元素从左到右元素的电负性增强,则该分子中N、O、F的电负性的大小顺序为F>O>N,故C正确;
D. C=C键的键长短,作用力大,该分子中C=C键的键能大于C-C键的键能,故D正确;
故选A。
7.B
【详解】
①石墨时混合型晶体,石墨层中碳原子靠共价键链接,层与层之间靠范德华力维系,①正确;
②石墨是混合型晶体,②正确;
③石墨中的碳原子与相邻的三个碳原子以σ键结合,形成平面正六边形结构,碳原子的杂化类型为sp2杂化,③正确;
④石墨中的共价键键长比金刚石中共价键键长短,具有的能量更多,所以石墨的熔点比金刚石的高,④错误;
⑤石墨中,一个碳原子上有3个单键,每个单键被2个碳原子共用,所以平均每个碳原子对应1.5个单键,故石墨中碳原子个数和C C键个数之比为2:3,⑤错误;
⑥石墨质软,金刚石的硬度大,⑥错误;
⑦石墨的导电性只能沿石墨平面的方向,⑦正确;
综上所述,正确的有①②③⑦,B项符合题意。
8.B
【详解】
A.离子半径比较,先看电子层数,同层原子序数小对应离子半径大,则离子半径:Z >W>Y>X,故A错误;
B.单质非金属性越强阴离子还原性越弱,还原性:Z>W,故B正确;
C.非金属性越强电负性越强,则电负性:W > Z,故C错误;
D.H2S与HCl原子数不同,不是等电子体,故D错误;
故选B。
9.B
【详解】
A. 胆矾晶体中离子不能自由移动,不导电,但溶于水能导电,胆矾为纯净物属于电解质,故A正确;
B. 胆矾晶体中存在离子键、极性键、氢键等作用力,氢键不属于化学键,故B错误;
C. “熬之则成胆矾”是浓缩结晶,析出晶体的过程,故C正确;
D. 钾原子半径最大,核对最外层电子的作用力小,易失去最外层的电子,铜所在周期第一电离能最小和电负性最小的元素都是钾,故D正确;
故选B。
10.D
【详解】
A.由题给结构可知,高温高压并有催化剂存在时,石墨转化得到的物质B为金刚石。键长金刚石>石墨,则键能金刚石<石墨,键能越大,键越牢固,物质越稳定,石墨温度,A项正确;
B.石墨和金刚石互为同素异形体,石墨转化为金刚石的过程涉及旧化学键的断裂和新化学键的形成,是化学变化,B项正确;
C.金刚石的结构是共价键三维骨架结构,属于共价晶体,其硬度比石墨的大,C项正确;
D.石墨中的C采取杂化,键角是120°,金刚石中的C采取杂化,键角是,D项错误。
答案选D。
11.C
【详解】
A. 铁原子失去4s能级上的2个电子,二价铁离子的基态电子排布式为,故A正确;
B. 图1中氮原子的上下左右前后各有1个铁原子,氮原子的配位数为6,故B正确;
C. 晶胞中Fe原子个数:6×=3,Cu:8×=1,N:1, 更稳定的Cu替代型产物的化学式为,故C错误;
D.由图1将顶点置于体心,即当a位置的Fe位于体心时,b位置的Fe位于棱心,故D正确;
故选C。
12.C
【详解】
如图结构所示,将左边结构补全会形成两个环,被两个环共用的氧原子左边有7个,右边有7个共14个,独立成个体的氧原子共有10个(上边有5个,下边有5个),同时每个环都有独立的硅原子,则Si:O=(4+4×0.5):(14×0.5+10)=6:17,这样,每个环所包含的 O 有 17个硅有6个,再根据Si+4,O-2 的化合价,其结构式的通式为(Si6O17),C正确;答案为C。
13.AC
【详解】
A.苯分子中每个碳原子的未参加杂化的2p轨道用来形成大键,每个碳原子都以杂化轨道形成α键,A错误;
B. 和均是V形结构,因此都是由极性键形成的极性分子,B正确;
C. 配离子(En是乙二胺的简写)中的配位原子是N原子,配位数是4,C错误;
D. 中的孤对电子数为2对,比的多,因此的键角比的键角小,D正确;答案选AC。
14.BD
【详解】
A.由模型可知,1,3,5,6代表氧原子,2,4代表B原子,可知Xm-是[H4B4O9]m-,依据化合价H为+1,B为+3,O为-2,可得m=2,则Xm-的化学式为:[H4B4O9]2-,故A错误;
B.2号B形成3个键,价层电子对数为3,则B原子为sp2杂化,B一般是形成3个键,4号B形成4个键,其中1个键是配位键,配位键存在4号与5号之间,4号B形成4个键,价层电子对数为4,则B原子为sp3杂化,故B正确;
C.B原子含有空轨道、O原子含有孤电子对,4、5(或5、4)原子之间存在配位键,故C错误;
D.硼砂晶体中有共价键、配位键和离子键三种化学键,故D正确;
答案选BD。
15.BD
【详解】
A.镍元素的核电荷数为28,失去2个电子形成镍离子,则基态Ni2+的电子排布式为1s22s22p63s23p63d8,故A正确;
B.由丁二酮肟分子结构可知,分子中有的碳原子形成1个双键和2个单键,碳原子的杂化方式为sp2杂化,还有的碳原子全部是单键,碳原子的杂化方式为sp3杂化,故B错误;
C.由二(丁二酮肟)合镍(II)的结构可知,配合物中含有4个配位键、4个双键和24个单键,共32个σ键,故C正确;
D.由二(丁二酮肟)合镍(II)的结构可知,配合物的中心原子为镍离子,配位数为4,配位体为2个丁二酮肟,故D错误;
故选BD。
16.CD
【详解】
A.基态Na+有10个核外电子,所以存在10种运动状态,A正确;
B.S2O的结构可以看做硫酸根中的一个氧原子被硫取代,结构和硫酸根类似,中心硫原子的孤电子对数为0,价层电子对数为4,所以空间结构为四面体形,中心原子S的杂化方式为sp3,B正确;
C.Na3[Ag(S2O3)2]中银离子与S2O形成配位键,无单独的银离子,不能用NaCl标准溶液滴定Ag+,C错误;
D.氯化钠晶体中每个Na+周围有6个Cl-,每个Cl-周围有6个Na+,NaBr的晶体结构与NaCl晶体相似,则每个Br-周围有6个Na+,D错误;
故选:CD。
17. LiCoO2 CH3OH+COCH3COOH 14 SO3 CO2的分子直径小于笼状空腔直径,且CO2与H2O的结合能大于CH4与H2O的结合能
【详解】
(1)由锂钴复合氧化物晶体的结构可知,Li离子在晶胞中6个位于中棱、4个位于上下棱、1个位于体内、2个位于测面心,Li离子个数为:6×1/3+4×1/4+1+2×1/2=5个, Co离子在晶胞中12个位于顶点、4个位于上下面心、4个位于上下棱,Co离子个数为:12×1/6+4×1/2+4×1/4=5个,O离子在晶胞中18个位于中棱、2个位于体内、4个位于测面心,Li离子个数为:18×1/3+2+4×1/2=10个, Li离子、Co离子和O离子个数比为5:5:10=1:1:2,化学式为LiCoO2,故答案为LiCoO2;
(2)由图可知右边下面进去1mol的水,而上面又出来1mol的水,所以实际反应的是甲醇;左边上面进去1mol的水,而下面又出来1mol的水,参与反应的是一氧化碳,而生成的醋酸,所以总反应的方程式为:CO+CH3OHCH3COOH,故答案为CO+CH3OHCH3COOH;
(3)Co是27号元素,核外电子数为27,其核外电子排布式为:1s22s22p63s23p63d74s2,价电子排布式为3d74s2,则其价电子排布图为:,故答案为;
(4)CH3COCo(CO)4配位化合物中,中心原子Co与配体形成5个δ键,CH3CO中有5个δ键,4个CO中共有4个δ键,共有14个个δ键;CO32—的原子个数为3、价电子数为24,则与其具有相同原子个数和价电子数的等电子体分子为SO3,故答案为SO3;
(5) 由表格可知:二氧化碳的分子直径小于笼状结构的空腔直径,即0.512<0.586,能顺利进入笼状空腔内,且二氧化碳与水的结合能力强于甲烷,即29.91>16.40,故答案为CO2的分子直径小于笼状空腔直径,且与H2O的结合能大于CH4。
18. [Kr]4d105s25p6 B 离子键、配位键 C Li、Na、K 金属键 sp sp3 120°
【详解】
(1)X位于第五周期的sp区,处于全满稳定状态,核外电子排布式为[Kr]4d105s25p6;氙原子半径大,电离能越小,越容易失去电子,化学性质越活泼,A、氙为稀有气体,含量比较少,A错误;B、氙原子半径大,电离能小,B正确;C、氙在稀有气体中原子半径较大,电离能较小,C错误,答案选B;(2)根据相似相溶原理,XePtF6不溶于CCl4等非极性溶剂,XePtF6具有较强的极性,其化学键类型为离子键和配位键;(3)金属Pt采用“…ABCABC…”型堆积方式,为立方面心结构,因此选C;(4)由铯的最外层电子排布式为6s1可知X、Y、Z为第ⅠA族,而ⅠA族前四周期的元素分别为H、Li、Na、K,又由提供的X、Y的第一电离能的差值与Y、Z的第一电离能的差值相差不大可知,X、Y、Z不可能有H元素,而同主族元素随着电子层数的增加,第一电离能逐渐减小,故X、Y、Z分别为Li、Na、K;都是金属单质,微粒均以金属键结合;(5)BeF2分子内中心原子为Be,其价电子数为2,F提供2个电子,所以Be原子的价层电子对数为(2+2)/2=2,Be原子的杂化类型为sp杂化;H2O分子的中心原子为O,其价电子数为6,H提供2个电子,所以O原子的价层电子对数为(6+2)/2=4,O原子杂化类型为sp3;(6)硼原子价电子数为3,Cl提供3个电子,硼原子的价层电子对数为(3+3)/2=3,因价层电子对中没有孤对电子,故BCl3为平面正三角形结构,分子中B-Cl键的键角为120°。
19. 2 sp2 30NA σ键、π键 > 4 折线型 (CH3)3Ga+AsH3GaAs+3CH4
【详解】
(1)基态Ni原子核外电子排布式为1s22s22p63s23p63d84s2,3d轨道有2个单电子,因此,本题正确答案是:2;
(2)每个C原子成3个σ键、没有孤电子对,杂化轨道数目为3,所以C原子采用sp2杂化;每个碳原子含有的π键个数为1/2,所以1molC60分子中π键的数目=1×60×1/2×NA =30NA因此,本题正确答案是: sp2;30NA;
(3)C、N原子之间形成双键、单键,单键为σ键,双键含有1个σ键、1个π键;配位键由提供孤电子对的原子指向提供空轨道的原子,所以该配合物中的配位键为: ,因此,本题正确答案是: σ键、π键;
(3)①As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,As原子4p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于Se,所以第一电离能 ,因此,本题正确答案是:>;②由晶胞结构可以知道,每个硫离子连接4个锌离子,所其配位数是4,因此,本题正确答案是:4;③二氧化硒分子中Se原子价层电子对=2+(6-2×2)/2=3,且含有一个孤电子对,所以其空间结构为V形;因此,本题正确答案是:V形;④砷化镓可由(CH3)3Ga 和AsH3在700℃下反应制得,由元素守恒可以知道还生成甲烷,反应方程式为: (CH3)3Ga+AsH3GaAs+3CH4因此,本题正确答案是: (CH3)3Ga+AsH3 GaAs+3CH4
20. 3d104s1 AD sp2、sp3 8
【详解】
⑴D为O元素,基态原子的价层电子排布图:;F为Cu元素,基态原子的外围电子排布式为:3d104s1;故答案为:;3d104s1。
⑵A选项,沸点:SiO2 > CO2,是由于二氧化硅属于原子晶体,二氧化碳形成分子晶体,故A错误;B选项,同周期随原子序数增大电负性增大,故电负性顺序:C < N < O,故B正确;C选项,N2与CO分子都含有2个原子、价电子总数都是10,二者为等电子体,结构相似,故C正确;D选项,稳定性:H2O > H2S,是因为非金属性O > S,与分子之间存在氢键无关,故D错误;综上所述,答案为:AD。
⑶C与A形成的气体X,则A为H元素,X为NH3,F的硫酸盐为CuSO4,向CuSO4溶液中通入过量的NH3可生成[Cu(NH3)4]2+,该离子的结构式为:,故答案为:。
⑷杂环上的碳原子含有3个δ键,没有孤对电子,采用sp2杂化,亚甲基上碳原子含有4个共价单键,采用sp3杂化,故答案为:sp2、sp3。
⑸由B单质的一种同素异形体的晶胞结构可知,B原子有4个位于晶胞内部,其余B原子位于定点、面心,则一个晶胞中所含B原子数为,故答案为:8。
⑹O与Cu形成离子个数比为1:1的化合物为CuO,晶胞与NaCl类似,其晶胞结构为,晶胞中铜离子数目阳离子数目,O2-离子的半径为apm,Cu2+离子的半径bpm,则晶胞中原子总体积,晶胞棱长,故晶胞体积,故该晶胞的空间利用率,故答案为:。
21. 4 13 GaCl3+3NH3·H2O=3NH4Cl+Ga(OH)3↓ Na2O·CaO·6SiO2 SiO2+2NaOH= Na2SiO3+H2O CaAl2Si2O8 弱 d
【详解】
(1)铝原子的电子排布为1s22s22p63s22p1,13个电子的运动状态各不相同,其中包含s能级的1种轨道和p能级的3种轨道,一共四种轨道,即有4个不同的伸展方向;
(2)类比氯化铝与氨水的反应,可知镓的氯化物和氨水反应的化学方程式为GaCl3+3NH3·H2O=3NH4Cl+Ga(OH)3↓;
(3)Na2CaSi6O14写成氧化物形式为Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,是因为氢氧化钠与玻璃中的二氧化硅反应:SiO2+2NaOH=Na2SiO3+H2O。由钠长石化学式NaAlSi3O8可知,O原子的物质的量分数为。根据不同类长石其氧原子的物质的量分数相同,则一分子钙长石含有13个原子,其中O为8,假设钙、铝、硅的原子个数分别为x、y、z,则x+y+z=5,根据化合物中化合价代数和为0可知,x+3y+4z=16,联立方程可得,x=1、y=2、z=2,钙长石的化学式为CaAl2Si2O8;
(4)根据元素周期律可知,常温下Al的金属性比Ba弱,利用2Al+4BaO3Ba↑+BaO Al2O3可制取Ba,是利用Ba的沸点比Al低,高温时Ba转化为气体逸出,使反应正向进行。
22. H S Fe Cu N>O>S 电子从高能级跃迁回低能级,以光的形式释放能量 大于 sp3 AB 。
【详解】
(1) 根据分析,a、d、e、f各元素分别为H、S、Fe、Cu,故答案为:H、S、Fe、Cu。
(2) 同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,同一主族元素中,元素第一电离能随着原子序数增大而减小,N元素第一电离能最大,O元素大于S元素的第一电离能,所以b、c、d元素第一电离能由大到小的顺序为N>O>S,f的价层电子为3d、4s电子,其价层电子排布图为,当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子,激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量,e是Fe,f是Cu,Cu失去一个电子后形成全满稳定结构,而Fe失去一个电子后不稳定结构,因此Fe大于Cu,故答案为:N>O>S,,电子从高能级跃迁回低能级,以光的形式释放能量,大于。
(3)a是H,b是N,c是O,d是S,a与其他元素形成的二元共价化合物中,一种化合物分子成三角锥形,该分子式为NH3,N原子上1对孤对电子,形成3个N-H键,中心原子的杂化方式为sp3杂化。
(4)①f是Cu,[Cu (NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,故答案为AB。
(5) [Cu (NH3)4]2+的结构式为,故答案为。
23. 第2周期VA族 -3 1:2 深 强 K和Rb是上下相邻的同主族元素,Rb的原子半径大于K,原子核对最外层电子的吸引作用小于K,所以其原子的失电子能力强于K
【详解】
(1)氮原子序数为7,电子分两层排布,最外层5个电子,在周期表中的位置是第2周期VA族,2个氮原子间通过共用3对电子对形成分子,故N2的电子式是,硅的非金属性比氮弱,化合价是+4价,故化合物Si3N4中N的化合价-3价;
(2)反应:2N2H4+N2O4=3N2+4H2O中,N2O4中氮元素化合价降低,氧化剂为N2O4、N2H4中氮元素化合价升高,还原剂为N2H4,氧化剂与还原剂的物质的量之比为1:2,将封装有NO2和NO混合气体的圆底烧瓶浸入热水中,2NO2 N2O4向逆反应方向移动,红棕色NO2浓度增大,混合物颜色变深;
(3)Rb元素原子的失电子能力大于K,K和Rb是上下相邻的同主族元素,Rb的原子半径大于K,原子核对最外层电子的吸引作用小于K,所以其原子的失电子能力强于K。
24. NH3 H3O+ 三角锥形 极性 NH4+ + H2ONH3 H2O + H+ NH3 + H3O+ = NH4+ + H2O
【详解】
(1)OH-离子的电子式是,故答案为:。
(2)具有相同空间构型的粒子NH3和H3O+,都为三角锥形,E分子的空间构型为三角锥形,空间不对称,为极性分子;故答案为:NH3;H3O+;三角锥形;极性。
(3) A+和D水解反应生成一水合氨和氢离子、B+和E反应生成铵根和水,其离子方程式分别为NH4+ + H2ONH3 H2O + H+,E、D为NH3 + H3O+ = NH4+ + H2O;故答案为:NH4+ + H2ONH3 H2O + H+;E、D为NH3 + H3O+ = NH4+ + H2O。
一、选择题(共16题)
1.下列各组分子中中心原子的杂化轨道类型相同的是
A.与 B.与 C.与 D.与
2.下列有关说法不正确的是
A.水分子间存在氢键,故水很稳定,1000 ℃以上才会部分分解
B.乳酸()分子中含有一个手性碳原子
C.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D.已知H3PO4()酸性强于H3BO3(),原因是H3PO4中非羟基氧原子数大于H3BO3中非羟基氧原子数
3.我国的激光技术在世界上处于领先地位,科学家用激光将置于铁室中石墨靶上的碳原子炸松,与此同时再用射频电火花喷射氮气,此时碳、氮原子结合成氮碳化合物薄膜,氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料,其中β一氮化碳的结构如图。下列有关氮化碳的说法错误的是
A.氮化碳属于共价晶体 B.氮化碳的化学式为
C.碳、氮原子均采取杂化 D.1mol氮化碳中含有4molN—C键
4.短周期元素X、 Y、Z、M原子序数依次增大,Z的基态原子2p轨道半充满,M的最高正价与最低负价绝对值之差为4,它们组成的一种分子结构如图。下列说法正确的是
A.电负性:X>Y>Z
B.原子半径:Y>Z>X
C.分子中Z原子的杂化方式均为sp2
D.Y、Z、M的最高价氧化物的水化物均为强酸
5.钛有“二十一世纪的金属”、“全能金属”、“现代金属”的美称。镁与熔融的四氯化钛反应可制取钛:2Mg+TiCl42MgCl2+Ti。下列说法正确的是
A.基态Ti原子的外围电子排布式:3d4
B.Cl-结构示意图:
C.MgCl2的电子:
D.TiCl4熔点是-25℃,沸点是136.4℃,可溶于苯和CCl4,该晶体属于离子晶体
6.法匹拉韦是治疗新冠肺炎的一种药物,结构简式如图,下列说法不正确的是
A.该分子中所有原子可能在同一平面
B.该分子中σ键与π键数目之比为15∶4
C.该分子中N、O、F的电负性由大到小的顺序为:F>O>N
D.该分子中C=C键的键能大于C-C键的键能
7.下列有关石墨晶体的说法正确的是
①石墨层内作用力为共价键,层间靠范德华力维系②石墨是混合型晶体③石墨中的C为杂化④石墨的熔、沸点都比金刚石的低⑤石墨中碳原子个数和键个数之比为1:3⑥石墨和金刚石的硬度相同⑦石墨的导电性只能沿石墨平面的方向
A.全部 B.①②③⑦ C.仅②③⑦ D.①②⑤⑦
8.短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y同族但不相邻,基态Z原子价电子排布。下列说法正确的是
A.简单离子半径:W>Z>Y>X
B.简单阴离子还原性:Z>W
C.电负性:Z>W
D.Z与W的简单气态氢化物互为等电子体
9.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列叙述错误的是
A.胆矾晶体不导电,胆矾属于电解质
B.胆矾晶体中存在离子键、极性键、氢键等化学键
C.“熬之则成胆矾”是浓缩结晶过程
D.铜所在周期第一电离能最小和电负性最小的元素都是钾
10.用高压釜施加高温高压并加入金属镍等催化剂,可实现如图所示的石墨转化为物质B的过程,下列有关说法错误的是
A.石墨的层状结构比物质B的结构更稳定
B.在该条件下,石墨转化为物质B的变化是化学变化
C.物质B的硬度比石墨的大,属于共价晶体
D.石墨和物质B中的C均采取杂化,键角均为120°
11.铁氮化合物()在磁记录材料领域有着广泛的应用前景。某的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物。转化为两种Cu替代型产物的能量变化如图2所示,下列有关说法不正确的是
A.二价铁离子的基态电子排布式为
B.图1中氮原子的配位数为6
C.更稳定的Cu替代型产物的化学式为
D.当a位置的Fe位于体心时,b位置的Fe位于棱心
12.天然硅酸盐组成复杂,其阴离子基本结构单元大多是SiO4四面体。在中,表示硅氧四面体,则该结构式的通式为
A.(Si2O5) B.(SiO3) C.(Si6O17) D.(Si8O24)
13.下列说法不正确的是
A.苯分子中每个碳原子的杂化轨道中的其中一个形成大键
B.和都是由极性键形成的极性分子
C.配离子(En是乙二胺的简写)中的配位原子是C原子,配位数是4
D.中的孤对电子数比的多,故的键角比的键角小
14.硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图实所示。下列叙述正确的是
A.Xm-的化学式为[H4B4O9]3-
B.硼原子轨道的杂化类型有sp2、sp3
C.配位键存在于4、6原子之间
D.硼砂晶体中有离子键、共价键和配位键三种化学键
15.实验室中常用丁二酮肟来检验Ni2+,反应时形成双齿配合物.离子方程式如下:
下列说法错误的是
A.基态Ni2+的电子排布式为1s22s22p63s23p63d8
B.丁二酮肟分子中碳原子与氮原子的杂化方式均为sp2
C.每个二(丁二酮肟)合镍(II)含有32个σ键
D.二(丁二酮肟)合镍( II )的中心原子的配体数目和配位数均为4
16.硫代硫酸钠(Na2S2O3)可作定影剂,反应的化学方程式为AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr,产物中的Na3[Ag(S2O3)2]常用于切花保鲜。下列说法错误的是
A.基态Na+的核外电子存在10种运动状态
B.S2O的空间结构为四面体形,中心原子S的杂化方式为sp3
C.欲测定切花保鲜液中Na3[Ag(S2O3)2]的浓度,可用NaCl标准溶液滴定Ag+
D.NaBr的晶体结构与NaCl晶体相似,每个Br-周围有8个Na+
二、综合题
17.钴(Co)有多种化合物.在高压条件下.采用钴碘催化循环法制备醋酸过程如图所示。
(1)一种锂钴复合氧化物晶体的结构如图所示,其化学式为___________。
(2)下图表示的总反应的化学方程式为______________________。
(3)基态Co原子的价电子排布图为______________。
(4)1个CH3COCo(CO)4分子中含有键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。
(5)CH4、CO2是合成CH3OH的基本原料。一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。 CH4与H2O形成的水合物晶体.俗称“可燃冰”。为开采深海海底的“可燃冰’,有科学家提出用以CO2换CH4的设想。已知下图中笼状结构的空腔直径为0.586 nm.结合图表从物质结构及性质的角度分析,该设想的依据是___________。
18.惰性气体以性质稳定著称,但随着科学的发展,科学家们合成了一些氙的化合物。根据所学知识回答下列问题:
(1) Xe原子的核外电子排布式为________。稀有气体中只有氙能合成出多种化合物,其原因可能是_____ (填序号)。
A.氙含量比较丰富 B.氙原子半径大,电离能小 C.氙原子半径小,电离能大
(2) 研究报告指出:“关于XePtF6的化合价有[]、[]两种可能,经证实XePtF6不溶于CC14等非极性溶剂。”据此可确定Xe[PtF6]中化学键类型为_____________。
(3)金属Pt采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是__________ (填序号)。
(4)已知与铯同主族的前四周期(包括第四周期)的三种元素X、Y、Z的电离能如下表:
元素代号 X Y Z
第一电离能(kJ.mol-1) 520 496 419
那么三种元素X、Y、Z的元素符号分别为__________,形成其单质晶体的化学键类型是____________。
(5)氟元素与碘元素同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,两者分子中的中心原子Be和O的杂化方式分别是___________、__________________。
(6)与碘同主族的氯具有较高的活泼性,能够形成大量的含氯化合物,如金属氯化物、非金属氯化物等。BC13是一种非金属氯化物,该物质分子中B-Cl键的键角为_____________。
19.能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,基态镍原子M层上的未成对电子数为_______。
(2)大阪大学近日宣布,有机太阳能固体电池效率突破5.3%,而高纯度C60是其“秘密武器”。C60的结构如图1,分子中碳原子轨道的杂化类型为______;1 mol C60分子中π键的数目为________。
(3)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图2。该结构中,碳氮之间的共价键类型有_____(按原子轨道重叠方式填写共价键的类型),请在下图2中用箭头表示出配位键_____。
图1 图2 图3
(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As_____Se(填“>”、“<”或“=”)。
②硫化锌的晶胞中(结构如图3所示),硫离子的配位数是_____。
③二氧化硒分子的空间构型为______________。
④砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为__________。
20.现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
⑴请写出:D基态原子的价层电子排图: ______ ;F 基态原子的外围电子排布式: ______ .
⑵下列说法错误的是 ______ .
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.电负性顺序:B < C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O > H2S,水分子更稳定的原因是水分子间存在氢键
⑶F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点,向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成(F(X)4)2+,该离子的结构式为 ______ 用元素符号表示.
⑷某化合物与F(I)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有 ______ .
⑸B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为 ______ .
⑹D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率 ______ .
21.金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)铝原子核外电子云有___种不同的伸展方向,有___种不同运动状态的电子。
(2)镓(Ga)与铝同族。写出镓的氯化物和氨水反应的化学方程式___。
(3)硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成氧化物形式___。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式为___。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为___。
(4)用铝和金属氧化物反应制备金属单质是工业上常用的方法。如:2Al+4BaO3Ba↑+BaO Al2O3。常温下Al的金属性比Ba的金属性___(选填“强”“弱”)。利用上述方法可制取Ba的主要原因是___。
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaO Al2O3比Al2O3稳定 d.Ba的沸点比Al的低
22.周期表前四周期的元素a、b、c、d、e,f原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的外围电子排布式为3d64s2,f的最外层只有一个电子,但次外层有18个电子.回答下列问题:
(1)a、d、e、f各元素分别是_________、_______、_______、_______。
(2)b、c、d中第一电离能由大到小的顺序是:_______________(填元素符号),f的价层电子轨道示意图为_________________________________,f的焰色反应为亮绿色,请用原子结构的知识解释原因___________________,预测电离能I4(e)_______I4(f)的大小(填大于、小于、等于)。
(3)a和b、c、d形成的二元共价化合物有很多种,其中有一分子呈三角锥形,该分子的中心原子的杂化方式为__________;
(4)f2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[f(NH3)4]2+中存在的化学键类型有________(填序号)。
A.配位键B.极性共价键C.非极性共价键D.离子键
②写出[f(NH3)4]2+的结构式____________。(只标出配位键)
23.按要求回答下列问题。
(1)2019年,我国青年化学家雷晓光被遴选为“青年化学家元素周期表”氮元素的代言人。氮元素在周期表中的位置是________,N2的电子式是________,化合物Si3N4中N的化合价是_______价。
(2)2020年6月23日,长征系列运载大箭将北斗三号“收官之星”成功送入太空。火箭燃料燃烧的化学方程式为:2N2H4+N2O4=3N2+4H20。该反应中氧化剂与还原剂的物质的量之比为______,将封装有NO2和NO混合气体的圆底烧瓶浸入热水中,气体混合物颜色变_______(填“深”或“浅”)。
(3)我国拥有自主知识产权的铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第5周期IA族元素。Rb元素原子的失电子能力______填(“强”或“弱”)于K,请用原子结构的知识解释其原因:______。
24.A+、B+、C–、D、E五种粒子(分子和离子)中,每个粒子均有10个电子。已知:①A++C–=E+D②B++C–=2D
(1)C–离子的电子式是_________
(2)具有相同空间构型的粒子______和______,E分子的空间构型为_________,_______性分子。
(3)分别写出A+和D反应、B+和E反应的离子方程式_____________、_____________。
参考答案:
1.B
【详解】
A.价层电子对数为,为杂化;价层电子对数为,为杂化,故A错误;
B.价层电子对数为,为杂化;价层电子对数为,为杂化,故B正确;
C.价层电子对数为,为杂化;价层电子对数为,为杂化,故C错误;
D.与中每个碳原子连接的原子个数分别为2、3,每个C原子分别形成2个键、2个键和3个键、1个键,C原子杂化类型分别为杂化、杂化,故D错误;
故选B。
2.A
【详解】
A.水很稳定,是因为水分子内H、O原子间的共价键键能大,与水分子间的氢键无关,A不正确;
B.乳酸()分子中,与-OH相连的碳原子,分别连有-CH3、-OH、-H、-COOH,所以此碳原子为手性碳原子,B正确;
C.碘、甲烷、四氯化碳都为非极性分子,非极性分子组成的溶质易溶于非极性分子组成的溶剂,可用“相似相溶”原理解释,C正确;
D.在含氧酸分子中,非羟基氧原子数越多,酸性越强,H3PO4中非羟基氧原子数为1,H3BO3中非羟基氧原子数为0,所以H3PO4()酸性强于H3BO3(),D正确;
故选A。
3.D
【详解】
A.氮化碳为网状结构,硬度超过金刚石晶体,则氮化碳晶体为共价晶体,A项正确;
B.每个C和4个N形成共价键,每个N与3个C相连,所以氮化碳的化学式为,B项正确;
C.C、N原子均采取杂化,C项正确;
D.1mol氮化碳中含有12molN—C键,D项错误;
故选D。
4.B
【详解】
A.由上述分析可知,X为H元素,Y为C元素,Z为N元素,则电负性:N>C>H,A错误;
B.H原子核外有1个电子层,而C、N原子核外均有2个电子层,电子层数越多,半径越大,电子层数相同,核电荷数越大,半径越小,则原子半径:C>N>H,B正确;
C.分子中N原子均形成共价单键,为sp3杂化,C错误;
D.C元素的最高价氧化物的水化物为H2CO3,H2CO3为弱酸,D错误;
答案选B。
5.C
【详解】
A.钛是22号元素,根据构造原理知其基态原子核外电子排布式为1s22s22p63s23p63d24s2,则其基态原子的价电子排布式为3d24s2,故A错误;
B.Cl-结构示意图为,故B错误;
C.MgCl2是离子化合物,其电子式为:,故C正确;
D.TiCl4熔、沸点低,可溶于苯和CCl4,由此可判断TiCl4是由共价键结合形成的分子,晶体类型为分子晶体,故D错误;
答案选C。
6.A
【详解】
A. 分子中两个氮原子采用sp3杂化,是三角锥形结构,该分子中所有原子不可能在同一平面,故A错误;
B. 有机物含有1个C-H、1个C=C、1个C=N、2个C=O、3个N-H、4个C-N、1个C-F、2个C-C键,其中双键含有1个σ键、1个π键,该分子中σ键与π键数目之比为15∶4,故B正确;
C. 同周期元素从左到右元素的电负性增强,则该分子中N、O、F的电负性的大小顺序为F>O>N,故C正确;
D. C=C键的键长短,作用力大,该分子中C=C键的键能大于C-C键的键能,故D正确;
故选A。
7.B
【详解】
①石墨时混合型晶体,石墨层中碳原子靠共价键链接,层与层之间靠范德华力维系,①正确;
②石墨是混合型晶体,②正确;
③石墨中的碳原子与相邻的三个碳原子以σ键结合,形成平面正六边形结构,碳原子的杂化类型为sp2杂化,③正确;
④石墨中的共价键键长比金刚石中共价键键长短,具有的能量更多,所以石墨的熔点比金刚石的高,④错误;
⑤石墨中,一个碳原子上有3个单键,每个单键被2个碳原子共用,所以平均每个碳原子对应1.5个单键,故石墨中碳原子个数和C C键个数之比为2:3,⑤错误;
⑥石墨质软,金刚石的硬度大,⑥错误;
⑦石墨的导电性只能沿石墨平面的方向,⑦正确;
综上所述,正确的有①②③⑦,B项符合题意。
8.B
【详解】
A.离子半径比较,先看电子层数,同层原子序数小对应离子半径大,则离子半径:Z >W>Y>X,故A错误;
B.单质非金属性越强阴离子还原性越弱,还原性:Z>W,故B正确;
C.非金属性越强电负性越强,则电负性:W > Z,故C错误;
D.H2S与HCl原子数不同,不是等电子体,故D错误;
故选B。
9.B
【详解】
A. 胆矾晶体中离子不能自由移动,不导电,但溶于水能导电,胆矾为纯净物属于电解质,故A正确;
B. 胆矾晶体中存在离子键、极性键、氢键等作用力,氢键不属于化学键,故B错误;
C. “熬之则成胆矾”是浓缩结晶,析出晶体的过程,故C正确;
D. 钾原子半径最大,核对最外层电子的作用力小,易失去最外层的电子,铜所在周期第一电离能最小和电负性最小的元素都是钾,故D正确;
故选B。
10.D
【详解】
A.由题给结构可知,高温高压并有催化剂存在时,石墨转化得到的物质B为金刚石。键长金刚石>石墨,则键能金刚石<石墨,键能越大,键越牢固,物质越稳定,石墨温度,A项正确;
B.石墨和金刚石互为同素异形体,石墨转化为金刚石的过程涉及旧化学键的断裂和新化学键的形成,是化学变化,B项正确;
C.金刚石的结构是共价键三维骨架结构,属于共价晶体,其硬度比石墨的大,C项正确;
D.石墨中的C采取杂化,键角是120°,金刚石中的C采取杂化,键角是,D项错误。
答案选D。
11.C
【详解】
A. 铁原子失去4s能级上的2个电子,二价铁离子的基态电子排布式为,故A正确;
B. 图1中氮原子的上下左右前后各有1个铁原子,氮原子的配位数为6,故B正确;
C. 晶胞中Fe原子个数:6×=3,Cu:8×=1,N:1, 更稳定的Cu替代型产物的化学式为,故C错误;
D.由图1将顶点置于体心,即当a位置的Fe位于体心时,b位置的Fe位于棱心,故D正确;
故选C。
12.C
【详解】
如图结构所示,将左边结构补全会形成两个环,被两个环共用的氧原子左边有7个,右边有7个共14个,独立成个体的氧原子共有10个(上边有5个,下边有5个),同时每个环都有独立的硅原子,则Si:O=(4+4×0.5):(14×0.5+10)=6:17,这样,每个环所包含的 O 有 17个硅有6个,再根据Si+4,O-2 的化合价,其结构式的通式为(Si6O17),C正确;答案为C。
13.AC
【详解】
A.苯分子中每个碳原子的未参加杂化的2p轨道用来形成大键,每个碳原子都以杂化轨道形成α键,A错误;
B. 和均是V形结构,因此都是由极性键形成的极性分子,B正确;
C. 配离子(En是乙二胺的简写)中的配位原子是N原子,配位数是4,C错误;
D. 中的孤对电子数为2对,比的多,因此的键角比的键角小,D正确;答案选AC。
14.BD
【详解】
A.由模型可知,1,3,5,6代表氧原子,2,4代表B原子,可知Xm-是[H4B4O9]m-,依据化合价H为+1,B为+3,O为-2,可得m=2,则Xm-的化学式为:[H4B4O9]2-,故A错误;
B.2号B形成3个键,价层电子对数为3,则B原子为sp2杂化,B一般是形成3个键,4号B形成4个键,其中1个键是配位键,配位键存在4号与5号之间,4号B形成4个键,价层电子对数为4,则B原子为sp3杂化,故B正确;
C.B原子含有空轨道、O原子含有孤电子对,4、5(或5、4)原子之间存在配位键,故C错误;
D.硼砂晶体中有共价键、配位键和离子键三种化学键,故D正确;
答案选BD。
15.BD
【详解】
A.镍元素的核电荷数为28,失去2个电子形成镍离子,则基态Ni2+的电子排布式为1s22s22p63s23p63d8,故A正确;
B.由丁二酮肟分子结构可知,分子中有的碳原子形成1个双键和2个单键,碳原子的杂化方式为sp2杂化,还有的碳原子全部是单键,碳原子的杂化方式为sp3杂化,故B错误;
C.由二(丁二酮肟)合镍(II)的结构可知,配合物中含有4个配位键、4个双键和24个单键,共32个σ键,故C正确;
D.由二(丁二酮肟)合镍(II)的结构可知,配合物的中心原子为镍离子,配位数为4,配位体为2个丁二酮肟,故D错误;
故选BD。
16.CD
【详解】
A.基态Na+有10个核外电子,所以存在10种运动状态,A正确;
B.S2O的结构可以看做硫酸根中的一个氧原子被硫取代,结构和硫酸根类似,中心硫原子的孤电子对数为0,价层电子对数为4,所以空间结构为四面体形,中心原子S的杂化方式为sp3,B正确;
C.Na3[Ag(S2O3)2]中银离子与S2O形成配位键,无单独的银离子,不能用NaCl标准溶液滴定Ag+,C错误;
D.氯化钠晶体中每个Na+周围有6个Cl-,每个Cl-周围有6个Na+,NaBr的晶体结构与NaCl晶体相似,则每个Br-周围有6个Na+,D错误;
故选:CD。
17. LiCoO2 CH3OH+COCH3COOH 14 SO3 CO2的分子直径小于笼状空腔直径,且CO2与H2O的结合能大于CH4与H2O的结合能
【详解】
(1)由锂钴复合氧化物晶体的结构可知,Li离子在晶胞中6个位于中棱、4个位于上下棱、1个位于体内、2个位于测面心,Li离子个数为:6×1/3+4×1/4+1+2×1/2=5个, Co离子在晶胞中12个位于顶点、4个位于上下面心、4个位于上下棱,Co离子个数为:12×1/6+4×1/2+4×1/4=5个,O离子在晶胞中18个位于中棱、2个位于体内、4个位于测面心,Li离子个数为:18×1/3+2+4×1/2=10个, Li离子、Co离子和O离子个数比为5:5:10=1:1:2,化学式为LiCoO2,故答案为LiCoO2;
(2)由图可知右边下面进去1mol的水,而上面又出来1mol的水,所以实际反应的是甲醇;左边上面进去1mol的水,而下面又出来1mol的水,参与反应的是一氧化碳,而生成的醋酸,所以总反应的方程式为:CO+CH3OHCH3COOH,故答案为CO+CH3OHCH3COOH;
(3)Co是27号元素,核外电子数为27,其核外电子排布式为:1s22s22p63s23p63d74s2,价电子排布式为3d74s2,则其价电子排布图为:,故答案为;
(4)CH3COCo(CO)4配位化合物中,中心原子Co与配体形成5个δ键,CH3CO中有5个δ键,4个CO中共有4个δ键,共有14个个δ键;CO32—的原子个数为3、价电子数为24,则与其具有相同原子个数和价电子数的等电子体分子为SO3,故答案为SO3;
(5) 由表格可知:二氧化碳的分子直径小于笼状结构的空腔直径,即0.512<0.586,能顺利进入笼状空腔内,且二氧化碳与水的结合能力强于甲烷,即29.91>16.40,故答案为CO2的分子直径小于笼状空腔直径,且与H2O的结合能大于CH4。
18. [Kr]4d105s25p6 B 离子键、配位键 C Li、Na、K 金属键 sp sp3 120°
【详解】
(1)X位于第五周期的sp区,处于全满稳定状态,核外电子排布式为[Kr]4d105s25p6;氙原子半径大,电离能越小,越容易失去电子,化学性质越活泼,A、氙为稀有气体,含量比较少,A错误;B、氙原子半径大,电离能小,B正确;C、氙在稀有气体中原子半径较大,电离能较小,C错误,答案选B;(2)根据相似相溶原理,XePtF6不溶于CCl4等非极性溶剂,XePtF6具有较强的极性,其化学键类型为离子键和配位键;(3)金属Pt采用“…ABCABC…”型堆积方式,为立方面心结构,因此选C;(4)由铯的最外层电子排布式为6s1可知X、Y、Z为第ⅠA族,而ⅠA族前四周期的元素分别为H、Li、Na、K,又由提供的X、Y的第一电离能的差值与Y、Z的第一电离能的差值相差不大可知,X、Y、Z不可能有H元素,而同主族元素随着电子层数的增加,第一电离能逐渐减小,故X、Y、Z分别为Li、Na、K;都是金属单质,微粒均以金属键结合;(5)BeF2分子内中心原子为Be,其价电子数为2,F提供2个电子,所以Be原子的价层电子对数为(2+2)/2=2,Be原子的杂化类型为sp杂化;H2O分子的中心原子为O,其价电子数为6,H提供2个电子,所以O原子的价层电子对数为(6+2)/2=4,O原子杂化类型为sp3;(6)硼原子价电子数为3,Cl提供3个电子,硼原子的价层电子对数为(3+3)/2=3,因价层电子对中没有孤对电子,故BCl3为平面正三角形结构,分子中B-Cl键的键角为120°。
19. 2 sp2 30NA σ键、π键 > 4 折线型 (CH3)3Ga+AsH3GaAs+3CH4
【详解】
(1)基态Ni原子核外电子排布式为1s22s22p63s23p63d84s2,3d轨道有2个单电子,因此,本题正确答案是:2;
(2)每个C原子成3个σ键、没有孤电子对,杂化轨道数目为3,所以C原子采用sp2杂化;每个碳原子含有的π键个数为1/2,所以1molC60分子中π键的数目=1×60×1/2×NA =30NA因此,本题正确答案是: sp2;30NA;
(3)C、N原子之间形成双键、单键,单键为σ键,双键含有1个σ键、1个π键;配位键由提供孤电子对的原子指向提供空轨道的原子,所以该配合物中的配位键为: ,因此,本题正确答案是: σ键、π键;
(3)①As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,As原子4p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于Se,所以第一电离能 ,因此,本题正确答案是:>;②由晶胞结构可以知道,每个硫离子连接4个锌离子,所其配位数是4,因此,本题正确答案是:4;③二氧化硒分子中Se原子价层电子对=2+(6-2×2)/2=3,且含有一个孤电子对,所以其空间结构为V形;因此,本题正确答案是:V形;④砷化镓可由(CH3)3Ga 和AsH3在700℃下反应制得,由元素守恒可以知道还生成甲烷,反应方程式为: (CH3)3Ga+AsH3GaAs+3CH4因此,本题正确答案是: (CH3)3Ga+AsH3 GaAs+3CH4
20. 3d104s1 AD sp2、sp3 8
【详解】
⑴D为O元素,基态原子的价层电子排布图:;F为Cu元素,基态原子的外围电子排布式为:3d104s1;故答案为:;3d104s1。
⑵A选项,沸点:SiO2 > CO2,是由于二氧化硅属于原子晶体,二氧化碳形成分子晶体,故A错误;B选项,同周期随原子序数增大电负性增大,故电负性顺序:C < N < O,故B正确;C选项,N2与CO分子都含有2个原子、价电子总数都是10,二者为等电子体,结构相似,故C正确;D选项,稳定性:H2O > H2S,是因为非金属性O > S,与分子之间存在氢键无关,故D错误;综上所述,答案为:AD。
⑶C与A形成的气体X,则A为H元素,X为NH3,F的硫酸盐为CuSO4,向CuSO4溶液中通入过量的NH3可生成[Cu(NH3)4]2+,该离子的结构式为:,故答案为:。
⑷杂环上的碳原子含有3个δ键,没有孤对电子,采用sp2杂化,亚甲基上碳原子含有4个共价单键,采用sp3杂化,故答案为:sp2、sp3。
⑸由B单质的一种同素异形体的晶胞结构可知,B原子有4个位于晶胞内部,其余B原子位于定点、面心,则一个晶胞中所含B原子数为,故答案为:8。
⑹O与Cu形成离子个数比为1:1的化合物为CuO,晶胞与NaCl类似,其晶胞结构为,晶胞中铜离子数目阳离子数目,O2-离子的半径为apm,Cu2+离子的半径bpm,则晶胞中原子总体积,晶胞棱长,故晶胞体积,故该晶胞的空间利用率,故答案为:。
21. 4 13 GaCl3+3NH3·H2O=3NH4Cl+Ga(OH)3↓ Na2O·CaO·6SiO2 SiO2+2NaOH= Na2SiO3+H2O CaAl2Si2O8 弱 d
【详解】
(1)铝原子的电子排布为1s22s22p63s22p1,13个电子的运动状态各不相同,其中包含s能级的1种轨道和p能级的3种轨道,一共四种轨道,即有4个不同的伸展方向;
(2)类比氯化铝与氨水的反应,可知镓的氯化物和氨水反应的化学方程式为GaCl3+3NH3·H2O=3NH4Cl+Ga(OH)3↓;
(3)Na2CaSi6O14写成氧化物形式为Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,是因为氢氧化钠与玻璃中的二氧化硅反应:SiO2+2NaOH=Na2SiO3+H2O。由钠长石化学式NaAlSi3O8可知,O原子的物质的量分数为。根据不同类长石其氧原子的物质的量分数相同,则一分子钙长石含有13个原子,其中O为8,假设钙、铝、硅的原子个数分别为x、y、z,则x+y+z=5,根据化合物中化合价代数和为0可知,x+3y+4z=16,联立方程可得,x=1、y=2、z=2,钙长石的化学式为CaAl2Si2O8;
(4)根据元素周期律可知,常温下Al的金属性比Ba弱,利用2Al+4BaO3Ba↑+BaO Al2O3可制取Ba,是利用Ba的沸点比Al低,高温时Ba转化为气体逸出,使反应正向进行。
22. H S Fe Cu N>O>S 电子从高能级跃迁回低能级,以光的形式释放能量 大于 sp3 AB 。
【详解】
(1) 根据分析,a、d、e、f各元素分别为H、S、Fe、Cu,故答案为:H、S、Fe、Cu。
(2) 同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,同一主族元素中,元素第一电离能随着原子序数增大而减小,N元素第一电离能最大,O元素大于S元素的第一电离能,所以b、c、d元素第一电离能由大到小的顺序为N>O>S,f的价层电子为3d、4s电子,其价层电子排布图为,当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子,激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量,e是Fe,f是Cu,Cu失去一个电子后形成全满稳定结构,而Fe失去一个电子后不稳定结构,因此Fe大于Cu,故答案为:N>O>S,,电子从高能级跃迁回低能级,以光的形式释放能量,大于。
(3)a是H,b是N,c是O,d是S,a与其他元素形成的二元共价化合物中,一种化合物分子成三角锥形,该分子式为NH3,N原子上1对孤对电子,形成3个N-H键,中心原子的杂化方式为sp3杂化。
(4)①f是Cu,[Cu (NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,故答案为AB。
(5) [Cu (NH3)4]2+的结构式为,故答案为。
23. 第2周期VA族 -3 1:2 深 强 K和Rb是上下相邻的同主族元素,Rb的原子半径大于K,原子核对最外层电子的吸引作用小于K,所以其原子的失电子能力强于K
【详解】
(1)氮原子序数为7,电子分两层排布,最外层5个电子,在周期表中的位置是第2周期VA族,2个氮原子间通过共用3对电子对形成分子,故N2的电子式是,硅的非金属性比氮弱,化合价是+4价,故化合物Si3N4中N的化合价-3价;
(2)反应:2N2H4+N2O4=3N2+4H2O中,N2O4中氮元素化合价降低,氧化剂为N2O4、N2H4中氮元素化合价升高,还原剂为N2H4,氧化剂与还原剂的物质的量之比为1:2,将封装有NO2和NO混合气体的圆底烧瓶浸入热水中,2NO2 N2O4向逆反应方向移动,红棕色NO2浓度增大,混合物颜色变深;
(3)Rb元素原子的失电子能力大于K,K和Rb是上下相邻的同主族元素,Rb的原子半径大于K,原子核对最外层电子的吸引作用小于K,所以其原子的失电子能力强于K。
24. NH3 H3O+ 三角锥形 极性 NH4+ + H2ONH3 H2O + H+ NH3 + H3O+ = NH4+ + H2O
【详解】
(1)OH-离子的电子式是,故答案为:。
(2)具有相同空间构型的粒子NH3和H3O+,都为三角锥形,E分子的空间构型为三角锥形,空间不对称,为极性分子;故答案为:NH3;H3O+;三角锥形;极性。
(3) A+和D水解反应生成一水合氨和氢离子、B+和E反应生成铵根和水,其离子方程式分别为NH4+ + H2ONH3 H2O + H+,E、D为NH3 + H3O+ = NH4+ + H2O;故答案为:NH4+ + H2ONH3 H2O + H+;E、D为NH3 + H3O+ = NH4+ + H2O。
