2.3分子结构与物质的性质—基础训练(word版 含解析)
文档属性
| 名称 | 2.3分子结构与物质的性质—基础训练(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 390.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-25 17:35:54 | ||
图片预览




文档简介
2.3分子结构与物质的性质
一、选择题(共16题)
1.下列有关范德华力的叙述正确的是
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B.范德华力与化学键的区别是作用力的强弱不同
C.任何分子间在任意情况下都会产生范德华力
D.范德华力非常微弱,故破坏范德华力不需要消耗能量
2.下列说法中不正确的是
A.键比键的电子云重叠程度大,形成的共价键强
B. 键与键的电子云形状对称性相同
C.丙烯分子有8个键1个键
D.分子中有一个键,2个键;中4个键的键能不相同
3.CH4、NH3和N2H4均可作为燃料电池的燃料。下列说法错误的是
A.CH4、NH3和N2H4中C、N杂化方式均相同
B.CH4和NH3的空间结构分别为正四面体形、三角锥形
C.CH4、NH3和N2H4均为极性分子
D.沸点:N2H4>NH3>CH4
4.下列说法错误的是
A.两个原子之间最多能形成1个键
B.HF、HCl、HBr、HI的沸点逐渐升高
C.是一种含极性键和非极性键的极性分子
D.气体单质分子中不一定有键和键
5.下列有关N、P及其化合物的说法错误的是
A.N的电负性比P的大,可推断NCl3分子的极性比PCl3的大
B.N与N的π键比P与P的强,可推断N≡N的稳定性比P≡P的高
C.NH3的成键电子对间排斥力较大,可推断NH3的键角比PH3的大
D.HNO3的分子间作用力较小,可推断HNO3的熔点比H3PO4的低
6.已知为共价化合物,两个键间的夹角为180°,则属于
A.由极性键构成的极性分子
B.由极性键构成的非极性分子
C.由非极性键构成的极性分子
D.由非极性键构成的非极性分子
7.下列关于范德华力的叙述中,正确的是( )
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊化学键
B.任何分子间在任意情况下都会产生范德华力
C.范德华力与化学键的区别是作用力的强弱问题
D.范德华力非常微弱,故破坏范德华力不需要消耗能量
8.“冰面为什么滑?”,这与冰层表面的结构有关,下列有关说法正确的是
A.由于氢键的存在,水分子的稳定性好,高温下也很难分解
B.第一层固态冰中,水分子间通过共价键形成空间网状结构
C.第二层“准液体”中,水分子间形成共价键机会减少,形成氢键的机会增加
D.当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流动性的水分子”,使冰面变滑
9.现有4种短周期元素W、X、Y和Z,原子序数依次增大,W、Y可形成两种常见液态化合物,其最简式分别为WY和W2Y;X的最低价氢化物与它的最高价氧化物对应水化物能反应;Z是地壳中最多的金属元素。下列说法正确的是
A.W、X与Y只能形成共价化合物
B.第四周期且与Y同主族的单质可用作制造半导体材料。
C.工业上常用W单质冶炼获取金属Z
D.X的最低价氢化物沸点比同主族其它元素最低价气态氢化物沸点低
10.下列说法正确的是
A.非极性分子中的原子上一定不含孤电子对
B.平面三角形分子一定是非极性分子
C.二氯甲烷(CH2Cl2)分子的中心原子采取sp3杂化,键角均为109°28′
D.ABn型分子的中心原子最外层满足8电子结构,则ABn不一定是非极性分子
11.X、Y、Z、W是四种原子半径依次增大的短周期主族元素,Z的最高正价与最低负价的绝对值之差为6,Y的最外层电子数等于K层电子数的3倍,四种元素的原子序数之和为45。下列说法正确的是
A.Z2Y中各原子均满足8电子结构 B.简单氢化物的沸点:X>Y>Z
C.离子半径:W>Z>Y>X D.Y、Z、W三种元素仅能形成一种盐
12.下列现象与化学键有关的是( )
A.F2、Cl2、Br2、I2的熔点依次升高
B.H2O的沸点远高于H2S的沸点
C.H2O在高温下难分解
D.干冰升华
13.六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但扩散到空气中会引起温室效应。下列有关六氟化硫的推测正确的是
A.六氟化硫易燃烧生成二氧化硫
B.六氟化硫的空间结构说明分子世界的丰富多彩
C.六氟化硫分子中的都是σ键,且键长、键能都相等
D.六氟化硫分子中既含有极性键又含有非极性键
14.关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键
B.冰、水中都存在氢键
C.分子间形成的氢键使物质的熔点和沸点升高
D.H2O是一种非常稳定的化合物,这是由于氢键所致
15.近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe、Sm、As、F、O组成的化合物。下列说法正确的是
A.元素As与N同族可预测AsH3分子中As-H键的键角小于NH3中N-H键的键角
B.NH3的水溶液中存在四种不同的氢键,其中根据氨水显碱性可以推测NH3和H2O存在的主要氢键形式可能为:(NH3)N…H-O(H2O)
C.配合物Fe(CO)n可用作催化剂,Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=4
D.每个H2O分子最多可与两个H2O分子形成两个氢键
16.g—C3N4晶体中存在的微粒间作用力有
A.非极性键 B.金属键 C.π键 D.范德华力
二、综合题
17.二氧化氯(ClO2)是国际公认高效、安全的杀菌、保鲜剂,是氯制剂的理想替代品。工业上制备ClO2的方法很多,NaClO3和NaClO2是制取ClO2的常见原料。
完成下列填空:
(1)以下反应是制备ClO2的一种方法:H2C2O4+ 2 NaClO3+ H2SO4 = Na2SO4+ 2 CO2↑ + 2 ClO2↑ + 2 H2O,上述反应物中属于第三周期的元素的原子半径大小顺序是__________;其中原子半径最大元素的原子,其核外有___________种不同能量的电子。
(2)ClO2的分子构型为“V”形,则ClO2是______________(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气__________(选填“大”、“小”、“一样”)。
(3)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2的___________倍(保留2位小数)。
(4)若以NaClO2为原料制取ClO2,需要加入具有________(填“氧化”、“还原”)性的物质。
(5)工业上将氯碱工业和制取NaClO3联合进行。研究发现,电解时,不同反应环境下的总反应分别为:
4 NaCl + 18 H2O =4 NaClO3+ 3 O2↑+ 18 H2↑(中性环境)
NaCl + 3 H2O = NaClO3+ 3 H2↑(微酸性环境)
①电解时,氢气在__________极产生。
②更有利于工业生产NaClO3的反应环境是___________,理由__________________。
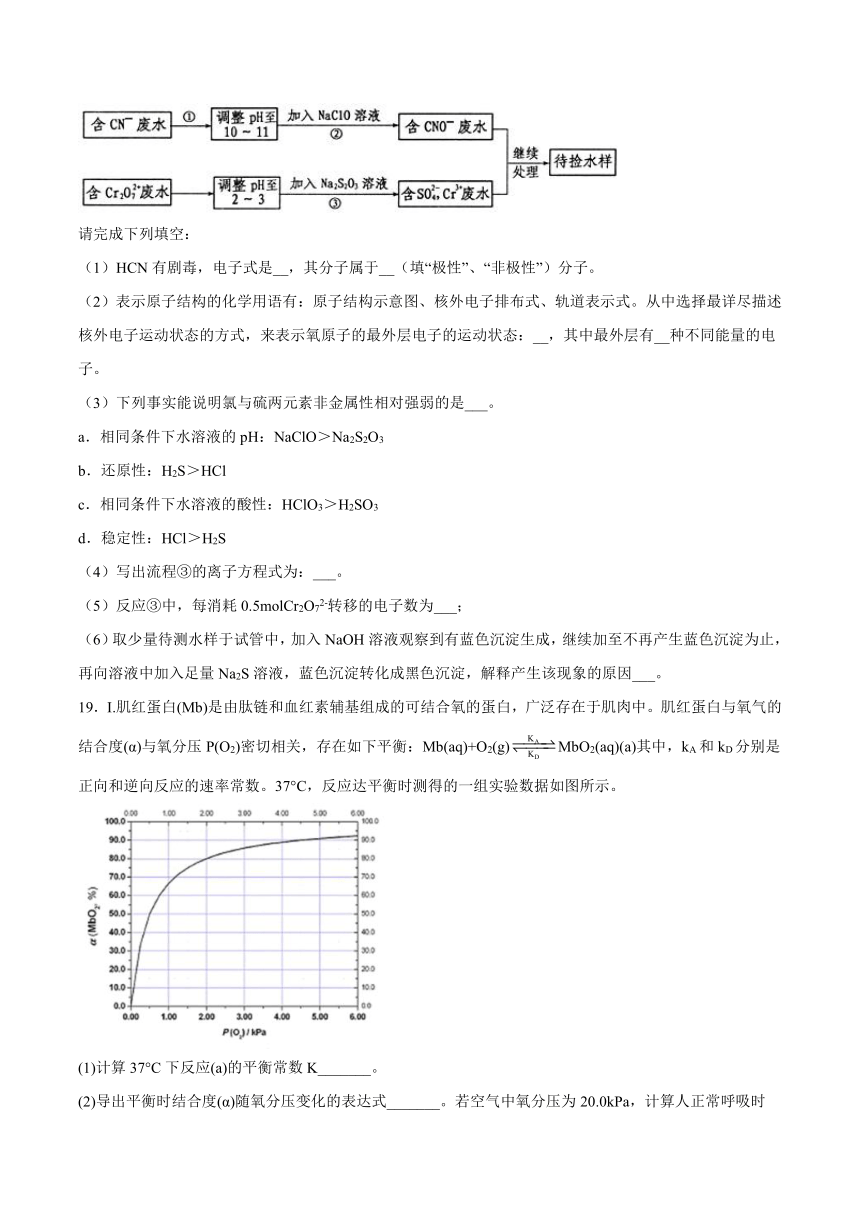
18.某电镀铜厂有两种废水,分别含有CN-和Cr2O72-等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
请完成下列填空:
(1)HCN有剧毒,电子式是__,其分子属于__(填“极性”、“非极性”)分子。
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式。从中选择最详尽描述核外电子运动状态的方式,来表示氧原子的最外层电子的运动状态:__,其中最外层有__种不同能量的电子。
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是___。
a.相同条件下水溶液的pH:NaClO>Na2S2O3
b.还原性:H2S>HCl
c.相同条件下水溶液的酸性:HClO3>H2SO3
d.稳定性:HCl>H2S
(4)写出流程③的离子方程式为:___。
(5)反应③中,每消耗0.5molCr2O72-转移的电子数为___;
(6)取少量待测水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,解释产生该现象的原因___。
19.I.肌红蛋白(Mb)是由肽链和血红素辅基组成的可结合氧的蛋白,广泛存在于肌肉中。肌红蛋白与氧气的结合度(α)与氧分压P(O2)密切相关,存在如下平衡:Mb(aq)+O2(g)MbO2(aq)(a)其中,kA和kD分别是正向和逆向反应的速率常数。37°C,反应达平衡时测得的一组实验数据如图所示。
(1)计算37°C下反应(a)的平衡常数K_______。
(2)导出平衡时结合度(α)随氧分压变化的表达式_______。若空气中氧分压为20.0kPa,计算人正常呼吸时Mb与氧气的最大结合度_______。
(3)研究发现,正向反应速率v正=kA(Mb)P(O2);逆向反应速率v逆=kD(MbO2)。已知kD=60s-1,计算速率常数kA=_______。当保持氧分压为20.0kPa,计算结合度达50%所需时间_______。(提示:对于v逆=kD(MbO2),MbO2分解50%所需时间为t=0.693/kD)
II.Mb含有一个Fe(II),呈顺磁性,与O2结合后形成的MbO2是抗磁性的。MbO2中的铁周围的配位场可近似为八面体场。
(4)这一过程中Fe(II)的价态是否发生改变_______,简述原因_______。
(5)写出MbO2中铁离子在八面体场中的价电子排布_______。
(6)结合O2前后铁离子的半径是不变、变大还是变小_______,简述原因_______。
(7)O2分子呈顺磁性,它与Mb结合后,价电子排布是否发生变化___,简述原因____。
20.某烟道气的主要成分是CO2,并含有少量硫氧化物、氮氧化物等杂质。其中的硫元素可在高温下通过CH4的作用回收,主要反应如下:2SO2(g)+CH4(g) CO2(g)+2H2O(g)+S2(g)+Q(Q>0)
(1)以mol/(L min)为单位,SO2的反应速率是S2生成速率的_________倍。
(2)恒容条件下,不能说明该反应已经达到平衡状态的是_______(选填编号)
a.混合气体中水蒸气含量不再变化
b.混合气体密度不发生变化
c.容器内压强不再变化
d.混合物平均相对分子质量不再变化
达到平衡后升高体系温度,则平衡常数K_________(填“增大”、“减小”、或“不变”)。
(3)请在下式中标出上述反应中电子转移的方向和数目:_____
2SO2(g)+CH4(g) …该反应的氧化产物是_________。SO2的主要性质除氧化性、漂白性外还有________性。
(4)该反应混合物中有两种极性分子,分别是______和_____;固态硫的分子式可能是S8,它与S2互为________。
(5)烟道气中的NO2也能与CH4反应并生成无害气体,完全转化3.0molNO2气体时,需要甲烷的物质的量为__________mol.
21.(1)NH3在水中的溶解度很大。下列说法与NH3的水溶性无关的是______(填标号)。
a.NH3和H2O都是极性分子
b.NH3在水中易形成氢键
c.NH3溶于水建立了平衡NH3+H2ONH3·H2ONH+OH-
d.NH3是一种易液化的气体
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是______(填“极性”或“非极性”)分子。
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4,Ni(CO)4呈正四面体形。Ni(CO)4易溶于下列物质中的______(填标号)。
a.水 b.CCl4 c.苯 d.NiSO4溶液
(4)甲醛、甲醇和甲酸等碳原子数较少的醛、醇和羧酸均易溶于水的原因是______。
22.(1)我国科学家最近成功合成了世界上首个五氮阴离子盐.经X射线衍射测得化合物R的晶体结构,其局部结构如图所示.图中虚线代表氢键其表示式为 … 、_______、_______。
(2)在低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_______,原因是_______。
23.(1)写出分子的空间结构:___________,它是___________分子(填“极性”或“非极性”),它的中心原子采用的杂化方式是___________。
(2)甲醛(HCHO)在Ni催化作用下加氢可得甲醇()。甲醇分子内C原子的杂化方式为___________,甲醇分子内O-C-H的键角___________(填“>”“<”或“=”)甲醛分子内O-C-H的键角;甲醇极易溶于水,其主要原因是___________。
24.已知N、P同属于元素周期表的第ⅤA族元素,N在第二周期,P在第三周期。NH3分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N-H键间的夹角是107°。
(1)PH3分子与NH3分子的空间结构______(填“相似”或“不相似”),P-H键______(填“有”或“无”)极性,PH3分子______(填“有”或“无”)极性。
(2)NH3与PH3相比,热稳定性更强的是______。
参考答案:
1.B
【详解】
A.范德华力的实质也是一种电性作用,但是范德华力是分子间较弱的作用力,它不是化学键,A错误;
B.化学键是微粒间的强烈的相互作用,范德华力是分子间较弱的作用力,所以范德华力与化学键的区别是作用力的强弱不同,B正确;
C.当分子间的距离足够远时,分子间没有范德华力,所以并不是任何分子间在任意情况下都会产生范德华力,C错误;
D.虽然范德华力非常微弱,但是破坏范德华力也要消耗能量,D错误;
答案选B。
2.D
【详解】
A.键是电子云“头碰头”的方式重叠,键是电子云“肩并肩”的方式重叠,键比键的电子云重叠程度大,形成的共价键强,A正确;
B.键与键都是轴对称的,所以键与键的电子云形状对称性相同,B正确;
C.丙烯分子有8个键,1个键,C正确;
D.分子的结构式为,有1个键,2个键,中4个键的键能完全相同,D错误;
故选D。
3.C
【详解】
A.CH4、NH3和N2H4中C、N都为sp3杂化,故杂化方式均相同,故A正确;
B.CH4的中心原子为sp3杂化,无孤对电子,为正四面体形,NH3的中心原子为sp3杂化,一个孤电子对,为三角锥形,故B正确;
C.CH4为正四面体形的对称结构,为非极性分子,故C错误;
D.因为N2H4、NH3都存在分子间氢键,故N2H4、NH3的沸点高于CH4,N2H4分子间氢键数目多于NH3,故N2H4沸点高于NH3,故沸点:N2H4>NH3>CH4,故D正确;
故选C。
4.B
【详解】
A.两个原子之间形成的第一条键为σ键,第二条开始为π键,则最多能形成l个σ键,A正确;
B.HCl、HBr、HI的沸点逐渐升高,而HF分子间存在氢键,其沸点高于HCl,B错误;
C.H2O2种存在H-O、O-O键,从结构上看,是二面角结构,正负电荷中心不能重合,是一种含极性键和非极性键的极性分子,C正确;
D.气体单质分子中不一定键和键,如He气体,为单原子分子,不存在化学键,D正确;
故选B。
5.A
【详解】
A.P和Cl的电负性差值比N和Cl的电负性差值大,因此PCl3分子的极性比NCl3分子极性大,A项错误;
B.N与N的键比P与P的强,故的稳定性比的高,B项正确;
C.N的电负性比P大,NH3中成键电子对距离N比PH3中成键电子对距离P近,NH3中成键电子对间的斥力大,因此NH3的键角比PH3的大,C项正确;
D.相对分子质量:HNO3故选A。
6.B
【详解】
中键是不同元素的原子形成的共价键,为极性键,两个键间的夹角为180°,说明分子是对称的,正电荷重心与负电荷重心重合,属于非极性分子,故是由极性键形成的非极性分子,故选:B。
7.C
【详解】
A. 范德华力的实质也是一种电性作用,但是范德华力是分子间较弱的作用力,它不是化学键,A错误;
B. 当分子间的距离足够远时,分子间没有范德华力,所以并不是任何分子间在任意情况下都会产生范德华力,B错误;
C. 化学键是微粒间的一种强烈的相互作用,而范德华力是分子间较弱的作用力,所以范德华力与化学键的区别是作用力的强弱问题,C正确;
D. 虽然范德华力非常微弱,但是破坏范德华力也要消耗能量,D错误;
故合理选项是C。
8.D
【详解】
A.水分子的稳定性好,是由水分子内氢氧共价键的键能决定的,与分子间形成的氢键无关,A错误;
B.分子间不存在共价键,应该是通过氢键形成空间网状结构,B错误;
C.分子间不存在共价键应该是氢键个数减少,C错误;
D.当温度达到一定数值时,“准液体”中的水分子与下层冰连接的氢键被破坏,使一部分水分子能够自由流动,从而产生“流动性的水分子”,造成冰面变滑,D正确;
故选D。
9.B
【详解】
A. W、X与Y既能形成共价化合物、又能形成离子化合物如硝酸铵等,A错误;
B. 第四周期且与Y同主族的单质为Se,位于金属与非金属分界线附近,则可用作制造半导体材料,B正确;
C. 工业上常用电解熔融的氧化铝冶炼获取金属Z(Al),C错误;
D.因为分子间存在氢键, X的最低价氢化物(NH3)沸点比同主族其它元素最低价气态氢化物沸点高,D错误;
答案选B。
10.D
【详解】
A.CH4、CCl4均为是非极性分子,CH4分子中的原子无孤电子对,CCl4分子中的氯原子含有孤电子对,A错误;
B.甲醛中心原子C上无孤电子对,价层电子对数为3,空间构型为平面三角形,碳原子位于三角形内部,结构不对称,所以为极性分子,B错误;
C.甲烷是正四面体,键角均为109°28′,二氯甲烷分子的构型是四面体,键角发生了变化,不等于109°28′,C错误;
D.NH3中心原子N最外层满足8电子结构,其为极性分子;中心原子最外层满足8电子结构的ABn型分子,若中心原子的化合价的绝对值等为于价电子数则一定是非极性分子 ,如CH4, D正确;
故选D。
11.A
【详解】
A.Cl2O分子中氯原子和氧原子均满足8电子结构,故A正确;
B.水分子间形成氢键的数目多于氟化氢,分子间的作用力强于氟化氢,沸点高于氟化氢,故B错误;
C.电子层结构相同的离子,随核电荷数的增大,离子半径依次减小,同主族元素从上到下,离子的离子半径依次增大,则四种元素形成的离子中钠离子的离子半径最小,故C错误;
D.钠元素、氯元素和氧元素形成的盐有次氯酸钠、亚氯酸钠、氯酸钠、高氯酸钠等,不止一种,故D错误;
故选A。
12.C
【详解】
A.F2、Cl2、Br2、I2的熔点依次升高与分子间作用力有关,故不选A;
B.H2O的沸点远高于H2S的沸点与水分子间易形成氢键有关,故不选B;
C.H2O在高温下难分解是因为O-H键的键能大,故选C;
D.干冰升华,二氧化碳分子没变,化学键不变,干冰升华与化学键无关,故不选D;
选C。
13.BC
【详解】
A.中S为+6价,不能和反应生成,故A项错误;
B.六氟化硫的空间结构是正八面体形,结合部分已知分子的空间结构,说明分子结构是多样的,故B项正确;
C.该分子中的都是单键,即均为σ键,则键长、键能都相等,故C项正确;
D.分子中只有极性键,故D项错误;
故答案为:BC。
14.BC
15.AB
【详解】
A.AsH3和NH3分子内,共用电子对均偏离氢原子,元素与同族,的电负性大于,N-H和As-H相比,两个键间的排斥力更大,中键角更大,因此分子中键的键角小于中键的键角,A正确;
B.由于NH3 H2O NH4++OH-,据此可以推测NH3和H2O存在的主要氢键形式可能为:(NH3)N…H-O(H2O),B正确;
C. 的价层电子排布为,价电子数为8,配合物一个配体提供2个电子,内中心原子价电子数与配体提供电子总数之和为18,因此,则,C错误;
D.冰中每个分子最多与周围四个水分子形成氢键,为四面体形结构,冰中,一个水分子平均可以形成 个氢键,D错误。
故选AB。
16.CD
【详解】
该晶体是一种近似石墨烯的平面二维片层结构,由题给示意图可知,故g—C3N4晶体中存在碳氮单键和和大π键,层间存在范德华力,不存在非极性键和金属键,故选CD。
17. Na > S > Cl 4 极性 大 2.63 氧化 阴极 微酸性环境 转移电子都生成氯酸钠,能量利用率高;水消耗少;不同时生成氢气和氧气,相对更安全
【详解】
(1)反应中属于第三周期的是Na、S、Cl,同一周期自左向右原子半径逐渐减小,所以原子半径由大到小的顺序为Na > S > Cl;钠原子的核外排布式为1s22s22p63s1,有4种不同能量的电子。
(2)ClO2的分子构型为“V”形,分子中正负电中心不重合,所以ClO2是极性分子;ClO2、H2O都是极性分子,Cl2是非极性分子,根据“相似相溶”的经验规律,ClO2在水中溶解度比氯气大。
(3)设质量都是m,ClO2消毒的效率是Cl2的=2.63倍。
(4)以NaClO2为原料制取ClO2,氯元素的化合价由+3价升至+4价,NaClO2被氧化,所以需加入氧化性物质。
(5)①电解时,H元素的化合价由+1价降至0价,氢离子得电子生成氢气,所以H2在阴极产生;
②对比两个反应方程式可知,更有利于工业生产NaClO3的反应环境是微酸性环境,理由是:微酸性环境中,转移电子都生成氯酸钠,能量利用率高;水消耗少;不同时生成氢气和氧气,相对更安全。
18. 极性 2 bd 3S2O32-+4Cr2O72-+26H+→6SO42-+8Cr3++13H2O 3.0NA(或1.806×1024) Cu2++2OH- = Cu(OH)2↓、Cu(OH)2(s)+S2 (aq) CuS(s)+2OH-(aq)或相同温度下,S(CuS)【详解】
⑴HCN有剧毒,氢和碳共用一对电子,碳和氮共用三对电子,因此电子式是,HCN没有对称性,其分子属于极性分子;故答案为:;极性。
⑵最详尽描述核外电子运动状态的是轨道表示式,氧原子的最外层有6个电子,其最外层电子的运动状态:,1个能级就是一种能量,因此最外层有2种不同能量的电子;故答案为:;2。
⑶a.最高价氧化物对应水化物的相同阳离子的盐(一般钠盐)的pH越大,则对应酸越弱,非金属性越弱,因此比较相同条件下水溶液的pH:NaClO>Na2S2O3,不能比较非金属性,因为不是最高价氧化物对应水化物的钠盐,故a不符合题意;b.非金属性越强,其简单氢化物还原性越弱,还原性:H2S>HCl,说明氯非金属性与硫强,故b符合题意;c.非金属越强,其最高价氧化物对应水化物酸性越强,相同条件下水溶液的酸性:HClO3>H2SO3,不是最高价氧化物对应水化物的酸性,因此不能比较,故c不符合题意;d.非金属性越强,其简单氢化物越稳定,稳定性:HCl>H2S,因此能说明氯非金属性比硫强,故d符合题意;综上所述,答案为bd。
⑷流程③是S2O32 与Cr2O72 在酸性条件下反应生成SO42 、Cr3+和H2O,其离子方程式为:3S2O32 +4Cr2O72 +26H+ = 6SO42 +8Cr3++13H2O;故答案为:3S2O32 +4Cr2O72 +26H+ = 6SO42 +8Cr3++13H2O。
⑸反应③中,根据离子方程式可知1mol Cr2O72 转移了6mol电子,因此每消耗0.5mol Cr2O72 转移的电子物质的量为0.5mol× 6=3mol,电子数为3NA;故答案为:3NA(或1.806×1024);
⑹取少量待测水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,Cu2++2OH-= Cu(OH)2↓,继续加至不再产生蓝色沉淀为止,生成了氢氧化铜再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,说明难溶的氢氧化铜转变成更难溶的硫化铜,Cu(OH)2(s)+S2 (aq) CuS(s)+2OH-(aq);故答案为:Cu2++2OH-= Cu(OH)2↓、Cu(OH)2(s)+S2 (aq) CuS(s)+2OH-(aq)或相同温度下,S(CuS)19. 2.00 kPa-1 α= K P(O2)/{1+ K P(O2)} 97.6% kA/kD 2.9 × 10-4s 不发生变化 Fe(II)的电子构型为3d6,若在MbO2中价态发生变化,则变为Fe(III),电子构型为3d5,存在单电子,必然显示顺磁性,但MbO2为抗磁性的,不符合 或t2geg 变小 因为Fe(II)由高自旋态变为低自旋态 发生变化 因为配位前O2是顺磁性的,存在未成对电子,而MbO2为抗磁性的,其中的配体O2也应是抗磁性的,电子也应该配对。
【详解】
(1)P(O2)= 2.00kPa,α=80.0%,[MbO2] = 0.800 ct, [Mb]= 0.200ct
K= (0.800 ct)/ ({(0.200ct) × 2.00kPa} = 2.00 kPa-1
(2)K= [MbO2]/ {[Mb] P(O2)},得: [MbO2]/ [Mb]= K P(O2)
又知a= [MbO2] / ([MbO2]+ [Mb])= 1/(1+[Mb][MbO2] )
得:α= K P(O2)/{1+ K P(O2)}
P(O2)= 20.0 kPa, α= 2.00 × 20.0/(1+ 2.00 × 20.0)= 97.6%
(3) K=kA/kD
kA=1.2 × 102s-1 kPa-1
kA'=kA P(O2)=2.4 ×103 s-1
t= 0.693/(2.4 ×103)=2.9 × 10-4s
20. 2 b 减小 CO2 酸性氧化物 SO2 H2O 同素异形体 1.5
【详解】
(1)根据反应方程式分析,每消耗2molSO2,生成1molS2(g),则SO2的反应速率是S2生成速率的2倍;
(2)a.反应达到平衡时,各物质的浓度不再改变,所以混合气体中水蒸气含量不再变化,能说明化学反应是否达到平衡,故a不选;
b.反应物和生成物均为气体的反应,气体总质量反应前后质量守恒,保持不变,恒容容器体积不发生改变,则整个反应达到化学平衡前后,混合气体的密度都不变,不能根据密度说明化学反应是否达到平衡,故b选;
c.随着反应进行,气体分子数增加,气体压强增大,当容器内压强不再变化时,可以说明化学反应是否达到平衡,故c不选;
d.反应前后质量守恒,混合气体总质量不变,随着反应进行,混合气体的物质的量发生改变,所以当混合物平均相对分子质量不再变化时,可以说明反应是否达到平衡,故d不选;
综上所述答案为b;
该反应为放热反应,达到平衡后升高体系温度,平衡左移,平衡常数K减小;
(3)反应为氧化还原反应,SO2做氧化剂,在反应中得到电子,CH4做还原剂,在反应中失去电子,根据电子守恒可得电子转移数目为8,所以答案为:;
反应中C元素化合价升高,氧化产物是CO2,SO2的主要性质除氧化性、漂白性外还有还原性和酸性氧化物的性质;
(4)极性分子是指分子中正负电荷中心不重合的分子,则分别是SO2和H2O;S8与S2为S元素的不同单质,互为同素异形体;
(5)烟道气中的NO2也能与CH4反应并生成无害气体,可判断为CO2和H2O和N2,反应的化学方程式为:2NO2+CH4=CO2+N2+2H2O,完全转化3.0molNO2气体时,根据反应方程式计算,则需要甲烷的物质的量为1.5mol。
21. d 非极性 bc 它们都是极性分子且都能与H2O分子形成分子间氢键
【详解】
(1)a.NH3和H2O都是极性分子,相似相溶,a有关;
b.NH3极易溶于水,主要原因有NH3分子与H2O分子间形成氢键,b有关;
c.NH3和H2O能发生化学反应,加速NH3的溶解,c有关;
d.NH3易液化是因为NH3分子之间易形成氢键,与其水溶性无关,d无关;
故答案选d;
(2)CCl4、CS2是非极性溶剂,根据“相似相溶”原理可知,CrO2Cl2是非极性分子;
(3)由Ni(CO)4易挥发且其空间结构为正四面体形可知,Ni(CO)4为非极性分子,根据“相似相溶”原理可知,Ni(CO)4易溶于CCl4和苯;
(4)甲醛、甲醇和甲酸等碳原子数较少的醛、醇和羧酸均易溶于水的原因是它们都是极性分子且都能与H2O分子形成分子间氢键。
22. 与均为极性分子, 中氢键比甲醇多;与均为非极性分子,相对分子质量较大、范德华力较大
【详解】
(1)结合题图可知与中的原子、中的原子间均存在氢键;
故答案为:;。
(2)比较分子晶体的沸点时注意考虑范德华力和氢键,与均为极性分子, 中氢键比甲醇多;与均为非极性分子,相对分子质量较大、范德华力较大;
故答案为:;与均为极性分子, 中氢键比甲醇多;与均为非极性分子,相对分子质量较大、范德华力较大。
23. 平面三角形 非极性 杂化 杂化 < 甲醇是极性分子,有亲水基团,可与水结合形成氢键
【详解】
(1)三氧化硫分子中S原子价层电子对数为,不含孤电子对,所以为平面三角形结构,正电中心和负电中心重合,为非极性分子,中心S原子形成3个键,孤电子对数为,所以中心原子采取杂化。
(2)甲醇分子内C原子的价层电子对数为4,所以C原子的杂化方式为杂化,则的键角约为,甲醛分子内C原子的杂化方式为杂化,则的键角约为120°,所以甲醇分子内的键角小于甲醛分子内的键角;甲醇极易溶于水,其主要原因是甲醇是极性分子,有亲水基团,可与水结合形成氢键。
24. 相似 有 有 NH3
【详解】
(1)N、P属于同族元素,原子最外层都有5个电子,其中三个成单电子分别与3个H原子形成3对共用电子对,在中性原子上都存在1对孤对电子,所以NH3分子与PH3分子的空间结构相似,均为三角锥形,分子结构不对称,正负电荷重心不重合,因此二者都属于极性分子。P-H键为不同元素原子之间形成的共价键,属于极性键;
(2)元素的非金属性越强,其形成的化学键就越强,断裂消耗的能量就越高,物质的稳定性就越强。由N、P在元素周期表中的位置关系和元素周期律可知,元素的非金属性:N>P,所以热稳定性:NH3>PH3,即NH3与PH3相比,热稳定性更强的是NH3。
一、选择题(共16题)
1.下列有关范德华力的叙述正确的是
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B.范德华力与化学键的区别是作用力的强弱不同
C.任何分子间在任意情况下都会产生范德华力
D.范德华力非常微弱,故破坏范德华力不需要消耗能量
2.下列说法中不正确的是
A.键比键的电子云重叠程度大,形成的共价键强
B. 键与键的电子云形状对称性相同
C.丙烯分子有8个键1个键
D.分子中有一个键,2个键;中4个键的键能不相同
3.CH4、NH3和N2H4均可作为燃料电池的燃料。下列说法错误的是
A.CH4、NH3和N2H4中C、N杂化方式均相同
B.CH4和NH3的空间结构分别为正四面体形、三角锥形
C.CH4、NH3和N2H4均为极性分子
D.沸点:N2H4>NH3>CH4
4.下列说法错误的是
A.两个原子之间最多能形成1个键
B.HF、HCl、HBr、HI的沸点逐渐升高
C.是一种含极性键和非极性键的极性分子
D.气体单质分子中不一定有键和键
5.下列有关N、P及其化合物的说法错误的是
A.N的电负性比P的大,可推断NCl3分子的极性比PCl3的大
B.N与N的π键比P与P的强,可推断N≡N的稳定性比P≡P的高
C.NH3的成键电子对间排斥力较大,可推断NH3的键角比PH3的大
D.HNO3的分子间作用力较小,可推断HNO3的熔点比H3PO4的低
6.已知为共价化合物,两个键间的夹角为180°,则属于
A.由极性键构成的极性分子
B.由极性键构成的非极性分子
C.由非极性键构成的极性分子
D.由非极性键构成的非极性分子
7.下列关于范德华力的叙述中,正确的是( )
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊化学键
B.任何分子间在任意情况下都会产生范德华力
C.范德华力与化学键的区别是作用力的强弱问题
D.范德华力非常微弱,故破坏范德华力不需要消耗能量
8.“冰面为什么滑?”,这与冰层表面的结构有关,下列有关说法正确的是
A.由于氢键的存在,水分子的稳定性好,高温下也很难分解
B.第一层固态冰中,水分子间通过共价键形成空间网状结构
C.第二层“准液体”中,水分子间形成共价键机会减少,形成氢键的机会增加
D.当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流动性的水分子”,使冰面变滑
9.现有4种短周期元素W、X、Y和Z,原子序数依次增大,W、Y可形成两种常见液态化合物,其最简式分别为WY和W2Y;X的最低价氢化物与它的最高价氧化物对应水化物能反应;Z是地壳中最多的金属元素。下列说法正确的是
A.W、X与Y只能形成共价化合物
B.第四周期且与Y同主族的单质可用作制造半导体材料。
C.工业上常用W单质冶炼获取金属Z
D.X的最低价氢化物沸点比同主族其它元素最低价气态氢化物沸点低
10.下列说法正确的是
A.非极性分子中的原子上一定不含孤电子对
B.平面三角形分子一定是非极性分子
C.二氯甲烷(CH2Cl2)分子的中心原子采取sp3杂化,键角均为109°28′
D.ABn型分子的中心原子最外层满足8电子结构,则ABn不一定是非极性分子
11.X、Y、Z、W是四种原子半径依次增大的短周期主族元素,Z的最高正价与最低负价的绝对值之差为6,Y的最外层电子数等于K层电子数的3倍,四种元素的原子序数之和为45。下列说法正确的是
A.Z2Y中各原子均满足8电子结构 B.简单氢化物的沸点:X>Y>Z
C.离子半径:W>Z>Y>X D.Y、Z、W三种元素仅能形成一种盐
12.下列现象与化学键有关的是( )
A.F2、Cl2、Br2、I2的熔点依次升高
B.H2O的沸点远高于H2S的沸点
C.H2O在高温下难分解
D.干冰升华
13.六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但扩散到空气中会引起温室效应。下列有关六氟化硫的推测正确的是
A.六氟化硫易燃烧生成二氧化硫
B.六氟化硫的空间结构说明分子世界的丰富多彩
C.六氟化硫分子中的都是σ键,且键长、键能都相等
D.六氟化硫分子中既含有极性键又含有非极性键
14.关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键
B.冰、水中都存在氢键
C.分子间形成的氢键使物质的熔点和沸点升高
D.H2O是一种非常稳定的化合物,这是由于氢键所致
15.近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe、Sm、As、F、O组成的化合物。下列说法正确的是
A.元素As与N同族可预测AsH3分子中As-H键的键角小于NH3中N-H键的键角
B.NH3的水溶液中存在四种不同的氢键,其中根据氨水显碱性可以推测NH3和H2O存在的主要氢键形式可能为:(NH3)N…H-O(H2O)
C.配合物Fe(CO)n可用作催化剂,Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=4
D.每个H2O分子最多可与两个H2O分子形成两个氢键
16.g—C3N4晶体中存在的微粒间作用力有
A.非极性键 B.金属键 C.π键 D.范德华力
二、综合题
17.二氧化氯(ClO2)是国际公认高效、安全的杀菌、保鲜剂,是氯制剂的理想替代品。工业上制备ClO2的方法很多,NaClO3和NaClO2是制取ClO2的常见原料。
完成下列填空:
(1)以下反应是制备ClO2的一种方法:H2C2O4+ 2 NaClO3+ H2SO4 = Na2SO4+ 2 CO2↑ + 2 ClO2↑ + 2 H2O,上述反应物中属于第三周期的元素的原子半径大小顺序是__________;其中原子半径最大元素的原子,其核外有___________种不同能量的电子。
(2)ClO2的分子构型为“V”形,则ClO2是______________(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气__________(选填“大”、“小”、“一样”)。
(3)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2的___________倍(保留2位小数)。
(4)若以NaClO2为原料制取ClO2,需要加入具有________(填“氧化”、“还原”)性的物质。
(5)工业上将氯碱工业和制取NaClO3联合进行。研究发现,电解时,不同反应环境下的总反应分别为:
4 NaCl + 18 H2O =4 NaClO3+ 3 O2↑+ 18 H2↑(中性环境)
NaCl + 3 H2O = NaClO3+ 3 H2↑(微酸性环境)
①电解时,氢气在__________极产生。
②更有利于工业生产NaClO3的反应环境是___________,理由__________________。
18.某电镀铜厂有两种废水,分别含有CN-和Cr2O72-等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
请完成下列填空:
(1)HCN有剧毒,电子式是__,其分子属于__(填“极性”、“非极性”)分子。
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式。从中选择最详尽描述核外电子运动状态的方式,来表示氧原子的最外层电子的运动状态:__,其中最外层有__种不同能量的电子。
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是___。
a.相同条件下水溶液的pH:NaClO>Na2S2O3
b.还原性:H2S>HCl
c.相同条件下水溶液的酸性:HClO3>H2SO3
d.稳定性:HCl>H2S
(4)写出流程③的离子方程式为:___。
(5)反应③中,每消耗0.5molCr2O72-转移的电子数为___;
(6)取少量待测水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,解释产生该现象的原因___。
19.I.肌红蛋白(Mb)是由肽链和血红素辅基组成的可结合氧的蛋白,广泛存在于肌肉中。肌红蛋白与氧气的结合度(α)与氧分压P(O2)密切相关,存在如下平衡:Mb(aq)+O2(g)MbO2(aq)(a)其中,kA和kD分别是正向和逆向反应的速率常数。37°C,反应达平衡时测得的一组实验数据如图所示。
(1)计算37°C下反应(a)的平衡常数K_______。
(2)导出平衡时结合度(α)随氧分压变化的表达式_______。若空气中氧分压为20.0kPa,计算人正常呼吸时Mb与氧气的最大结合度_______。
(3)研究发现,正向反应速率v正=kA(Mb)P(O2);逆向反应速率v逆=kD(MbO2)。已知kD=60s-1,计算速率常数kA=_______。当保持氧分压为20.0kPa,计算结合度达50%所需时间_______。(提示:对于v逆=kD(MbO2),MbO2分解50%所需时间为t=0.693/kD)
II.Mb含有一个Fe(II),呈顺磁性,与O2结合后形成的MbO2是抗磁性的。MbO2中的铁周围的配位场可近似为八面体场。
(4)这一过程中Fe(II)的价态是否发生改变_______,简述原因_______。
(5)写出MbO2中铁离子在八面体场中的价电子排布_______。
(6)结合O2前后铁离子的半径是不变、变大还是变小_______,简述原因_______。
(7)O2分子呈顺磁性,它与Mb结合后,价电子排布是否发生变化___,简述原因____。
20.某烟道气的主要成分是CO2,并含有少量硫氧化物、氮氧化物等杂质。其中的硫元素可在高温下通过CH4的作用回收,主要反应如下:2SO2(g)+CH4(g) CO2(g)+2H2O(g)+S2(g)+Q(Q>0)
(1)以mol/(L min)为单位,SO2的反应速率是S2生成速率的_________倍。
(2)恒容条件下,不能说明该反应已经达到平衡状态的是_______(选填编号)
a.混合气体中水蒸气含量不再变化
b.混合气体密度不发生变化
c.容器内压强不再变化
d.混合物平均相对分子质量不再变化
达到平衡后升高体系温度,则平衡常数K_________(填“增大”、“减小”、或“不变”)。
(3)请在下式中标出上述反应中电子转移的方向和数目:_____
2SO2(g)+CH4(g) …该反应的氧化产物是_________。SO2的主要性质除氧化性、漂白性外还有________性。
(4)该反应混合物中有两种极性分子,分别是______和_____;固态硫的分子式可能是S8,它与S2互为________。
(5)烟道气中的NO2也能与CH4反应并生成无害气体,完全转化3.0molNO2气体时,需要甲烷的物质的量为__________mol.
21.(1)NH3在水中的溶解度很大。下列说法与NH3的水溶性无关的是______(填标号)。
a.NH3和H2O都是极性分子
b.NH3在水中易形成氢键
c.NH3溶于水建立了平衡NH3+H2ONH3·H2ONH+OH-
d.NH3是一种易液化的气体
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是______(填“极性”或“非极性”)分子。
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4,Ni(CO)4呈正四面体形。Ni(CO)4易溶于下列物质中的______(填标号)。
a.水 b.CCl4 c.苯 d.NiSO4溶液
(4)甲醛、甲醇和甲酸等碳原子数较少的醛、醇和羧酸均易溶于水的原因是______。
22.(1)我国科学家最近成功合成了世界上首个五氮阴离子盐.经X射线衍射测得化合物R的晶体结构,其局部结构如图所示.图中虚线代表氢键其表示式为 … 、_______、_______。
(2)在低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_______,原因是_______。
23.(1)写出分子的空间结构:___________,它是___________分子(填“极性”或“非极性”),它的中心原子采用的杂化方式是___________。
(2)甲醛(HCHO)在Ni催化作用下加氢可得甲醇()。甲醇分子内C原子的杂化方式为___________,甲醇分子内O-C-H的键角___________(填“>”“<”或“=”)甲醛分子内O-C-H的键角;甲醇极易溶于水,其主要原因是___________。
24.已知N、P同属于元素周期表的第ⅤA族元素,N在第二周期,P在第三周期。NH3分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N-H键间的夹角是107°。
(1)PH3分子与NH3分子的空间结构______(填“相似”或“不相似”),P-H键______(填“有”或“无”)极性,PH3分子______(填“有”或“无”)极性。
(2)NH3与PH3相比,热稳定性更强的是______。
参考答案:
1.B
【详解】
A.范德华力的实质也是一种电性作用,但是范德华力是分子间较弱的作用力,它不是化学键,A错误;
B.化学键是微粒间的强烈的相互作用,范德华力是分子间较弱的作用力,所以范德华力与化学键的区别是作用力的强弱不同,B正确;
C.当分子间的距离足够远时,分子间没有范德华力,所以并不是任何分子间在任意情况下都会产生范德华力,C错误;
D.虽然范德华力非常微弱,但是破坏范德华力也要消耗能量,D错误;
答案选B。
2.D
【详解】
A.键是电子云“头碰头”的方式重叠,键是电子云“肩并肩”的方式重叠,键比键的电子云重叠程度大,形成的共价键强,A正确;
B.键与键都是轴对称的,所以键与键的电子云形状对称性相同,B正确;
C.丙烯分子有8个键,1个键,C正确;
D.分子的结构式为,有1个键,2个键,中4个键的键能完全相同,D错误;
故选D。
3.C
【详解】
A.CH4、NH3和N2H4中C、N都为sp3杂化,故杂化方式均相同,故A正确;
B.CH4的中心原子为sp3杂化,无孤对电子,为正四面体形,NH3的中心原子为sp3杂化,一个孤电子对,为三角锥形,故B正确;
C.CH4为正四面体形的对称结构,为非极性分子,故C错误;
D.因为N2H4、NH3都存在分子间氢键,故N2H4、NH3的沸点高于CH4,N2H4分子间氢键数目多于NH3,故N2H4沸点高于NH3,故沸点:N2H4>NH3>CH4,故D正确;
故选C。
4.B
【详解】
A.两个原子之间形成的第一条键为σ键,第二条开始为π键,则最多能形成l个σ键,A正确;
B.HCl、HBr、HI的沸点逐渐升高,而HF分子间存在氢键,其沸点高于HCl,B错误;
C.H2O2种存在H-O、O-O键,从结构上看,是二面角结构,正负电荷中心不能重合,是一种含极性键和非极性键的极性分子,C正确;
D.气体单质分子中不一定键和键,如He气体,为单原子分子,不存在化学键,D正确;
故选B。
5.A
【详解】
A.P和Cl的电负性差值比N和Cl的电负性差值大,因此PCl3分子的极性比NCl3分子极性大,A项错误;
B.N与N的键比P与P的强,故的稳定性比的高,B项正确;
C.N的电负性比P大,NH3中成键电子对距离N比PH3中成键电子对距离P近,NH3中成键电子对间的斥力大,因此NH3的键角比PH3的大,C项正确;
D.相对分子质量:HNO3
6.B
【详解】
中键是不同元素的原子形成的共价键,为极性键,两个键间的夹角为180°,说明分子是对称的,正电荷重心与负电荷重心重合,属于非极性分子,故是由极性键形成的非极性分子,故选:B。
7.C
【详解】
A. 范德华力的实质也是一种电性作用,但是范德华力是分子间较弱的作用力,它不是化学键,A错误;
B. 当分子间的距离足够远时,分子间没有范德华力,所以并不是任何分子间在任意情况下都会产生范德华力,B错误;
C. 化学键是微粒间的一种强烈的相互作用,而范德华力是分子间较弱的作用力,所以范德华力与化学键的区别是作用力的强弱问题,C正确;
D. 虽然范德华力非常微弱,但是破坏范德华力也要消耗能量,D错误;
故合理选项是C。
8.D
【详解】
A.水分子的稳定性好,是由水分子内氢氧共价键的键能决定的,与分子间形成的氢键无关,A错误;
B.分子间不存在共价键,应该是通过氢键形成空间网状结构,B错误;
C.分子间不存在共价键应该是氢键个数减少,C错误;
D.当温度达到一定数值时,“准液体”中的水分子与下层冰连接的氢键被破坏,使一部分水分子能够自由流动,从而产生“流动性的水分子”,造成冰面变滑,D正确;
故选D。
9.B
【详解】
A. W、X与Y既能形成共价化合物、又能形成离子化合物如硝酸铵等,A错误;
B. 第四周期且与Y同主族的单质为Se,位于金属与非金属分界线附近,则可用作制造半导体材料,B正确;
C. 工业上常用电解熔融的氧化铝冶炼获取金属Z(Al),C错误;
D.因为分子间存在氢键, X的最低价氢化物(NH3)沸点比同主族其它元素最低价气态氢化物沸点高,D错误;
答案选B。
10.D
【详解】
A.CH4、CCl4均为是非极性分子,CH4分子中的原子无孤电子对,CCl4分子中的氯原子含有孤电子对,A错误;
B.甲醛中心原子C上无孤电子对,价层电子对数为3,空间构型为平面三角形,碳原子位于三角形内部,结构不对称,所以为极性分子,B错误;
C.甲烷是正四面体,键角均为109°28′,二氯甲烷分子的构型是四面体,键角发生了变化,不等于109°28′,C错误;
D.NH3中心原子N最外层满足8电子结构,其为极性分子;中心原子最外层满足8电子结构的ABn型分子,若中心原子的化合价的绝对值等为于价电子数则一定是非极性分子 ,如CH4, D正确;
故选D。
11.A
【详解】
A.Cl2O分子中氯原子和氧原子均满足8电子结构,故A正确;
B.水分子间形成氢键的数目多于氟化氢,分子间的作用力强于氟化氢,沸点高于氟化氢,故B错误;
C.电子层结构相同的离子,随核电荷数的增大,离子半径依次减小,同主族元素从上到下,离子的离子半径依次增大,则四种元素形成的离子中钠离子的离子半径最小,故C错误;
D.钠元素、氯元素和氧元素形成的盐有次氯酸钠、亚氯酸钠、氯酸钠、高氯酸钠等,不止一种,故D错误;
故选A。
12.C
【详解】
A.F2、Cl2、Br2、I2的熔点依次升高与分子间作用力有关,故不选A;
B.H2O的沸点远高于H2S的沸点与水分子间易形成氢键有关,故不选B;
C.H2O在高温下难分解是因为O-H键的键能大,故选C;
D.干冰升华,二氧化碳分子没变,化学键不变,干冰升华与化学键无关,故不选D;
选C。
13.BC
【详解】
A.中S为+6价,不能和反应生成,故A项错误;
B.六氟化硫的空间结构是正八面体形,结合部分已知分子的空间结构,说明分子结构是多样的,故B项正确;
C.该分子中的都是单键,即均为σ键,则键长、键能都相等,故C项正确;
D.分子中只有极性键,故D项错误;
故答案为:BC。
14.BC
15.AB
【详解】
A.AsH3和NH3分子内,共用电子对均偏离氢原子,元素与同族,的电负性大于,N-H和As-H相比,两个键间的排斥力更大,中键角更大,因此分子中键的键角小于中键的键角,A正确;
B.由于NH3 H2O NH4++OH-,据此可以推测NH3和H2O存在的主要氢键形式可能为:(NH3)N…H-O(H2O),B正确;
C. 的价层电子排布为,价电子数为8,配合物一个配体提供2个电子,内中心原子价电子数与配体提供电子总数之和为18,因此,则,C错误;
D.冰中每个分子最多与周围四个水分子形成氢键,为四面体形结构,冰中,一个水分子平均可以形成 个氢键,D错误。
故选AB。
16.CD
【详解】
该晶体是一种近似石墨烯的平面二维片层结构,由题给示意图可知,故g—C3N4晶体中存在碳氮单键和和大π键,层间存在范德华力,不存在非极性键和金属键,故选CD。
17. Na > S > Cl 4 极性 大 2.63 氧化 阴极 微酸性环境 转移电子都生成氯酸钠,能量利用率高;水消耗少;不同时生成氢气和氧气,相对更安全
【详解】
(1)反应中属于第三周期的是Na、S、Cl,同一周期自左向右原子半径逐渐减小,所以原子半径由大到小的顺序为Na > S > Cl;钠原子的核外排布式为1s22s22p63s1,有4种不同能量的电子。
(2)ClO2的分子构型为“V”形,分子中正负电中心不重合,所以ClO2是极性分子;ClO2、H2O都是极性分子,Cl2是非极性分子,根据“相似相溶”的经验规律,ClO2在水中溶解度比氯气大。
(3)设质量都是m,ClO2消毒的效率是Cl2的=2.63倍。
(4)以NaClO2为原料制取ClO2,氯元素的化合价由+3价升至+4价,NaClO2被氧化,所以需加入氧化性物质。
(5)①电解时,H元素的化合价由+1价降至0价,氢离子得电子生成氢气,所以H2在阴极产生;
②对比两个反应方程式可知,更有利于工业生产NaClO3的反应环境是微酸性环境,理由是:微酸性环境中,转移电子都生成氯酸钠,能量利用率高;水消耗少;不同时生成氢气和氧气,相对更安全。
18. 极性 2 bd 3S2O32-+4Cr2O72-+26H+→6SO42-+8Cr3++13H2O 3.0NA(或1.806×1024) Cu2++2OH- = Cu(OH)2↓、Cu(OH)2(s)+S2 (aq) CuS(s)+2OH-(aq)或相同温度下,S(CuS)
⑴HCN有剧毒,氢和碳共用一对电子,碳和氮共用三对电子,因此电子式是,HCN没有对称性,其分子属于极性分子;故答案为:;极性。
⑵最详尽描述核外电子运动状态的是轨道表示式,氧原子的最外层有6个电子,其最外层电子的运动状态:,1个能级就是一种能量,因此最外层有2种不同能量的电子;故答案为:;2。
⑶a.最高价氧化物对应水化物的相同阳离子的盐(一般钠盐)的pH越大,则对应酸越弱,非金属性越弱,因此比较相同条件下水溶液的pH:NaClO>Na2S2O3,不能比较非金属性,因为不是最高价氧化物对应水化物的钠盐,故a不符合题意;b.非金属性越强,其简单氢化物还原性越弱,还原性:H2S>HCl,说明氯非金属性与硫强,故b符合题意;c.非金属越强,其最高价氧化物对应水化物酸性越强,相同条件下水溶液的酸性:HClO3>H2SO3,不是最高价氧化物对应水化物的酸性,因此不能比较,故c不符合题意;d.非金属性越强,其简单氢化物越稳定,稳定性:HCl>H2S,因此能说明氯非金属性比硫强,故d符合题意;综上所述,答案为bd。
⑷流程③是S2O32 与Cr2O72 在酸性条件下反应生成SO42 、Cr3+和H2O,其离子方程式为:3S2O32 +4Cr2O72 +26H+ = 6SO42 +8Cr3++13H2O;故答案为:3S2O32 +4Cr2O72 +26H+ = 6SO42 +8Cr3++13H2O。
⑸反应③中,根据离子方程式可知1mol Cr2O72 转移了6mol电子,因此每消耗0.5mol Cr2O72 转移的电子物质的量为0.5mol× 6=3mol,电子数为3NA;故答案为:3NA(或1.806×1024);
⑹取少量待测水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,Cu2++2OH-= Cu(OH)2↓,继续加至不再产生蓝色沉淀为止,生成了氢氧化铜再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,说明难溶的氢氧化铜转变成更难溶的硫化铜,Cu(OH)2(s)+S2 (aq) CuS(s)+2OH-(aq);故答案为:Cu2++2OH-= Cu(OH)2↓、Cu(OH)2(s)+S2 (aq) CuS(s)+2OH-(aq)或相同温度下,S(CuS)
【详解】
(1)P(O2)= 2.00kPa,α=80.0%,[MbO2] = 0.800 ct, [Mb]= 0.200ct
K= (0.800 ct)/ ({(0.200ct) × 2.00kPa} = 2.00 kPa-1
(2)K= [MbO2]/ {[Mb] P(O2)},得: [MbO2]/ [Mb]= K P(O2)
又知a= [MbO2] / ([MbO2]+ [Mb])= 1/(1+[Mb][MbO2] )
得:α= K P(O2)/{1+ K P(O2)}
P(O2)= 20.0 kPa, α= 2.00 × 20.0/(1+ 2.00 × 20.0)= 97.6%
(3) K=kA/kD
kA=1.2 × 102s-1 kPa-1
kA'=kA P(O2)=2.4 ×103 s-1
t= 0.693/(2.4 ×103)=2.9 × 10-4s
20. 2 b 减小 CO2 酸性氧化物 SO2 H2O 同素异形体 1.5
【详解】
(1)根据反应方程式分析,每消耗2molSO2,生成1molS2(g),则SO2的反应速率是S2生成速率的2倍;
(2)a.反应达到平衡时,各物质的浓度不再改变,所以混合气体中水蒸气含量不再变化,能说明化学反应是否达到平衡,故a不选;
b.反应物和生成物均为气体的反应,气体总质量反应前后质量守恒,保持不变,恒容容器体积不发生改变,则整个反应达到化学平衡前后,混合气体的密度都不变,不能根据密度说明化学反应是否达到平衡,故b选;
c.随着反应进行,气体分子数增加,气体压强增大,当容器内压强不再变化时,可以说明化学反应是否达到平衡,故c不选;
d.反应前后质量守恒,混合气体总质量不变,随着反应进行,混合气体的物质的量发生改变,所以当混合物平均相对分子质量不再变化时,可以说明反应是否达到平衡,故d不选;
综上所述答案为b;
该反应为放热反应,达到平衡后升高体系温度,平衡左移,平衡常数K减小;
(3)反应为氧化还原反应,SO2做氧化剂,在反应中得到电子,CH4做还原剂,在反应中失去电子,根据电子守恒可得电子转移数目为8,所以答案为:;
反应中C元素化合价升高,氧化产物是CO2,SO2的主要性质除氧化性、漂白性外还有还原性和酸性氧化物的性质;
(4)极性分子是指分子中正负电荷中心不重合的分子,则分别是SO2和H2O;S8与S2为S元素的不同单质,互为同素异形体;
(5)烟道气中的NO2也能与CH4反应并生成无害气体,可判断为CO2和H2O和N2,反应的化学方程式为:2NO2+CH4=CO2+N2+2H2O,完全转化3.0molNO2气体时,根据反应方程式计算,则需要甲烷的物质的量为1.5mol。
21. d 非极性 bc 它们都是极性分子且都能与H2O分子形成分子间氢键
【详解】
(1)a.NH3和H2O都是极性分子,相似相溶,a有关;
b.NH3极易溶于水,主要原因有NH3分子与H2O分子间形成氢键,b有关;
c.NH3和H2O能发生化学反应,加速NH3的溶解,c有关;
d.NH3易液化是因为NH3分子之间易形成氢键,与其水溶性无关,d无关;
故答案选d;
(2)CCl4、CS2是非极性溶剂,根据“相似相溶”原理可知,CrO2Cl2是非极性分子;
(3)由Ni(CO)4易挥发且其空间结构为正四面体形可知,Ni(CO)4为非极性分子,根据“相似相溶”原理可知,Ni(CO)4易溶于CCl4和苯;
(4)甲醛、甲醇和甲酸等碳原子数较少的醛、醇和羧酸均易溶于水的原因是它们都是极性分子且都能与H2O分子形成分子间氢键。
22. 与均为极性分子, 中氢键比甲醇多;与均为非极性分子,相对分子质量较大、范德华力较大
【详解】
(1)结合题图可知与中的原子、中的原子间均存在氢键;
故答案为:;。
(2)比较分子晶体的沸点时注意考虑范德华力和氢键,与均为极性分子, 中氢键比甲醇多;与均为非极性分子,相对分子质量较大、范德华力较大;
故答案为:;与均为极性分子, 中氢键比甲醇多;与均为非极性分子,相对分子质量较大、范德华力较大。
23. 平面三角形 非极性 杂化 杂化 < 甲醇是极性分子,有亲水基团,可与水结合形成氢键
【详解】
(1)三氧化硫分子中S原子价层电子对数为,不含孤电子对,所以为平面三角形结构,正电中心和负电中心重合,为非极性分子,中心S原子形成3个键,孤电子对数为,所以中心原子采取杂化。
(2)甲醇分子内C原子的价层电子对数为4,所以C原子的杂化方式为杂化,则的键角约为,甲醛分子内C原子的杂化方式为杂化,则的键角约为120°,所以甲醇分子内的键角小于甲醛分子内的键角;甲醇极易溶于水,其主要原因是甲醇是极性分子,有亲水基团,可与水结合形成氢键。
24. 相似 有 有 NH3
【详解】
(1)N、P属于同族元素,原子最外层都有5个电子,其中三个成单电子分别与3个H原子形成3对共用电子对,在中性原子上都存在1对孤对电子,所以NH3分子与PH3分子的空间结构相似,均为三角锥形,分子结构不对称,正负电荷重心不重合,因此二者都属于极性分子。P-H键为不同元素原子之间形成的共价键,属于极性键;
(2)元素的非金属性越强,其形成的化学键就越强,断裂消耗的能量就越高,物质的稳定性就越强。由N、P在元素周期表中的位置关系和元素周期律可知,元素的非金属性:N>P,所以热稳定性:NH3>PH3,即NH3与PH3相比,热稳定性更强的是NH3。
