10.2.3酸碱中和反应课件—2021-2022学年九年级化学人教版下册(29张PPT)
文档属性
| 名称 | 10.2.3酸碱中和反应课件—2021-2022学年九年级化学人教版下册(29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 605.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-26 07:15:59 | ||
图片预览






文档简介
(共29张PPT)
溶液酸碱性与溶液酸碱度
课题2 酸和碱的--中和反应
【第3课时】
第十单元 酸和碱
1、碱的化学性质:
① 吸收、除去CO2的化学方程式:
。
②证明、检验CO2的化学方程式:
。
③ 氢氧化钙 + 稀盐酸:
。
课前三分钟
2NaOH + CO2 === Na2CO3 + H2O
Ca(OH)2 + CO2 ==
CaCO3↓+ H2O
Ca(OH)2 + 2HCl === CaCl2 + 2H2O
2.写出下列溶液的酸、碱、中性 :
二氧化碳的水溶液 ,氨水 ,
氯化钠溶液 ,碳酸钠溶液 。
3.写出下列物质的化学式:
蓝色沉淀 ,红褐色沉淀 , 不溶于稀硝酸的白色沉淀 、 。
4.写出下列物质的俗名:
NaOH: 苛性钠、 、 。
Ca(OH)2: 、 。
CaO: 。
CaCO3: 、 。
酸性
碱性
中性
碱性
Cu(OH)2
Fe(OH)3
AgCl
BaSO4
火碱
烧碱
熟石灰
消石灰
生石灰
大理石
石灰石
5、物质的性质决定其用途。用途正确( )
A. 烧碱NaOH用于治疗胃酸过多
B. 食盐水用于清洗伤口
C. 明矾用作水的净水剂
D. 氦气He用作火箭燃料
清洗伤口可用盐水,因为食盐溶液会使细菌蛋白质凝固,所以具有杀菌(消毒)作用
B C
三、溶液的酸碱性与酸碱度
用酸碱指示剂能区分右边A、B两组溶液吗?
B
A
A:能 B:不能
用“酸碱指示剂”检验
可用PH试纸或PH计检测
用pH 表示
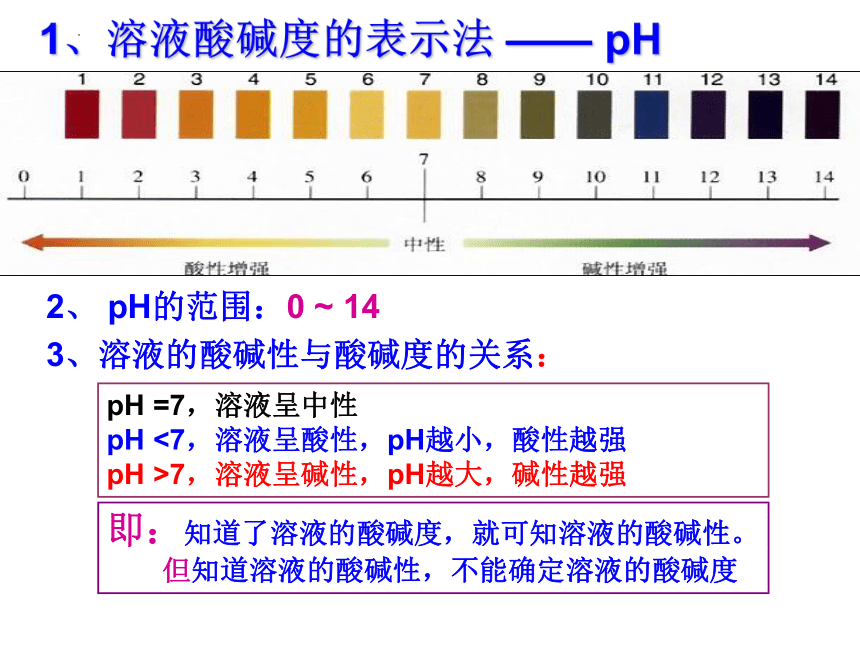
1、溶液酸碱度的表示法 —— pH
2、 pH的范围:0 ~ 14
3、溶液的酸碱性与酸碱度的关系:
即:知道了溶液的酸碱度,就可知溶液的酸碱性。
但知道溶液的酸碱性,不能确定溶液的酸碱度
pH =7,溶液呈中性
pH <7,溶液呈酸性,pH越小,酸性越强
pH >7,溶液呈碱性,pH越大,碱性越强
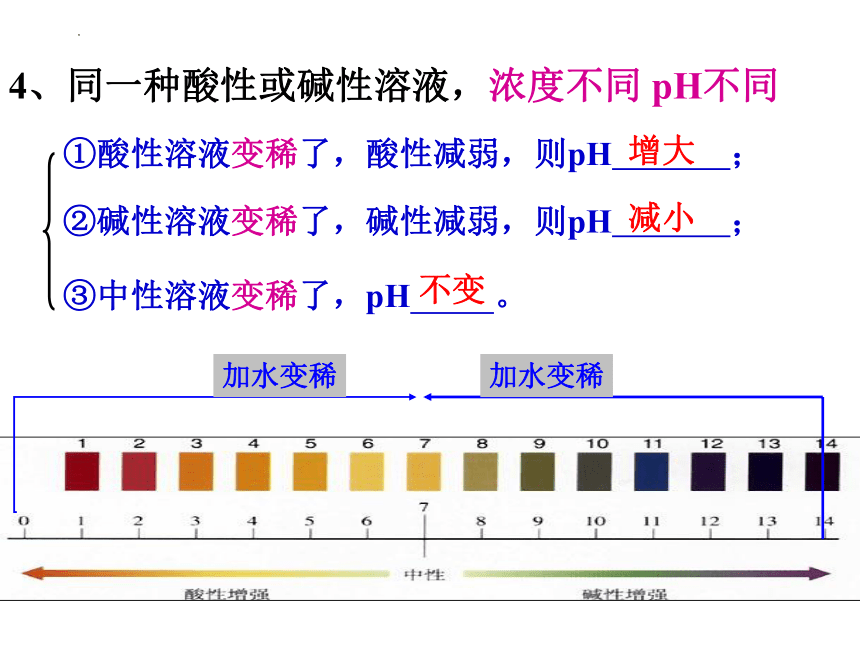
①酸性溶液变稀了,酸性减弱,则pH ;
4、同一种酸性或碱性溶液,浓度不同 pH不同
②碱性溶液变稀了,碱性减弱,则pH ;
③中性溶液变稀了,pH 。
增大
减小
不变
加水变稀
加水变稀
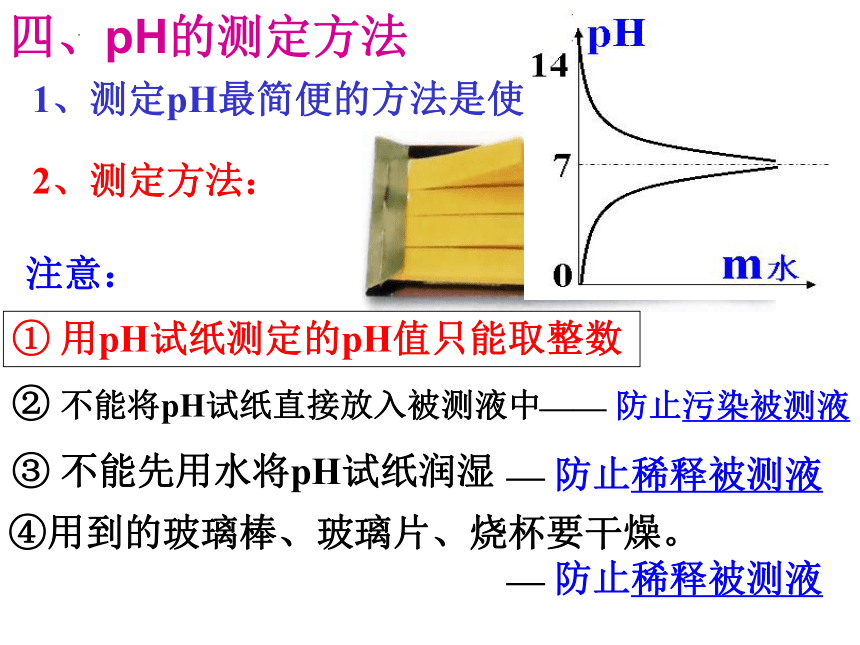
1、测定pH最简便的方法是使用 pH试纸
2、测定方法:
① 先用滴管将被测液滴在pH试纸上
(或用玻璃棒蘸取涂在pH试纸上)
(1)操 作:
② 立即(30秒内)与比色卡对照读数
四、pH的测定方法
1、测定pH最简便的方法是使用 pH试纸
2、测定方法:
① 用pH试纸测定的pH值只能取整数
注意:
③ 不能先用水将pH试纸润湿
② 不能将pH试纸直接放入被测液中
四、pH的测定方法
— 防止稀释被测液
—— 防止污染被测液
④用到的玻璃棒、玻璃片、烧杯要干燥。
— 防止稀释被测液
1、用水稀释一定质量分数的盐酸或NaOH溶液,请画出溶液pH与加水质量的关系:
pH
m水
用水稀释盐酸
14
7
0
pH
m水
用水稀释NaOH溶液
14
7
0
2、将碱滴入酸中 或 将酸滴入碱中,请画出
溶液pH与所加物质的关系:
pH
mNaOH
往盐酸中滴加
NaOH溶液
14
7
0
pH
mHCl
往NaOH溶液
中滴加盐酸
14
7
0
3、证明溶液显碱(OH-)性方法:
·石蕊 ——
·酚酞 ——
· 测pH值 ——
·CuSO4 或 FeCl3—
如:复分解反应:A B + C D = AD +CB
CuSO4+ 2NaOH = Na2SO4+Cu(OH)2 ↓
蓝色↓或 红褐色↓
pH > 7
变红
变蓝
4、证明溶液显酸(H+)性方法:
·石蕊 ——
· 测pH值 ——
· Fe ——
· Fe2O3 ——···
· Fe(OH)3 —···
·CaCO3 ——
★
★
★
★
★
— 最佳方法
如:CaCO3 +2 HCl =CaCl2 +H2O+CO2↑
变红
气泡
气泡
pH < 7
五、了解溶液酸碱度的重要意义
2、pH与土壤
3、pH与酸雨
1、pH与化工生产
·正常雨水:pH约为5.6 ( 溶解有CO2 )
·酸雨:pH < 5.6
·形成酸雨的气体主要有:SO2、NO2
【 注:CO2不是酸雨气体 】
pH < 7的雨水可能是正常雨水(5.6 < pH < 7);
也可能是酸雨( pH < 5.6)
4、pH与人体:
① pH与健康
② pH与美容
③ pH与智商
④PH与食品
测定生活中常见物质pH
草木灰(主要成分: K2CO3 )
和Na2CO3溶液一样显碱性
中性
酸性
碱性
酸性
资料:PH与健康
在生命长期的进化过程中,人体形成了较为稳定的 呈微碱性的内环境,人体血浆在正常状态下的pH为7.35~7.45 ,这样有利于机体对蛋白质等营养物质的吸收利用,并使体内的血液循环和免疫系统保持良好状态,人的精力也就显得较为充沛。也就是说,人体在处于偏碱性状态时,是最平衡、最健康的。
有些孩子表现脾气暴躁、多动,学习精力不集中, 常感疲乏无力,且易患感冒、龋齿及牙周炎等疾病,其原因可能与体液酸碱度偏高有关。
资料:PH与健康
·人体血浆的PH值是 7.35~7.45时,正常;
·人体血浆的PH值 < 7.35 时,处于亚健康状况;
·人体血浆的PH值 = 6.9 时,变成植物人;
·人体血浆的PH值是 6.85~6.45时,死亡。
85%以上的多种疾病患者的血液PH低于正常值
人的大部分器官和组织显碱性,如:血浆、骨骼、肌肉、脑、心脏、肝脏、肾脏等;
只有很少显酸性的部分,如:皮肤、头发,皮脂膜显弱酸性( pH约为5.0~5.6 )。
资料:PH与美容
★ 洗头 —— 洗发水(弱碱性)去油腻;
护发素(弱酸性)调回酸性 。
★ 洗脸 —— 洗面奶(弱碱性)去油腻;
爽肤水(弱酸性)调回酸性 。
建议:
近年来,医学研究发现,人体体液的酸碱度与智商水平有密切关系。在体液酸碱度允许的范围内,酸性偏高者智商较低,碱性偏高则智商较高。
科学家测试了数十名6至13岁的男孩,结果表明,大脑皮层中的体液pH大于7.0的孩子,比 小于7.0的孩子的智商高出1倍之多。
资料:PH与智商
判断酸、碱性食物,并非以口感为据。日常所吃的食物按其本身所含元素成分的多少,可分为碱性食物、酸性食物和中性食物。
·碱性食物是含钾、钙、钠、镁等元素较多的食物,如:各种蔬菜、水果、牛奶、大豆和菌类食物等;
·酸性食物是含磷、硫、氯等元素较多的食物,如:肉类、禽蛋类、鱼类等动物性食物及面粉、大米、花生等;
·中性食物是指提炼出很纯的油脂、糖、淀粉类食物。
资料:PH与食品
碱性食品:除了五谷杂粮外的植物性食品
·强碱性 —— 葡萄、葡萄酒、海带芽、海带,等。 尤其是天然绿藻,最佳饮用时间为早9点至11点。
·中碱性 —— 大豆、红萝卜、番茄、香蕉、橘子、 南瓜、草莓、蛋白、梅干、柠檬、菠菜,等。
·弱碱性 —— 红豆、萝卜、苹果、甘蓝菜、洋葱、 豆腐,等。
酸性食品:牛奶以外的动物性食品
·强酸性 —— 蛋黄、乳酪、白糖做的西点或柿子、 柴鱼,等。
·中酸性 —— 火腿、培根、鸡肉、猪肉、鳗鱼、 牛肉、面包、小麦、奶油,等。
·弱酸性——大米、花生、啤酒、海苔、泥鳅,等。
中性食品:油、盐、咖啡、茶,等
资料:常见的酸碱食品
1、测定某溶液的pH,若先用水把试纸润湿再测定pH,则实际测得值与真实值相比( )
A. 变大 B. 变小 C. 不变 D. 无法确定
2、某溶液pH值为1,现欲使溶液的pH值变为5,则可以加入下列哪种溶液( )
A. pH=3的溶液
B. pH=7的溶液
C. pH=9的溶液
B
D
3、(2010 ·宜昌中考)生活中一些常见物质的pH如下图,下列四种物质中酸碱性与众不同的是( )
4、用pH试纸测定白醋的酸碱度时,如果先将试纸用蒸馏水润湿,再把白醋滴到试纸上,则测得的结果与白醋实际的pH比较( )A.偏低 B.偏高 C.相等 D.无法比较
5、下列各PH表示溶液酸性最强的是( )
A. PH=14 B. PH=7 C. PH=1 D. PH=0
B
A.肥皂水 B.牙膏 C.西瓜汁 D.玉米粥
C
D
6、某中学学生到野外交游,若不小心被蚊虫叮咬(蚊虫能分泌出蚁酸),下列物质用手涂抹以减轻疼痛的是 (填字母).
A.食醋(pH<7) B.食盐水(pH=7) C.肥皂水(pH>7)
小明想用pH试纸测定食醋的pH试纸用水润湿后,用筷子将食醋滴在pH试纸上,他测得的pH将比实际结果 (填“偏大”“偏小”或“不变”)
7、测定pH值最简单的方法是使用 , 测定时,用 蘸取待测溶液,滴在 上,然后再与 对照,便可测出溶液的pH值。若用此法测得土壤的pH值小于5,可以施用适量的 来改良土壤。
C
偏大
pH试纸
玻璃棒
pH试纸
标准比色卡
碱石灰
物质 肥皂水 雨水 糖水 柠檬汁 洗洁精
pH 10.2 5.2 7.0 2.5 12.2
8、小明同学取下列生活中的物质,测得其pH如下表所示:
由此判断:
(1)酸性最强的物质是________。
(2)能使无色酚酞试液变红色的物质是_____ _(填一种物质即可)。
(3)正常雨水的pH约为5.6。小明生活的环境所降的雨水_____(填“属于”或“不属于”)酸雨。
柠檬汁
肥皂水
属于
酸性溶液
酸溶液
酸溶液一定显酸性;酸性溶液不一定是酸
—— 溶质为酸的溶液
— 显酸性的溶液(能使石蕊变红)
碱溶液一定显碱性;碱性溶液不一定是碱
酸液 HCl、H2SO4
盐溶液 CuSO4溶液
酸液 HCl 、H2SO4
【补充2】酸溶液一定显酸性?酸性溶液一定是酸?
碱溶液
碱性溶液
碱溶液一定显碱性;碱性溶液不一定是碱 !
【补充1】碱溶液一定显碱性?碱性溶液一定是碱?
—— 显碱性的溶液
(能使石蕊变蓝、酚酞变红的溶液)
—— 溶质为碱的溶液
碱液 NaOH、Ca(OH)2
盐溶液 Na2CO3液、NaHCO3液
碱液 NaOH、石灰水Ca(OH)2
补充·拓展
强酸:HCl,H2SO4
弱酸:H2CO3
强碱:NaOH、Ca(OH)2
弱碱:NH3·H2O、Cu(OH)2等不溶性碱
问题:为什么盐溶液会显中性、碱性或酸性?
酸 + 碱 —— 盐 + H2O 【复分解;中和】
补充·拓展
强酸 + 强碱 → 盐,溶液显中性,如:NaCl、 CaCl2 、 Na2SO4 ,等 【强酸强碱盐显中性】
酸 + 碱 —— 盐 + H2O 【复分解;中和】
问题:为什么盐溶液会显中性、碱性或酸性?
弱酸 + 强碱 → 盐,溶液显碱性,如:Na2CO3、 NaHCO3 ,等 【弱酸强碱盐显碱性】
强酸 + 弱碱 → 盐,溶液显酸性,如:NH4Cl、 CuSO4 ,等 【强酸弱碱盐显酸性】
溶液酸碱性与溶液酸碱度
课题2 酸和碱的--中和反应
【第3课时】
第十单元 酸和碱
1、碱的化学性质:
① 吸收、除去CO2的化学方程式:
。
②证明、检验CO2的化学方程式:
。
③ 氢氧化钙 + 稀盐酸:
。
课前三分钟
2NaOH + CO2 === Na2CO3 + H2O
Ca(OH)2 + CO2 ==
CaCO3↓+ H2O
Ca(OH)2 + 2HCl === CaCl2 + 2H2O
2.写出下列溶液的酸、碱、中性 :
二氧化碳的水溶液 ,氨水 ,
氯化钠溶液 ,碳酸钠溶液 。
3.写出下列物质的化学式:
蓝色沉淀 ,红褐色沉淀 , 不溶于稀硝酸的白色沉淀 、 。
4.写出下列物质的俗名:
NaOH: 苛性钠、 、 。
Ca(OH)2: 、 。
CaO: 。
CaCO3: 、 。
酸性
碱性
中性
碱性
Cu(OH)2
Fe(OH)3
AgCl
BaSO4
火碱
烧碱
熟石灰
消石灰
生石灰
大理石
石灰石
5、物质的性质决定其用途。用途正确( )
A. 烧碱NaOH用于治疗胃酸过多
B. 食盐水用于清洗伤口
C. 明矾用作水的净水剂
D. 氦气He用作火箭燃料
清洗伤口可用盐水,因为食盐溶液会使细菌蛋白质凝固,所以具有杀菌(消毒)作用
B C
三、溶液的酸碱性与酸碱度
用酸碱指示剂能区分右边A、B两组溶液吗?
B
A
A:能 B:不能
用“酸碱指示剂”检验
可用PH试纸或PH计检测
用pH 表示
1、溶液酸碱度的表示法 —— pH
2、 pH的范围:0 ~ 14
3、溶液的酸碱性与酸碱度的关系:
即:知道了溶液的酸碱度,就可知溶液的酸碱性。
但知道溶液的酸碱性,不能确定溶液的酸碱度
pH =7,溶液呈中性
pH <7,溶液呈酸性,pH越小,酸性越强
pH >7,溶液呈碱性,pH越大,碱性越强
①酸性溶液变稀了,酸性减弱,则pH ;
4、同一种酸性或碱性溶液,浓度不同 pH不同
②碱性溶液变稀了,碱性减弱,则pH ;
③中性溶液变稀了,pH 。
增大
减小
不变
加水变稀
加水变稀
1、测定pH最简便的方法是使用 pH试纸
2、测定方法:
① 先用滴管将被测液滴在pH试纸上
(或用玻璃棒蘸取涂在pH试纸上)
(1)操 作:
② 立即(30秒内)与比色卡对照读数
四、pH的测定方法
1、测定pH最简便的方法是使用 pH试纸
2、测定方法:
① 用pH试纸测定的pH值只能取整数
注意:
③ 不能先用水将pH试纸润湿
② 不能将pH试纸直接放入被测液中
四、pH的测定方法
— 防止稀释被测液
—— 防止污染被测液
④用到的玻璃棒、玻璃片、烧杯要干燥。
— 防止稀释被测液
1、用水稀释一定质量分数的盐酸或NaOH溶液,请画出溶液pH与加水质量的关系:
pH
m水
用水稀释盐酸
14
7
0
pH
m水
用水稀释NaOH溶液
14
7
0
2、将碱滴入酸中 或 将酸滴入碱中,请画出
溶液pH与所加物质的关系:
pH
mNaOH
往盐酸中滴加
NaOH溶液
14
7
0
pH
mHCl
往NaOH溶液
中滴加盐酸
14
7
0
3、证明溶液显碱(OH-)性方法:
·石蕊 ——
·酚酞 ——
· 测pH值 ——
·CuSO4 或 FeCl3—
如:复分解反应:A B + C D = AD +CB
CuSO4+ 2NaOH = Na2SO4+Cu(OH)2 ↓
蓝色↓或 红褐色↓
pH > 7
变红
变蓝
4、证明溶液显酸(H+)性方法:
·石蕊 ——
· 测pH值 ——
· Fe ——
· Fe2O3 ——···
· Fe(OH)3 —···
·CaCO3 ——
★
★
★
★
★
— 最佳方法
如:CaCO3 +2 HCl =CaCl2 +H2O+CO2↑
变红
气泡
气泡
pH < 7
五、了解溶液酸碱度的重要意义
2、pH与土壤
3、pH与酸雨
1、pH与化工生产
·正常雨水:pH约为5.6 ( 溶解有CO2 )
·酸雨:pH < 5.6
·形成酸雨的气体主要有:SO2、NO2
【 注:CO2不是酸雨气体 】
pH < 7的雨水可能是正常雨水(5.6 < pH < 7);
也可能是酸雨( pH < 5.6)
4、pH与人体:
① pH与健康
② pH与美容
③ pH与智商
④PH与食品
测定生活中常见物质pH
草木灰(主要成分: K2CO3 )
和Na2CO3溶液一样显碱性
中性
酸性
碱性
酸性
资料:PH与健康
在生命长期的进化过程中,人体形成了较为稳定的 呈微碱性的内环境,人体血浆在正常状态下的pH为7.35~7.45 ,这样有利于机体对蛋白质等营养物质的吸收利用,并使体内的血液循环和免疫系统保持良好状态,人的精力也就显得较为充沛。也就是说,人体在处于偏碱性状态时,是最平衡、最健康的。
有些孩子表现脾气暴躁、多动,学习精力不集中, 常感疲乏无力,且易患感冒、龋齿及牙周炎等疾病,其原因可能与体液酸碱度偏高有关。
资料:PH与健康
·人体血浆的PH值是 7.35~7.45时,正常;
·人体血浆的PH值 < 7.35 时,处于亚健康状况;
·人体血浆的PH值 = 6.9 时,变成植物人;
·人体血浆的PH值是 6.85~6.45时,死亡。
85%以上的多种疾病患者的血液PH低于正常值
人的大部分器官和组织显碱性,如:血浆、骨骼、肌肉、脑、心脏、肝脏、肾脏等;
只有很少显酸性的部分,如:皮肤、头发,皮脂膜显弱酸性( pH约为5.0~5.6 )。
资料:PH与美容
★ 洗头 —— 洗发水(弱碱性)去油腻;
护发素(弱酸性)调回酸性 。
★ 洗脸 —— 洗面奶(弱碱性)去油腻;
爽肤水(弱酸性)调回酸性 。
建议:
近年来,医学研究发现,人体体液的酸碱度与智商水平有密切关系。在体液酸碱度允许的范围内,酸性偏高者智商较低,碱性偏高则智商较高。
科学家测试了数十名6至13岁的男孩,结果表明,大脑皮层中的体液pH大于7.0的孩子,比 小于7.0的孩子的智商高出1倍之多。
资料:PH与智商
判断酸、碱性食物,并非以口感为据。日常所吃的食物按其本身所含元素成分的多少,可分为碱性食物、酸性食物和中性食物。
·碱性食物是含钾、钙、钠、镁等元素较多的食物,如:各种蔬菜、水果、牛奶、大豆和菌类食物等;
·酸性食物是含磷、硫、氯等元素较多的食物,如:肉类、禽蛋类、鱼类等动物性食物及面粉、大米、花生等;
·中性食物是指提炼出很纯的油脂、糖、淀粉类食物。
资料:PH与食品
碱性食品:除了五谷杂粮外的植物性食品
·强碱性 —— 葡萄、葡萄酒、海带芽、海带,等。 尤其是天然绿藻,最佳饮用时间为早9点至11点。
·中碱性 —— 大豆、红萝卜、番茄、香蕉、橘子、 南瓜、草莓、蛋白、梅干、柠檬、菠菜,等。
·弱碱性 —— 红豆、萝卜、苹果、甘蓝菜、洋葱、 豆腐,等。
酸性食品:牛奶以外的动物性食品
·强酸性 —— 蛋黄、乳酪、白糖做的西点或柿子、 柴鱼,等。
·中酸性 —— 火腿、培根、鸡肉、猪肉、鳗鱼、 牛肉、面包、小麦、奶油,等。
·弱酸性——大米、花生、啤酒、海苔、泥鳅,等。
中性食品:油、盐、咖啡、茶,等
资料:常见的酸碱食品
1、测定某溶液的pH,若先用水把试纸润湿再测定pH,则实际测得值与真实值相比( )
A. 变大 B. 变小 C. 不变 D. 无法确定
2、某溶液pH值为1,现欲使溶液的pH值变为5,则可以加入下列哪种溶液( )
A. pH=3的溶液
B. pH=7的溶液
C. pH=9的溶液
B
D
3、(2010 ·宜昌中考)生活中一些常见物质的pH如下图,下列四种物质中酸碱性与众不同的是( )
4、用pH试纸测定白醋的酸碱度时,如果先将试纸用蒸馏水润湿,再把白醋滴到试纸上,则测得的结果与白醋实际的pH比较( )A.偏低 B.偏高 C.相等 D.无法比较
5、下列各PH表示溶液酸性最强的是( )
A. PH=14 B. PH=7 C. PH=1 D. PH=0
B
A.肥皂水 B.牙膏 C.西瓜汁 D.玉米粥
C
D
6、某中学学生到野外交游,若不小心被蚊虫叮咬(蚊虫能分泌出蚁酸),下列物质用手涂抹以减轻疼痛的是 (填字母).
A.食醋(pH<7) B.食盐水(pH=7) C.肥皂水(pH>7)
小明想用pH试纸测定食醋的pH试纸用水润湿后,用筷子将食醋滴在pH试纸上,他测得的pH将比实际结果 (填“偏大”“偏小”或“不变”)
7、测定pH值最简单的方法是使用 , 测定时,用 蘸取待测溶液,滴在 上,然后再与 对照,便可测出溶液的pH值。若用此法测得土壤的pH值小于5,可以施用适量的 来改良土壤。
C
偏大
pH试纸
玻璃棒
pH试纸
标准比色卡
碱石灰
物质 肥皂水 雨水 糖水 柠檬汁 洗洁精
pH 10.2 5.2 7.0 2.5 12.2
8、小明同学取下列生活中的物质,测得其pH如下表所示:
由此判断:
(1)酸性最强的物质是________。
(2)能使无色酚酞试液变红色的物质是_____ _(填一种物质即可)。
(3)正常雨水的pH约为5.6。小明生活的环境所降的雨水_____(填“属于”或“不属于”)酸雨。
柠檬汁
肥皂水
属于
酸性溶液
酸溶液
酸溶液一定显酸性;酸性溶液不一定是酸
—— 溶质为酸的溶液
— 显酸性的溶液(能使石蕊变红)
碱溶液一定显碱性;碱性溶液不一定是碱
酸液 HCl、H2SO4
盐溶液 CuSO4溶液
酸液 HCl 、H2SO4
【补充2】酸溶液一定显酸性?酸性溶液一定是酸?
碱溶液
碱性溶液
碱溶液一定显碱性;碱性溶液不一定是碱 !
【补充1】碱溶液一定显碱性?碱性溶液一定是碱?
—— 显碱性的溶液
(能使石蕊变蓝、酚酞变红的溶液)
—— 溶质为碱的溶液
碱液 NaOH、Ca(OH)2
盐溶液 Na2CO3液、NaHCO3液
碱液 NaOH、石灰水Ca(OH)2
补充·拓展
强酸:HCl,H2SO4
弱酸:H2CO3
强碱:NaOH、Ca(OH)2
弱碱:NH3·H2O、Cu(OH)2等不溶性碱
问题:为什么盐溶液会显中性、碱性或酸性?
酸 + 碱 —— 盐 + H2O 【复分解;中和】
补充·拓展
强酸 + 强碱 → 盐,溶液显中性,如:NaCl、 CaCl2 、 Na2SO4 ,等 【强酸强碱盐显中性】
酸 + 碱 —— 盐 + H2O 【复分解;中和】
问题:为什么盐溶液会显中性、碱性或酸性?
弱酸 + 强碱 → 盐,溶液显碱性,如:Na2CO3、 NaHCO3 ,等 【弱酸强碱盐显碱性】
强酸 + 弱碱 → 盐,溶液显酸性,如:NH4Cl、 CuSO4 ,等 【强酸弱碱盐显酸性】
同课章节目录
