9.2.1饱和溶液和不饱和溶液课件—2021-2022学年九年级化学人教版下册(18张PPT)
文档属性
| 名称 | 9.2.1饱和溶液和不饱和溶液课件—2021-2022学年九年级化学人教版下册(18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-26 07:17:06 | ||
图片预览



文档简介
(共18张PPT)
第九单元 溶 液
课题2 溶解度
(第1课时)
1. 饱和、不饱和溶液
3. 饱和、不饱和的相互转化
2. 如何判断一瓶溶液是不是饱和溶液?
内容:
二、溶解度
(一)物质的溶解性
1.影响因素
—粗略表示物质溶解能力的大小
内因:溶质种类、溶剂种类
(或溶质性质、溶剂性质 )
2.溶解性分类:
难溶、微溶、可溶、易溶
外因:温度
食盐
碘
20℃ 10g水
汽油
水
油脂
10℃10克水
60℃10克水
KNO3
2.0g
11g
溶质
溶剂
溶液质量
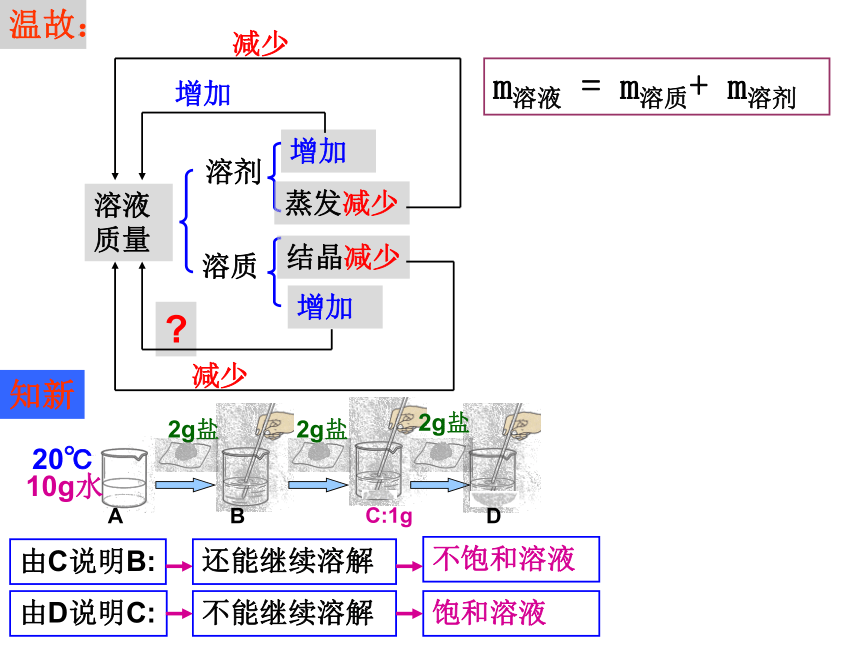
温故:
m溶液 = m溶质+ m溶剂
增加
增加
蒸发减少
结晶减少
增加
减少
减少
2g盐
2g盐
2g盐
20℃
10g水
A
B
C:1g
D
不饱和溶液
饱和溶液
由C说明B:
还能继续溶解
不能继续溶解
由D说明C:
知新
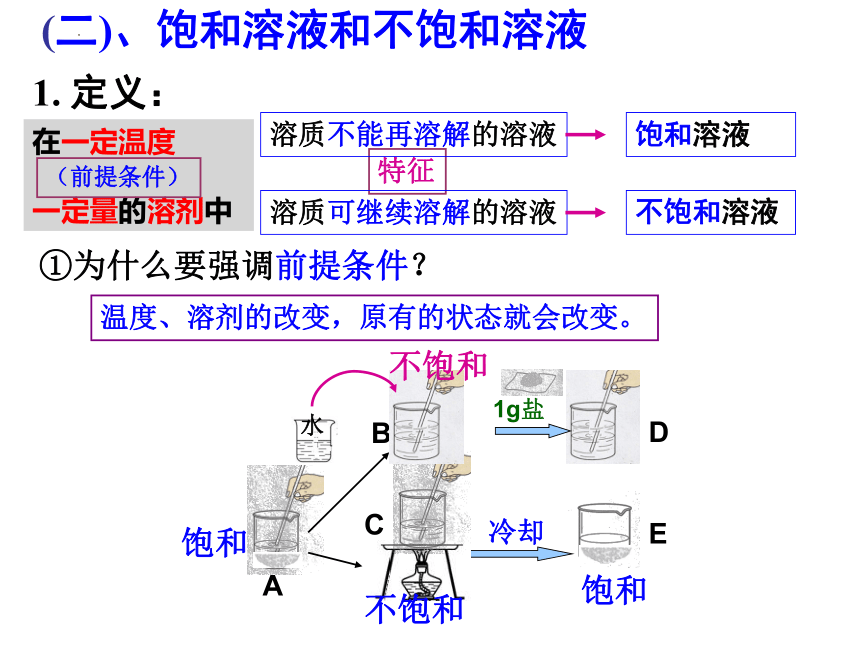
温度、溶剂的改变,原有的状态就会改变。
(二)、饱和溶液和不饱和溶液
饱和溶液
不饱和溶液
在一定温度
一定量的溶剂中
1. 定义:
(前提条件)
特征
①为什么要强调前提条件?
溶质可继续溶解的溶液
溶质不能再溶解的溶液
冷却
1g盐
B
D
E
C
A
饱和
不饱和
不饱和
饱和
水
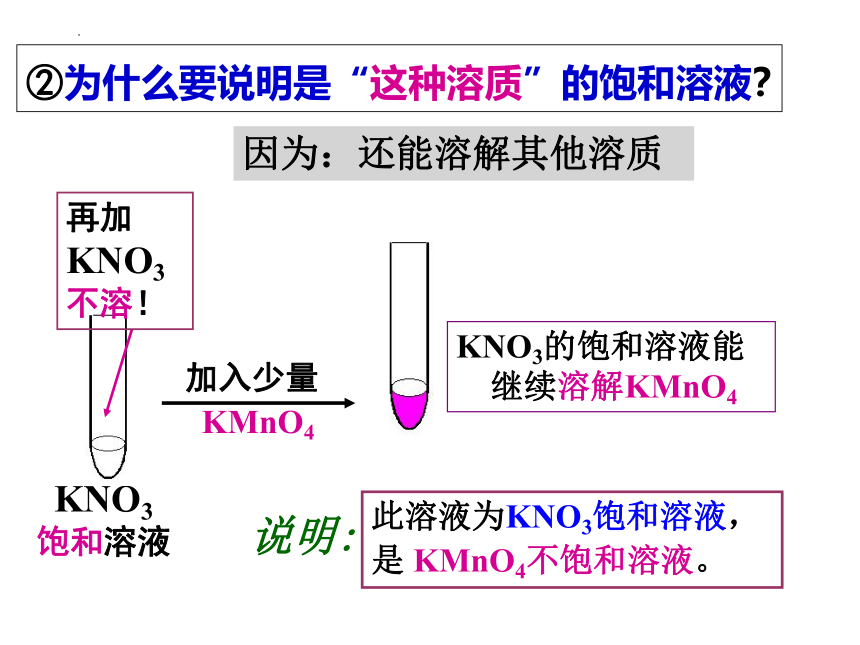
KNO3
饱和溶液
加入少量
KMnO4
说明:
KNO3的饱和溶液能
继续溶解KMnO4
此溶液为KNO3饱和溶液,
是 KMnO4不饱和溶液。
②为什么要说明是“这种溶质”的饱和溶液?
因为:还能溶解其他溶质
再加
KNO3
不溶!
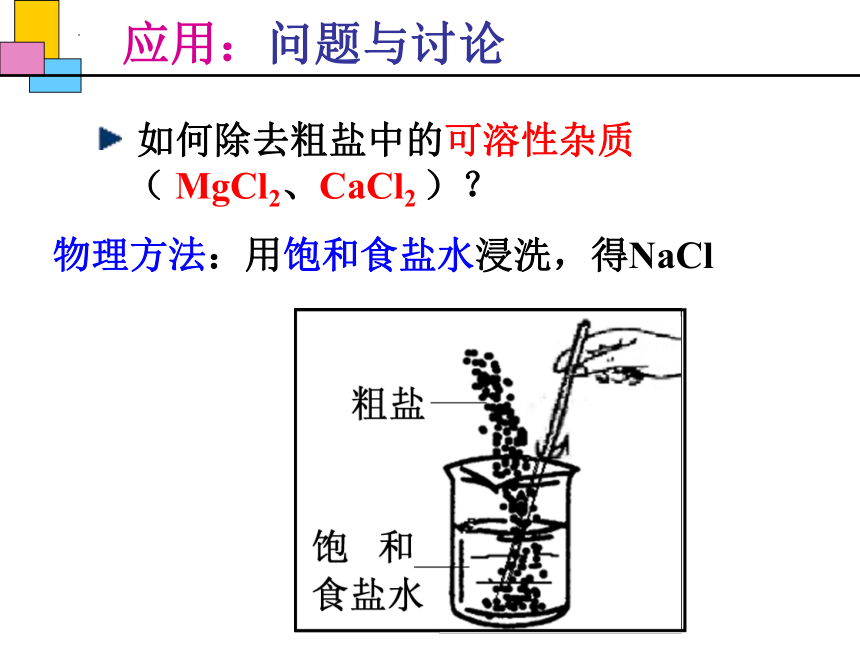
应用:问题与讨论
如何除去粗盐中的可溶性杂质( MgCl2、CaCl2 )?
物理方法:用饱和食盐水浸洗,得NaCl
2. 如何判断一瓶溶液是不是饱和溶液?
B
A
M物质在t℃完成溶解过程的A、B两种状态,如下图:
溶液为饱和状态
看不见溶质
可能是:
恰好饱和
不饱和
加入该溶质
不溶
能溶
温度不变
溶剂不变
剩余溶质
3.不饱和、饱和的相互转化
不饱和溶液 饱和溶液
加溶质
蒸发水分
降温(一般)
思考 2: 如何将KNO3饱和溶液变成不饱和溶液?
加水;
升温
思考 1: 如何将KNO3不饱和溶液变成饱和溶液?
加KNO3;
蒸发水分;
降温
加水
升温
蒸发水分
结晶
降温
(一般)
结晶后的溶液为
母液--
饱和
思考 3:为什么对温度要强调一般?
一定可行
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
固体溶解度与温度的关系
.a
.b
溶解度:是溶解性的定量表示。
用温度改变溶液的状态,一定要考滤:
固体溶解度与温度的关系
C
饱和溶液 不饱和溶液
加水;
降温
加Ca(OH)2;
蒸发水分;
升温
提醒:
绝大多数固体的溶解性随温度升高而增大;
但 氢氧化钙(熟石灰)则相反。
对Ca(OH)2,特别要注意温度!
—— 一定量溶剂中含溶质质量的多少
思考:有人说饱和溶液一定就是浓溶液,
稀溶液肯定是不饱和的,你认为对吗?
浓溶液、稀溶液
浓溶液
(浓度大)
稀溶液 (浓度小)
生活所说的“浓溶液、稀溶液”
是什么意思?
4、“饱和溶液、不饱和溶液”与“浓溶液、稀溶液”的关系
【饱,溶0.04g】
【不饱,溶2g】
【饱,稀】
【不饱,浓】
结论:溶质不同,饱和溶液不一定是浓溶液!
【饱,溶3.6g】
4、“饱和溶液、不饱和溶液”与“浓溶液、稀溶液”的关系
【饱,溶0.04g】
【不饱,溶2g】
【饱,稀】
【不饱,稀】
【饱,溶3.6g】
问题:
溶质相同,
饱和溶液
一定浓吗
【饱,浓】
结论:同温同溶质同剂,饱和溶液一定比不饱和浓
不一定;
还要看
温度。
一、饱和溶液和不饱和溶液
结论2:
同温、同溶质的饱和溶液一定比不饱和浓!
1. 饱和、不饱和溶液
3. 饱和、不饱和的相互转化
4. 饱和、不饱和与浓、稀没有必然的联系
结论1:饱和溶液不一定是浓溶液!
稀溶液不一定不饱!
2. 如何判断一瓶溶液是不是饱和溶液?
1. 下列说法正确的是 ( )
A. 同种溶质的饱和溶液一定比不饱和溶液浓
B. 同一温度下,饱和溶液一定比不饱和溶液浓
C. 不饱和溶液降温一定会变成饱和溶液
D. 同一溶质,同一温度,饱和溶液一定比 不饱和溶液浓
D
巩固练习【学案:P30】
2.理清溶液及相关基本概念的关系,用“一定”或“不一定”填空:
(1)溶液 是混合物,溶液 是无色的。
(2)溶液中 含有溶质,但溶质 是一种,并且溶质 是固体。
(3)饱和溶液 是浓溶液,不饱和溶液 是稀溶液。
(4)一定温度,同种溶质的饱和溶液 比
不饱和溶液浓。
3.我们已经知道这样的事实:
① 食盐易溶于水,难溶于植物油;
② 硝酸钾易溶于水,碳酸钙难溶于水;
③ 蔗糖在热水中溶解的质量比在等质量的冷水中溶解的质量多。
请你回答下列问题:
(1)以上事实表明,固体物质的溶解能力与
、 、 三种因素有关。
(2)请你举出上述三种因素中的一个应用实例
(要求与上面所列事实不同)
。
溶剂种类 溶质种类 温度
医疗上将碘溶于酒精配制碘酒,进行消毒;
油污难溶于水,生活中用汽油去油污;
1. 有哪些因素可以影响食盐溶解的速率?
因素一: ;你的预测: 。
温度
4.讨论
因素二: ;
因素三: 。
搅拌 或 振荡
接触面积
温度越高,溶解越快
2. 选一种因素,设计实验证明你的预测:
探究实验:
因素一: ;你的预测: 。
温度
温度越高,溶解越快
在等质量的、 20℃和80℃的水中,加入等质量的同种食盐,食盐在80℃的水中溶解得更快。
第九单元 溶 液
课题2 溶解度
(第1课时)
1. 饱和、不饱和溶液
3. 饱和、不饱和的相互转化
2. 如何判断一瓶溶液是不是饱和溶液?
内容:
二、溶解度
(一)物质的溶解性
1.影响因素
—粗略表示物质溶解能力的大小
内因:溶质种类、溶剂种类
(或溶质性质、溶剂性质 )
2.溶解性分类:
难溶、微溶、可溶、易溶
外因:温度
食盐
碘
20℃ 10g水
汽油
水
油脂
10℃10克水
60℃10克水
KNO3
2.0g
11g
溶质
溶剂
溶液质量
温故:
m溶液 = m溶质+ m溶剂
增加
增加
蒸发减少
结晶减少
增加
减少
减少
2g盐
2g盐
2g盐
20℃
10g水
A
B
C:1g
D
不饱和溶液
饱和溶液
由C说明B:
还能继续溶解
不能继续溶解
由D说明C:
知新
温度、溶剂的改变,原有的状态就会改变。
(二)、饱和溶液和不饱和溶液
饱和溶液
不饱和溶液
在一定温度
一定量的溶剂中
1. 定义:
(前提条件)
特征
①为什么要强调前提条件?
溶质可继续溶解的溶液
溶质不能再溶解的溶液
冷却
1g盐
B
D
E
C
A
饱和
不饱和
不饱和
饱和
水
KNO3
饱和溶液
加入少量
KMnO4
说明:
KNO3的饱和溶液能
继续溶解KMnO4
此溶液为KNO3饱和溶液,
是 KMnO4不饱和溶液。
②为什么要说明是“这种溶质”的饱和溶液?
因为:还能溶解其他溶质
再加
KNO3
不溶!
应用:问题与讨论
如何除去粗盐中的可溶性杂质( MgCl2、CaCl2 )?
物理方法:用饱和食盐水浸洗,得NaCl
2. 如何判断一瓶溶液是不是饱和溶液?
B
A
M物质在t℃完成溶解过程的A、B两种状态,如下图:
溶液为饱和状态
看不见溶质
可能是:
恰好饱和
不饱和
加入该溶质
不溶
能溶
温度不变
溶剂不变
剩余溶质
3.不饱和、饱和的相互转化
不饱和溶液 饱和溶液
加溶质
蒸发水分
降温(一般)
思考 2: 如何将KNO3饱和溶液变成不饱和溶液?
加水;
升温
思考 1: 如何将KNO3不饱和溶液变成饱和溶液?
加KNO3;
蒸发水分;
降温
加水
升温
蒸发水分
结晶
降温
(一般)
结晶后的溶液为
母液--
饱和
思考 3:为什么对温度要强调一般?
一定可行
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
200
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸铵
硝酸钾
硝酸钠
氯化铵
氯化钠
硼酸
固体溶解度与温度的关系
.a
.b
溶解度:是溶解性的定量表示。
用温度改变溶液的状态,一定要考滤:
固体溶解度与温度的关系
C
饱和溶液 不饱和溶液
加水;
降温
加Ca(OH)2;
蒸发水分;
升温
提醒:
绝大多数固体的溶解性随温度升高而增大;
但 氢氧化钙(熟石灰)则相反。
对Ca(OH)2,特别要注意温度!
—— 一定量溶剂中含溶质质量的多少
思考:有人说饱和溶液一定就是浓溶液,
稀溶液肯定是不饱和的,你认为对吗?
浓溶液、稀溶液
浓溶液
(浓度大)
稀溶液 (浓度小)
生活所说的“浓溶液、稀溶液”
是什么意思?
4、“饱和溶液、不饱和溶液”与“浓溶液、稀溶液”的关系
【饱,溶0.04g】
【不饱,溶2g】
【饱,稀】
【不饱,浓】
结论:溶质不同,饱和溶液不一定是浓溶液!
【饱,溶3.6g】
4、“饱和溶液、不饱和溶液”与“浓溶液、稀溶液”的关系
【饱,溶0.04g】
【不饱,溶2g】
【饱,稀】
【不饱,稀】
【饱,溶3.6g】
问题:
溶质相同,
饱和溶液
一定浓吗
【饱,浓】
结论:同温同溶质同剂,饱和溶液一定比不饱和浓
不一定;
还要看
温度。
一、饱和溶液和不饱和溶液
结论2:
同温、同溶质的饱和溶液一定比不饱和浓!
1. 饱和、不饱和溶液
3. 饱和、不饱和的相互转化
4. 饱和、不饱和与浓、稀没有必然的联系
结论1:饱和溶液不一定是浓溶液!
稀溶液不一定不饱!
2. 如何判断一瓶溶液是不是饱和溶液?
1. 下列说法正确的是 ( )
A. 同种溶质的饱和溶液一定比不饱和溶液浓
B. 同一温度下,饱和溶液一定比不饱和溶液浓
C. 不饱和溶液降温一定会变成饱和溶液
D. 同一溶质,同一温度,饱和溶液一定比 不饱和溶液浓
D
巩固练习【学案:P30】
2.理清溶液及相关基本概念的关系,用“一定”或“不一定”填空:
(1)溶液 是混合物,溶液 是无色的。
(2)溶液中 含有溶质,但溶质 是一种,并且溶质 是固体。
(3)饱和溶液 是浓溶液,不饱和溶液 是稀溶液。
(4)一定温度,同种溶质的饱和溶液 比
不饱和溶液浓。
3.我们已经知道这样的事实:
① 食盐易溶于水,难溶于植物油;
② 硝酸钾易溶于水,碳酸钙难溶于水;
③ 蔗糖在热水中溶解的质量比在等质量的冷水中溶解的质量多。
请你回答下列问题:
(1)以上事实表明,固体物质的溶解能力与
、 、 三种因素有关。
(2)请你举出上述三种因素中的一个应用实例
(要求与上面所列事实不同)
。
溶剂种类 溶质种类 温度
医疗上将碘溶于酒精配制碘酒,进行消毒;
油污难溶于水,生活中用汽油去油污;
1. 有哪些因素可以影响食盐溶解的速率?
因素一: ;你的预测: 。
温度
4.讨论
因素二: ;
因素三: 。
搅拌 或 振荡
接触面积
温度越高,溶解越快
2. 选一种因素,设计实验证明你的预测:
探究实验:
因素一: ;你的预测: 。
温度
温度越高,溶解越快
在等质量的、 20℃和80℃的水中,加入等质量的同种食盐,食盐在80℃的水中溶解得更快。
同课章节目录
