9.3.2溶液的浓度课件—2021-2022学年九年级化学人教版下册(19张PPT)
文档属性
| 名称 | 9.3.2溶液的浓度课件—2021-2022学年九年级化学人教版下册(19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 304.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-26 08:01:18 | ||
图片预览





文档简介
(共19张PPT)
第九单元 溶 液
(第二课时)
内容:
a.溶液的稀释 b.W%与化学方程式
c.溶解度曲线中温度变化与W%变化
溶质的质量分数—溶液浓度
3、变式1:溶质质量 =
1、概念:溶质质量与溶液质量之比。
2、基本公式:
溶质的质量分数 (w%)=
溶质质量
溶液质量
×100%
溶质
w%
变式2:溶液质量 =
溶液质量 × w%
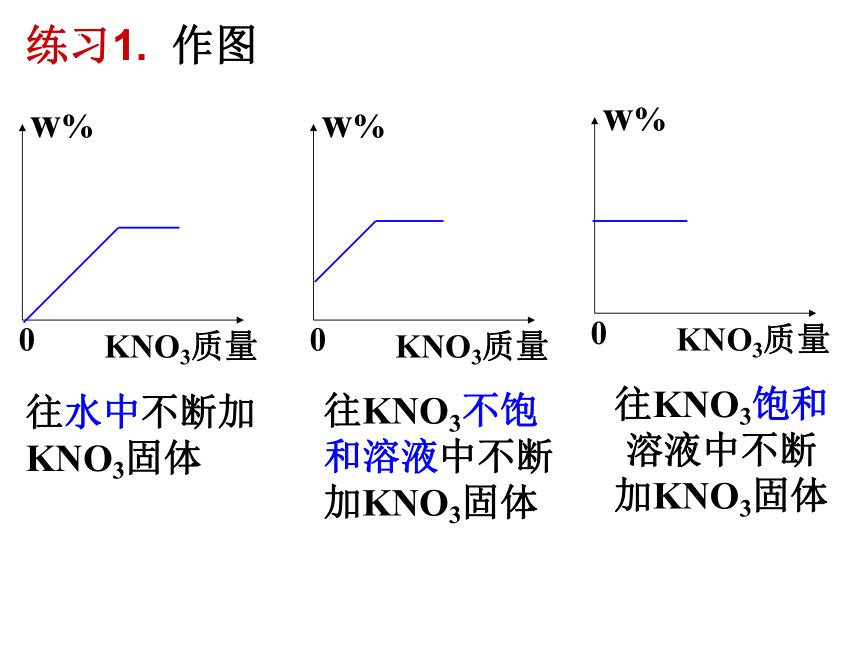
w%
KNO3质量
0
往水中不断加KNO3固体
往KNO3不饱和溶液中不断加KNO3固体
往KNO3饱和溶液中不断 加KNO3固体
w%
KNO3质量
0
w%
KNO3质量
0
练习1. 作图
一、溶液的增浓
例1.若将100g 10%的硝酸钾溶液,变成20%
原溶质的质量:
(1)加溶质。需要加硝酸钾固体多少g?
解1:设加硝酸钾质量为 x
—— 增加溶质或蒸发水分
(2)蒸发溶剂。需要蒸发多少g水?
解2:设蒸发水质量为 y
=20%
10g+x
100g+x
×100%
10g
100g-y
×100%
=20%
100g ×10%=10g
溶质的质量分数 (w%)=
溶质质量
溶液质量
×100%
依据:
答:…………。
×= a g
y= b g
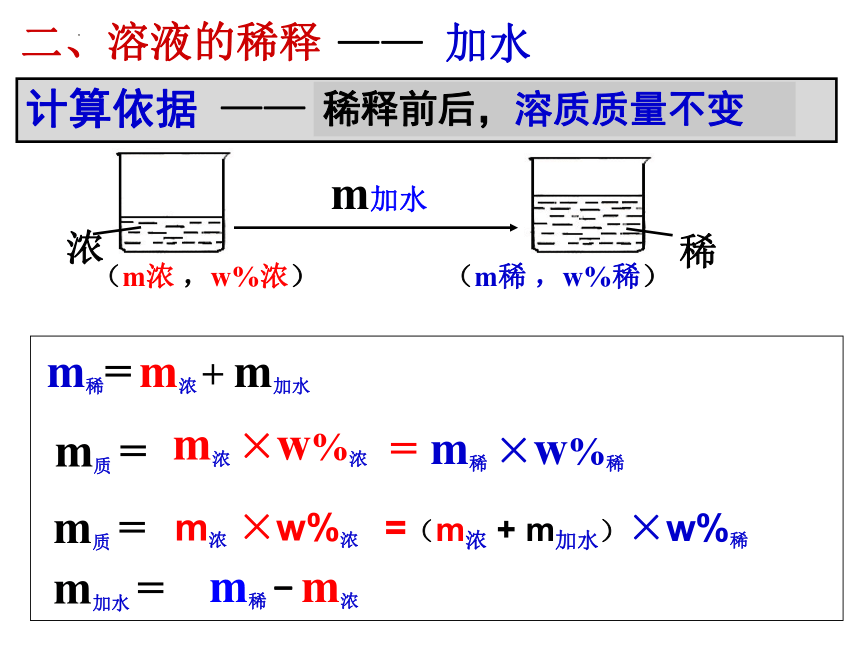
二、溶液的稀释
计算依据 ——
稀释前后,溶质质量不变
浓
稀
(m浓 ,w%浓)
(m稀 ,w%稀)
m加水
m浓 ×w%浓
= m稀 ×w%稀
m加水 =
—— 加水
m质 =
m稀 - m浓
m稀= m浓 + m加水
m浓 ×w%浓
=(m浓 + m加水)×w%稀
m质 =
【教材P44】 例题2. 要把50g质量分数为98%的浓硫酸稀释为20%的硫酸溶液,需要多少克水?
解:
设 稀硫酸的质量为x。
50g × 98% = x × 20%
x = 245g
m加水 = 245g - 50g = 195g
m加水 = m稀 - m浓
m浓 ×w%浓
= m稀 ×w%稀
二法:设加水的质量为Y。
50g× 98%=(50g+Y)× 20%
X=195g
答:…………。
练习. 列式计算:对100g 10%的氯化钠溶液进行下列两种操作,其浓度如何变化?
(1)加入10g 水
(2)加入10g NaCl (全溶)
NaCl% =
加水,w%↓
= 9.1%
加溶质,w%↑
10g + 10g
100g + 10g
×100%
= 18.2%
m溶质 =m溶液 × W%
mNaCl(原) =
m溶液 =
10g
100g + 10g
×100%
m溶液 = m溶质 + m溶剂
100g× 10%=10g
100g+10g=110g
解:
100g+10g=110g
100g× 10%=10g
NaCl% =
解:
mNaCl =
m溶液 =
溶液在参加反应时,反应物是纯净的溶质。
溶液、合金、矿石是混合物,不能将其的质量直接代入化学方程式进行计算。
m溶质 = m溶液 × w%
× 100%
w% =
m溶质
m溶液
代入方程式的数据一定是“参加反应”的“纯净物”的质量
三、化学方程式中涉及溶液的计算
M有效成分 = M混合物 × 有效成分%
73g质量分数为20%的盐酸与足量的大理石反应,生成CO2的质量为多少?
例1.(教材P45:6)
解:设CO2的质量为 x
73g×20% x
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
-------- -----
2×36.5 44
73g×20% x
2×36.5 44
=
x = 8.8g
答:…………。
强调:
已知量:带单位,未知量:不带单位
H — 1 O — 16 S — 32 Zn — 65
13g锌与100g某硫酸恰好完全反应,试计算:
Zn + H2SO4 == ZnSO4 + H2↑
(1)生成氢气
(2)这种硫酸中溶质的质量分数。
13g x
解:设H2质量为x
例2.(教材P45:5)
65 2
13g x
65 2
=
x = 0.4g
答:…………。
再次强调:
已知量:带单位,未知量:不带单位
65
13g
H — 1 O — 16 S — 32 Zn — 65
13g锌与100g某硫酸恰好完全反应。
Zn + H2SO4 == ZnSO4 + H2↑
试计算(2)这种硫酸中溶质的质量分数。
y
解:设纯H2SO4质量为y
例2.(教材P45:5)
H2SO4%= ×100% = 19.6%
19.6g
100g
要 求 a%,
先求 m溶质
98
13g y
65 98
=
y = 19.6g
× 100%
w% =
m溶质
m溶液
再求 :
答:…………。
—交点及温度变化与W%的变化
四、溶解度曲线
溶解度(克)
温度
A
B
注 意:①相应温度,两物质饱和溶液中溶质质量不一定相等;
(相应温度,两物质等质量的饱和溶液中溶质质量一定相等)
1、交 点:
①表示相应温度下,两种
物质的溶解度相等;
②相应温度时,两种物质
饱和溶液的 w%相等。
t
2、溶解度曲线 — 温度变化,引起w% 的变化
方法:先判断温度变化后,溶液是饱还是不饱
w%不变
饱
饱
不饱
w%变小
t1 →t2: 饱和 → 点沿曲线移动→ w%变小
t2→t1: 不饱 → 点平移 → w%不变
溶解度(克)
温度(t)
A
B
t1 t2
问1: t1℃,A、B
饱和溶液升温到 t2 ℃,
t1℃: A1% B1%;
t2℃ :A2% B2%。
A2(不饱)
B2(饱)
B1(饱)
A1(饱)
3、固体溶解度曲线 —— 温度变化,w%大小比较
溶解度(克)
温度(t)
A
B
t1 t2
3、固体溶解度曲线 —— 温度变化,w%大小比较
B1(不饱)
A1(饱)
问2: t2℃,A、B
饱和溶液降温到 t1 ℃,
t2℃: A2% B2%;
t1℃ :A1% B1%。
A2
B2
a
b
c
t2 温度/℃
溶解度/g
0 t1
练习1.如图是a、b、c三种物质的溶解度曲线。 现将t1℃时的三种物质的饱和溶液,将其都升温至t2℃时,下列说法错误的是( )
A.a溶液中的溶质质量分数最大
B.c溶液中的溶质质量分数最小
C.a、b溶液均为不饱和溶液
D.c溶液中有晶体析出
c1
c2(饱)
b1
b2(不饱)
a1
a2(不饱)
A
练2. 将80℃的硝酸钾不饱和溶液降温至20℃(有晶体析出),下列说法不正确的是( )
A.溶液变成饱和,溶质的质量分数变大
B.溶剂的质量不变
C.溶液变成饱和,溶质的质量分数变小
D.硝酸钾的溶解度变小
KNO3不饱 → 饱 m质 m水 m液 w%
① 加KNO3
② 蒸发水分
③ 降温
↘ — ↘ ↘
刚好饱和
析出晶体
A
练3.如图为M、N两固体物质的溶解度曲线。根据图示判断下列说法中正确的是( )
A.t1℃时,M、N的饱和溶液中溶质的质量分数相等
B.t1℃时,将M的饱和溶液升温至t2℃,溶液中溶质的质量分数增大
C.t1℃时,将N的饱和溶液升温至t2℃,溶液中溶质的质量分数不变
D.t2℃时,M、N的饱和溶液分别降温至t1℃,
两溶液中都析出晶体
A
练习4判断.勾画关键词!
1.一定温度下,蔗糖的饱和溶液,一定比它的不饱和溶液的浓度大 ( )
2.不饱和溶液→变饱和,其w%一定增大 ( )
3.饱和溶液恒温蒸发溶剂析出晶体,w%一定减小 ( )
4.某饱和溶液降温析出晶体后,w%一定减小 ( )
第九单元 溶 液
(第二课时)
内容:
a.溶液的稀释 b.W%与化学方程式
c.溶解度曲线中温度变化与W%变化
溶质的质量分数—溶液浓度
3、变式1:溶质质量 =
1、概念:溶质质量与溶液质量之比。
2、基本公式:
溶质的质量分数 (w%)=
溶质质量
溶液质量
×100%
溶质
w%
变式2:溶液质量 =
溶液质量 × w%
w%
KNO3质量
0
往水中不断加KNO3固体
往KNO3不饱和溶液中不断加KNO3固体
往KNO3饱和溶液中不断 加KNO3固体
w%
KNO3质量
0
w%
KNO3质量
0
练习1. 作图
一、溶液的增浓
例1.若将100g 10%的硝酸钾溶液,变成20%
原溶质的质量:
(1)加溶质。需要加硝酸钾固体多少g?
解1:设加硝酸钾质量为 x
—— 增加溶质或蒸发水分
(2)蒸发溶剂。需要蒸发多少g水?
解2:设蒸发水质量为 y
=20%
10g+x
100g+x
×100%
10g
100g-y
×100%
=20%
100g ×10%=10g
溶质的质量分数 (w%)=
溶质质量
溶液质量
×100%
依据:
答:…………。
×= a g
y= b g
二、溶液的稀释
计算依据 ——
稀释前后,溶质质量不变
浓
稀
(m浓 ,w%浓)
(m稀 ,w%稀)
m加水
m浓 ×w%浓
= m稀 ×w%稀
m加水 =
—— 加水
m质 =
m稀 - m浓
m稀= m浓 + m加水
m浓 ×w%浓
=(m浓 + m加水)×w%稀
m质 =
【教材P44】 例题2. 要把50g质量分数为98%的浓硫酸稀释为20%的硫酸溶液,需要多少克水?
解:
设 稀硫酸的质量为x。
50g × 98% = x × 20%
x = 245g
m加水 = 245g - 50g = 195g
m加水 = m稀 - m浓
m浓 ×w%浓
= m稀 ×w%稀
二法:设加水的质量为Y。
50g× 98%=(50g+Y)× 20%
X=195g
答:…………。
练习. 列式计算:对100g 10%的氯化钠溶液进行下列两种操作,其浓度如何变化?
(1)加入10g 水
(2)加入10g NaCl (全溶)
NaCl% =
加水,w%↓
= 9.1%
加溶质,w%↑
10g + 10g
100g + 10g
×100%
= 18.2%
m溶质 =m溶液 × W%
mNaCl(原) =
m溶液 =
10g
100g + 10g
×100%
m溶液 = m溶质 + m溶剂
100g× 10%=10g
100g+10g=110g
解:
100g+10g=110g
100g× 10%=10g
NaCl% =
解:
mNaCl =
m溶液 =
溶液在参加反应时,反应物是纯净的溶质。
溶液、合金、矿石是混合物,不能将其的质量直接代入化学方程式进行计算。
m溶质 = m溶液 × w%
× 100%
w% =
m溶质
m溶液
代入方程式的数据一定是“参加反应”的“纯净物”的质量
三、化学方程式中涉及溶液的计算
M有效成分 = M混合物 × 有效成分%
73g质量分数为20%的盐酸与足量的大理石反应,生成CO2的质量为多少?
例1.(教材P45:6)
解:设CO2的质量为 x
73g×20% x
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
-------- -----
2×36.5 44
73g×20% x
2×36.5 44
=
x = 8.8g
答:…………。
强调:
已知量:带单位,未知量:不带单位
H — 1 O — 16 S — 32 Zn — 65
13g锌与100g某硫酸恰好完全反应,试计算:
Zn + H2SO4 == ZnSO4 + H2↑
(1)生成氢气
(2)这种硫酸中溶质的质量分数。
13g x
解:设H2质量为x
例2.(教材P45:5)
65 2
13g x
65 2
=
x = 0.4g
答:…………。
再次强调:
已知量:带单位,未知量:不带单位
65
13g
H — 1 O — 16 S — 32 Zn — 65
13g锌与100g某硫酸恰好完全反应。
Zn + H2SO4 == ZnSO4 + H2↑
试计算(2)这种硫酸中溶质的质量分数。
y
解:设纯H2SO4质量为y
例2.(教材P45:5)
H2SO4%= ×100% = 19.6%
19.6g
100g
要 求 a%,
先求 m溶质
98
13g y
65 98
=
y = 19.6g
× 100%
w% =
m溶质
m溶液
再求 :
答:…………。
—交点及温度变化与W%的变化
四、溶解度曲线
溶解度(克)
温度
A
B
注 意:①相应温度,两物质饱和溶液中溶质质量不一定相等;
(相应温度,两物质等质量的饱和溶液中溶质质量一定相等)
1、交 点:
①表示相应温度下,两种
物质的溶解度相等;
②相应温度时,两种物质
饱和溶液的 w%相等。
t
2、溶解度曲线 — 温度变化,引起w% 的变化
方法:先判断温度变化后,溶液是饱还是不饱
w%不变
饱
饱
不饱
w%变小
t1 →t2: 饱和 → 点沿曲线移动→ w%变小
t2→t1: 不饱 → 点平移 → w%不变
溶解度(克)
温度(t)
A
B
t1 t2
问1: t1℃,A、B
饱和溶液升温到 t2 ℃,
t1℃: A1% B1%;
t2℃ :A2% B2%。
A2(不饱)
B2(饱)
B1(饱)
A1(饱)
3、固体溶解度曲线 —— 温度变化,w%大小比较
溶解度(克)
温度(t)
A
B
t1 t2
3、固体溶解度曲线 —— 温度变化,w%大小比较
B1(不饱)
A1(饱)
问2: t2℃,A、B
饱和溶液降温到 t1 ℃,
t2℃: A2% B2%;
t1℃ :A1% B1%。
A2
B2
a
b
c
t2 温度/℃
溶解度/g
0 t1
练习1.如图是a、b、c三种物质的溶解度曲线。 现将t1℃时的三种物质的饱和溶液,将其都升温至t2℃时,下列说法错误的是( )
A.a溶液中的溶质质量分数最大
B.c溶液中的溶质质量分数最小
C.a、b溶液均为不饱和溶液
D.c溶液中有晶体析出
c1
c2(饱)
b1
b2(不饱)
a1
a2(不饱)
A
练2. 将80℃的硝酸钾不饱和溶液降温至20℃(有晶体析出),下列说法不正确的是( )
A.溶液变成饱和,溶质的质量分数变大
B.溶剂的质量不变
C.溶液变成饱和,溶质的质量分数变小
D.硝酸钾的溶解度变小
KNO3不饱 → 饱 m质 m水 m液 w%
① 加KNO3
② 蒸发水分
③ 降温
↘ — ↘ ↘
刚好饱和
析出晶体
A
练3.如图为M、N两固体物质的溶解度曲线。根据图示判断下列说法中正确的是( )
A.t1℃时,M、N的饱和溶液中溶质的质量分数相等
B.t1℃时,将M的饱和溶液升温至t2℃,溶液中溶质的质量分数增大
C.t1℃时,将N的饱和溶液升温至t2℃,溶液中溶质的质量分数不变
D.t2℃时,M、N的饱和溶液分别降温至t1℃,
两溶液中都析出晶体
A
练习4判断.勾画关键词!
1.一定温度下,蔗糖的饱和溶液,一定比它的不饱和溶液的浓度大 ( )
2.不饱和溶液→变饱和,其w%一定增大 ( )
3.饱和溶液恒温蒸发溶剂析出晶体,w%一定减小 ( )
4.某饱和溶液降温析出晶体后,w%一定减小 ( )
同课章节目录
