10.2酸碱中和反应课件—2021-2022学年九年级化学人教版下册(16张PPT)
文档属性
| 名称 | 10.2酸碱中和反应课件—2021-2022学年九年级化学人教版下册(16张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-26 08:02:25 | ||
图片预览





文档简介
(共16张PPT)
课题2 酸和碱的---中和反应
预习并思考:
1、中和反应的定义
2、中和反应的有关实验
3、中和反应的实质
4、中和反应在实际生活中的应用
【第1、2课时】 中和反应及其应用
第十单元 酸和碱
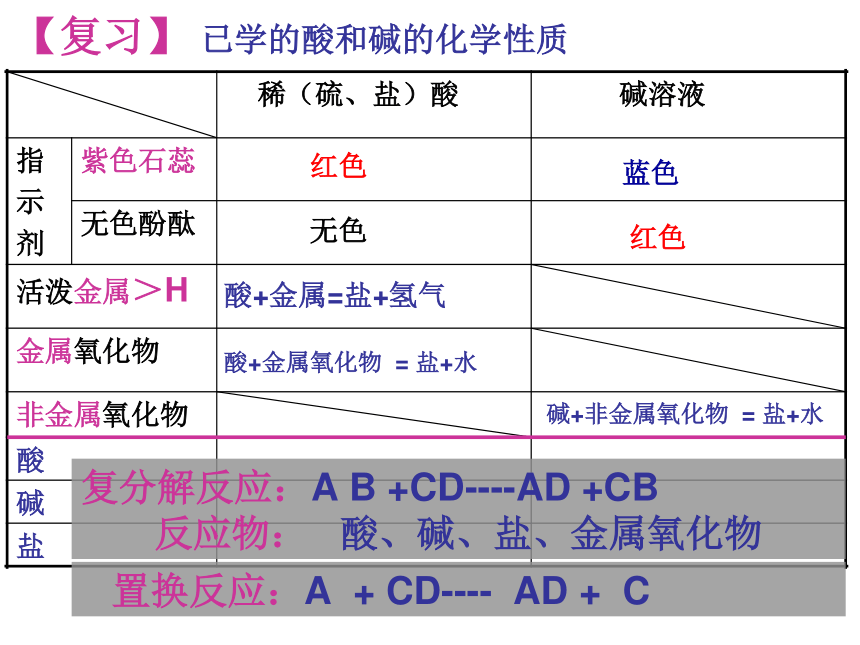
【复习】 已学的酸和碱的化学性质
稀(硫、盐)酸 碱溶液
指 示 剂 紫色石蕊
无色酚酞
活泼金属>H
金属氧化物
非金属氧化物
酸
碱
盐
蓝色
红色
红色
无色
酸+金属=盐+氢气
酸+金属氧化物 = 盐+水
碱+非金属氧化物 = 盐+水
复分解反应:A B +CD----AD +CB
反应物: 酸、碱、盐、金属氧化物
置换反应:A + CD---- AD + C
中和反应:酸 + 碱 —— 盐 + H2O
【知新】
3 2 == Fe2(SO4)3 + 6H2O
· HCl + Cu(OH)2
酸 + 碱 —— 盐 + H2O 【复分解】
· H2SO4 + Fe(OH)3
· HCl + NaOH
2 === CuCl2 + 2H2O
=== NaCl + H2O
一、中和反应:酸 和 碱反应生成盐和水
( 酸碱中和)
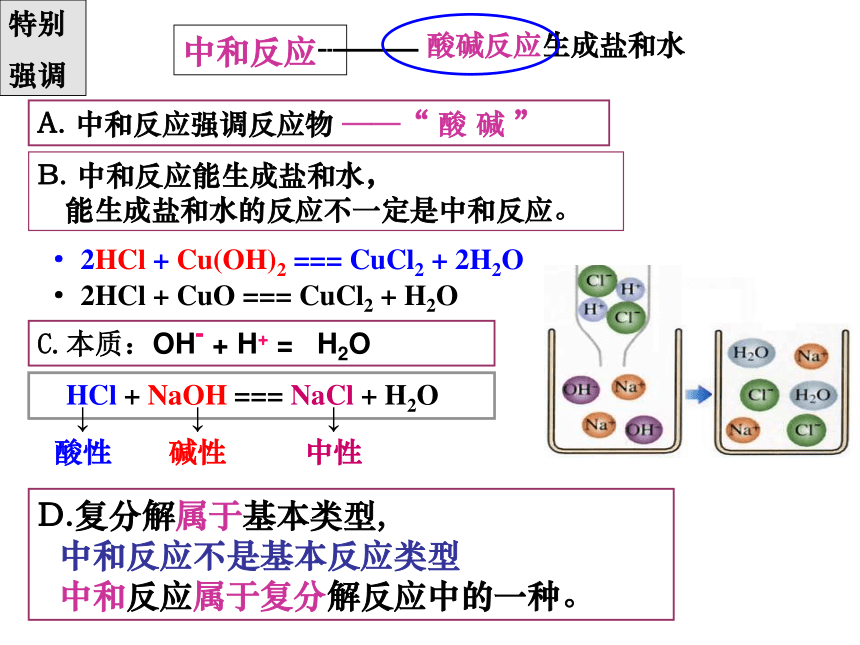
D.复分解属于基本类型,
中和反应不是基本反应类型
中和反应属于复分解反应中的一种。
酸碱反应生成盐和水
中和反应
B. 中和反应能生成盐和水,
能生成盐和水的反应不一定是中和反应。
A. 中和反应强调反应物 ——“ 酸 碱 ”
· 2HCl + CuO === CuCl2 + H2O
· 2HCl + Cu(OH)2 === CuCl2 + 2H2O
特别
强调
HCl + NaOH === NaCl + H2O
↓
碱性
↓
中性
↓
酸性
C.本质:OH- + H+ = H2O
·H2SO4 + Cu(OH)2 === CuSO4 + 2H2O
现象:① 蓝色固体消失;② 溶液变成蓝色。
· HCl + NaOH === NaCl + H2O
现象:无明显现象,但要放热(较少)
中和反应的现象
提出问题
问题:NaOH和HCl反应没有明显现象,
如何证明二者发生了反应?
方案一
中和反应的现象
—— 中和反应要放热(较少)
测定混合溶液前后的温度,
若温度升高,证明二者发生了化学反应。
问题:NaOH和HCl反应没有明显现象,
如何证明二者发生了反应?
提出问题
方案二
使用酸碱
指示剂
1.(HCl + NaOH)不用指示剂有什么不好?
2. 什么现象说明酸和碱恰好完全反应?
3. 能用石蕊溶液代替酚酞溶液作指示剂?
红色刚好变成无色。
可以。
无法判断二者是否反应,及是否完全反应。
· HCl + NaOH === NaCl + H2O
① 中性(恰好完全反应)
② 酸性(HCl过量)
例. 若一开始忘了滴加指示剂,
滴加一定量盐酸后再滴加酚酞,
溶液没有变色,能不能说明二者
恰好完全反应?
盐酸和NaOH
反应后的溶液
设计:证明反应后的溶液是显酸性还是中性?
·石蕊 —— 变红,显酸性,盐酸过量;
不变色,显中性,恰好完全反应。
·Fe —— ···
·CaCO3 —— ···
溶液不可能显碱性!
HCl + NaOH === NaCl + H2O
借助:酸碱指示剂
硫酸厂的污水中含有硫酸等杂质,可以用熟石灰进行中和处理。
Ca(OH)2 + H2SO4 === CaSO4 + 2H2O
二、中和反应在实际中的应用
熟石灰改良酸性土壤
Ca(OH)2 + H2SO4 === CaSO4 + 2H2O
1. 改变土壤的酸碱性 —— 农业
总结:中和反应的应用
2. 处理工厂的废水 工业
Ca(OH)2 + H2SO4 === CaSO4 + 2H2O
3. 用于医药 生活
(2)Mg(OH)2治疗胃酸(即“盐酸”)过多。
(1)用Al(OH)3、Mg(OH)2 难溶、无毒的碱治疗
胃酸过多【即“盐酸”过多】
Mg(OH)2 + 2HCl === MgCl2 + 2H2O
(3)用肥皂水处理蚊虫叮咬。
课题2 酸和碱的---中和反应
预习并思考:
1、中和反应的定义
2、中和反应的有关实验
3、中和反应的实质
4、中和反应在实际生活中的应用
【第1、2课时】 中和反应及其应用
第十单元 酸和碱
【复习】 已学的酸和碱的化学性质
稀(硫、盐)酸 碱溶液
指 示 剂 紫色石蕊
无色酚酞
活泼金属>H
金属氧化物
非金属氧化物
酸
碱
盐
蓝色
红色
红色
无色
酸+金属=盐+氢气
酸+金属氧化物 = 盐+水
碱+非金属氧化物 = 盐+水
复分解反应:A B +CD----AD +CB
反应物: 酸、碱、盐、金属氧化物
置换反应:A + CD---- AD + C
中和反应:酸 + 碱 —— 盐 + H2O
【知新】
3 2 == Fe2(SO4)3 + 6H2O
· HCl + Cu(OH)2
酸 + 碱 —— 盐 + H2O 【复分解】
· H2SO4 + Fe(OH)3
· HCl + NaOH
2 === CuCl2 + 2H2O
=== NaCl + H2O
一、中和反应:酸 和 碱反应生成盐和水
( 酸碱中和)
D.复分解属于基本类型,
中和反应不是基本反应类型
中和反应属于复分解反应中的一种。
酸碱反应生成盐和水
中和反应
B. 中和反应能生成盐和水,
能生成盐和水的反应不一定是中和反应。
A. 中和反应强调反应物 ——“ 酸 碱 ”
· 2HCl + CuO === CuCl2 + H2O
· 2HCl + Cu(OH)2 === CuCl2 + 2H2O
特别
强调
HCl + NaOH === NaCl + H2O
↓
碱性
↓
中性
↓
酸性
C.本质:OH- + H+ = H2O
·H2SO4 + Cu(OH)2 === CuSO4 + 2H2O
现象:① 蓝色固体消失;② 溶液变成蓝色。
· HCl + NaOH === NaCl + H2O
现象:无明显现象,但要放热(较少)
中和反应的现象
提出问题
问题:NaOH和HCl反应没有明显现象,
如何证明二者发生了反应?
方案一
中和反应的现象
—— 中和反应要放热(较少)
测定混合溶液前后的温度,
若温度升高,证明二者发生了化学反应。
问题:NaOH和HCl反应没有明显现象,
如何证明二者发生了反应?
提出问题
方案二
使用酸碱
指示剂
1.(HCl + NaOH)不用指示剂有什么不好?
2. 什么现象说明酸和碱恰好完全反应?
3. 能用石蕊溶液代替酚酞溶液作指示剂?
红色刚好变成无色。
可以。
无法判断二者是否反应,及是否完全反应。
· HCl + NaOH === NaCl + H2O
① 中性(恰好完全反应)
② 酸性(HCl过量)
例. 若一开始忘了滴加指示剂,
滴加一定量盐酸后再滴加酚酞,
溶液没有变色,能不能说明二者
恰好完全反应?
盐酸和NaOH
反应后的溶液
设计:证明反应后的溶液是显酸性还是中性?
·石蕊 —— 变红,显酸性,盐酸过量;
不变色,显中性,恰好完全反应。
·Fe —— ···
·CaCO3 —— ···
溶液不可能显碱性!
HCl + NaOH === NaCl + H2O
借助:酸碱指示剂
硫酸厂的污水中含有硫酸等杂质,可以用熟石灰进行中和处理。
Ca(OH)2 + H2SO4 === CaSO4 + 2H2O
二、中和反应在实际中的应用
熟石灰改良酸性土壤
Ca(OH)2 + H2SO4 === CaSO4 + 2H2O
1. 改变土壤的酸碱性 —— 农业
总结:中和反应的应用
2. 处理工厂的废水 工业
Ca(OH)2 + H2SO4 === CaSO4 + 2H2O
3. 用于医药 生活
(2)Mg(OH)2治疗胃酸(即“盐酸”)过多。
(1)用Al(OH)3、Mg(OH)2 难溶、无毒的碱治疗
胃酸过多【即“盐酸”过多】
Mg(OH)2 + 2HCl === MgCl2 + 2H2O
(3)用肥皂水处理蚊虫叮咬。
同课章节目录
