人教版化学九年级下册 10.2 酸和碱的中和反应-课件(共20张PPT)
文档属性
| 名称 | 人教版化学九年级下册 10.2 酸和碱的中和反应-课件(共20张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-26 09:12:02 | ||
图片预览






文档简介
(共22张PPT)
第十单元课题2
酸和碱的中和反应
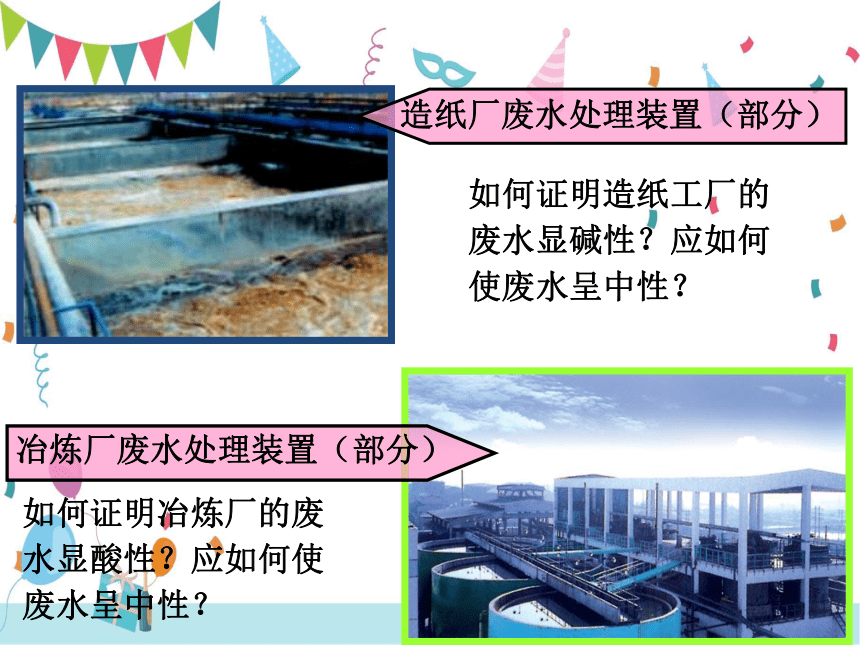
如何证明冶炼厂的废水显酸性?应如何使废水呈中性?
造纸厂废水处理装置(部分)
冶炼厂废水处理装置(部分)
如何证明造纸工厂的废水显碱性?应如何使废水呈中性?
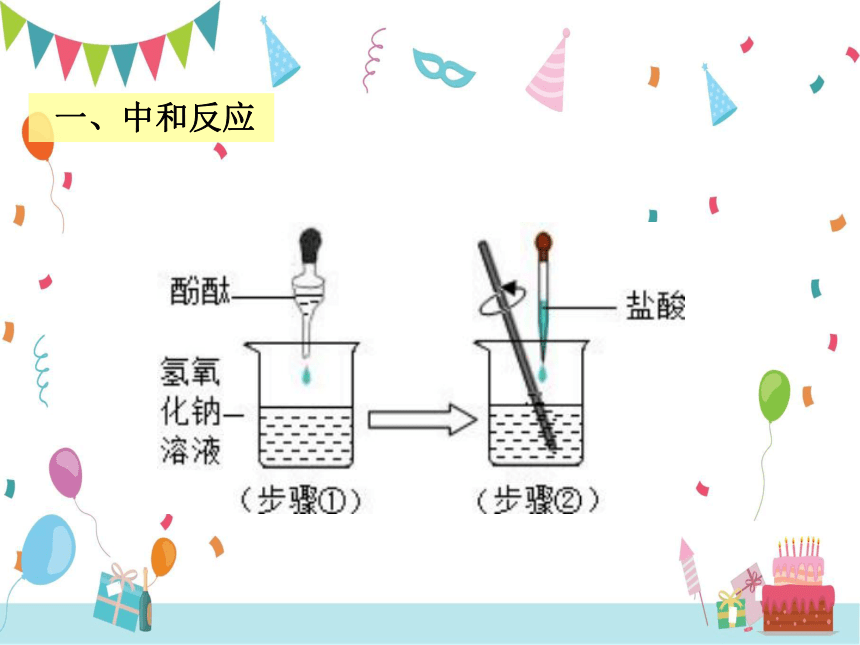
一、中和反应
答:防止稀盐酸滴加过量。
答:起指示作用。因为NaOH与HCl反应无明显的现象发生,根据酚酞溶液由红色变为无色来判断NaOH和HCl是否反应完全。
2. 为什么在操作中必须逐滴滴入稀盐酸?
1. 酚酞在实验中起什么作用?
注意:
滴加盐酸至红色恰好变成无色时立即停止。
否则盐酸过量。
讨论
氢氧化钠(碱)和稀盐酸(酸)反应,生成了
什么?
NaOH + HCl == NaCl + H2O
碱
酸
水
盐
思考:
NaCl == Na+ + Cl-
这个“盐”是指一类物质,和平时说的“食盐”可不同哦!
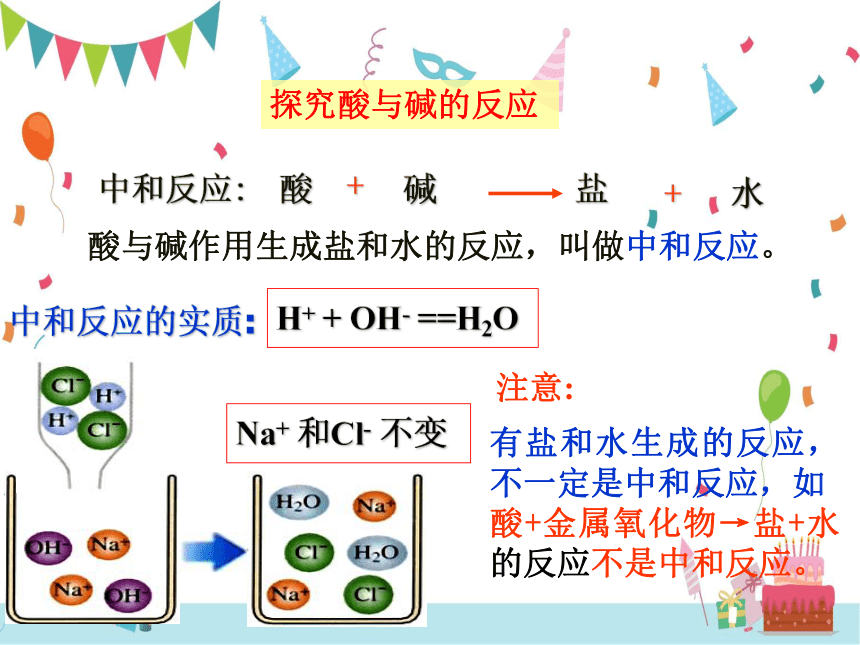
探究酸与碱的反应
中和反应:
碱
酸
盐
水
+
+
中和反应的实质:
H+ + OH- ==H2O
酸与碱作用生成盐和水的反应,叫做中和反应。
Na+ 和Cl- 不变
注意:
有盐和水生成的反应,不一定是中和反应,如
酸+金属氧化物→盐+水的反应不是中和反应。
1.改良土壤的酸碱性
加入 酸性物质
中性土壤
中性土壤
酸性土壤
熟石灰
Ca(OH)2
盐碱地
碱性土壤
二、中和反应在实际中的应用
(1)为什么向酸性土壤中加入熟石灰,而不可以加入氢氧化钠粉末?
答:因为氢氧化钠的腐蚀性太强。
答:是酸雨或化肥。
(2)导致土壤显酸性的主要原因是什么?
讨论:
2. 处理工厂的废水
(1)如何处理硫酸厂生产中形成的含硫酸的污水?
(2)请写出有关反应的化学方程式:
H2
Ca
SO4
(OH)2
2H2O
(3)用CaO来中和污水行不行?
H2SO4+ Ca(OH)2==CaSO4 + 2H2O
H2SO4+ Ca(OH)2==CaSO4 + 2H2O
CaO + H2O==Ca(OH)2
3. 用于医药
(1)中和胃酸过多
用含有氢氧化铝的胃药中和胃中过多的盐酸。
化学方程式:
Al(OH)3 + 3HCl==AlCl3 + 3H2O
(2)中和蚁酸
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么?
可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水。
答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
4.调配食物
如NaCl、Na2SO4
等溶液
如HCl、H2SO4等溶液
如Na2CO3、 Ca(OH)2 、NaOH等溶液
能使石蕊溶液变红
能使酚酞溶液变红,石蕊溶液变蓝
石蕊和酚酞溶液都不变色
三、溶液酸碱度的表示法——pH
pH的范围通常在0~14之间
1.溶液的酸碱性
表示溶液是酸性、中性还是碱性的。(用酸碱指示剂检验)
2.溶液的酸碱度
表示溶液酸碱性的强弱程度。 (用pH试纸测定)
碱性增强
酸性增强
中性
⑴pH 7,溶液显中性 。
⑶ pH 7,溶液显碱性,pH越大,碱性越强。
=
﹥
如NaCl、Na2SO4等溶液
如HCl、H2SO4等溶液
⑵ pH 7,溶液显酸性, pH越小,酸性越强。
如Na2CO3、 Ca(OH)2 、NaOH 等溶液
讨论:溶液的酸碱性与pH的关系
0 7 14
碱性增强
酸性增强
中性
﹤
3.pH的测定——用pH试纸测定
在白瓷板或玻璃片上放一小片pH 试纸,用干净的玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
测定方法:
4.了解溶液的酸碱度有重要意义
①化工生产中许多反应必须在一定pH溶液里才能进行;
②在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
③测定雨水的pH,可以了解空气的污染情况;
[注:正常雨水(含H2CO3)的pH约为5.6,酸雨的pH小于5.6]
④测定人体内或排出的液体的pH,可以了解人体的健康状况。
5.人体内的一些液体和排泄物的正常pH范围
血浆 7.35~7.45
唾液 6.6 ~ 7.1
胃液 0.9 ~ 1.5
乳汁 6.6 ~ 7.6
胆汁 7.1 ~ 7.3
胰液 7.5 ~ 8.0
尿液 4.7 ~ 8.4
粪便 4.6 ~ 8.4
3.由金属离子和酸根离子构成的化合物叫做盐。
1.中和反应:
中和反应在生活和生产中有广泛的应用:
(1)农业 (2)工业 (3)生活
2.溶液的酸碱度可用pH表示,用pH试纸可以测定溶液的酸碱度。 pH 在0~14之间。
(2)了解溶液酸碱度在实际中有重要的意义
农业 、工业 、环境 、生活
酸+碱→盐+水
①pH 7,溶液呈中性,
②pH 7溶液呈酸性, pH越小,酸性越强,
③pH 7溶液呈碱性, pH越大,碱性越强。
(1)溶液的酸碱性与pH的关系:
﹥
﹤
=
小结
2.某工厂排放的废水的pH是4.5,取少量该废水加入试管中,再滴酚酞溶液,溶液呈______色,如果要使试管里溶液的pH升高到=7,可以采用 __________ 的方法。
无
加碱性溶液
1. pH =0的溶液是 ( )
A.不存在 B.酸性溶液 C.碱性溶液 D.中性溶液
B
过关练习
3.下列实验操作记录与序号相同的图像所表示的变化关系不相符合的是( )
A. 向稀NaOH溶液中逐滴滴入pH=1的稀盐酸至过量
B.用水稀释pH=1的硫酸溶液
C.向稀硫酸中逐滴滴入Ba(OH)2溶液至稍过量
D.向镁粉中加入足量的稀硫酸
B
Ba(OH)2+H2SO4=BaSO4↓+2H2O
Mg+H2SO4=MgSO4+2H2↑
4.失去标签的三瓶无色液体,分别是稀HCl、蒸馏水、NaOH溶液,可用 加以区分。
中性溶液
(提示:HCl + NaOH==NaCl + H2O)
稀HCl
蒸馏水
NaOH
步骤:
(2)分别滴加酚酞,振荡。
变红的是NaOH溶液
(3)取少量NaOH溶液再分别滴到另外两只试管中,振荡。
(1)用三支试管,分别取少量三种无色液体。
变红的无色液体是蒸馏水,仍为无色的是稀盐酸。
紫色石蕊溶液
能否用酚酞溶液将它们鉴别出来?
第十单元课题2
酸和碱的中和反应
如何证明冶炼厂的废水显酸性?应如何使废水呈中性?
造纸厂废水处理装置(部分)
冶炼厂废水处理装置(部分)
如何证明造纸工厂的废水显碱性?应如何使废水呈中性?
一、中和反应
答:防止稀盐酸滴加过量。
答:起指示作用。因为NaOH与HCl反应无明显的现象发生,根据酚酞溶液由红色变为无色来判断NaOH和HCl是否反应完全。
2. 为什么在操作中必须逐滴滴入稀盐酸?
1. 酚酞在实验中起什么作用?
注意:
滴加盐酸至红色恰好变成无色时立即停止。
否则盐酸过量。
讨论
氢氧化钠(碱)和稀盐酸(酸)反应,生成了
什么?
NaOH + HCl == NaCl + H2O
碱
酸
水
盐
思考:
NaCl == Na+ + Cl-
这个“盐”是指一类物质,和平时说的“食盐”可不同哦!
探究酸与碱的反应
中和反应:
碱
酸
盐
水
+
+
中和反应的实质:
H+ + OH- ==H2O
酸与碱作用生成盐和水的反应,叫做中和反应。
Na+ 和Cl- 不变
注意:
有盐和水生成的反应,不一定是中和反应,如
酸+金属氧化物→盐+水的反应不是中和反应。
1.改良土壤的酸碱性
加入 酸性物质
中性土壤
中性土壤
酸性土壤
熟石灰
Ca(OH)2
盐碱地
碱性土壤
二、中和反应在实际中的应用
(1)为什么向酸性土壤中加入熟石灰,而不可以加入氢氧化钠粉末?
答:因为氢氧化钠的腐蚀性太强。
答:是酸雨或化肥。
(2)导致土壤显酸性的主要原因是什么?
讨论:
2. 处理工厂的废水
(1)如何处理硫酸厂生产中形成的含硫酸的污水?
(2)请写出有关反应的化学方程式:
H2
Ca
SO4
(OH)2
2H2O
(3)用CaO来中和污水行不行?
H2SO4+ Ca(OH)2==CaSO4 + 2H2O
H2SO4+ Ca(OH)2==CaSO4 + 2H2O
CaO + H2O==Ca(OH)2
3. 用于医药
(1)中和胃酸过多
用含有氢氧化铝的胃药中和胃中过多的盐酸。
化学方程式:
Al(OH)3 + 3HCl==AlCl3 + 3H2O
(2)中和蚁酸
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么?
可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水。
答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
4.调配食物
如NaCl、Na2SO4
等溶液
如HCl、H2SO4等溶液
如Na2CO3、 Ca(OH)2 、NaOH等溶液
能使石蕊溶液变红
能使酚酞溶液变红,石蕊溶液变蓝
石蕊和酚酞溶液都不变色
三、溶液酸碱度的表示法——pH
pH的范围通常在0~14之间
1.溶液的酸碱性
表示溶液是酸性、中性还是碱性的。(用酸碱指示剂检验)
2.溶液的酸碱度
表示溶液酸碱性的强弱程度。 (用pH试纸测定)
碱性增强
酸性增强
中性
⑴pH 7,溶液显中性 。
⑶ pH 7,溶液显碱性,pH越大,碱性越强。
=
﹥
如NaCl、Na2SO4等溶液
如HCl、H2SO4等溶液
⑵ pH 7,溶液显酸性, pH越小,酸性越强。
如Na2CO3、 Ca(OH)2 、NaOH 等溶液
讨论:溶液的酸碱性与pH的关系
0 7 14
碱性增强
酸性增强
中性
﹤
3.pH的测定——用pH试纸测定
在白瓷板或玻璃片上放一小片pH 试纸,用干净的玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
测定方法:
4.了解溶液的酸碱度有重要意义
①化工生产中许多反应必须在一定pH溶液里才能进行;
②在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
③测定雨水的pH,可以了解空气的污染情况;
[注:正常雨水(含H2CO3)的pH约为5.6,酸雨的pH小于5.6]
④测定人体内或排出的液体的pH,可以了解人体的健康状况。
5.人体内的一些液体和排泄物的正常pH范围
血浆 7.35~7.45
唾液 6.6 ~ 7.1
胃液 0.9 ~ 1.5
乳汁 6.6 ~ 7.6
胆汁 7.1 ~ 7.3
胰液 7.5 ~ 8.0
尿液 4.7 ~ 8.4
粪便 4.6 ~ 8.4
3.由金属离子和酸根离子构成的化合物叫做盐。
1.中和反应:
中和反应在生活和生产中有广泛的应用:
(1)农业 (2)工业 (3)生活
2.溶液的酸碱度可用pH表示,用pH试纸可以测定溶液的酸碱度。 pH 在0~14之间。
(2)了解溶液酸碱度在实际中有重要的意义
农业 、工业 、环境 、生活
酸+碱→盐+水
①pH 7,溶液呈中性,
②pH 7溶液呈酸性, pH越小,酸性越强,
③pH 7溶液呈碱性, pH越大,碱性越强。
(1)溶液的酸碱性与pH的关系:
﹥
﹤
=
小结
2.某工厂排放的废水的pH是4.5,取少量该废水加入试管中,再滴酚酞溶液,溶液呈______色,如果要使试管里溶液的pH升高到=7,可以采用 __________ 的方法。
无
加碱性溶液
1. pH =0的溶液是 ( )
A.不存在 B.酸性溶液 C.碱性溶液 D.中性溶液
B
过关练习
3.下列实验操作记录与序号相同的图像所表示的变化关系不相符合的是( )
A. 向稀NaOH溶液中逐滴滴入pH=1的稀盐酸至过量
B.用水稀释pH=1的硫酸溶液
C.向稀硫酸中逐滴滴入Ba(OH)2溶液至稍过量
D.向镁粉中加入足量的稀硫酸
B
Ba(OH)2+H2SO4=BaSO4↓+2H2O
Mg+H2SO4=MgSO4+2H2↑
4.失去标签的三瓶无色液体,分别是稀HCl、蒸馏水、NaOH溶液,可用 加以区分。
中性溶液
(提示:HCl + NaOH==NaCl + H2O)
稀HCl
蒸馏水
NaOH
步骤:
(2)分别滴加酚酞,振荡。
变红的是NaOH溶液
(3)取少量NaOH溶液再分别滴到另外两只试管中,振荡。
(1)用三支试管,分别取少量三种无色液体。
变红的无色液体是蒸馏水,仍为无色的是稀盐酸。
紫色石蕊溶液
能否用酚酞溶液将它们鉴别出来?
同课章节目录
