人教版化学九年级下册课题1 生活中常见的盐 第四课时 粗盐提纯 课件(共22张PPT)
文档属性
| 名称 | 人教版化学九年级下册课题1 生活中常见的盐 第四课时 粗盐提纯 课件(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-26 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
第十一单元 盐 化肥
课题1 生活中常见的盐
第四课时 粗盐提纯
海盐
我国丰富的原盐资源
岩盐
井盐
湖盐
?
粗盐
精盐
海水晒盐后,得到的粗盐可以
直接食用吗?
【思考】:
1、了解粗盐的初步提纯,掌握过滤和蒸发操作的要点。
2、掌握粗盐中可溶性杂质的去除
阅读课本87-88页,解决以下问题:
1、除去粗盐中难溶性杂质要经过哪些步骤?
2、过滤和蒸发操作中都需要用到什么仪器?
3、溶解、蒸发、过滤操作中玻璃棒分别起到什么作用
4、蒸发操作中什么时候停止加热?
学习目标
①溶解
②过滤
③蒸发
除去粗盐中难溶性杂质要经过哪些步骤?
活动与探究——粗盐中难溶性杂质的去除
活动与探究——粗盐中难溶性杂质的去除
1、过滤和蒸发操作中分别需要什么仪器?
过滤:铁架台、漏斗、烧杯、玻璃棒、
蒸发:铁架台、蒸发皿、玻璃棒、酒精灯
2、溶解、过滤、蒸发操作中都用到了玻璃棒,都起到什么作用呢?
溶解时:搅拌,加速固体溶解
过滤时:引流
蒸发时:搅拌,防止局部温度
过高,造成液滴飞溅
活动与探究——粗盐中难溶性杂质的去除
3、蒸发时,什么时候停止加热呢?为什么?
当蒸发皿中出现较多固体时就停止加热,利用余热使其蒸干
4、经过以上步骤后的食盐,是否为纯净物?
实验中,只能将一些难溶性的固体杂质除去,而一些可溶性的杂质仍混在食盐中,因此,得到的固体不是纯净的食盐。
MgCl2
Na2SO4
CaCl2
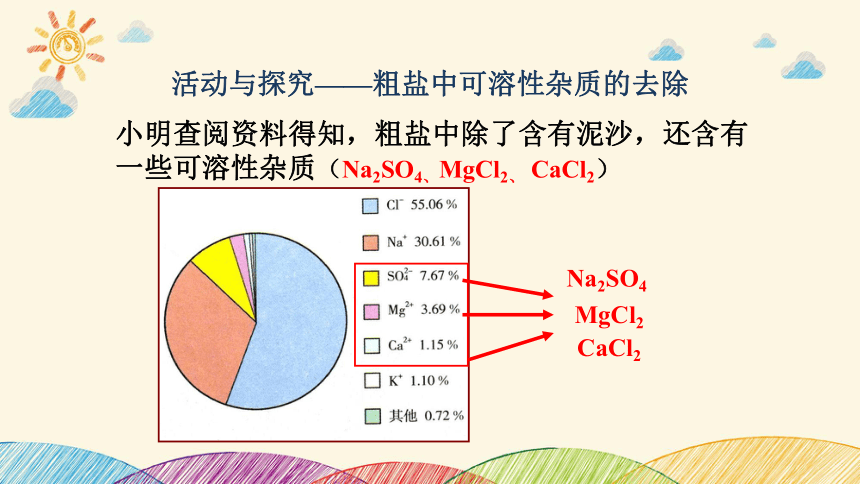
小明查阅资料得知,粗盐中除了含有泥沙,还含有一些可溶性杂质(Na2SO4、MgCl2、 CaCl2)
活动与探究——粗盐中可溶性杂质的去除
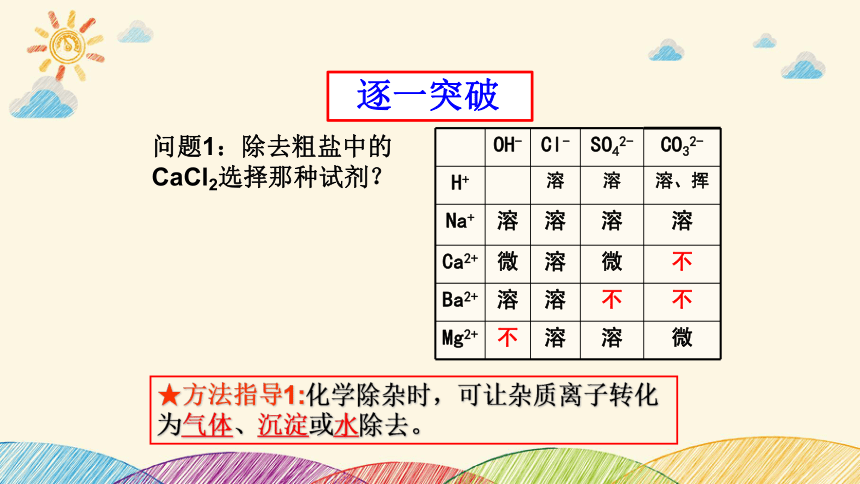
OH- Cl- SO42- CO32-
H+ 溶 溶 溶、挥
Na+ 溶 溶 溶 溶
Ca2+ 微 溶 微 不
Ba2+ 溶 溶 不 不
Mg2+ 不 溶 溶 微
逐一突破
问题1:除去粗盐中的CaCl2选择那种试剂?
★方法指导1:化学除杂时,可让杂质离子转化为气体、沉淀或水除去。
OH- Cl- SO42- CO32-
H+ 溶 溶 溶、挥
Na+ 溶 溶 溶 溶
Ca2+ 微 溶 微 不
Ba2+ 溶 溶 不 不
Mg2+ 不 溶 溶 微
问题2:除去粗盐中的
Na2SO4选择那种试剂?
问题3:除去粗盐中的
MgCl2选择那种试剂?
BaCl2
Na2CO3
NaOH
Ca2+
SO42-
Mg2+
除杂试剂
★方法指导2:为了使杂质能除得比较干净,所加试剂一般要过量,试剂过量则又可能引入新杂质。为此要设计加入试剂的顺序,即要使前面过量试剂在后续除杂操作中除去。
过量
过量
过量
过量处理
Na2CO3
盐酸
盐酸
注:一定要先加BaCl2,再加Na2CO3,NaOH可放在任意一步,最后加盐酸
活动与探究——粗盐中可溶性杂质的去除
思考与交流:
请大家归纳一下,除去粗盐中可溶性杂质Ca2+、 Mg2+、 SO4 2-,加入Na2CO3、 BaCl2、NaOH、HCl顺序共有几种?并尝试着写出任一种顺序中每一步的方程式?
小组合作
(方案二)BaCl2——Na2CO3——NaOH——HCl
(方案一)BaCl2——NaOH——Na2CO3——HCl
(方案三)NaOH——BaCl2——Na2CO3——HCl
【集思广益】
过滤
注:一定要先加BaCl2,再加Na2CO3,NaOH可放在任意一步,最后加盐酸 先钡后碳,碱自由,最后一步是盐酸
活动与探究——粗盐中可溶性杂质的去除
除去粗盐中可溶性杂质小结
粗盐中可能含有MgCl2、CaCl2、MgSO4、Na2CO3等物质:
加BaCl2(除硫酸盐)→加NaOH(除MgCl2)→加Na2CO3(除CaCl2、BaCl2)→过滤→加HCl(中和NaOH、Na2CO3)
注:一定要先加BaCl2,再加Na2CO3,NaOH可放在任意一步,最后加盐酸
先钡后碳,碱自由,最后一步是盐酸
学
以
致
用
1.实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放置酒精灯 ②固定铁圈位置 ③放置蒸发皿 ④加热搅拌 ⑤停止加热,余热蒸干。其中正确的操作顺序是( )
A.②③④⑤① B.①②③④⑤ C.②③①④⑤ D.②①③④⑤
B
2、下列过滤装置及其操作的简图中,正确的是( )
A
3、“粗盐提纯”实验中,蒸发时,下列操作正确的是( )
A.把浑浊的液体倒入蒸发皿内加热
B.开始析出晶体后用玻璃棒搅拌
C.蒸发皿中出现较多量固体时停止加热
D.待液体蒸干后停止加热
C
粗盐提纯(重点、考点)
实验目的:除去粗盐中的难溶性杂质,得到较纯净的精盐
操作步骤:
溶解、过滤、蒸发、转移、计算产率
实验用品:托盘天平、药匙、铁架台(带铁圈)、烧杯、玻璃棒、滤纸、漏斗、酒精灯、蒸发皿、坩埚钳
(1)溶解
玻璃棒的作用:搅拌,加快溶解速度
(2)过滤(一贴、二低、三靠)
玻璃棒的作用:引流,防止液体冲破滤纸或溅出。
(3)蒸发
玻璃棒的作用:搅拌,防止液体局部过热,液滴飞溅
注意:等到蒸发皿中出现较多固体的时候就停止加热
用坩埚钳取下蒸发皿
玻璃棒的作用:转移固体
(4)转移
蒸发皿中所装滤液不超过蒸发皿容积的2/3。
(5)计算产率
精盐的质量
粗盐的质量
X 100%
操作中可能出现误差的原因:
溶解:食盐未完全溶解使产率偏 ;
过滤:滤液飞溅产率偏 ;
蒸发:液体(固体)飞溅产率偏 ;蒸发后固体较潮湿产率偏 。
转移:转移不完全产率偏 。
低
低
低
高
低
除去粗盐中的难溶性杂质,得到较纯净的精盐(还含有少量可溶性杂质)
经过以上能得到纯净的NaCl吗?为什么?
补充:常见酸、碱和盐的溶解性(P114)
1、常见的酸:H2SO4、HNO3、HCl、CH3COOH等都溶于水。
2、常见的碱:
可溶: NaOH、KOH、 Ba(OH)2 NH3·H2O
微溶: Ca(OH)2
蓝色难溶: Cu(OH)2 红褐色难溶: Fe(OH)3
白色难溶: Mg(OH)2、Al(OH)3
BaSO4↓、AgCl ↓(既不溶于水,也不溶于酸)
3、盐的溶解性口诀:
钾钠铵硝盐全溶,
盐酸不溶有银盐,硫酸不溶有钡盐
溶碱钾钠钡铵钙,其他的碱都不溶
碳酸只溶钾钠铵,其他的盐都不溶
微溶物质:
Ca(OH)2、CaSO4、MgSO4、MgCO3
第十一单元 盐 化肥
课题1 生活中常见的盐
第四课时 粗盐提纯
海盐
我国丰富的原盐资源
岩盐
井盐
湖盐
?
粗盐
精盐
海水晒盐后,得到的粗盐可以
直接食用吗?
【思考】:
1、了解粗盐的初步提纯,掌握过滤和蒸发操作的要点。
2、掌握粗盐中可溶性杂质的去除
阅读课本87-88页,解决以下问题:
1、除去粗盐中难溶性杂质要经过哪些步骤?
2、过滤和蒸发操作中都需要用到什么仪器?
3、溶解、蒸发、过滤操作中玻璃棒分别起到什么作用
4、蒸发操作中什么时候停止加热?
学习目标
①溶解
②过滤
③蒸发
除去粗盐中难溶性杂质要经过哪些步骤?
活动与探究——粗盐中难溶性杂质的去除
活动与探究——粗盐中难溶性杂质的去除
1、过滤和蒸发操作中分别需要什么仪器?
过滤:铁架台、漏斗、烧杯、玻璃棒、
蒸发:铁架台、蒸发皿、玻璃棒、酒精灯
2、溶解、过滤、蒸发操作中都用到了玻璃棒,都起到什么作用呢?
溶解时:搅拌,加速固体溶解
过滤时:引流
蒸发时:搅拌,防止局部温度
过高,造成液滴飞溅
活动与探究——粗盐中难溶性杂质的去除
3、蒸发时,什么时候停止加热呢?为什么?
当蒸发皿中出现较多固体时就停止加热,利用余热使其蒸干
4、经过以上步骤后的食盐,是否为纯净物?
实验中,只能将一些难溶性的固体杂质除去,而一些可溶性的杂质仍混在食盐中,因此,得到的固体不是纯净的食盐。
MgCl2
Na2SO4
CaCl2
小明查阅资料得知,粗盐中除了含有泥沙,还含有一些可溶性杂质(Na2SO4、MgCl2、 CaCl2)
活动与探究——粗盐中可溶性杂质的去除
OH- Cl- SO42- CO32-
H+ 溶 溶 溶、挥
Na+ 溶 溶 溶 溶
Ca2+ 微 溶 微 不
Ba2+ 溶 溶 不 不
Mg2+ 不 溶 溶 微
逐一突破
问题1:除去粗盐中的CaCl2选择那种试剂?
★方法指导1:化学除杂时,可让杂质离子转化为气体、沉淀或水除去。
OH- Cl- SO42- CO32-
H+ 溶 溶 溶、挥
Na+ 溶 溶 溶 溶
Ca2+ 微 溶 微 不
Ba2+ 溶 溶 不 不
Mg2+ 不 溶 溶 微
问题2:除去粗盐中的
Na2SO4选择那种试剂?
问题3:除去粗盐中的
MgCl2选择那种试剂?
BaCl2
Na2CO3
NaOH
Ca2+
SO42-
Mg2+
除杂试剂
★方法指导2:为了使杂质能除得比较干净,所加试剂一般要过量,试剂过量则又可能引入新杂质。为此要设计加入试剂的顺序,即要使前面过量试剂在后续除杂操作中除去。
过量
过量
过量
过量处理
Na2CO3
盐酸
盐酸
注:一定要先加BaCl2,再加Na2CO3,NaOH可放在任意一步,最后加盐酸
活动与探究——粗盐中可溶性杂质的去除
思考与交流:
请大家归纳一下,除去粗盐中可溶性杂质Ca2+、 Mg2+、 SO4 2-,加入Na2CO3、 BaCl2、NaOH、HCl顺序共有几种?并尝试着写出任一种顺序中每一步的方程式?
小组合作
(方案二)BaCl2——Na2CO3——NaOH——HCl
(方案一)BaCl2——NaOH——Na2CO3——HCl
(方案三)NaOH——BaCl2——Na2CO3——HCl
【集思广益】
过滤
注:一定要先加BaCl2,再加Na2CO3,NaOH可放在任意一步,最后加盐酸 先钡后碳,碱自由,最后一步是盐酸
活动与探究——粗盐中可溶性杂质的去除
除去粗盐中可溶性杂质小结
粗盐中可能含有MgCl2、CaCl2、MgSO4、Na2CO3等物质:
加BaCl2(除硫酸盐)→加NaOH(除MgCl2)→加Na2CO3(除CaCl2、BaCl2)→过滤→加HCl(中和NaOH、Na2CO3)
注:一定要先加BaCl2,再加Na2CO3,NaOH可放在任意一步,最后加盐酸
先钡后碳,碱自由,最后一步是盐酸
学
以
致
用
1.实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放置酒精灯 ②固定铁圈位置 ③放置蒸发皿 ④加热搅拌 ⑤停止加热,余热蒸干。其中正确的操作顺序是( )
A.②③④⑤① B.①②③④⑤ C.②③①④⑤ D.②①③④⑤
B
2、下列过滤装置及其操作的简图中,正确的是( )
A
3、“粗盐提纯”实验中,蒸发时,下列操作正确的是( )
A.把浑浊的液体倒入蒸发皿内加热
B.开始析出晶体后用玻璃棒搅拌
C.蒸发皿中出现较多量固体时停止加热
D.待液体蒸干后停止加热
C
粗盐提纯(重点、考点)
实验目的:除去粗盐中的难溶性杂质,得到较纯净的精盐
操作步骤:
溶解、过滤、蒸发、转移、计算产率
实验用品:托盘天平、药匙、铁架台(带铁圈)、烧杯、玻璃棒、滤纸、漏斗、酒精灯、蒸发皿、坩埚钳
(1)溶解
玻璃棒的作用:搅拌,加快溶解速度
(2)过滤(一贴、二低、三靠)
玻璃棒的作用:引流,防止液体冲破滤纸或溅出。
(3)蒸发
玻璃棒的作用:搅拌,防止液体局部过热,液滴飞溅
注意:等到蒸发皿中出现较多固体的时候就停止加热
用坩埚钳取下蒸发皿
玻璃棒的作用:转移固体
(4)转移
蒸发皿中所装滤液不超过蒸发皿容积的2/3。
(5)计算产率
精盐的质量
粗盐的质量
X 100%
操作中可能出现误差的原因:
溶解:食盐未完全溶解使产率偏 ;
过滤:滤液飞溅产率偏 ;
蒸发:液体(固体)飞溅产率偏 ;蒸发后固体较潮湿产率偏 。
转移:转移不完全产率偏 。
低
低
低
高
低
除去粗盐中的难溶性杂质,得到较纯净的精盐(还含有少量可溶性杂质)
经过以上能得到纯净的NaCl吗?为什么?
补充:常见酸、碱和盐的溶解性(P114)
1、常见的酸:H2SO4、HNO3、HCl、CH3COOH等都溶于水。
2、常见的碱:
可溶: NaOH、KOH、 Ba(OH)2 NH3·H2O
微溶: Ca(OH)2
蓝色难溶: Cu(OH)2 红褐色难溶: Fe(OH)3
白色难溶: Mg(OH)2、Al(OH)3
BaSO4↓、AgCl ↓(既不溶于水,也不溶于酸)
3、盐的溶解性口诀:
钾钠铵硝盐全溶,
盐酸不溶有银盐,硫酸不溶有钡盐
溶碱钾钠钡铵钙,其他的碱都不溶
碳酸只溶钾钠铵,其他的盐都不溶
微溶物质:
Ca(OH)2、CaSO4、MgSO4、MgCO3
同课章节目录
