2019高考化学真题解析试卷(天津卷)
文档属性
| 名称 | 2019高考化学真题解析试卷(天津卷) |  | |
| 格式 | docx | ||
| 文件大小 | 274.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-05 15:52:10 | ||
图片预览




文档简介
2019全国高考化学真题
(天津卷)
一、选择题(共6小题,每小题6分,满分36分)
1.化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是( )
A.利用废弃的秸秆生产生物质燃料乙醇
B.利用石油生产塑料、化纤等高分子材料
C.利用基本的化学原料生产化学合成药物
D.利用反渗透膜从海水中分离出淡水
2.下列离子方程式能用来解释相应实验现象的是( )
选项 实验现象 离子方程式
A 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 Mg(OH)2+═Mg2++2NH3 H2O
B 向沸水中滴加饱和氯化铁溶液得到红褐色液体 Fe3++3H2O═Fe(OH)3↓+3H+
C 二氧化硫使酸性高锰酸钾溶液褪色 3SO2++4H+═+2Mn2++2H2O
D 氧化亚铁溶于稀硝酸 FeO+2H+═Fe2++H2O
3.下列有关金属及其化合物的应用不合理的是( )
A.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
B.铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业
C.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良
D.无水CoCl2呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
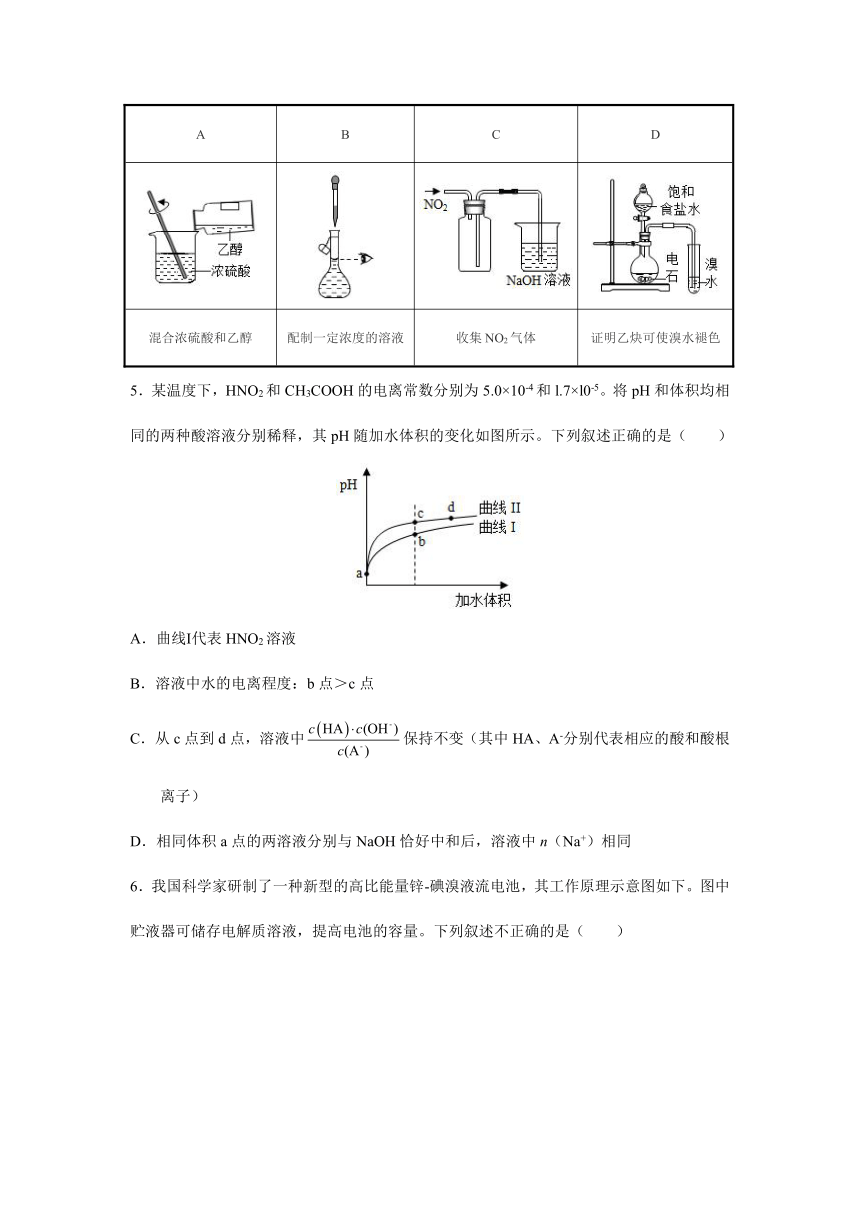
4.下列实验操作或装置能达到目的是( )
A B C D
混合浓硫酸和乙醇 配制一定浓度的溶液 收集NO2气体 证明乙炔可使溴水褪色
5.某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和l.7×l0-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中保持不变(其中HA、A-分别代表相应的酸和酸根 离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
6.我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是( )
A.放电时,a电极反应为I2Br-+2e-═2I-+Br-
B.放电时,溶液中离子的数目增大
C.充电时,b电极每增重0.65 g,溶液中有0.02 mol I-被氧化
D.充电时,a电极接外电源负极
二、解答题(共4小题,满分64分)
7.氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置 。Mc的中子数为 。
已知:P(s,白磷)═P(s,黑磷)△H=-39.3 kJ mol-1;
P(s,白磷)═P(s,红磷)△H=-17.6 kJ mol-1;
由此推知,其中最稳定的磷单质是 。
(2)氮和磷氢化物性质的比较:
热稳定性:NH3 PH3(填“>”或“<”)。
沸点:N2H4 P2H4(填“>”或“<”),判断依据是 。
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是(填序号)。
a.不能与NaOH反应 b.含离子键、共价键 c.能与水反应
(4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式
,因此,配制SbCl3溶液应注意 。
(5)在1L真空密闭容器中加入a mol PH4I固体,t ℃时发生如下反应:
PH4I(S) PH3 (g)+HI(g) ①
4PH3(g) P4(g)+6H2(g) ②
2HI(g) H2(g)+I2(g) ③
达平衡时,体系中n(HI)=b mol,n(I2)=c mol,n(H2)=d mol,则t ℃时反应①的平衡常数K值为 (用字母表示)。
8.我国化学家首次实现了膦催化的(3+2)环加成反应,并依据该反应,发展了一条合成中草药活性成分茅苍术醇的有效路线。
已知(3+2)环加成反应:
回答下列问题:
(1)茅苍术醇的分子式为 ,所含官能团名称为 ,分子中手性碳原子(连有四个不同的原子或原子团)的数目为 。
(2)化合物B的核磁共振氢谱中有 个吸收峰;其满足以下条件的同分异构体(不考虑手性异构)数目为 。
①分子中含有碳碳三键和乙酯基(-COOCH2CH3)
②分子中有连续四个碳原子在一条直线上
写出其中碳碳三键和乙酯基直接相连的同分异构体的结构简式 。
(3)C→D的反应类型为 。
(4)D→E的化学方程式为 ,除E外该反应另一产物的系统命名为 。
(5)下列试剂分别与F和G反应,可生成相同环状产物的是 (填序号)。
a.Br2 b.HBr c.NaOH溶液
(6)参考以上合成路线及条件,选择两种链状不饱和酯,通过两步反应合成化合物M,在方框中写出路线流程图(其他试剂任选)。
9.环己烯是重要的化工原料。其实验室制备流程如图:
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为 ,现象为 。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
①烧瓶A中进行的可逆反应化学方程式为 ,浓硫酸也可作该反应的催化剂,选择FeCl3 6H2O而不用浓硫酸的原因为 (填序号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3 6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeC13 6H2O比浓硫酸的平衡转化率高
②仪器B的作用为 。
(3)操作2用到的玻璃仪器是 。
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石, ,弃去前馏分,收集83 ℃的馏分。
Ⅱ.环己烯含量的测定
在一定条件下,向a g环己烯样品中加入定量制得的b mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用c mol L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液V mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①
②Br2+2KI═I2+2KBr
③I2+2Na2S2O3═2NaI+Na2S4O6
(5)滴定所用指示剂为 。样品中环己烯的质量分数为 (用字母表示)。
(6)下列情况会导致测定结果偏低的是 (填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.Na2S2O3标准溶液部分被氧化
10.多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
回答下列问题:
Ⅰ.硅粉与HCl在300 ℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,该反应的热化学方程式为 。SiHCl3的电子式为 。
Ⅱ.将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2 (g) SiHCl3(g)+HCl(g)△H1>0
②3SiCl4 (g)+2H2 (g)+Si(s) 4SiHCl3(g)△H2<0
③2SiCl4(g)+H2 (g)+Si(s)+HCl(g) 3SiHCl3(g) △H3
(1)氢化过程中所需的高纯度H2可用惰性电极电解KOH溶液制备,写出产生H2的电极名称 (填“阳极”或“阴极”),该电极反应方程式为 。
(2)已知体系自由能变△G=△H-T△S,△G<0时反应自发进行。三个氢化反应的△G与温度的关系如图1所示,可知:反应①能自发进行的最低温度是 ;相同温度下,反应②比反应①的△G小,主要原因是 。
(3)不同温度下反应②中SiCl4转化率如图2所示。下列叙述正确的是 (填序号)。
a.B点:v正>v逆 b.v正:A点>E点 c.反应适宜温度:480~520 °C
(4)反应③的△H3= (用△H1,△H2表示)。温度升高,反应③的平衡常数K (填“增大”“减小”或“不变”)。
(5)由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3和Si外,还有 (填分子式)。
化学试题答案
一、选择题
1.D。【解析】A选项,秸秆通过发酵生成乙醇,为化学变化,故A不符合题意;B选项,石油生产塑料、化纤,是将石油先裂化生成小分子,小分子发生加聚反应再生成高分子,为化学变化,故B不符合题意;C选项,利用基本的化学原料生产化学合成药物,则为基本化学原料发生反应生成新物质,为化学变化,故C不符合题意;D选项,利用反渗透膜从海水中分离出淡水,无新物质生成,是物理变化,故D符合题意。故选D。
2.A。【解析】A选项,向氢氧化镁悬浊液中滴加氯化铵溶液,水解导致溶液呈酸性,Mg(OH)2能溶于酸,离子方程式为Mg(OH)2+═Mg2++2NH3 H2O,故A正确;B选项,向沸水中滴加饱和氯化铁溶液得到的是胶体,胶体不是沉淀,不能写沉淀符号,离子方程式为Fe3++3H2O═Fe(OH)3(胶体)+3H+,故B错误;C选项,二氧化硫和酸性高锰酸钾溶液发生氧化还原反应生成锰离子、硫酸根离子,方程式中转移电子不守恒,离子方程式为5SO2++2H2O═+2Mn2++4H+,故C错误;D选项,氧化亚铁溶于稀硝酸,则亚铁离子易被硝酸氧化生成铁离子,离子方程式为3FeO+10H++═3Fe3++NO↑+5H2O,故D错误。故选A。
3.C。【解析】A选项,氯气具有强氧化性,能将氧化亚铁离子氧化为铁离子,铁离子能将Fe氧化为亚铁离子,涉及的反应为2Fe2++Cl2=2Fe3++2Cl-、2Fe3++Fe=3Fe2+,从而除去氯气,故A正确;B选项,Li-Al合金密度较小且硬度及强度大,所以Li-Al合金可以用于航空工业,故B正确;C选项,熟石灰成分为氢氧化钙,具有碱性,碳酸钠水解导致其水溶液呈碱性,所以盐碱地中加入熟石灰不能改良土壤,故C错误;D选项,无水CoCl2呈蓝色,吸水会变为粉红色,则可以根据变色硅胶的颜色变化判断是否吸水,故D正确。故选C。
4.B。【解析】A选项,混合浓硫酸和乙醇相当于浓硫酸的稀释,应该将浓硫酸倒入乙醇中并不断搅拌,故A错误;B选项,定容时视线与凹液面最低处相平,故B正确;C选项,二氧化氮密度大于空气,应该采用向上排空气法收集,所以导气管应该遵循“长进短出”原则,故C错误;D选项,乙炔中若含有其他也能使溴水褪色的气体时,应该先将得到的气体除杂,然后再通入溴水检验乙炔,故D错误。故选B。
5.C。【解析】酸的电离平衡常数越大,酸性越强,根据电离平衡常数知,酸性:HNO2>
CH3COOH,A选项,加水稀释促进弱酸电离,pH相同的两种酸稀释相同倍数,pH变化大的酸性较强,根据图知,pH变化较大的是Ⅱ,则Ⅱ表示较强的酸HNO2,所以曲线Ⅰ表示CH3COOH,故A错误;B选项,酸或碱抑制水的电离,酸中c(H+)越大其抑制水电离程度越大,酸中c(H+):b>c,则抑制水电离程度:b>c,所以水的电离程度:b<c,故B错误;C选项,水解平衡常数只与温度有关,=Kh,从c点到d点,温度不变,水解平衡常数不变,所以溶液中保持不变,故C正确;D选项,a点两种溶液的pH相同,但是两种溶液浓度:HNO2<CH3COOH,相同体积的a点两种溶液中溶质物质的量:HNO2<CH3COOH,消耗的碱与酸的物质的量成正比,所以消耗的碱:HNO2<
CH3COOH,根据Na原子守恒知溶液中n(Na+):HNO2<CH3COOH,故D错误。故选C。
6.D。【解析】A选项,放电时,a电极I2Br-生成I-,发生还原反应,电极反应为I2Br-+
2e-═2I-+Br-,故A正确;B选项,放电时正极的I2Br-生成I-、Br-,负极生成Zn2+,则溶液中离子的数目增大,故B正确;C选项,充电时,b电极生成Zn,每增重0.65 g,即生成0.01 mol Zn,则转移0.02 mol电子,阳极发生2I-+Br--2e-=I2Br-,溶液中有0.02 mol I-被氧化,故C正确;D选项,充电时,a电极生成I2Br-,发生氧化反应,则a为阳极,连接电源的正极,故D错误。故选D。
二、解答题
7.(1)第四周期第VA族;173;黑磷;(2)>;>;N2H4分子间存在氢键;(3)bc;
(4)SbCl3+H2O SbOCl↓+2HCl;加入盐酸抑制水解;(5)()×b
【解析】(1)As位于第四周期第ⅤA族,中子数=质量数-质子数=288-115=173;能量越低越稳定,P(s,白磷)═P(s,黑磷)△H=-39.3 kJ mol-1 ①
P(s,白磷)═P(s,红磷)△H=-17.6 kJ mol-1 ②
将方程式①-②得P(s,红磷)═P(s,黑磷)△H=(-39.3+17.6)kJ/mol=-21.7 kJ/mol,
则能量:红磷>黑磷,则黑磷最稳定;
(2)元素的非金属性越强,其氢化物的稳定性越强;非金属性N>P,所以热稳定性:
NH3>PH3;N2H4能形成分子间氢键、P2H4分子间不能形成氢键,所以沸点:N2H4>P2H4;
分子晶体熔沸点与分子间作用力和氢键有关,能形成氢键的氢化物熔沸点较高;
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似,PH3与HI反应产物为PH4I,相当于铵盐,具有铵盐结构性质,a选项,铵盐能和NaOH发生复分解反应,所以PH4I能与NaOH反应,故a错误;b选项,铵盐中存在离子键和共价键,所以PH4I中含离子键、共价键,故b正确;c选项,铵盐都易发生水解反应,所以PH4I能与水反应,故c正确。故选bc;
(4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,根据元素守恒知,还生成HCl,反应方程式为SbCl3+H2O SbOCl↓+2HCl;配制SbCl3溶液要防止其水解,其水溶液呈酸性,所以酸能抑制水解,则配制该溶液时为防止水解应该加入盐酸;
(5)可逆反应 2HI(g) H2(g)+I2(g) ③
平衡(mol/L) b c c
可逆反应 4PH3(g) P4(g)+6H2(g) ②
反应(mol/L) (d-c) d-c
可逆反应 PH4I(S) PH3(g)+HI(g) ①
平衡(mol/L) b+2c-(d-c) b
则t ℃时反应①的平衡常数K=c(PH3)×c(HI)=[b+2c-(d-c)]×b=()×b。
8.(1)C15H26O;碳碳双键、碳原子;3;
(2)2;5;;
(3)加成反应(或还原反应);
(4);2-甲基-2-丙醇;(5)b;
(6)
【解析】(1)茅苍术醇分子中有15个C原子、1个O原子,分子不饱和度为3,则分子中H原子数目=2×15+2-2×3=26,故茅苍术醇分子式为C15H26O;由结构可知分子中含有的官能团有:碳碳双键、羟基;分子中有如图“*”所示3个碳原子连接连有四个不同的原子或原子团:,即有3个手性碳原子;
(2)化合物B分子中只有2种化学环境不同的H原子,故其核磁共振氢谱有2个吸收峰,B的同分异构体满足:①分子中含有碳碳三键和乙酯基(-COOCH2CH3),②分子中有连续四个碳原子在一条直线上,存在C-C≡C-C碳链结构,形成酯的酸可以看作CH3C≡CCH2CH3中1个H原子被-COOH替代,有3种酸,也可以是HOOC-C≡CCH2CH2CH3、HOOC-C≡CCH(CH3)2,故符合条件的同分异构体有3+2=5种,其中碳碳三键和乙酯基直接相连的同分异构体的结构简式为:
;
(3)对比C、D的结构,可知C中碳碳双键与氢气发生加成反应生成D,也属于还原反应;
(4)对比D、E的结构,可知D与甲醇发生发生取代反应生成E,同时还生成(CH3)3COH,反应方程式为:,(CH3)3COH的名称为2-甲基-2-丙醇;
(5)F、G均含有碳碳双键与酯基,但碳碳双键位置不同,在碱性条件下水解得到环状产物不同,与溴发生反应时溴原子位置不完全相同,但与HBr加成后溴原子连接位置可能相同,即可生成相同环状产物;
(6)两种链状不饱和酯合成目标物M,模仿A与B反应,结合(3+2)环加成反应,可以由或与氢气加成反应得到目标物。而CH3C≡CCOOCH3与CH2=CHCOOCH2CH3反应得到。CH3C≡CCOOCH2CH3与CH2=CHCOOCH3反应得到,合成路线流程图为:。
9.(1)FeCl3溶液;溶液显紫色;(2)①;ab;②减少环己醇蒸出,增大环己醇利用率;(3)分液漏斗、烧杯;(4)通冷凝水、加热;(5)淀粉溶液;;(6)bc
【解析】环己醇发生消去反应生成环己烯和水,环己烯不溶于水,饱和食盐水溶解环己醇、氯化铁,然后分液,得到的水相中含有环己醇、氯化铁,得到的有机相中含有环己烯,然后干燥、过滤、蒸馏得到环己烯;
(1)苯酚能和氯化铁溶液发生显色反应导致混合溶液呈紫色,所以可以用FeCl3溶液检验苯酚;
(2)①烧瓶A中进行的可逆反应为环己醇的消去反应,反应方程式为;
a选项,浓硫酸具有强吸水性和强氧化性,易使原料炭化并产生SO2,从而降低环己烯产率,故a正确;b选项,FeCl3 6H2O污染小、可循环使用,符合绿色化学理念,故b正确;c选项,催化剂只影响反应速率,不影响平衡移动,所以催化剂不影响产率,故c错误。故选ab;
②仪器B能冷凝回流环己醇,所以B的作用是减少环己醇蒸出,增大环己醇利用率;
(3)操作2为分液,分液用到的玻璃仪器有分液漏斗、烧杯;
(4)操作3(蒸馏)的步骤:安装蒸馏装置,加入待蒸馏的物质和沸石,通冷凝水、加热,弃去前馏分,收集83 ℃的馏分;
(5)碘遇淀粉溶液变蓝色,所以可以用淀粉溶液检验碘,所以选取的试剂为淀粉溶液;
②Br2+2KI═I2+2KBr、③I2+2Na2S2O3═2NaI+Na2S4O6得关系式Br2~I2~2Na2S2O3,则与KI反应的n(Br2)=n(Na2S2O3)=×cV×10-3 mol,所以与环己烯反应的n(Br2)=(b-×cV×10-3)mol,根据得n(环己烯)=(b-×cV×10-3)mol,m(环己烯)=(b-×cV×10-3)mol×82 g/mol,环己烯质量分数==
=;
(6)a选项,样品中含有苯酚杂质,苯酚和溴发生取代反应生成沉淀,消耗相同质量的溴,消耗环己烯的质量大于苯酚,所以如果含有苯酚导致测定偏高,故a错误;b选项,在测定过程中部分环己烯挥发导致环己烯质量减少,导致测定结果偏低,故b正确;c选项,Na2S2O3标准溶液部分被氧化导致消耗的硫代硫酸钠偏大,与环己烯反应的溴的质量偏低,导致测定结果偏低,故c正确。故选bc。
10.Ⅰ. △H=-225 kJ/mol;;
(1)阴极;2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑);(2)1000 ℃;△H2<△H1导致反应②的△G小;(3)ac;(4)△H2-△H1;减小;(5)HCl、H2
【解析】Ⅰ.硅粉与HCl在300 ℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,根据反应热及反应物状态、反应条件,该反应的热化学方程式为 △H=-225 kJ/mol;SiHCl3中存在1个Si-H键、3个Si-Cl键,其电子式为;
(1)电解KOH溶液时,阳极上水或氢氧根离子失电子生成氧气,阴极上水或氢离子得电子生成氢气,电极反应式为2H2O+2e-═H2↑+2OH-或2H++2e-═H2↑;
(2)①SiCl4(g)+H2(g) SiHCl3(g)+HCl(g),该反应的△S=0,要使△G=△H-0<0,根据图知,反应①能自发进行的最低温度是1000 ℃;相同温度下,①中△H>0、②中△H<0,且反应②△S<0,因此反应②的△G小;
(3)根据图知,A到D点,随着温度升高,SiCl4转化率增大,说明平衡正向移动且没有达到平衡状态,D点后升高温度SiCl4转化率降低,说明升高温度平衡逆向移动,则D为平衡点,a选项,B点平衡正向移动,所以v正>v逆,故a正确;b选项,温度越高化学反应速率越大,温度A<E,所以反应速率A<E,故b错误;c选项,转化率越大越好且温度不能太高,根据图知,反应适宜温度:480~520 ℃,故c正确;
(4)①SiCl4(g)+H2(g) SiHCl3(g)+HCl(g)△H1>0
②3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)△H2<0
将方程式②-①得③2SiCl4(g)+H2(g)+Si(s)+HCl(g) 3SiHCl3(g),则△H3=△H2-
△H1<0,升高温度平衡向吸热方向移动,该反应的正反应是放热反应,则升高温度平衡逆向移动,所以升高温度反应③的平衡常数K减小;
(5)根据图知,粗硅和干燥HCl反应生成混合物,SiHCl3和氢气反应生成HCl;混合物分离得到氢气,SiHCl3和氢气反应生成HCl需要氢气,所以由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3和Si外,还有HCl、H2。
(天津卷)
一、选择题(共6小题,每小题6分,满分36分)
1.化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是( )
A.利用废弃的秸秆生产生物质燃料乙醇
B.利用石油生产塑料、化纤等高分子材料
C.利用基本的化学原料生产化学合成药物
D.利用反渗透膜从海水中分离出淡水
2.下列离子方程式能用来解释相应实验现象的是( )
选项 实验现象 离子方程式
A 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 Mg(OH)2+═Mg2++2NH3 H2O
B 向沸水中滴加饱和氯化铁溶液得到红褐色液体 Fe3++3H2O═Fe(OH)3↓+3H+
C 二氧化硫使酸性高锰酸钾溶液褪色 3SO2++4H+═+2Mn2++2H2O
D 氧化亚铁溶于稀硝酸 FeO+2H+═Fe2++H2O
3.下列有关金属及其化合物的应用不合理的是( )
A.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
B.铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业
C.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良
D.无水CoCl2呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
4.下列实验操作或装置能达到目的是( )
A B C D
混合浓硫酸和乙醇 配制一定浓度的溶液 收集NO2气体 证明乙炔可使溴水褪色
5.某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和l.7×l0-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中保持不变(其中HA、A-分别代表相应的酸和酸根 离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
6.我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是( )
A.放电时,a电极反应为I2Br-+2e-═2I-+Br-
B.放电时,溶液中离子的数目增大
C.充电时,b电极每增重0.65 g,溶液中有0.02 mol I-被氧化
D.充电时,a电极接外电源负极
二、解答题(共4小题,满分64分)
7.氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置 。Mc的中子数为 。
已知:P(s,白磷)═P(s,黑磷)△H=-39.3 kJ mol-1;
P(s,白磷)═P(s,红磷)△H=-17.6 kJ mol-1;
由此推知,其中最稳定的磷单质是 。
(2)氮和磷氢化物性质的比较:
热稳定性:NH3 PH3(填“>”或“<”)。
沸点:N2H4 P2H4(填“>”或“<”),判断依据是 。
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是(填序号)。
a.不能与NaOH反应 b.含离子键、共价键 c.能与水反应
(4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式
,因此,配制SbCl3溶液应注意 。
(5)在1L真空密闭容器中加入a mol PH4I固体,t ℃时发生如下反应:
PH4I(S) PH3 (g)+HI(g) ①
4PH3(g) P4(g)+6H2(g) ②
2HI(g) H2(g)+I2(g) ③
达平衡时,体系中n(HI)=b mol,n(I2)=c mol,n(H2)=d mol,则t ℃时反应①的平衡常数K值为 (用字母表示)。
8.我国化学家首次实现了膦催化的(3+2)环加成反应,并依据该反应,发展了一条合成中草药活性成分茅苍术醇的有效路线。
已知(3+2)环加成反应:
回答下列问题:
(1)茅苍术醇的分子式为 ,所含官能团名称为 ,分子中手性碳原子(连有四个不同的原子或原子团)的数目为 。
(2)化合物B的核磁共振氢谱中有 个吸收峰;其满足以下条件的同分异构体(不考虑手性异构)数目为 。
①分子中含有碳碳三键和乙酯基(-COOCH2CH3)
②分子中有连续四个碳原子在一条直线上
写出其中碳碳三键和乙酯基直接相连的同分异构体的结构简式 。
(3)C→D的反应类型为 。
(4)D→E的化学方程式为 ,除E外该反应另一产物的系统命名为 。
(5)下列试剂分别与F和G反应,可生成相同环状产物的是 (填序号)。
a.Br2 b.HBr c.NaOH溶液
(6)参考以上合成路线及条件,选择两种链状不饱和酯,通过两步反应合成化合物M,在方框中写出路线流程图(其他试剂任选)。
9.环己烯是重要的化工原料。其实验室制备流程如图:
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为 ,现象为 。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
①烧瓶A中进行的可逆反应化学方程式为 ,浓硫酸也可作该反应的催化剂,选择FeCl3 6H2O而不用浓硫酸的原因为 (填序号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3 6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeC13 6H2O比浓硫酸的平衡转化率高
②仪器B的作用为 。
(3)操作2用到的玻璃仪器是 。
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石, ,弃去前馏分,收集83 ℃的馏分。
Ⅱ.环己烯含量的测定
在一定条件下,向a g环己烯样品中加入定量制得的b mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用c mol L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液V mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①
②Br2+2KI═I2+2KBr
③I2+2Na2S2O3═2NaI+Na2S4O6
(5)滴定所用指示剂为 。样品中环己烯的质量分数为 (用字母表示)。
(6)下列情况会导致测定结果偏低的是 (填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.Na2S2O3标准溶液部分被氧化
10.多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
回答下列问题:
Ⅰ.硅粉与HCl在300 ℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,该反应的热化学方程式为 。SiHCl3的电子式为 。
Ⅱ.将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2 (g) SiHCl3(g)+HCl(g)△H1>0
②3SiCl4 (g)+2H2 (g)+Si(s) 4SiHCl3(g)△H2<0
③2SiCl4(g)+H2 (g)+Si(s)+HCl(g) 3SiHCl3(g) △H3
(1)氢化过程中所需的高纯度H2可用惰性电极电解KOH溶液制备,写出产生H2的电极名称 (填“阳极”或“阴极”),该电极反应方程式为 。
(2)已知体系自由能变△G=△H-T△S,△G<0时反应自发进行。三个氢化反应的△G与温度的关系如图1所示,可知:反应①能自发进行的最低温度是 ;相同温度下,反应②比反应①的△G小,主要原因是 。
(3)不同温度下反应②中SiCl4转化率如图2所示。下列叙述正确的是 (填序号)。
a.B点:v正>v逆 b.v正:A点>E点 c.反应适宜温度:480~520 °C
(4)反应③的△H3= (用△H1,△H2表示)。温度升高,反应③的平衡常数K (填“增大”“减小”或“不变”)。
(5)由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3和Si外,还有 (填分子式)。
化学试题答案
一、选择题
1.D。【解析】A选项,秸秆通过发酵生成乙醇,为化学变化,故A不符合题意;B选项,石油生产塑料、化纤,是将石油先裂化生成小分子,小分子发生加聚反应再生成高分子,为化学变化,故B不符合题意;C选项,利用基本的化学原料生产化学合成药物,则为基本化学原料发生反应生成新物质,为化学变化,故C不符合题意;D选项,利用反渗透膜从海水中分离出淡水,无新物质生成,是物理变化,故D符合题意。故选D。
2.A。【解析】A选项,向氢氧化镁悬浊液中滴加氯化铵溶液,水解导致溶液呈酸性,Mg(OH)2能溶于酸,离子方程式为Mg(OH)2+═Mg2++2NH3 H2O,故A正确;B选项,向沸水中滴加饱和氯化铁溶液得到的是胶体,胶体不是沉淀,不能写沉淀符号,离子方程式为Fe3++3H2O═Fe(OH)3(胶体)+3H+,故B错误;C选项,二氧化硫和酸性高锰酸钾溶液发生氧化还原反应生成锰离子、硫酸根离子,方程式中转移电子不守恒,离子方程式为5SO2++2H2O═+2Mn2++4H+,故C错误;D选项,氧化亚铁溶于稀硝酸,则亚铁离子易被硝酸氧化生成铁离子,离子方程式为3FeO+10H++═3Fe3++NO↑+5H2O,故D错误。故选A。
3.C。【解析】A选项,氯气具有强氧化性,能将氧化亚铁离子氧化为铁离子,铁离子能将Fe氧化为亚铁离子,涉及的反应为2Fe2++Cl2=2Fe3++2Cl-、2Fe3++Fe=3Fe2+,从而除去氯气,故A正确;B选项,Li-Al合金密度较小且硬度及强度大,所以Li-Al合金可以用于航空工业,故B正确;C选项,熟石灰成分为氢氧化钙,具有碱性,碳酸钠水解导致其水溶液呈碱性,所以盐碱地中加入熟石灰不能改良土壤,故C错误;D选项,无水CoCl2呈蓝色,吸水会变为粉红色,则可以根据变色硅胶的颜色变化判断是否吸水,故D正确。故选C。
4.B。【解析】A选项,混合浓硫酸和乙醇相当于浓硫酸的稀释,应该将浓硫酸倒入乙醇中并不断搅拌,故A错误;B选项,定容时视线与凹液面最低处相平,故B正确;C选项,二氧化氮密度大于空气,应该采用向上排空气法收集,所以导气管应该遵循“长进短出”原则,故C错误;D选项,乙炔中若含有其他也能使溴水褪色的气体时,应该先将得到的气体除杂,然后再通入溴水检验乙炔,故D错误。故选B。
5.C。【解析】酸的电离平衡常数越大,酸性越强,根据电离平衡常数知,酸性:HNO2>
CH3COOH,A选项,加水稀释促进弱酸电离,pH相同的两种酸稀释相同倍数,pH变化大的酸性较强,根据图知,pH变化较大的是Ⅱ,则Ⅱ表示较强的酸HNO2,所以曲线Ⅰ表示CH3COOH,故A错误;B选项,酸或碱抑制水的电离,酸中c(H+)越大其抑制水电离程度越大,酸中c(H+):b>c,则抑制水电离程度:b>c,所以水的电离程度:b<c,故B错误;C选项,水解平衡常数只与温度有关,=Kh,从c点到d点,温度不变,水解平衡常数不变,所以溶液中保持不变,故C正确;D选项,a点两种溶液的pH相同,但是两种溶液浓度:HNO2<CH3COOH,相同体积的a点两种溶液中溶质物质的量:HNO2<CH3COOH,消耗的碱与酸的物质的量成正比,所以消耗的碱:HNO2<
CH3COOH,根据Na原子守恒知溶液中n(Na+):HNO2<CH3COOH,故D错误。故选C。
6.D。【解析】A选项,放电时,a电极I2Br-生成I-,发生还原反应,电极反应为I2Br-+
2e-═2I-+Br-,故A正确;B选项,放电时正极的I2Br-生成I-、Br-,负极生成Zn2+,则溶液中离子的数目增大,故B正确;C选项,充电时,b电极生成Zn,每增重0.65 g,即生成0.01 mol Zn,则转移0.02 mol电子,阳极发生2I-+Br--2e-=I2Br-,溶液中有0.02 mol I-被氧化,故C正确;D选项,充电时,a电极生成I2Br-,发生氧化反应,则a为阳极,连接电源的正极,故D错误。故选D。
二、解答题
7.(1)第四周期第VA族;173;黑磷;(2)>;>;N2H4分子间存在氢键;(3)bc;
(4)SbCl3+H2O SbOCl↓+2HCl;加入盐酸抑制水解;(5)()×b
【解析】(1)As位于第四周期第ⅤA族,中子数=质量数-质子数=288-115=173;能量越低越稳定,P(s,白磷)═P(s,黑磷)△H=-39.3 kJ mol-1 ①
P(s,白磷)═P(s,红磷)△H=-17.6 kJ mol-1 ②
将方程式①-②得P(s,红磷)═P(s,黑磷)△H=(-39.3+17.6)kJ/mol=-21.7 kJ/mol,
则能量:红磷>黑磷,则黑磷最稳定;
(2)元素的非金属性越强,其氢化物的稳定性越强;非金属性N>P,所以热稳定性:
NH3>PH3;N2H4能形成分子间氢键、P2H4分子间不能形成氢键,所以沸点:N2H4>P2H4;
分子晶体熔沸点与分子间作用力和氢键有关,能形成氢键的氢化物熔沸点较高;
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似,PH3与HI反应产物为PH4I,相当于铵盐,具有铵盐结构性质,a选项,铵盐能和NaOH发生复分解反应,所以PH4I能与NaOH反应,故a错误;b选项,铵盐中存在离子键和共价键,所以PH4I中含离子键、共价键,故b正确;c选项,铵盐都易发生水解反应,所以PH4I能与水反应,故c正确。故选bc;
(4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,根据元素守恒知,还生成HCl,反应方程式为SbCl3+H2O SbOCl↓+2HCl;配制SbCl3溶液要防止其水解,其水溶液呈酸性,所以酸能抑制水解,则配制该溶液时为防止水解应该加入盐酸;
(5)可逆反应 2HI(g) H2(g)+I2(g) ③
平衡(mol/L) b c c
可逆反应 4PH3(g) P4(g)+6H2(g) ②
反应(mol/L) (d-c) d-c
可逆反应 PH4I(S) PH3(g)+HI(g) ①
平衡(mol/L) b+2c-(d-c) b
则t ℃时反应①的平衡常数K=c(PH3)×c(HI)=[b+2c-(d-c)]×b=()×b。
8.(1)C15H26O;碳碳双键、碳原子;3;
(2)2;5;;
(3)加成反应(或还原反应);
(4);2-甲基-2-丙醇;(5)b;
(6)
【解析】(1)茅苍术醇分子中有15个C原子、1个O原子,分子不饱和度为3,则分子中H原子数目=2×15+2-2×3=26,故茅苍术醇分子式为C15H26O;由结构可知分子中含有的官能团有:碳碳双键、羟基;分子中有如图“*”所示3个碳原子连接连有四个不同的原子或原子团:,即有3个手性碳原子;
(2)化合物B分子中只有2种化学环境不同的H原子,故其核磁共振氢谱有2个吸收峰,B的同分异构体满足:①分子中含有碳碳三键和乙酯基(-COOCH2CH3),②分子中有连续四个碳原子在一条直线上,存在C-C≡C-C碳链结构,形成酯的酸可以看作CH3C≡CCH2CH3中1个H原子被-COOH替代,有3种酸,也可以是HOOC-C≡CCH2CH2CH3、HOOC-C≡CCH(CH3)2,故符合条件的同分异构体有3+2=5种,其中碳碳三键和乙酯基直接相连的同分异构体的结构简式为:
;
(3)对比C、D的结构,可知C中碳碳双键与氢气发生加成反应生成D,也属于还原反应;
(4)对比D、E的结构,可知D与甲醇发生发生取代反应生成E,同时还生成(CH3)3COH,反应方程式为:,(CH3)3COH的名称为2-甲基-2-丙醇;
(5)F、G均含有碳碳双键与酯基,但碳碳双键位置不同,在碱性条件下水解得到环状产物不同,与溴发生反应时溴原子位置不完全相同,但与HBr加成后溴原子连接位置可能相同,即可生成相同环状产物;
(6)两种链状不饱和酯合成目标物M,模仿A与B反应,结合(3+2)环加成反应,可以由或与氢气加成反应得到目标物。而CH3C≡CCOOCH3与CH2=CHCOOCH2CH3反应得到。CH3C≡CCOOCH2CH3与CH2=CHCOOCH3反应得到,合成路线流程图为:。
9.(1)FeCl3溶液;溶液显紫色;(2)①;ab;②减少环己醇蒸出,增大环己醇利用率;(3)分液漏斗、烧杯;(4)通冷凝水、加热;(5)淀粉溶液;;(6)bc
【解析】环己醇发生消去反应生成环己烯和水,环己烯不溶于水,饱和食盐水溶解环己醇、氯化铁,然后分液,得到的水相中含有环己醇、氯化铁,得到的有机相中含有环己烯,然后干燥、过滤、蒸馏得到环己烯;
(1)苯酚能和氯化铁溶液发生显色反应导致混合溶液呈紫色,所以可以用FeCl3溶液检验苯酚;
(2)①烧瓶A中进行的可逆反应为环己醇的消去反应,反应方程式为;
a选项,浓硫酸具有强吸水性和强氧化性,易使原料炭化并产生SO2,从而降低环己烯产率,故a正确;b选项,FeCl3 6H2O污染小、可循环使用,符合绿色化学理念,故b正确;c选项,催化剂只影响反应速率,不影响平衡移动,所以催化剂不影响产率,故c错误。故选ab;
②仪器B能冷凝回流环己醇,所以B的作用是减少环己醇蒸出,增大环己醇利用率;
(3)操作2为分液,分液用到的玻璃仪器有分液漏斗、烧杯;
(4)操作3(蒸馏)的步骤:安装蒸馏装置,加入待蒸馏的物质和沸石,通冷凝水、加热,弃去前馏分,收集83 ℃的馏分;
(5)碘遇淀粉溶液变蓝色,所以可以用淀粉溶液检验碘,所以选取的试剂为淀粉溶液;
②Br2+2KI═I2+2KBr、③I2+2Na2S2O3═2NaI+Na2S4O6得关系式Br2~I2~2Na2S2O3,则与KI反应的n(Br2)=n(Na2S2O3)=×cV×10-3 mol,所以与环己烯反应的n(Br2)=(b-×cV×10-3)mol,根据得n(环己烯)=(b-×cV×10-3)mol,m(环己烯)=(b-×cV×10-3)mol×82 g/mol,环己烯质量分数==
=;
(6)a选项,样品中含有苯酚杂质,苯酚和溴发生取代反应生成沉淀,消耗相同质量的溴,消耗环己烯的质量大于苯酚,所以如果含有苯酚导致测定偏高,故a错误;b选项,在测定过程中部分环己烯挥发导致环己烯质量减少,导致测定结果偏低,故b正确;c选项,Na2S2O3标准溶液部分被氧化导致消耗的硫代硫酸钠偏大,与环己烯反应的溴的质量偏低,导致测定结果偏低,故c正确。故选bc。
10.Ⅰ. △H=-225 kJ/mol;;
(1)阴极;2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑);(2)1000 ℃;△H2<△H1导致反应②的△G小;(3)ac;(4)△H2-△H1;减小;(5)HCl、H2
【解析】Ⅰ.硅粉与HCl在300 ℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,根据反应热及反应物状态、反应条件,该反应的热化学方程式为 △H=-225 kJ/mol;SiHCl3中存在1个Si-H键、3个Si-Cl键,其电子式为;
(1)电解KOH溶液时,阳极上水或氢氧根离子失电子生成氧气,阴极上水或氢离子得电子生成氢气,电极反应式为2H2O+2e-═H2↑+2OH-或2H++2e-═H2↑;
(2)①SiCl4(g)+H2(g) SiHCl3(g)+HCl(g),该反应的△S=0,要使△G=△H-0<0,根据图知,反应①能自发进行的最低温度是1000 ℃;相同温度下,①中△H>0、②中△H<0,且反应②△S<0,因此反应②的△G小;
(3)根据图知,A到D点,随着温度升高,SiCl4转化率增大,说明平衡正向移动且没有达到平衡状态,D点后升高温度SiCl4转化率降低,说明升高温度平衡逆向移动,则D为平衡点,a选项,B点平衡正向移动,所以v正>v逆,故a正确;b选项,温度越高化学反应速率越大,温度A<E,所以反应速率A<E,故b错误;c选项,转化率越大越好且温度不能太高,根据图知,反应适宜温度:480~520 ℃,故c正确;
(4)①SiCl4(g)+H2(g) SiHCl3(g)+HCl(g)△H1>0
②3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)△H2<0
将方程式②-①得③2SiCl4(g)+H2(g)+Si(s)+HCl(g) 3SiHCl3(g),则△H3=△H2-
△H1<0,升高温度平衡向吸热方向移动,该反应的正反应是放热反应,则升高温度平衡逆向移动,所以升高温度反应③的平衡常数K减小;
(5)根据图知,粗硅和干燥HCl反应生成混合物,SiHCl3和氢气反应生成HCl;混合物分离得到氢气,SiHCl3和氢气反应生成HCl需要氢气,所以由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3和Si外,还有HCl、H2。
同课章节目录
