2019年高考化学真题解析卷(北京卷)
文档属性
| 名称 | 2019年高考化学真题解析卷(北京卷) |  | |
| 格式 | docx | ||
| 文件大小 | 397.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-05 15:52:10 | ||
图片预览




文档简介
2019年高考化学真题(北京卷)
一、选择题(本部分共7小题,每小题6分,共42分)
1.下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是( )
A.4.03米大口径碳化硅反射镜 B.2022年冬奥会聚氨酯速滑服
C.能屏蔽电磁波的碳包覆银纳米线 D.“玉兔二号”钛合金筛网轮
2.下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)( )
A.NaCl═Na++Cl- B.CuCl2═Cu2++2Cl-
C.CH3COOH CH3COO-+H+ D.H2(g)+Cl2(g)═2HCl(g) △H=-183 kJ mol-1
3.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )
A.In是第五周期第ⅢA族元素 B.In的中子数与电子数的差值为17
C.原子半径:In>Al D.碱性:In(OH)3>RbOH
4.交联聚合物P的结构片段如图所示。下列说法不正确的是(图中表示链延长) ( )
A.聚合物P中有酯基,能水解
B.聚合物P的合成反应为缩聚反应
C.聚合物P的原料之一丙三醇可由油脂水解获得
D.邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚 合物P的交联结构
5.下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( )
选项 物质(括号内为杂质) 除杂试剂
A FeCl2溶液(FeCl3) Fe粉
B NaCl溶液(MgCl2) NaOH溶液、稀HCl
C Cl2(HCl) H2O、浓H2SO4
D NO(NO2) H2O、无水CaCl2
6.探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol L-1 H2C2O4的pH=1.3)
实验 装置 试剂a 现象
① Ca(OH)2溶液(含酚酞) 溶液褪色,产生白色沉淀
② 少量NaHCO3溶液 产生气泡
③ 酸性KMnO4溶液 紫色溶液褪色
④
C2H5OH和浓硫酸 加热后产生有香味物质
由上述实验所得草酸性质所对应的方程式不正确的是( )
A.H2C2O4有酸性,Ca(OH)2+H2C2O4═CaC2O4↓+2H2O
B.酸性:H2C2O4>H2CO3,NaHCO3+H2C2O4═NaHC2O4+CO2↑+H2O
C.H2C2O4有还原性,++16H+═2Mn2++10CO2↑+8H2O
D.H2C2O4可发生酯化反应,
7.实验测得0.5 mol L-1 CH3COONa溶液、0.5 mol L-1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是( )
A.随温度升高,纯水中c(H+)>c(OH-)
B.随温度升高,CH3COONa的溶液的c(OH-)减小
C.随温度升高,CuSO4的溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D.随水温升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
二、非选择题(本部分共4小题,共58分)
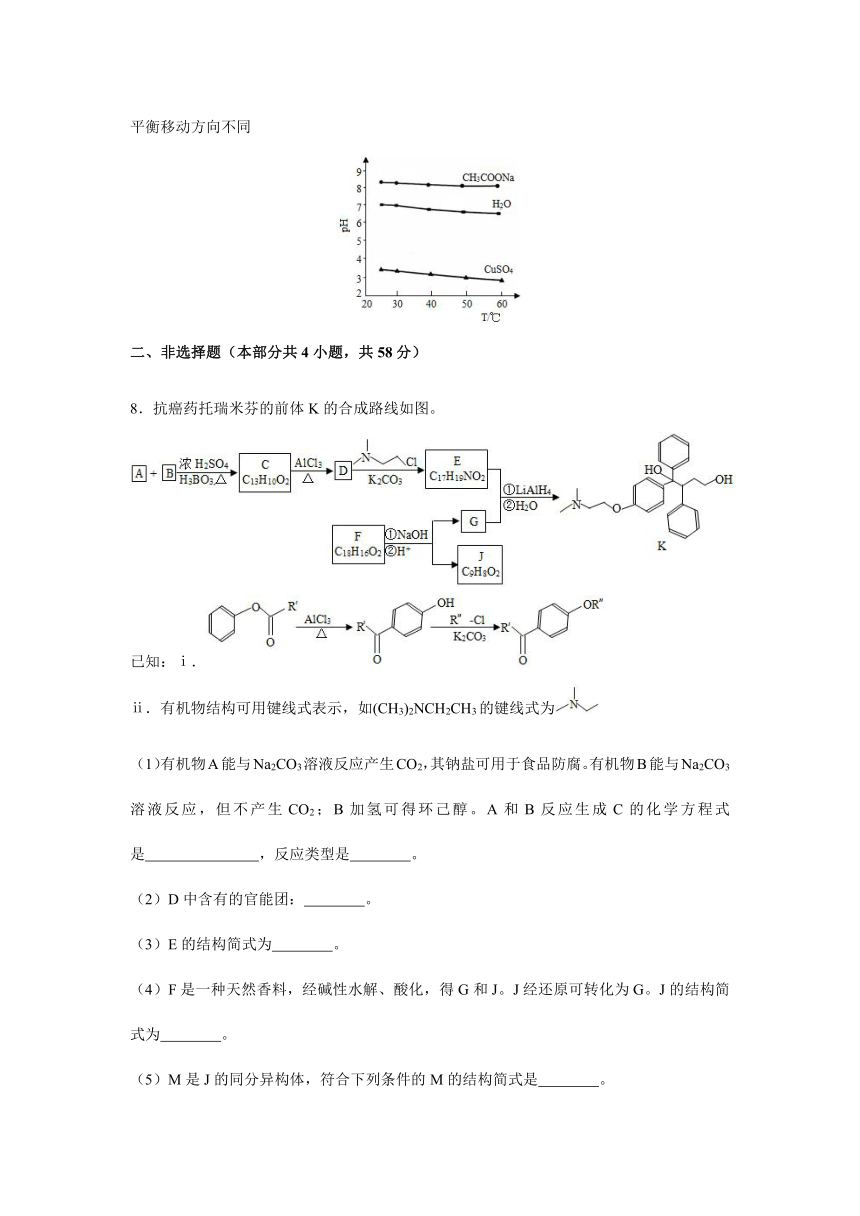
8.抗癌药托瑞米芬的前体K的合成路线如图。
已知:ⅰ.
ⅱ.有机物结构可用键线式表示,如(CH3)2NCH2CH3的键线式为
(1)有机物A能与Na2CO3溶液反应产生CO2,其钠盐可用于食品防腐。有机物B能与Na2CO3溶液反应,但不产生CO2;B加氢可得环己醇。A和B反应生成C的化学方程式是 ,反应类型是 。
(2)D中含有的官能团: 。
(3)E的结构简式为 。
(4)F是一种天然香料,经碱性水解、酸化,得G和J。J经还原可转化为G。J的结构简式为 。
(5)M是J的同分异构体,符合下列条件的M的结构简式是 。
①包含2个六元环
②M可水解,与NaOH溶液共热时,1 mol M最多消耗2 mol NaOH
(6)推测E和G反应得到K的过程中,反应物LiAlH4和H2O的作用是 。
(7)由K合成托瑞米芬的过程如下图所示:托瑞米芬具有反式结构,其结构简式是 。
9.化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。
Ⅰ、用已准确称量的KBrO3固体配制一定体积的a mol L-1 KBrO3标准溶液;
Ⅱ、取V1 mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色;
Ⅲ、向Ⅱ所得溶液中加入V2 mL废水;
Ⅳ、向Ⅲ中加入过量KI;
Ⅴ、用b mol L-1 Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液V3 mL。
已知:I2+2Na2S2O3═2NaI+Na2S4O6
Na2S2O3和Na2S4O6溶液颜色均为无色
(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)Ⅱ中发生反应的离子方程式是 。
(3)Ⅲ中发生反应的化学方程式是 。
(4)Ⅳ中加KI前,溶液颜色须为黄色,原因是 。
(5)KI与KBrO3物质的量关系为n(KI)≥6n(KBrO3)时,KI一定过量,理由是
。
(6)V中滴定至终点的现象是 。
(7)废水中苯酚的含量为 g L-1 (苯酚摩尔质量:94 g mol-1)。
(8)由于Br2具有 的性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。
10.氢能源是最具有应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是 。
②已知反应器中还存在如下反应:
ⅰ.CH4(g)+H2O(g)═CO(g)+3H2(g)△H1
ⅱ.CO(g)+H2O(g)═CO2(g)+H2(g)△H2
ⅲ.CH4(g)═C(s)+2H2(g)△H3
…
ⅲ为积炭反应,利用△H1和△H2计算△H3时,还需要利用 反应的△H。
③反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是 (选填字母序号)。
a.促进CH4转化
b.促进CO转化为CO2
c.减少积炭生成
④用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如图所示。
从t1时开始,H2体积分数显著降低,单位时间CaO消耗率
(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因: 。
(2)可利用太阳能光伏电池电解水制高纯氢,工作示意图如图所示。通过控制开关连接K1或K2,可交替得到H2和O2。
①制H2时,连接 。产生H2的电极方程式是 。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用: 。
11.化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如图装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B
①浓H2SO4与Cu反应的化学方程式是 。
②试剂a是 。
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或二者混合物。
(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分
①写出Ag2SO3溶于氨水的离子方程式: 。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是 。
(3)根据沉淀F的存在,推测的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,被氧化为进入D。
实验三:探究的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有 ;取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由: 。
②实验三的结论: 。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是 。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和生成。
(6)根据上述实验所得结论: 。
化学试题答案
一、选择题
1.A。【解析】A选项,C、Si都位于第IV A族,二者位于同一主族,故A正确;B选项,聚氨酯中含有C、H、O、N元素,分别位于第IV A族、第I A族、第VI A族、第V A族,这几种元素位于不同主族,且聚氨酯属于有机高分子材料,故B错误;C选项,C位于第IV A族、Ag位于第I B族,二者位于不同族且Ag为副族元素,故C错误;D选项,钛合金主要成分有Ti、Al等,Ti位于第IV B族,Al位于第III A族,二者位于不同族且Ti为副族元素,故D错误。故选A。
2.B。【解析】A选项,NaCl为强电解质,则电离方程式为NaCl═Na++Cl-,故A正确;B选项,电解氯化铜生成Cu和氯气,则方程式为,故B错误;C选项,醋酸为弱电解质,存在电离平衡,则电离方程式为CH3COOH CH3COO-+H+,故C正确;D选项,焓变等于断裂化学键吸收的能量减去成键释放的能量,则△H=(436+243-431×2)kJ mol-1=-183 kJ mol-1,由状态及焓变可知热化学方程式为H2(g)+Cl2═2HCl(g)△H=-183
kJ mol-1,故D正确。故选B。
3.D。【解析】A选项,In的原子序数为49,原子核外有5个电子层,数目分别为2、8、18、18、3,则铟处于第五周期第ⅢA族,故A正确;B选项,In的中子数为115-49=66,In原子的核外电子数为49,则In的中子数与电子数的差值为66-49=17,故B正确;C选项,同主族元素从上到下原子半径依次增大,则原子半径:In>Al,故C正确;D选项,金属性Rb>In,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性In(OH)3<RbOH,故D错误。故选D。
4.D。【解析】A选项,Y与X发生缩聚反应生成P,P含-COOC-,可发生水解反应,故A正确;B选项,-COOH、-OH发生反应,则聚合物P的合成反应为缩聚反应,故B正确;C选项,油脂为高级脂肪酸甘油酯,则水解可生成甘油,故C正确;D选项,邻苯二甲酸和乙二醇发生缩聚反应生成直链结构的高分子,不能形成类似聚合物P的交联结构,故D错误。故选D。
5.B。【解析】A选项,Fe与氯化铁反应生成氯化亚铁,为氧化还原反应,故A不符合题意;B选项,NaOH与氯化镁发生复分解反应,加盐酸中和过量的NaOH,也为复分解反应,可除杂,整个过程不涉及氧化还原反应,故B符合题意;C选项,氯气与水反应,发生氧化还原反应,应选饱和食盐水抑制氯气的溶解,故C不符合题意;D选项,二氧化氮与水反应生成NO,为氧化还原反应,故D不符合题意。故选B。
6.C。【解析】A选项,Ca(OH)2溶液(含酚酞)中加入草酸溶液,溶液褪色,说明混合溶液碱性减弱,且生成白色沉淀,则说明Ca(OH)2溶液与草酸溶液发生中和反应,从而体现草酸的酸性,反应方程式为Ca(OH)2+H2C2O4═CaC2O4↓+2H2O,故A正确;B选项,向少量NaHCO3溶液加入草酸有气泡生成,说明有二氧化碳生成,强酸能和弱酸盐反应生成弱酸,根据实验现象可知,酸性:H2C2O4>H2CO3,反应方程式为NaHCO3+H2C2O4═NaHC2O4+
CO2↑+H2O,故B正确;C选项,酸性KMnO4溶液具有强氧化性,向酸性KMnO4溶液加入草酸,溶液褪色,说明酸性KMnO4溶液氧化了草酸,则体现草酸的还原性,根据题干信息,草酸为弱酸,+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,故C错误;D选项,酯具有香味,C2H5OH和浓硫酸溶液中加入草酸加热后产生有香味物质,说明有酯生成,所以发生了酯化反应,则草酸可以发生酯化反应,故D正确。故选C。
7.C。【解析】A选项,升高温度促进水电离,但是纯水中仍然存在c(H+)=c(OH-),故A错误;B选项,升高温度促进醋酸钠水解、水的电离,溶液中c(OH-)增大,故B错误;C选项,盐类水解和水的电离都是吸热反应,升高温度促进CuSO4水解也促进水电离,所以升高温度导致Kw增大,则升高温度CuSO4的溶液的pH变化是Kw改变与水解平衡移动共同作用的结果,故C正确;D选项,升高温度促进盐类水解,醋酸钠和硫酸铜中都有弱离子水解,升高温度促进CH3COO-、Cu2+水解,所以CH3COO-、Cu2+水解平衡移动方向相同,故D错误。故选C。
二、非选择题
8.(1)++H2O;取代反应(或酯化反应);(2)羰基、羟基;(3);(4);
(5);(6)还原剂;(7)
【解析】(1)通过以上分析知,A为,B为,C为,A和B反应生成C的化学方程式是++H2O,反应类型是取代反应或酯化反应;
(2)D为,D中含有的官能团:羰基、羟基;
(3)E的结构简式为;
(4)J的结构简式为;
(5)J为,M是J的同分异构体,①包含2个六元环;②M可水解,说明含有酯基;与NaOH溶液共热时,1 mol M最多消耗 2 mol NaOH,说明水解生成酚羟基和羧基,符合条件的结构简式为;
(6)推测E和G反应得到K的过程中,该反应为加成反应,羰基上加上H原子,则反应物LiAlH4和H2O的作用是还原剂;
(7)托瑞米芬结构简式为。
9.(1)容量瓶;(2)BrO3-+5Br-+6H+═3Br2+3H2O;(3);
(4)确保溴过量,保证苯酚已经完全反应;(5)由电子守恒可知,当n(KI)=6n(KBrO3)时,KI恰好与步骤II中生成的溴完全反应,而步骤III中苯酚会消耗一定量的溴,所以n(KI)≥6n(KBrO3)时,KI一定过量;(6)最后一滴Na2S2O3溶液滴入后,溶液恰好蓝色消失,且半分钟内不变色;(7);(8)挥发性
【解析】(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和容量瓶;
(2)Ⅱ中发生反应的离子方程式是BrO3-+5Br-+6H+═3Br2+3H2O;
(3)Ⅲ中发生反应的化学方程式是苯酚与浓溴水反应的化学方程式为;
(4)Ⅳ中加KI前,溶液颜色须为黄色,原因是确保溴过量,保证苯酚已经完全反应;
(5)KI与KBrO3物质的量关系为n(KI)≥6n(KBrO3)时,KI一定过量,理由是由电子守恒可知,当n(KI)=6n(KBrO3)时,KI恰好与步骤II中生成的溴完全反应,而步骤III中苯酚会消耗一定量的溴,所以n(KI)≥6n(KBrO3)时,KI一定过量;
(6)V中滴定至终点的现象是最后一滴Na2S2O3溶液滴入后,溶液恰好蓝色消失,且半分钟内不变色;
(7)由BrO3-+5Br-+6H+═3Br2+3H2O、I2+2Na2S2O3═2NaI+Na2S4O6、可知,生成的溴的物质的量为a mol/L×V1×10-3 L×3=
3aV1×10-3 mol,由溴与碘化钾反应生成的碘的物质的量为b mol/L×V3×10-3 L×=5bV3×10-4 mol,所以与苯酚反应的溴的物质的量为3aV1×10-3 mol-5bV3×10-4 mol=(30aV1-5bV3)×10-4 mol,由可知,苯酚的物质的量为(30aV1-5bV3)×10-4 mol×,废水中苯酚的含量为=g L-1;
(8)由于Br2具有挥发性的性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。
10.(1)①CH4+2H2O(g)2H2+CO2;②2H2(g)+CO2(g)═C(S)+2H2O(g)[或C(s)+CO2(g)═2CO(g)];③abc;④降低;二氧化碳与CaO发生CO2+CaO═CaCO3,覆盖在CaO的表面,阻碍CO2的与CaO的继续进行;(2)①K1;2H2O+2e-═H2↑+2OH-;
③①中电极3发生Ni(OH)2-e-+OH-═NiOOH+H2O,制氢气时消耗电极1产生的OH-,②中电极3发生NiOOH+H2O+e-═Ni(OH)2+OH-,制氧气时补充电极2消耗的OH-
【解析】(1)①甲烷和水蒸气反应生成H2和CO2,其物质的量之比为4∶1,则反应的方程式为CH4+2H2O(g)4H2+CO2;
②ⅰ.CH4(g)+H2O(g)═CO(g)+3H2(g)△H1
ⅱ. CO(g)+H2O(g)═CO2(g)+H2(g)△H2,则i+ii可得CH4(g)+2H2O(g)═CO2(g)+4H2(g),如要得到ⅲ.CH4(g)═C(s)+2H2(g)△H3,则还应需要
2H2(g)+CO2(g)═C(S)+2H2O(g)的△H,CH4(g)+2H2O(g)═CO2(g)+
4H2(g)与2H2(g)+CO2(g)═C(S)+2H2O(g)相加可得CH4(g)═C(s)+2H2(g),
或i-ii得CH4(g)+CO2(g)═2CO(g)+2H2(g),然后与C(s)+CO2(g)═2CO(g)相减,亦可得到反应iii的△H;
③水过量,可分别与i中的CH4、ii中的CO反应,则可促进CH4转化、促进CO转化为CO2、且与iii生成的C等反应,减少积炭生成;
④由图象可知,CaO消耗率曲线斜率减小,则CaO消耗率降低;过多的二氧化碳与CaO发生反应CO2+CaO═CaCO3,生成的CaCO3覆盖在CaO的表面,阻碍CO2与CaO反应的继续进行,导致CaO消耗率约为35%时已失效;
(2)①电解水生成氢气和氧气,氧气在阳极生成,氢气在阴极生成,则应连接K1,电极方程式为2H2O+2e-═H2↑+2OH-;
③电极3可分别连接K1或K2,①中电极3发生反应Ni(OH)2-e-+OH-═NiOOH+H2O,制氢气时消耗电极1产生的OH-,②中电极3发生反应NiOOH+H2O+e-═Ni(OH)2+OH-,制氧气时补充电极2消耗的OH-,实现NiOOH Ni(OH)2的转化,且可循环使用。
11.(1)①;②饱和NaHSO3溶液;
(2)①Ag2SO3+4NH3 H2O═++4H2O;②加入稀硫酸,产生白色沉淀;
(3)①Ag+;因为Ag2SO4微溶于水,Ag2SO4(s) 2Ag++,向上层清液滴加氯化钡溶液,若含有Ag2SO4,则会出现沉淀;②产生的途径是被氧化为进入D;
(4)2Ag++SO2+H2O═Ag2SO3↓+2H+;(6)二氧化硫和硝酸银反应生成亚硫酸银和氢离子,同时生成少量硫酸银,则既能发生沉淀反应,又能发生氧化还原反应,其中沉淀反应的速率比氧化还原反应快
【解析】(1)①浓H2SO4可以与Cu反应生成硫酸铜、二氧化硫和水,方程式为:;
②试剂a用于除去二氧化硫中的杂质,一般用饱和饱和NaHSO3溶液;
(2)①Ag2SO3溶于氨水生成银氨络离子,反应的离子方程式为Ag2SO3+4NH3 H2O═++4H2O;
②由于亚硫酸钡溶于稀盐酸生成钡离子而硫酸钡不溶于稀盐酸,故用稀硫酸鉴别E中的钡离子从而证明D中主要是亚硫酸钡,进一步证实B中含有亚硫酸银;
(3)①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有Ag+;取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4,原因是Ag2SO4微溶于水,Ag2SO4(s) 2Ag++,向上层清液滴加氯化钡溶液,若含有Ag2SO4,则会出现沉淀;
②由实验三可知产生的途径是被氧化为进入D;
(4)由以上分析可知SO2与AgNO3溶液反应生成Ag2SO3和硝酸,离子方程式是2Ag++SO2+H2O═Ag2SO3↓+2H+;
(6)由以上实验现象可知二氧化硫和硝酸银反应生成亚硫酸银和氢离子,同时生成少量硫酸银,则既能发生沉淀反应,又能发生氧化还原反应,其中沉淀反应的速率比氧化还原反应快。
一、选择题(本部分共7小题,每小题6分,共42分)
1.下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是( )
A.4.03米大口径碳化硅反射镜 B.2022年冬奥会聚氨酯速滑服
C.能屏蔽电磁波的碳包覆银纳米线 D.“玉兔二号”钛合金筛网轮
2.下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)( )
A.NaCl═Na++Cl- B.CuCl2═Cu2++2Cl-
C.CH3COOH CH3COO-+H+ D.H2(g)+Cl2(g)═2HCl(g) △H=-183 kJ mol-1
3.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )
A.In是第五周期第ⅢA族元素 B.In的中子数与电子数的差值为17
C.原子半径:In>Al D.碱性:In(OH)3>RbOH
4.交联聚合物P的结构片段如图所示。下列说法不正确的是(图中表示链延长) ( )
A.聚合物P中有酯基,能水解
B.聚合物P的合成反应为缩聚反应
C.聚合物P的原料之一丙三醇可由油脂水解获得
D.邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚 合物P的交联结构
5.下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( )
选项 物质(括号内为杂质) 除杂试剂
A FeCl2溶液(FeCl3) Fe粉
B NaCl溶液(MgCl2) NaOH溶液、稀HCl
C Cl2(HCl) H2O、浓H2SO4
D NO(NO2) H2O、无水CaCl2
6.探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol L-1 H2C2O4的pH=1.3)
实验 装置 试剂a 现象
① Ca(OH)2溶液(含酚酞) 溶液褪色,产生白色沉淀
② 少量NaHCO3溶液 产生气泡
③ 酸性KMnO4溶液 紫色溶液褪色
④
C2H5OH和浓硫酸 加热后产生有香味物质
由上述实验所得草酸性质所对应的方程式不正确的是( )
A.H2C2O4有酸性,Ca(OH)2+H2C2O4═CaC2O4↓+2H2O
B.酸性:H2C2O4>H2CO3,NaHCO3+H2C2O4═NaHC2O4+CO2↑+H2O
C.H2C2O4有还原性,++16H+═2Mn2++10CO2↑+8H2O
D.H2C2O4可发生酯化反应,
7.实验测得0.5 mol L-1 CH3COONa溶液、0.5 mol L-1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是( )
A.随温度升高,纯水中c(H+)>c(OH-)
B.随温度升高,CH3COONa的溶液的c(OH-)减小
C.随温度升高,CuSO4的溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D.随水温升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
二、非选择题(本部分共4小题,共58分)
8.抗癌药托瑞米芬的前体K的合成路线如图。
已知:ⅰ.
ⅱ.有机物结构可用键线式表示,如(CH3)2NCH2CH3的键线式为
(1)有机物A能与Na2CO3溶液反应产生CO2,其钠盐可用于食品防腐。有机物B能与Na2CO3溶液反应,但不产生CO2;B加氢可得环己醇。A和B反应生成C的化学方程式是 ,反应类型是 。
(2)D中含有的官能团: 。
(3)E的结构简式为 。
(4)F是一种天然香料,经碱性水解、酸化,得G和J。J经还原可转化为G。J的结构简式为 。
(5)M是J的同分异构体,符合下列条件的M的结构简式是 。
①包含2个六元环
②M可水解,与NaOH溶液共热时,1 mol M最多消耗2 mol NaOH
(6)推测E和G反应得到K的过程中,反应物LiAlH4和H2O的作用是 。
(7)由K合成托瑞米芬的过程如下图所示:托瑞米芬具有反式结构,其结构简式是 。
9.化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。
Ⅰ、用已准确称量的KBrO3固体配制一定体积的a mol L-1 KBrO3标准溶液;
Ⅱ、取V1 mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色;
Ⅲ、向Ⅱ所得溶液中加入V2 mL废水;
Ⅳ、向Ⅲ中加入过量KI;
Ⅴ、用b mol L-1 Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液V3 mL。
已知:I2+2Na2S2O3═2NaI+Na2S4O6
Na2S2O3和Na2S4O6溶液颜色均为无色
(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)Ⅱ中发生反应的离子方程式是 。
(3)Ⅲ中发生反应的化学方程式是 。
(4)Ⅳ中加KI前,溶液颜色须为黄色,原因是 。
(5)KI与KBrO3物质的量关系为n(KI)≥6n(KBrO3)时,KI一定过量,理由是
。
(6)V中滴定至终点的现象是 。
(7)废水中苯酚的含量为 g L-1 (苯酚摩尔质量:94 g mol-1)。
(8)由于Br2具有 的性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。
10.氢能源是最具有应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是 。
②已知反应器中还存在如下反应:
ⅰ.CH4(g)+H2O(g)═CO(g)+3H2(g)△H1
ⅱ.CO(g)+H2O(g)═CO2(g)+H2(g)△H2
ⅲ.CH4(g)═C(s)+2H2(g)△H3
…
ⅲ为积炭反应,利用△H1和△H2计算△H3时,还需要利用 反应的△H。
③反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是 (选填字母序号)。
a.促进CH4转化
b.促进CO转化为CO2
c.减少积炭生成
④用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如图所示。
从t1时开始,H2体积分数显著降低,单位时间CaO消耗率
(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因: 。
(2)可利用太阳能光伏电池电解水制高纯氢,工作示意图如图所示。通过控制开关连接K1或K2,可交替得到H2和O2。
①制H2时,连接 。产生H2的电极方程式是 。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用: 。
11.化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如图装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B
①浓H2SO4与Cu反应的化学方程式是 。
②试剂a是 。
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或二者混合物。
(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分
①写出Ag2SO3溶于氨水的离子方程式: 。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是 。
(3)根据沉淀F的存在,推测的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,被氧化为进入D。
实验三:探究的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有 ;取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由: 。
②实验三的结论: 。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是 。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和生成。
(6)根据上述实验所得结论: 。
化学试题答案
一、选择题
1.A。【解析】A选项,C、Si都位于第IV A族,二者位于同一主族,故A正确;B选项,聚氨酯中含有C、H、O、N元素,分别位于第IV A族、第I A族、第VI A族、第V A族,这几种元素位于不同主族,且聚氨酯属于有机高分子材料,故B错误;C选项,C位于第IV A族、Ag位于第I B族,二者位于不同族且Ag为副族元素,故C错误;D选项,钛合金主要成分有Ti、Al等,Ti位于第IV B族,Al位于第III A族,二者位于不同族且Ti为副族元素,故D错误。故选A。
2.B。【解析】A选项,NaCl为强电解质,则电离方程式为NaCl═Na++Cl-,故A正确;B选项,电解氯化铜生成Cu和氯气,则方程式为,故B错误;C选项,醋酸为弱电解质,存在电离平衡,则电离方程式为CH3COOH CH3COO-+H+,故C正确;D选项,焓变等于断裂化学键吸收的能量减去成键释放的能量,则△H=(436+243-431×2)kJ mol-1=-183 kJ mol-1,由状态及焓变可知热化学方程式为H2(g)+Cl2═2HCl(g)△H=-183
kJ mol-1,故D正确。故选B。
3.D。【解析】A选项,In的原子序数为49,原子核外有5个电子层,数目分别为2、8、18、18、3,则铟处于第五周期第ⅢA族,故A正确;B选项,In的中子数为115-49=66,In原子的核外电子数为49,则In的中子数与电子数的差值为66-49=17,故B正确;C选项,同主族元素从上到下原子半径依次增大,则原子半径:In>Al,故C正确;D选项,金属性Rb>In,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性In(OH)3<RbOH,故D错误。故选D。
4.D。【解析】A选项,Y与X发生缩聚反应生成P,P含-COOC-,可发生水解反应,故A正确;B选项,-COOH、-OH发生反应,则聚合物P的合成反应为缩聚反应,故B正确;C选项,油脂为高级脂肪酸甘油酯,则水解可生成甘油,故C正确;D选项,邻苯二甲酸和乙二醇发生缩聚反应生成直链结构的高分子,不能形成类似聚合物P的交联结构,故D错误。故选D。
5.B。【解析】A选项,Fe与氯化铁反应生成氯化亚铁,为氧化还原反应,故A不符合题意;B选项,NaOH与氯化镁发生复分解反应,加盐酸中和过量的NaOH,也为复分解反应,可除杂,整个过程不涉及氧化还原反应,故B符合题意;C选项,氯气与水反应,发生氧化还原反应,应选饱和食盐水抑制氯气的溶解,故C不符合题意;D选项,二氧化氮与水反应生成NO,为氧化还原反应,故D不符合题意。故选B。
6.C。【解析】A选项,Ca(OH)2溶液(含酚酞)中加入草酸溶液,溶液褪色,说明混合溶液碱性减弱,且生成白色沉淀,则说明Ca(OH)2溶液与草酸溶液发生中和反应,从而体现草酸的酸性,反应方程式为Ca(OH)2+H2C2O4═CaC2O4↓+2H2O,故A正确;B选项,向少量NaHCO3溶液加入草酸有气泡生成,说明有二氧化碳生成,强酸能和弱酸盐反应生成弱酸,根据实验现象可知,酸性:H2C2O4>H2CO3,反应方程式为NaHCO3+H2C2O4═NaHC2O4+
CO2↑+H2O,故B正确;C选项,酸性KMnO4溶液具有强氧化性,向酸性KMnO4溶液加入草酸,溶液褪色,说明酸性KMnO4溶液氧化了草酸,则体现草酸的还原性,根据题干信息,草酸为弱酸,+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,故C错误;D选项,酯具有香味,C2H5OH和浓硫酸溶液中加入草酸加热后产生有香味物质,说明有酯生成,所以发生了酯化反应,则草酸可以发生酯化反应,故D正确。故选C。
7.C。【解析】A选项,升高温度促进水电离,但是纯水中仍然存在c(H+)=c(OH-),故A错误;B选项,升高温度促进醋酸钠水解、水的电离,溶液中c(OH-)增大,故B错误;C选项,盐类水解和水的电离都是吸热反应,升高温度促进CuSO4水解也促进水电离,所以升高温度导致Kw增大,则升高温度CuSO4的溶液的pH变化是Kw改变与水解平衡移动共同作用的结果,故C正确;D选项,升高温度促进盐类水解,醋酸钠和硫酸铜中都有弱离子水解,升高温度促进CH3COO-、Cu2+水解,所以CH3COO-、Cu2+水解平衡移动方向相同,故D错误。故选C。
二、非选择题
8.(1)++H2O;取代反应(或酯化反应);(2)羰基、羟基;(3);(4);
(5);(6)还原剂;(7)
【解析】(1)通过以上分析知,A为,B为,C为,A和B反应生成C的化学方程式是++H2O,反应类型是取代反应或酯化反应;
(2)D为,D中含有的官能团:羰基、羟基;
(3)E的结构简式为;
(4)J的结构简式为;
(5)J为,M是J的同分异构体,①包含2个六元环;②M可水解,说明含有酯基;与NaOH溶液共热时,1 mol M最多消耗 2 mol NaOH,说明水解生成酚羟基和羧基,符合条件的结构简式为;
(6)推测E和G反应得到K的过程中,该反应为加成反应,羰基上加上H原子,则反应物LiAlH4和H2O的作用是还原剂;
(7)托瑞米芬结构简式为。
9.(1)容量瓶;(2)BrO3-+5Br-+6H+═3Br2+3H2O;(3);
(4)确保溴过量,保证苯酚已经完全反应;(5)由电子守恒可知,当n(KI)=6n(KBrO3)时,KI恰好与步骤II中生成的溴完全反应,而步骤III中苯酚会消耗一定量的溴,所以n(KI)≥6n(KBrO3)时,KI一定过量;(6)最后一滴Na2S2O3溶液滴入后,溶液恰好蓝色消失,且半分钟内不变色;(7);(8)挥发性
【解析】(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和容量瓶;
(2)Ⅱ中发生反应的离子方程式是BrO3-+5Br-+6H+═3Br2+3H2O;
(3)Ⅲ中发生反应的化学方程式是苯酚与浓溴水反应的化学方程式为;
(4)Ⅳ中加KI前,溶液颜色须为黄色,原因是确保溴过量,保证苯酚已经完全反应;
(5)KI与KBrO3物质的量关系为n(KI)≥6n(KBrO3)时,KI一定过量,理由是由电子守恒可知,当n(KI)=6n(KBrO3)时,KI恰好与步骤II中生成的溴完全反应,而步骤III中苯酚会消耗一定量的溴,所以n(KI)≥6n(KBrO3)时,KI一定过量;
(6)V中滴定至终点的现象是最后一滴Na2S2O3溶液滴入后,溶液恰好蓝色消失,且半分钟内不变色;
(7)由BrO3-+5Br-+6H+═3Br2+3H2O、I2+2Na2S2O3═2NaI+Na2S4O6、可知,生成的溴的物质的量为a mol/L×V1×10-3 L×3=
3aV1×10-3 mol,由溴与碘化钾反应生成的碘的物质的量为b mol/L×V3×10-3 L×=5bV3×10-4 mol,所以与苯酚反应的溴的物质的量为3aV1×10-3 mol-5bV3×10-4 mol=(30aV1-5bV3)×10-4 mol,由可知,苯酚的物质的量为(30aV1-5bV3)×10-4 mol×,废水中苯酚的含量为=g L-1;
(8)由于Br2具有挥发性的性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。
10.(1)①CH4+2H2O(g)2H2+CO2;②2H2(g)+CO2(g)═C(S)+2H2O(g)[或C(s)+CO2(g)═2CO(g)];③abc;④降低;二氧化碳与CaO发生CO2+CaO═CaCO3,覆盖在CaO的表面,阻碍CO2的与CaO的继续进行;(2)①K1;2H2O+2e-═H2↑+2OH-;
③①中电极3发生Ni(OH)2-e-+OH-═NiOOH+H2O,制氢气时消耗电极1产生的OH-,②中电极3发生NiOOH+H2O+e-═Ni(OH)2+OH-,制氧气时补充电极2消耗的OH-
【解析】(1)①甲烷和水蒸气反应生成H2和CO2,其物质的量之比为4∶1,则反应的方程式为CH4+2H2O(g)4H2+CO2;
②ⅰ.CH4(g)+H2O(g)═CO(g)+3H2(g)△H1
ⅱ. CO(g)+H2O(g)═CO2(g)+H2(g)△H2,则i+ii可得CH4(g)+2H2O(g)═CO2(g)+4H2(g),如要得到ⅲ.CH4(g)═C(s)+2H2(g)△H3,则还应需要
2H2(g)+CO2(g)═C(S)+2H2O(g)的△H,CH4(g)+2H2O(g)═CO2(g)+
4H2(g)与2H2(g)+CO2(g)═C(S)+2H2O(g)相加可得CH4(g)═C(s)+2H2(g),
或i-ii得CH4(g)+CO2(g)═2CO(g)+2H2(g),然后与C(s)+CO2(g)═2CO(g)相减,亦可得到反应iii的△H;
③水过量,可分别与i中的CH4、ii中的CO反应,则可促进CH4转化、促进CO转化为CO2、且与iii生成的C等反应,减少积炭生成;
④由图象可知,CaO消耗率曲线斜率减小,则CaO消耗率降低;过多的二氧化碳与CaO发生反应CO2+CaO═CaCO3,生成的CaCO3覆盖在CaO的表面,阻碍CO2与CaO反应的继续进行,导致CaO消耗率约为35%时已失效;
(2)①电解水生成氢气和氧气,氧气在阳极生成,氢气在阴极生成,则应连接K1,电极方程式为2H2O+2e-═H2↑+2OH-;
③电极3可分别连接K1或K2,①中电极3发生反应Ni(OH)2-e-+OH-═NiOOH+H2O,制氢气时消耗电极1产生的OH-,②中电极3发生反应NiOOH+H2O+e-═Ni(OH)2+OH-,制氧气时补充电极2消耗的OH-,实现NiOOH Ni(OH)2的转化,且可循环使用。
11.(1)①;②饱和NaHSO3溶液;
(2)①Ag2SO3+4NH3 H2O═++4H2O;②加入稀硫酸,产生白色沉淀;
(3)①Ag+;因为Ag2SO4微溶于水,Ag2SO4(s) 2Ag++,向上层清液滴加氯化钡溶液,若含有Ag2SO4,则会出现沉淀;②产生的途径是被氧化为进入D;
(4)2Ag++SO2+H2O═Ag2SO3↓+2H+;(6)二氧化硫和硝酸银反应生成亚硫酸银和氢离子,同时生成少量硫酸银,则既能发生沉淀反应,又能发生氧化还原反应,其中沉淀反应的速率比氧化还原反应快
【解析】(1)①浓H2SO4可以与Cu反应生成硫酸铜、二氧化硫和水,方程式为:;
②试剂a用于除去二氧化硫中的杂质,一般用饱和饱和NaHSO3溶液;
(2)①Ag2SO3溶于氨水生成银氨络离子,反应的离子方程式为Ag2SO3+4NH3 H2O═++4H2O;
②由于亚硫酸钡溶于稀盐酸生成钡离子而硫酸钡不溶于稀盐酸,故用稀硫酸鉴别E中的钡离子从而证明D中主要是亚硫酸钡,进一步证实B中含有亚硫酸银;
(3)①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有Ag+;取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4,原因是Ag2SO4微溶于水,Ag2SO4(s) 2Ag++,向上层清液滴加氯化钡溶液,若含有Ag2SO4,则会出现沉淀;
②由实验三可知产生的途径是被氧化为进入D;
(4)由以上分析可知SO2与AgNO3溶液反应生成Ag2SO3和硝酸,离子方程式是2Ag++SO2+H2O═Ag2SO3↓+2H+;
(6)由以上实验现象可知二氧化硫和硝酸银反应生成亚硫酸银和氢离子,同时生成少量硫酸银,则既能发生沉淀反应,又能发生氧化还原反应,其中沉淀反应的速率比氧化还原反应快。
同课章节目录
