2019高考化学真题解析试卷(全国卷I)
文档属性
| 名称 | 2019高考化学真题解析试卷(全国卷I) |  | |
| 格式 | docx | ||
| 文件大小 | 309.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-05 15:52:19 | ||
图片预览




文档简介
2019年高考化学真题(全国卷I)
一、选择题(共7小题,每小题6分,满分42分)
1.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( )
A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
2.关于化合物2-苯基丙烯(),下列说法正确的是( )
A.不能使稀高锰酸钾溶液褪色 B.可以发生加成聚合反应
C.分子中所有原子共平面 D.易溶于水及甲苯
3.实验室制备溴苯的反应装置如图所示,关于实验操作或叙述错误的是( )
A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.实验中装置b中的液体逐渐变为浅红色
C.装置c中碳酸钠溶液的作用是吸收溴化氢
D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
4.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。如图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图,下列叙述错误的是( )
A.冰表面第一层中,HCl以分子形式存在
B.冰表面第二层中,H+浓度为5×10-3 mol L-1(设冰的密度为0.9 g cm-3)
C.冰表面第三层中,冰的氢键网络结构保持不变
D.冰表面各层之间,均存在可逆反应HCl H++Cl-
5.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
6.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是( )
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应H2+2MV2+═2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
7.科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
二、非选择题(共43分,第8~10题为必考题,每个试题考生都必须作答;第11~12题为选考题,考生根据要求作答)
(一)必考题
8.硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5 H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为
。
(2)“滤渣1”的主要成分有 。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是 。
(3)根据H3BO3的解离反应:H3BO3+H2O H++,Ka=5.81×10-10,可判断H3BO3是 酸;在“过滤2”前,将溶液pH调节至3.5,目的是 。
(4)在“沉镁”中生成Mg(OH)2 MgCO3沉淀的离子方程式为 ,母液经加热后可返回 工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是 。
9.硫酸铁铵[NH4Fe(SO4)2 xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如图,回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是 。
(2)步骤②需要加热的目的是 ,温度保持80~95 ℃,采用的合适加热方式是 。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为 (填标号)。
(3)步骤③中选用足量的H2O2,理由是 。分批加入H2O2,同时为了 ,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有 ,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时失掉1.5个结晶水,失重5.6%,硫酸铁铵晶体的化学式为 。
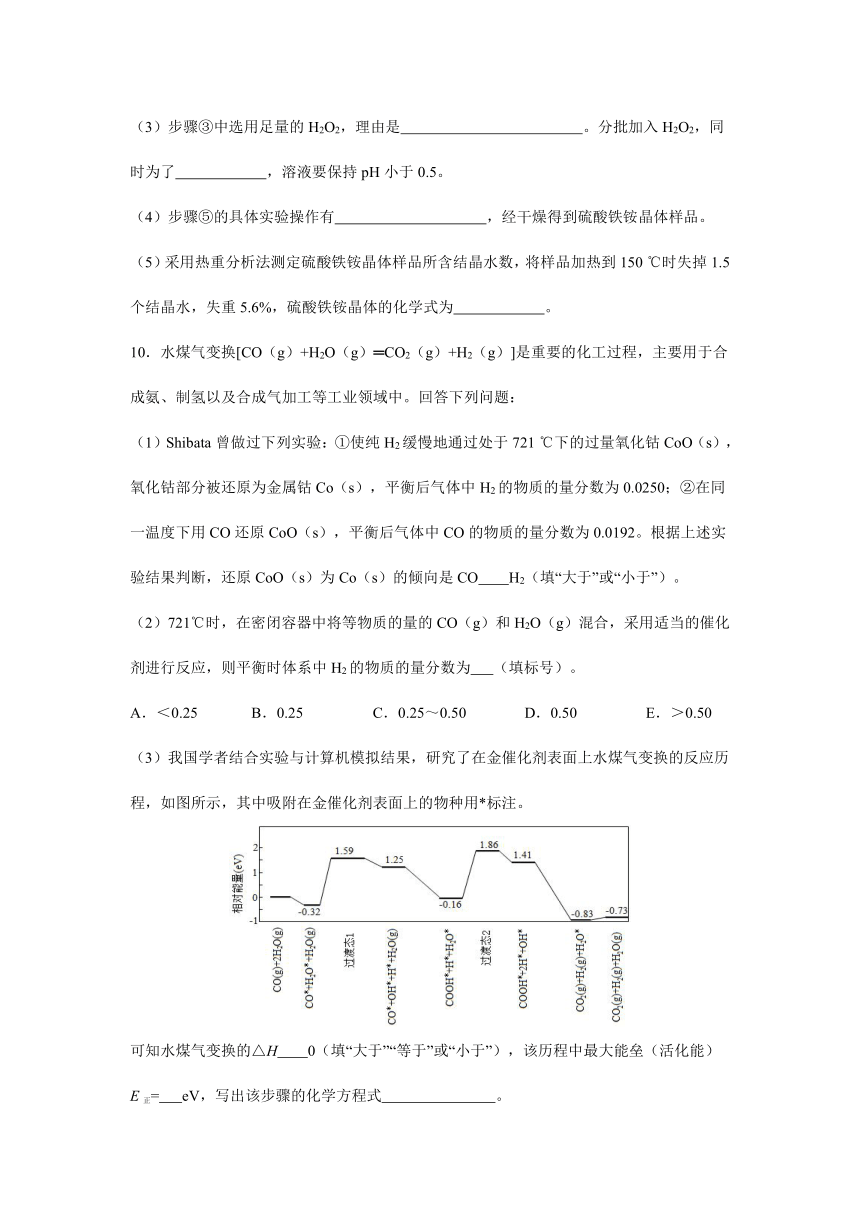
10.水煤气变换[CO(g)+H2O(g)═CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250;②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO H2(填“大于”或“小于”)。
(2)721℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为 (填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的△H 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)
E正= eV,写出该步骤的化学方程式 。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如图所示)。催化剂为氧化铁,实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和
p(H2)相等。
计算曲线a的反应在30~90 min内的平均速率v(a)= kPa min-1。467 ℃时p(H2)和
p(CO)随时间变化关系的曲线分别是 、 。489 ℃时p(H2)和p(CO)随时间变化关系的曲线分别是 、 。
(二)选考题(共15分,请考生从2道化学题中任选一题作答。如果多做,则按所做的第一题计分)
[化学—选修3:物质结构与性质]
11.在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是 (填标号)。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是
,其中与乙二胺形成的化合物稳定性相对较高的是 (填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物 Li2O MgO P4O6 SO2
熔点/℃ 1570 2800 23.8 -75.5
解释表中氧化物之间熔点差异的原因 。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x= pm,Mg原子之间最短距离y= pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是 g cm-3(列出计算表达式)。
[化学—选修5:有机化学基础]
12.化合物G是一种药物合成中间体,其合成路线如下,回答下列问题:
(1)A中的官能团名称是 。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出B的结构简式,用星号(*)标出B中的手性碳 。
(3)写出具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式
(不考虑立体异构,只需写出3个)。
(4)反应④所需的试剂和条件是 。
(5)⑤的反应类型是 。
(6)写出F到G的反应方程式 。
(7)设计由甲苯和乙酰乙酸乙酯(CH3COCH2COOC2H5)制备的合成路线
(无机试剂任选)。
化学试题答案
一、选择题
1.A。【解析】A选项,瓷器为青色,瓷器的原料高岭矿或高岭土中普遍含有铁元素,青瓷的烧制过程就是将含有红棕色氧化铁的色釉在火里烧,再经过还原成为青色,此时铁不再是三价铁,而是二价铁,故A错误;B选项,陶瓷的传统概念是指所有以黏土等无机非金属矿物为原材料,经过高温烧制而成的产品,闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成,故B正确;C选项,以含硅元素物质为原料通过高温加热发生复杂的物理、化学变化制得硅酸盐产品,传统硅酸盐产品包括:普通玻璃、陶瓷、水泥,陶瓷是用物理化学方法制造出来的最早的人造材料,一万多年以前,它的诞生使人类由旧石器时代进入了新石器时代,故C正确;D选项,陶瓷有:日用陶瓷、卫生陶瓷、建筑陶瓷、化工陶瓷和电瓷、压电陶瓷等,共性为具有抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等优点,故D正确。故选A。
2.B。【解析】A选项,分子中含有碳碳双键,所以具有烯烃性质,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故A错误;B选项,分子中含有碳碳双键,所以能发生加聚反应生成高分子化合物,故B正确;C选项,苯分子中所有原子共平面、乙烯分子中所有原子共平面,甲烷分子为正四面体结构,有3个原子共平面,该分子中甲基具有甲烷的结构特点,所以该分子中所有原子不能共平面,故C错误;D选项,该物质为有机物,没有亲水基,不易溶于水,易溶于甲苯,故D错误。故选B。
3.D。【解析】A选项,向圆底烧瓶中滴加苯和溴的混合液前,需先打开K才能平衡压强,以便加入混合液,故A正确;B选项,挥发出的HBr中含有溴,溴溶于四氯化碳呈浅红色,故B正确;C选项,HBr为污染物,需要用碳酸钠溶液吸收,故C正确;D选项,溴苯中含有剩余的苯,混合液分层,经稀碱溶液洗涤后应先分液再蒸馏,故D错误。故选D。
4.D。【解析】A选项,由图可知,冰表面第一层中存在HCl分子,则HCl以分子形式存在,故A正确;
B选项,冰表面第二层中,Cl-∶H2O=10-4∶1,设水的体积为1 L,溶液体积近似为1 L,则H+浓度为=5×10-3mol L-1,故B正确;C选项,冰表面第三层中,仍存在H2O分子,则冰的氢键网络结构保持不变,故C正确;D选项,由图可知,只有第二层存在HCl气体分子在冰表面吸附和溶解过程,第一、三层不存在,故D错误。故选D。
5.C。【解析】A选项,溶液的导电能力取决于电荷浓度的大小,由图象可知a、b、c点的离子种类、浓度不同,可知混合溶液的导电能力与离子浓度和种类有关,故A正确;B选项,由图象可知b点钾离子浓度较小,b点导电能力较大,b点存在Na+与A2-,可知Na+与A2-的导电能力之和大于HA-的,故B正确;C选项,由题给数据可知H2A为二元弱酸,b点溶质为Na2A、K2A,为强碱弱酸盐,溶液呈碱性,则pH>7,故C错误;D选项,c点NaOH过量,则n(NaOH)>n(KHA),溶液呈碱性,可知c(Na+)>c(K+)>c(OH-),故D正确。故选C。
6.B。【解析】A选项,利用生物燃料电池在室温下合成氨,既不需要高温加热,同时还能将化学能转化为电能,故A正确;B选项,原电池只有正、负极,不存在阴、阳极,其中负极区,氢气在氢化酶的作用下,发生氧化反应,反应式为H2+2MV2+═2H++2MV+,故B错误;C选项,N2在正极区得电子发生还原反应,生成NH3,故C正确;D选项,燃料电池工作时,负极区生成的H+透过质子交换膜进入正极区,故D正确;故选B。
7.B。【解析】通过以上分析知,W、X、Y、Z分别是Na、Si、P、Cl元素,A选项,WZ为NaCl,NaCl是强酸强碱盐,其水溶液呈中性,故A错误;B选项,同一周期元素非金属性随着原子序数的增大而增强,则非金属性Cl>P>Si,所以非金属性Z>Y>X,故B错误;C选项,Y为P元素,Y的最高价氧化物的水合物是H3PO4为中强酸,故C正确;D选项,Y为P元素,其最外层有5个电子,P原子形成2个共价键且该阴离子得到W原子的一个电子,所以P原子达到8电子结构,即Y原子达到8电子结构,故D错误。故选C。
二、非选择题
(一)必考题
8.(1)NH3+NH4HCO3═(NH4)2CO3;(2)SiO2、Fe2O3、Al2O3;KSCN;(3)一元弱;转化为H3BO3,促进析出;(4)2Mg2++3+2H2O═Mg(OH)2 MgCO3↓+2;溶浸;高温焙烧
【解析】硼镁矿(含Mg2B2O5 H2O、SiO2及少量Fe2O3、Al2O3)中加入硫酸铵溶液得到气体,根据硼镁矿和硫酸铵化学式知,得到的气体为NH3,用NH4HCO3吸收NH3,发生反应NH3+NH4HCO3═(NH4)2CO3;根据过滤2及沉镁成分知,过滤1中得到的滤渣为难溶性的SiO2、Fe2O3、Al2O3;调节溶液pH=3.5时得到H3BO3,滤液中含有MgSO4;沉镁过程发生的反应为2Mg2++3+2H2O═Mg(OH)2 MgCO3↓+2,将反应后的溶液加热分解可以得到轻质MgO;母液中则含有(NH4)2SO4;
(1)氨气为碱性气体,能和酸式铵盐吸收生成正盐,反应的化学方程式为NH3+NH4HCO3═
(NH4)2CO3;
(2)滤渣1为难溶性的SiO2、Fe2O3、Al2O3;Fe3+和KSCN溶液混合得到血红色液体,所以可以用KSCN溶液检验Fe3+;
(3)H3BO3能发生一步电离,且电离平衡常数很小,所以为一元弱酸;在“过滤2”前,将溶液pH调节至3.5,有利于析出H3BO3,如果溶液pH较大,得不到硼酸而得到硼酸盐;
(4)在“沉镁”中镁离子和碳酸根离子发生水解和复分解反应生成Mg(OH)2 MgCO3沉淀,同时还生成碳酸氢根离子,离子方程式为2Mg2++3+2H2O═Mg(OH)2 MgCO3↓+2;在母液中得到(NH4)2SO4,在溶浸时需要加入(NH4)2SO4,所以母液经加热后可返回溶浸工序循环使用,碱式碳酸镁高温易分解得到氧化镁、水和二氧化碳,所以高温焙烧就可以得到轻质氧化镁。
9.(1)碱煮水洗;(2)加快反应;热水浴;C;(3)将Fe2+全部氧化为Fe3+,不引入杂质;防止Fe3+水解;(4)蒸发浓缩、冷却结晶、过滤、洗涤;(5)NH4Fe(SO4)2 12H2O
【解析】废铁屑中含有油污,油污在碱性条件下水解,且碱和Fe不反应,所以可以用碱性溶液除去废铁屑中的油污;将干净铁屑放入稀硫酸中并加热,稀硫酸和Fe发生置换反应生成硫酸亚铁和氢气,过滤除去废渣得到滤液,滤液中含有未反应的稀硫酸和生成的硫酸亚铁,然后向滤液中加入H2O2,Fe2+被氧化生成Fe3+而得到硫酸铁溶液,然后向硫酸铁溶液中加入硫酸铵固体,然后通过加热浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铁铵固体;
(1)油污在碱性条件下水解生成羧酸盐和甘油,羧酸盐和甘油都易溶于水,然后经过水洗,即可除去油污;
(2)温度越高化学反应速率越快,反应所需时间越短,所以步骤②需要加热的目的是加快反应;低于100 ℃的加热需要水浴加热,所以温度保持80~95 ℃,采用的合适加热方式为热水浴;铁屑中含有少量硫化物,反应产生的气体需要净化处理,硫化物和稀硫酸反应生成H2S,H2S属于酸性气体,用碱液吸收,且要防止倒吸,BD不能防止倒吸且A溶解硫化氢能力较弱,所以选取C;
(3)H2O2具有氧化性,能将Fe2+氧化成Fe3+且双氧水被还原生成水,不引进杂质,所以选取双氧水作氧化剂;Fe3+水解导致溶液呈酸性,H+能抑制Fe3+水解,为防止Fe3+水解需要使溶液的pH要小于0.5;
(4)步骤⑤为从溶液中获取晶体,从溶液中获取晶体可采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法;
(5)将样品加热到150 ℃时失掉1.5个结晶水,失去结晶水的式量=18×1.5=27,失重5.6%,则该晶体式量==482,x==12,所以其化学式为NH4Fe(SO4)2 12H2O。
10.(1)②大于;(2)C;(3)小于;2.02;COOH*+H*+H2O*═COOH*+2H*+OH*或H2O*═H*+OH*;(4)0.0047;b;c;a;d
【解析】(1)①使纯H2缓慢地通过处于721 ℃下的过量的氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250,反应的化学方程式:H2+CoO Co+H2O;
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192,反应的化学方程式:CO+CoO Co+CO2,相同条件下还原反应达到平衡状态后,反应前后气体物质的量都是不变的反应,一氧化碳物质的量分数小于氢气物质的量分数,说明一氧化碳进行的程度大;
(2)假设氢气和一氧化碳物质的量均为1,变化量分别为a和b
①H2+CoO Co+H2O ②CO+CoO Co+CO2
起始量 1 0 起始量 1 0
变化量 a a 变化量 b b
平衡量 1-a a 平衡量 1-b b
=0.025,解得a=0.975 =0.0192,解得b=0.9818
K1==39 K2==51
设一氧化碳和氢气物质的量均为m,变化量均为x
CO(g)+H2O(g)═CO2(g)+H2(g),
起始量 m m 0 0
变化量 x x x x
平衡量 m-x m-x x x
=1.31>1,则x>m-x,则>0.25
等物质的量的一氧化碳和水蒸气反应生成二氧化碳和氢气,反应前后气体物质的量不变,当反应物全部反应氢气所占物质的量的分数50%,但反应为可逆反应不能进行彻底,氢气的物质的量分数一定小于50%,故选C;
(3)图象分析可知水煤气的生成过程经过了过渡态1和过渡态2,最后生成产物的能量低于反应物,反应的焓变小于0,正反应进行的方向需要吸收能量,结合图此分析判断,是发生的过渡反应:COOH*+H*+H2O*═COOH*+2H*+OH*或H2O*═H*+OH*,该历程中最大能垒(活化能)E正=1.86 eV-(-0.16 eV)=2.02 eV;
(4)曲线a的反应在30~90 min内,分压变化=4.08 kPa-3.80 kPa=0.28 kPa,平均速率
v(a)===0.0047 kPa/min,反应为放热反应,温度越高平衡逆向进行,CO分压越大,氢气分压越小,489 ℃时p(H2)和p(CO)随时间变化关系的曲线分别是a、d,467 ℃时p(H2)和p(CO)随时间变化关系的曲线分别是b、c。
(二)选考题
11.(1)A;(2)sp3;sp3;乙二胺的两个N提供孤对电子给金属离子形成配位键;Cu2+;
(3)Li2O和MgO是离子晶体、P4O6和SO2是分子晶体,晶格能MgO>Li2O,分子间作用力:P4O6>SO2;(4)a;a;
【解析】(1)A、D微粒都是Mg原子失去一个电子后得到的,但是D微粒能量高于A,而稳定性A>D,所以失电子所需能量A>D;B、C都是原子,但是B是基态、C是激发态,能量:C>B,稳定性B>C,所以失去一个电子所需能量:B>C;A为Mg+、B为Mg原子,A再失去电子所需能量就是Mg原子失去2个电子的能量,为Mg原子的第二电离能,B失去一个电子所需的能量是Mg原子的第一电离能,其第二电离能大于第一电离能,所以电离最外层一个电子所需能量A>B,通过以上分析知,电离最外层一个电子所需能量最大的是A;
(2)在乙二胺(H2NCH2CH2NH2)分子中,每个N原子形成2个N-H键、1个N-C键,且还含有1个孤电子对;每个C原子形成2个C-H键、2个C-N键,所以N、C原子价层电子对个数都是4,根据价层电子对互斥理论判断N、C原子杂化类型分别为sp3、sp3;含有孤电子对的原子和含有空轨道的原子之间易形成配位键,乙二胺的两个N提供孤对电子给金属离子形成配位键,所以乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子;碱土金属与乙二胺形成的化合物的稳定性较弱,所以与乙二胺形成的化合物稳定性相对较高的是Cu2+;
(3)晶体熔沸点:离子晶体>分子晶体,离子晶体熔沸点与晶格能有关,晶格能越大熔沸点越高,晶格能与离子半径成反比,与电荷成正比;分子晶体熔沸点与分子间作用力有关,分子间作用力与相对分子质量有关,相对分子质量越大其分子间作用力越大,Li2O和MgO是离子晶体、P4O6和SO2是分子晶体,且晶格能MgO>Li2O,分子间作用力:P4O6>SO2,所以熔沸点:MgO>Li2O>P4O6>SO2;
(4)如图所示,AB之间的距离为面对角线长度=a pm,AB之间距离相当于4个Cu原子直径,x距离1个Cu原子直径=a pm;
体对角线长度=棱长=a pm,CD距离为y,该长度为体对角线BC长度的,
即×a pm=a pm;
该晶胞中Mg原子位于8个顶点上、6个面心上,在晶胞内部有4个Mg原子,所以Mg原子个数=8×+6×+4=8,Cu原子都位于晶胞内部,有16个;
晶胞体积=(a×10-10 cm)3,晶胞密度== g/cm3= g/cm3。
12.(1)羟基;(2);(3);
(4)CH3CH2OH、浓硫酸、加热;(5)取代反应;
(6);
(7)
【解析】(1)A中的官能团名称是羟基;
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,则连接甲基的碳原子为手性碳,其手性碳为;
(3)具有六元环结构,说明环上有6个原子,能发生银镜反应,说明含有-CHO,B的不饱和度是2,环的不饱和度是1、醛基的不饱和度是1,则符合条件的B的同分异构体中不含其它碳碳不饱和键;取代基为-CH3、-CHO时,两个取代基可能位于同一个碳原子上,有1种;-CH3、-CHO取代基位于不同碳原子上时,有邻间对3种;取代基可能为-CH2CHO,有1种,所以符合条件的总共有5种,这5种结构简式分别为;
(4)反应④为羧基转化为酯基的酯化反应,生成羧酸乙酯,则所需的试剂和条件是CH3CH2OH、浓硫酸、加热;
(5)⑤的反应类型是取代反应;
(6)F先发生碱性条件下的水解反应生成羧酸盐和乙醇,然后羧酸盐酸化得到G,则F到G的反应方程式;
(7)由甲苯和乙酰乙酸乙酯(CH3COCH2COOC2H5)制备,首先甲苯和溴在光照条件下生成,然后CH3COCH2COOC2H5与发生取代反应生成CH3COCH(CH2C6H5)COOCH2CH3,最后发生碱性条件下水解然后酸化即可得到目标产物,其合成路线为:
。
一、选择题(共7小题,每小题6分,满分42分)
1.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( )
A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
2.关于化合物2-苯基丙烯(),下列说法正确的是( )
A.不能使稀高锰酸钾溶液褪色 B.可以发生加成聚合反应
C.分子中所有原子共平面 D.易溶于水及甲苯
3.实验室制备溴苯的反应装置如图所示,关于实验操作或叙述错误的是( )
A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.实验中装置b中的液体逐渐变为浅红色
C.装置c中碳酸钠溶液的作用是吸收溴化氢
D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
4.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。如图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图,下列叙述错误的是( )
A.冰表面第一层中,HCl以分子形式存在
B.冰表面第二层中,H+浓度为5×10-3 mol L-1(设冰的密度为0.9 g cm-3)
C.冰表面第三层中,冰的氢键网络结构保持不变
D.冰表面各层之间,均存在可逆反应HCl H++Cl-
5.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
6.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是( )
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应H2+2MV2+═2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
7.科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
二、非选择题(共43分,第8~10题为必考题,每个试题考生都必须作答;第11~12题为选考题,考生根据要求作答)
(一)必考题
8.硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5 H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为
。
(2)“滤渣1”的主要成分有 。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是 。
(3)根据H3BO3的解离反应:H3BO3+H2O H++,Ka=5.81×10-10,可判断H3BO3是 酸;在“过滤2”前,将溶液pH调节至3.5,目的是 。
(4)在“沉镁”中生成Mg(OH)2 MgCO3沉淀的离子方程式为 ,母液经加热后可返回 工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是 。
9.硫酸铁铵[NH4Fe(SO4)2 xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如图,回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是 。
(2)步骤②需要加热的目的是 ,温度保持80~95 ℃,采用的合适加热方式是 。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为 (填标号)。
(3)步骤③中选用足量的H2O2,理由是 。分批加入H2O2,同时为了 ,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有 ,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时失掉1.5个结晶水,失重5.6%,硫酸铁铵晶体的化学式为 。
10.水煤气变换[CO(g)+H2O(g)═CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250;②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO H2(填“大于”或“小于”)。
(2)721℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为 (填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的△H 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)
E正= eV,写出该步骤的化学方程式 。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如图所示)。催化剂为氧化铁,实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和
p(H2)相等。
计算曲线a的反应在30~90 min内的平均速率v(a)= kPa min-1。467 ℃时p(H2)和
p(CO)随时间变化关系的曲线分别是 、 。489 ℃时p(H2)和p(CO)随时间变化关系的曲线分别是 、 。
(二)选考题(共15分,请考生从2道化学题中任选一题作答。如果多做,则按所做的第一题计分)
[化学—选修3:物质结构与性质]
11.在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是 (填标号)。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是
,其中与乙二胺形成的化合物稳定性相对较高的是 (填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物 Li2O MgO P4O6 SO2
熔点/℃ 1570 2800 23.8 -75.5
解释表中氧化物之间熔点差异的原因 。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x= pm,Mg原子之间最短距离y= pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是 g cm-3(列出计算表达式)。
[化学—选修5:有机化学基础]
12.化合物G是一种药物合成中间体,其合成路线如下,回答下列问题:
(1)A中的官能团名称是 。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出B的结构简式,用星号(*)标出B中的手性碳 。
(3)写出具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式
(不考虑立体异构,只需写出3个)。
(4)反应④所需的试剂和条件是 。
(5)⑤的反应类型是 。
(6)写出F到G的反应方程式 。
(7)设计由甲苯和乙酰乙酸乙酯(CH3COCH2COOC2H5)制备的合成路线
(无机试剂任选)。
化学试题答案
一、选择题
1.A。【解析】A选项,瓷器为青色,瓷器的原料高岭矿或高岭土中普遍含有铁元素,青瓷的烧制过程就是将含有红棕色氧化铁的色釉在火里烧,再经过还原成为青色,此时铁不再是三价铁,而是二价铁,故A错误;B选项,陶瓷的传统概念是指所有以黏土等无机非金属矿物为原材料,经过高温烧制而成的产品,闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成,故B正确;C选项,以含硅元素物质为原料通过高温加热发生复杂的物理、化学变化制得硅酸盐产品,传统硅酸盐产品包括:普通玻璃、陶瓷、水泥,陶瓷是用物理化学方法制造出来的最早的人造材料,一万多年以前,它的诞生使人类由旧石器时代进入了新石器时代,故C正确;D选项,陶瓷有:日用陶瓷、卫生陶瓷、建筑陶瓷、化工陶瓷和电瓷、压电陶瓷等,共性为具有抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等优点,故D正确。故选A。
2.B。【解析】A选项,分子中含有碳碳双键,所以具有烯烃性质,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故A错误;B选项,分子中含有碳碳双键,所以能发生加聚反应生成高分子化合物,故B正确;C选项,苯分子中所有原子共平面、乙烯分子中所有原子共平面,甲烷分子为正四面体结构,有3个原子共平面,该分子中甲基具有甲烷的结构特点,所以该分子中所有原子不能共平面,故C错误;D选项,该物质为有机物,没有亲水基,不易溶于水,易溶于甲苯,故D错误。故选B。
3.D。【解析】A选项,向圆底烧瓶中滴加苯和溴的混合液前,需先打开K才能平衡压强,以便加入混合液,故A正确;B选项,挥发出的HBr中含有溴,溴溶于四氯化碳呈浅红色,故B正确;C选项,HBr为污染物,需要用碳酸钠溶液吸收,故C正确;D选项,溴苯中含有剩余的苯,混合液分层,经稀碱溶液洗涤后应先分液再蒸馏,故D错误。故选D。
4.D。【解析】A选项,由图可知,冰表面第一层中存在HCl分子,则HCl以分子形式存在,故A正确;
B选项,冰表面第二层中,Cl-∶H2O=10-4∶1,设水的体积为1 L,溶液体积近似为1 L,则H+浓度为=5×10-3mol L-1,故B正确;C选项,冰表面第三层中,仍存在H2O分子,则冰的氢键网络结构保持不变,故C正确;D选项,由图可知,只有第二层存在HCl气体分子在冰表面吸附和溶解过程,第一、三层不存在,故D错误。故选D。
5.C。【解析】A选项,溶液的导电能力取决于电荷浓度的大小,由图象可知a、b、c点的离子种类、浓度不同,可知混合溶液的导电能力与离子浓度和种类有关,故A正确;B选项,由图象可知b点钾离子浓度较小,b点导电能力较大,b点存在Na+与A2-,可知Na+与A2-的导电能力之和大于HA-的,故B正确;C选项,由题给数据可知H2A为二元弱酸,b点溶质为Na2A、K2A,为强碱弱酸盐,溶液呈碱性,则pH>7,故C错误;D选项,c点NaOH过量,则n(NaOH)>n(KHA),溶液呈碱性,可知c(Na+)>c(K+)>c(OH-),故D正确。故选C。
6.B。【解析】A选项,利用生物燃料电池在室温下合成氨,既不需要高温加热,同时还能将化学能转化为电能,故A正确;B选项,原电池只有正、负极,不存在阴、阳极,其中负极区,氢气在氢化酶的作用下,发生氧化反应,反应式为H2+2MV2+═2H++2MV+,故B错误;C选项,N2在正极区得电子发生还原反应,生成NH3,故C正确;D选项,燃料电池工作时,负极区生成的H+透过质子交换膜进入正极区,故D正确;故选B。
7.B。【解析】通过以上分析知,W、X、Y、Z分别是Na、Si、P、Cl元素,A选项,WZ为NaCl,NaCl是强酸强碱盐,其水溶液呈中性,故A错误;B选项,同一周期元素非金属性随着原子序数的增大而增强,则非金属性Cl>P>Si,所以非金属性Z>Y>X,故B错误;C选项,Y为P元素,Y的最高价氧化物的水合物是H3PO4为中强酸,故C正确;D选项,Y为P元素,其最外层有5个电子,P原子形成2个共价键且该阴离子得到W原子的一个电子,所以P原子达到8电子结构,即Y原子达到8电子结构,故D错误。故选C。
二、非选择题
(一)必考题
8.(1)NH3+NH4HCO3═(NH4)2CO3;(2)SiO2、Fe2O3、Al2O3;KSCN;(3)一元弱;转化为H3BO3,促进析出;(4)2Mg2++3+2H2O═Mg(OH)2 MgCO3↓+2;溶浸;高温焙烧
【解析】硼镁矿(含Mg2B2O5 H2O、SiO2及少量Fe2O3、Al2O3)中加入硫酸铵溶液得到气体,根据硼镁矿和硫酸铵化学式知,得到的气体为NH3,用NH4HCO3吸收NH3,发生反应NH3+NH4HCO3═(NH4)2CO3;根据过滤2及沉镁成分知,过滤1中得到的滤渣为难溶性的SiO2、Fe2O3、Al2O3;调节溶液pH=3.5时得到H3BO3,滤液中含有MgSO4;沉镁过程发生的反应为2Mg2++3+2H2O═Mg(OH)2 MgCO3↓+2,将反应后的溶液加热分解可以得到轻质MgO;母液中则含有(NH4)2SO4;
(1)氨气为碱性气体,能和酸式铵盐吸收生成正盐,反应的化学方程式为NH3+NH4HCO3═
(NH4)2CO3;
(2)滤渣1为难溶性的SiO2、Fe2O3、Al2O3;Fe3+和KSCN溶液混合得到血红色液体,所以可以用KSCN溶液检验Fe3+;
(3)H3BO3能发生一步电离,且电离平衡常数很小,所以为一元弱酸;在“过滤2”前,将溶液pH调节至3.5,有利于析出H3BO3,如果溶液pH较大,得不到硼酸而得到硼酸盐;
(4)在“沉镁”中镁离子和碳酸根离子发生水解和复分解反应生成Mg(OH)2 MgCO3沉淀,同时还生成碳酸氢根离子,离子方程式为2Mg2++3+2H2O═Mg(OH)2 MgCO3↓+2;在母液中得到(NH4)2SO4,在溶浸时需要加入(NH4)2SO4,所以母液经加热后可返回溶浸工序循环使用,碱式碳酸镁高温易分解得到氧化镁、水和二氧化碳,所以高温焙烧就可以得到轻质氧化镁。
9.(1)碱煮水洗;(2)加快反应;热水浴;C;(3)将Fe2+全部氧化为Fe3+,不引入杂质;防止Fe3+水解;(4)蒸发浓缩、冷却结晶、过滤、洗涤;(5)NH4Fe(SO4)2 12H2O
【解析】废铁屑中含有油污,油污在碱性条件下水解,且碱和Fe不反应,所以可以用碱性溶液除去废铁屑中的油污;将干净铁屑放入稀硫酸中并加热,稀硫酸和Fe发生置换反应生成硫酸亚铁和氢气,过滤除去废渣得到滤液,滤液中含有未反应的稀硫酸和生成的硫酸亚铁,然后向滤液中加入H2O2,Fe2+被氧化生成Fe3+而得到硫酸铁溶液,然后向硫酸铁溶液中加入硫酸铵固体,然后通过加热浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铁铵固体;
(1)油污在碱性条件下水解生成羧酸盐和甘油,羧酸盐和甘油都易溶于水,然后经过水洗,即可除去油污;
(2)温度越高化学反应速率越快,反应所需时间越短,所以步骤②需要加热的目的是加快反应;低于100 ℃的加热需要水浴加热,所以温度保持80~95 ℃,采用的合适加热方式为热水浴;铁屑中含有少量硫化物,反应产生的气体需要净化处理,硫化物和稀硫酸反应生成H2S,H2S属于酸性气体,用碱液吸收,且要防止倒吸,BD不能防止倒吸且A溶解硫化氢能力较弱,所以选取C;
(3)H2O2具有氧化性,能将Fe2+氧化成Fe3+且双氧水被还原生成水,不引进杂质,所以选取双氧水作氧化剂;Fe3+水解导致溶液呈酸性,H+能抑制Fe3+水解,为防止Fe3+水解需要使溶液的pH要小于0.5;
(4)步骤⑤为从溶液中获取晶体,从溶液中获取晶体可采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法;
(5)将样品加热到150 ℃时失掉1.5个结晶水,失去结晶水的式量=18×1.5=27,失重5.6%,则该晶体式量==482,x==12,所以其化学式为NH4Fe(SO4)2 12H2O。
10.(1)②大于;(2)C;(3)小于;2.02;COOH*+H*+H2O*═COOH*+2H*+OH*或H2O*═H*+OH*;(4)0.0047;b;c;a;d
【解析】(1)①使纯H2缓慢地通过处于721 ℃下的过量的氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250,反应的化学方程式:H2+CoO Co+H2O;
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192,反应的化学方程式:CO+CoO Co+CO2,相同条件下还原反应达到平衡状态后,反应前后气体物质的量都是不变的反应,一氧化碳物质的量分数小于氢气物质的量分数,说明一氧化碳进行的程度大;
(2)假设氢气和一氧化碳物质的量均为1,变化量分别为a和b
①H2+CoO Co+H2O ②CO+CoO Co+CO2
起始量 1 0 起始量 1 0
变化量 a a 变化量 b b
平衡量 1-a a 平衡量 1-b b
=0.025,解得a=0.975 =0.0192,解得b=0.9818
K1==39 K2==51
设一氧化碳和氢气物质的量均为m,变化量均为x
CO(g)+H2O(g)═CO2(g)+H2(g),
起始量 m m 0 0
变化量 x x x x
平衡量 m-x m-x x x
=1.31>1,则x>m-x,则>0.25
等物质的量的一氧化碳和水蒸气反应生成二氧化碳和氢气,反应前后气体物质的量不变,当反应物全部反应氢气所占物质的量的分数50%,但反应为可逆反应不能进行彻底,氢气的物质的量分数一定小于50%,故选C;
(3)图象分析可知水煤气的生成过程经过了过渡态1和过渡态2,最后生成产物的能量低于反应物,反应的焓变小于0,正反应进行的方向需要吸收能量,结合图此分析判断,是发生的过渡反应:COOH*+H*+H2O*═COOH*+2H*+OH*或H2O*═H*+OH*,该历程中最大能垒(活化能)E正=1.86 eV-(-0.16 eV)=2.02 eV;
(4)曲线a的反应在30~90 min内,分压变化=4.08 kPa-3.80 kPa=0.28 kPa,平均速率
v(a)===0.0047 kPa/min,反应为放热反应,温度越高平衡逆向进行,CO分压越大,氢气分压越小,489 ℃时p(H2)和p(CO)随时间变化关系的曲线分别是a、d,467 ℃时p(H2)和p(CO)随时间变化关系的曲线分别是b、c。
(二)选考题
11.(1)A;(2)sp3;sp3;乙二胺的两个N提供孤对电子给金属离子形成配位键;Cu2+;
(3)Li2O和MgO是离子晶体、P4O6和SO2是分子晶体,晶格能MgO>Li2O,分子间作用力:P4O6>SO2;(4)a;a;
【解析】(1)A、D微粒都是Mg原子失去一个电子后得到的,但是D微粒能量高于A,而稳定性A>D,所以失电子所需能量A>D;B、C都是原子,但是B是基态、C是激发态,能量:C>B,稳定性B>C,所以失去一个电子所需能量:B>C;A为Mg+、B为Mg原子,A再失去电子所需能量就是Mg原子失去2个电子的能量,为Mg原子的第二电离能,B失去一个电子所需的能量是Mg原子的第一电离能,其第二电离能大于第一电离能,所以电离最外层一个电子所需能量A>B,通过以上分析知,电离最外层一个电子所需能量最大的是A;
(2)在乙二胺(H2NCH2CH2NH2)分子中,每个N原子形成2个N-H键、1个N-C键,且还含有1个孤电子对;每个C原子形成2个C-H键、2个C-N键,所以N、C原子价层电子对个数都是4,根据价层电子对互斥理论判断N、C原子杂化类型分别为sp3、sp3;含有孤电子对的原子和含有空轨道的原子之间易形成配位键,乙二胺的两个N提供孤对电子给金属离子形成配位键,所以乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子;碱土金属与乙二胺形成的化合物的稳定性较弱,所以与乙二胺形成的化合物稳定性相对较高的是Cu2+;
(3)晶体熔沸点:离子晶体>分子晶体,离子晶体熔沸点与晶格能有关,晶格能越大熔沸点越高,晶格能与离子半径成反比,与电荷成正比;分子晶体熔沸点与分子间作用力有关,分子间作用力与相对分子质量有关,相对分子质量越大其分子间作用力越大,Li2O和MgO是离子晶体、P4O6和SO2是分子晶体,且晶格能MgO>Li2O,分子间作用力:P4O6>SO2,所以熔沸点:MgO>Li2O>P4O6>SO2;
(4)如图所示,AB之间的距离为面对角线长度=a pm,AB之间距离相当于4个Cu原子直径,x距离1个Cu原子直径=a pm;
体对角线长度=棱长=a pm,CD距离为y,该长度为体对角线BC长度的,
即×a pm=a pm;
该晶胞中Mg原子位于8个顶点上、6个面心上,在晶胞内部有4个Mg原子,所以Mg原子个数=8×+6×+4=8,Cu原子都位于晶胞内部,有16个;
晶胞体积=(a×10-10 cm)3,晶胞密度== g/cm3= g/cm3。
12.(1)羟基;(2);(3);
(4)CH3CH2OH、浓硫酸、加热;(5)取代反应;
(6);
(7)
【解析】(1)A中的官能团名称是羟基;
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,则连接甲基的碳原子为手性碳,其手性碳为;
(3)具有六元环结构,说明环上有6个原子,能发生银镜反应,说明含有-CHO,B的不饱和度是2,环的不饱和度是1、醛基的不饱和度是1,则符合条件的B的同分异构体中不含其它碳碳不饱和键;取代基为-CH3、-CHO时,两个取代基可能位于同一个碳原子上,有1种;-CH3、-CHO取代基位于不同碳原子上时,有邻间对3种;取代基可能为-CH2CHO,有1种,所以符合条件的总共有5种,这5种结构简式分别为;
(4)反应④为羧基转化为酯基的酯化反应,生成羧酸乙酯,则所需的试剂和条件是CH3CH2OH、浓硫酸、加热;
(5)⑤的反应类型是取代反应;
(6)F先发生碱性条件下的水解反应生成羧酸盐和乙醇,然后羧酸盐酸化得到G,则F到G的反应方程式;
(7)由甲苯和乙酰乙酸乙酯(CH3COCH2COOC2H5)制备,首先甲苯和溴在光照条件下生成,然后CH3COCH2COOC2H5与发生取代反应生成CH3COCH(CH2C6H5)COOCH2CH3,最后发生碱性条件下水解然后酸化即可得到目标产物,其合成路线为:
。
同课章节目录
