广东省惠来二中2012-2013学年高二上学期期中考试化学试题(有答案)
文档属性
| 名称 | 广东省惠来二中2012-2013学年高二上学期期中考试化学试题(有答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 187.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-03-16 00:00:00 | ||
图片预览




文档简介
惠来二中2012-2013学年度第一学期高二级
期中考试化学试题
本试卷共6页,20小题,满分100分。考试用时80分钟
第Ⅰ卷(共52分)
一、单项选择题:(每小题3分,共36分,每小题只有一个选项符合题意)
1、在火烧圆明园时流失了大量的国宝,如:铜铸的鼠首和兔首。普通铜器时间稍久容易出现铜绿,其主要成分是〔Cu2(OH)2CO3〕,这两件1760年铜铸的国宝在240多年后看上去仍然熠熠生辉不生锈,下列对其原因的分析最可能的是 A.它们的表面都电镀上了一层耐腐蚀的黄金 B.环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去 C.铜的金属活动性比氢小,因此不易被氧化 D.它是含一定比例金、银、锡、锌的铜合金
2、下列过程中△H小于零的是
A. 氯酸钾分解制氧气 B. 氯化铵分解得氨气
C. 碳酸钙分解得二氧化碳 D. 实验室制备氢气
3、 用下列实验装置进行相应实验,能达到实验目的的是
A. 用图2 所示装置除去Cl2中含有的少量HCl
B. 用图3 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图4 所示装置制取少量纯净的CO2气体
D. 用图5 所示装置分离CCl4萃取碘水后已分层的有机层和水层
4、下列与有机物结构、性质相关的叙述正确的是
A.在水溶液里,乙酸分子中的—CH3可以电离出H+
B.甲烷和苯可以用酸性高锰酸钾溶液鉴别
C.甲烷和氯气反应生成一氯甲烷,与苯和氢气反应生成环己烷的反应类型相同
D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
5、关于如图所示装置的叙述,正确的是
A. 铜是负极,铜片上有气泡产生
B. 铜片质量逐渐减少
C. 电流从锌片经导线流向铜片
D. 氢离子在铜片表面被还原
6、下列事实,不能用勒夏特列原理解释的是
A.在溴水中存在如下平衡:Br2+H2O HBr+HBrO 当加入NaOH溶液后颜色变浅
B.对2HIH2+I2(g)平衡体系增加压强使颜色变深
C.反应CO+NO2CO2+NO ΔH<0 升高温度使平衡向逆方向移动
D.合成氨反应:,ΔH<0 为使氨的产率提高,理论上应采取低温高压的措施
7、下列有关化学用语表示正确的是
A. 乙酸的结构简式: C2H4O2 B. F-的结构示意图:
C. 中子数为20 的氯原子: 2017Cl D. NH3 的电子式:
8、已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A. +519.4kJ·mol-1 B. +259.7 kJ·mol-1
C. -259.7 kJ·mol-1 D. -519.4kJ·mol-1
9、如图所示,反应:X(g)+ 3Y(g) 2Z(g) ,正反应为放热反应,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W但是气态氢化物的稳定性比Z的气态氢化物的稳定性好,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是
A.XYZW的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
11、下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
12、以下反应均与几种常见的金属元素有关,其离子方程式不正确的是
A.FeCl3溶液与H2S溶液反应:2Fe3++H2S=2Fe2++S↓+2H+
B.AlCl3溶液与NaAlO2溶液反应:Al3++3AlO2-+6H2O=4 Al(OH)3↓
C.Fe(OH)2与HNO3溶液反应:Fe(OH)2+2H+= Fe2++2H2O
D.Zn与CuSO4溶液反应:Zn+Cu2+=Zn2++Cu
二、双项选择题(每小题4分,4题共16分。每小题有两个选项符合题意,少选且正确得2分,错选、多选不得分)
13、在一定温度下的定容密闭容器中,发生反应: A(s)+2B(g) C(g)+D(g)
当下列物理量不再变化时,表明反应已达平衡的是
A.混合气体的压强 B.混合气体的密度
C.混合气体的平均相对分子质量 D.气体总物质的量
14、海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.利用潮汐发电是将机械能转化为电能
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正
确的是
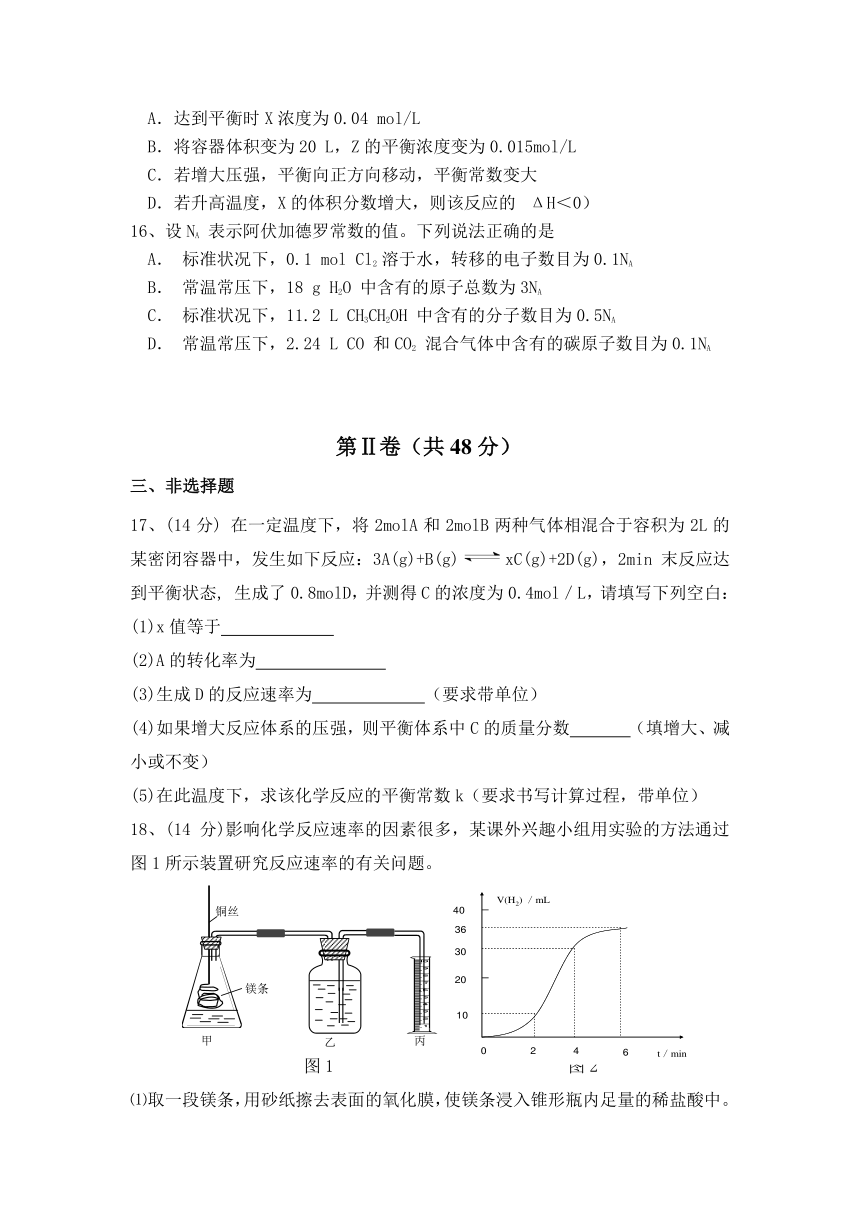
A.达到平衡时X浓度为0.04 mol/L
B.将容器体积变为20 L,Z的平衡浓度变为0.015mol/L
C.若增大压强,平衡向正方向移动,平衡常数变大
D.若升高温度,X的体积分数增大,则该反应的(ΔH<0)
16、设NA 表示阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA
B. 常温常压下,18 g H2O 中含有的原子总数为3NA
C. 标准状况下,11.2 L CH3CH2OH 中含有的分子数目为0.5NA
D. 常温常压下,2.24 L CO 和CO2 混合气体中含有的碳原子数目为0.1NA
第Ⅱ卷(共48分)
非选择题
17、(14分) 在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于
(2)A的转化率为
(3)生成D的反应速率为 (要求带单位)
(4)如果增大反应体系的压强,则平衡体系中C的质量分数 (填增大、减小或不变)
(5)在此温度下,求该化学反应的平衡常数k(要求书写计算过程,带单位)
18、(14分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
图1 图2
⑴取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3 的方框中画出上述反应的速率与时间的关系曲线。
图3
②在前4min内,镁条与盐酸的反应速率
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:______________________________________。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
原因Ⅲ:____________________________________________________;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:________________________________________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。若观察到实验a中_________________________,实验b中________________________,则说明原因Ⅰ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
19、(13分)在密闭容器中,有一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如图所示(已知气体的分压之比等于物质的量之比)。
⑴ 420K时,发生反应的化学方程式为:____________________________,若反应中消耗1 mol Xe,则转移电子______mol。
⑵ 600~800K时,会发生反应:XeF6(g) ?XeF4(g) + F2(g),其反应热△H________0(填“>”、“=”或“<”),理由是__________________________________________。
⑶ 900K时,容器中存在的组分有_________________。
20、(7分)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4和N2O4反应能放出大量的热。
已知:2NO2(g)=N2O4(g) △H=-57.20kJ/mol。
一定温度下,在密闭容器中反应2NO2(g) N2O4(g) 达到平衡。其他
条件不变时,下列措施能提高NO2转化率的是 (填字母)
A、加入催化剂 B、降低温度
C、增大压强 D、升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),
放出19.12kJ的热量。则反应2N2H4(l)+N2O4(l)3N2(g)+4H2O(l)的
△H= kJ/mol
(3)17℃、1.01*105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.030mol/L、c(N2O4)=0.0120mol/L。
此时反应2NO2(g) N2O4(g)的平衡常数K= (要求带单位)
惠来二中2012-2013学年度第一学期高二级
期中考试化学试题答题卡
第Ⅰ卷(共52分)
一、单选题(每小题3分, 12题共36分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
二、双选题(本题共4小题,每小题4分,共16分。每小题有两个选项符合题意,少选且正确得2分,错选、多选不得分)
题号
13
14
15
16
答案
第Ⅱ卷(共48分)
三、非选择题
17、(14分)(1) (2)
(3)______ _ (要求带单位) (4)
(5)(要求书写计算过程,带单位)
18、(14分)(1)①
图3
②_____ _
__
①原因Ⅲ:
原因Ⅴ:
②若观察到a中 ;
实验b中 (则说明原因Ⅰ是正确的)
19、(13分)(1) ; mol
(2)△H________0;理由是
(3)
(7分)(1) ;
(2) ;
(3)
1、C 2、B 3、D 4、A 5、D6、B 7、B 8、C 9、C 10、A 11、D 12、C
13、BC 14、CD 15、AD 16、AB
三、非选择题
17、(9分)(1)2 (2分) (2)60%(2分) (3)0.2mol/(L?min)(2分)
(4)不变 (1分)(5)0.5(7分)
18、(14分)
(1) ①
图中要标明2、4、6min时刻时的速率及要画出速率走向弧线(4分)
②镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大(2分);
4min后由于溶液中H+浓度降低,所以导致反应速率减小(2分)。
⑵①原因Ⅲ:Cl-对反应具有促进作用,而SO2- 4对反应具有阻碍作用(2分);
原因Ⅴ:Cl-、SO2- 4均对反应具有阻碍作用,但Cl-影响更小(或SO2- 4影响更大)(2分)。
②反应速率加快(1分); 反应速率不变(1分)。
19、(13分)(1)Xe? + 3 F2===== XeF6??? 6
(2)>(1分)??
随着温度的升高,XeF6(g)XeF4(g)+F2(g)平衡向右移动,根
据温度升高平衡向吸热反应方向移动的原理,则该反应的△H>0。(3分)
(3)XeF6、XeF4、XeF2、Xe、F2 (5分)
20、(7分)(1)BC(2分)(2)-1224.96(3)13.3L/mol
期中考试化学试题
本试卷共6页,20小题,满分100分。考试用时80分钟
第Ⅰ卷(共52分)
一、单项选择题:(每小题3分,共36分,每小题只有一个选项符合题意)
1、在火烧圆明园时流失了大量的国宝,如:铜铸的鼠首和兔首。普通铜器时间稍久容易出现铜绿,其主要成分是〔Cu2(OH)2CO3〕,这两件1760年铜铸的国宝在240多年后看上去仍然熠熠生辉不生锈,下列对其原因的分析最可能的是 A.它们的表面都电镀上了一层耐腐蚀的黄金 B.环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去 C.铜的金属活动性比氢小,因此不易被氧化 D.它是含一定比例金、银、锡、锌的铜合金
2、下列过程中△H小于零的是
A. 氯酸钾分解制氧气 B. 氯化铵分解得氨气
C. 碳酸钙分解得二氧化碳 D. 实验室制备氢气
3、 用下列实验装置进行相应实验,能达到实验目的的是
A. 用图2 所示装置除去Cl2中含有的少量HCl
B. 用图3 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图4 所示装置制取少量纯净的CO2气体
D. 用图5 所示装置分离CCl4萃取碘水后已分层的有机层和水层
4、下列与有机物结构、性质相关的叙述正确的是
A.在水溶液里,乙酸分子中的—CH3可以电离出H+
B.甲烷和苯可以用酸性高锰酸钾溶液鉴别
C.甲烷和氯气反应生成一氯甲烷,与苯和氢气反应生成环己烷的反应类型相同
D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
5、关于如图所示装置的叙述,正确的是
A. 铜是负极,铜片上有气泡产生
B. 铜片质量逐渐减少
C. 电流从锌片经导线流向铜片
D. 氢离子在铜片表面被还原
6、下列事实,不能用勒夏特列原理解释的是
A.在溴水中存在如下平衡:Br2+H2O HBr+HBrO 当加入NaOH溶液后颜色变浅
B.对2HIH2+I2(g)平衡体系增加压强使颜色变深
C.反应CO+NO2CO2+NO ΔH<0 升高温度使平衡向逆方向移动
D.合成氨反应:,ΔH<0 为使氨的产率提高,理论上应采取低温高压的措施
7、下列有关化学用语表示正确的是
A. 乙酸的结构简式: C2H4O2 B. F-的结构示意图:
C. 中子数为20 的氯原子: 2017Cl D. NH3 的电子式:
8、已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A. +519.4kJ·mol-1 B. +259.7 kJ·mol-1
C. -259.7 kJ·mol-1 D. -519.4kJ·mol-1
9、如图所示,反应:X(g)+ 3Y(g) 2Z(g) ,正反应为放热反应,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W但是气态氢化物的稳定性比Z的气态氢化物的稳定性好,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是
A.XYZW的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
11、下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
12、以下反应均与几种常见的金属元素有关,其离子方程式不正确的是
A.FeCl3溶液与H2S溶液反应:2Fe3++H2S=2Fe2++S↓+2H+
B.AlCl3溶液与NaAlO2溶液反应:Al3++3AlO2-+6H2O=4 Al(OH)3↓
C.Fe(OH)2与HNO3溶液反应:Fe(OH)2+2H+= Fe2++2H2O
D.Zn与CuSO4溶液反应:Zn+Cu2+=Zn2++Cu
二、双项选择题(每小题4分,4题共16分。每小题有两个选项符合题意,少选且正确得2分,错选、多选不得分)
13、在一定温度下的定容密闭容器中,发生反应: A(s)+2B(g) C(g)+D(g)
当下列物理量不再变化时,表明反应已达平衡的是
A.混合气体的压强 B.混合气体的密度
C.混合气体的平均相对分子质量 D.气体总物质的量
14、海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.利用潮汐发电是将机械能转化为电能
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正
确的是
A.达到平衡时X浓度为0.04 mol/L
B.将容器体积变为20 L,Z的平衡浓度变为0.015mol/L
C.若增大压强,平衡向正方向移动,平衡常数变大
D.若升高温度,X的体积分数增大,则该反应的(ΔH<0)
16、设NA 表示阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA
B. 常温常压下,18 g H2O 中含有的原子总数为3NA
C. 标准状况下,11.2 L CH3CH2OH 中含有的分子数目为0.5NA
D. 常温常压下,2.24 L CO 和CO2 混合气体中含有的碳原子数目为0.1NA
第Ⅱ卷(共48分)
非选择题
17、(14分) 在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于
(2)A的转化率为
(3)生成D的反应速率为 (要求带单位)
(4)如果增大反应体系的压强,则平衡体系中C的质量分数 (填增大、减小或不变)
(5)在此温度下,求该化学反应的平衡常数k(要求书写计算过程,带单位)
18、(14分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
图1 图2
⑴取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3 的方框中画出上述反应的速率与时间的关系曲线。
图3
②在前4min内,镁条与盐酸的反应速率
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:______________________________________。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
原因Ⅲ:____________________________________________________;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:________________________________________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。若观察到实验a中_________________________,实验b中________________________,则说明原因Ⅰ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
19、(13分)在密闭容器中,有一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如图所示(已知气体的分压之比等于物质的量之比)。
⑴ 420K时,发生反应的化学方程式为:____________________________,若反应中消耗1 mol Xe,则转移电子______mol。
⑵ 600~800K时,会发生反应:XeF6(g) ?XeF4(g) + F2(g),其反应热△H________0(填“>”、“=”或“<”),理由是__________________________________________。
⑶ 900K时,容器中存在的组分有_________________。
20、(7分)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4和N2O4反应能放出大量的热。
已知:2NO2(g)=N2O4(g) △H=-57.20kJ/mol。
一定温度下,在密闭容器中反应2NO2(g) N2O4(g) 达到平衡。其他
条件不变时,下列措施能提高NO2转化率的是 (填字母)
A、加入催化剂 B、降低温度
C、增大压强 D、升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),
放出19.12kJ的热量。则反应2N2H4(l)+N2O4(l)3N2(g)+4H2O(l)的
△H= kJ/mol
(3)17℃、1.01*105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.030mol/L、c(N2O4)=0.0120mol/L。
此时反应2NO2(g) N2O4(g)的平衡常数K= (要求带单位)
惠来二中2012-2013学年度第一学期高二级
期中考试化学试题答题卡
第Ⅰ卷(共52分)
一、单选题(每小题3分, 12题共36分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
二、双选题(本题共4小题,每小题4分,共16分。每小题有两个选项符合题意,少选且正确得2分,错选、多选不得分)
题号
13
14
15
16
答案
第Ⅱ卷(共48分)
三、非选择题
17、(14分)(1) (2)
(3)______ _ (要求带单位) (4)
(5)(要求书写计算过程,带单位)
18、(14分)(1)①
图3
②_____ _
__
①原因Ⅲ:
原因Ⅴ:
②若观察到a中 ;
实验b中 (则说明原因Ⅰ是正确的)
19、(13分)(1) ; mol
(2)△H________0;理由是
(3)
(7分)(1) ;
(2) ;
(3)
1、C 2、B 3、D 4、A 5、D6、B 7、B 8、C 9、C 10、A 11、D 12、C
13、BC 14、CD 15、AD 16、AB
三、非选择题
17、(9分)(1)2 (2分) (2)60%(2分) (3)0.2mol/(L?min)(2分)
(4)不变 (1分)(5)0.5(7分)
18、(14分)
(1) ①
图中要标明2、4、6min时刻时的速率及要画出速率走向弧线(4分)
②镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大(2分);
4min后由于溶液中H+浓度降低,所以导致反应速率减小(2分)。
⑵①原因Ⅲ:Cl-对反应具有促进作用,而SO2- 4对反应具有阻碍作用(2分);
原因Ⅴ:Cl-、SO2- 4均对反应具有阻碍作用,但Cl-影响更小(或SO2- 4影响更大)(2分)。
②反应速率加快(1分); 反应速率不变(1分)。
19、(13分)(1)Xe? + 3 F2===== XeF6??? 6
(2)>(1分)??
随着温度的升高,XeF6(g)XeF4(g)+F2(g)平衡向右移动,根
据温度升高平衡向吸热反应方向移动的原理,则该反应的△H>0。(3分)
(3)XeF6、XeF4、XeF2、Xe、F2 (5分)
20、(7分)(1)BC(2分)(2)-1224.96(3)13.3L/mol
同课章节目录
