人教版九年级化学下册第九单元课题2 饱和溶液和不饱和溶液梯度能力训练
文档属性
| 名称 | 人教版九年级化学下册第九单元课题2 饱和溶液和不饱和溶液梯度能力训练 |  | |
| 格式 | zip | ||
| 文件大小 | 225.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-03-17 21:03:07 | ||
图片预览




文档简介
课题2 饱和溶液和不饱和溶液
全能训练?梯度升级
基础达标
1.在一定温度下,某物质的饱和溶液一定是( )
A.很浓的溶液
B.很稀的溶液
C.不能溶解该物质的溶液
D.不能再溶解任何物质的溶液
2.取几根洗净的黄瓜,放入水槽中,然后向其中注入饱和食盐水,一段时间后将食盐水倒出。在相同的温度下,发现倒出的溶液还可溶解少量的食盐,这说明倒出的溶液( )
A.是饱和溶液
B.是不饱和溶液
C.倒出的溶液比原来变浓
D.溶液中溶剂的质量不变
3.室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中(如图所示),欲使硝酸钾溶液变为饱和溶液,可向大烧杯中加入的固体物质是( )
A.蔗糖 B.氯化钠
C.硝酸铵 D.氢氧化钠
4.下述方法中:①加水,②加硝酸钾,③蒸发水,④冷却,⑤加热但保持溶液质量不变,⑥加饱和硝酸钾溶液。能使接近饱和的硝酸钾溶液由不饱和变为饱和的是( )
A.①②⑤ B.①⑤⑥ C.②③④ D.②④⑥
5.20 ℃时,在一只烧杯中加入100 mL水,放入1 gCa(OH)2固体搅拌,静置,有白色沉淀沉降到烧杯底部,对于上层澄清液体的说法,错误的是( )
A.是无色溶液 B.是稀溶液 C.是饱和溶液 D.是浓溶液
6.20 ℃时,往50 g蔗糖溶液中加入5 g蔗糖固体充分搅拌后,尚有部分固体未溶解,稍加热后固体全部溶解。下列说法正确的是( )
A.搅拌后加热前一定是饱和溶液 B.搅拌后加热前一定是不饱和溶液
C.加热后一定是饱和溶液 D.加热后一定是不饱和溶液
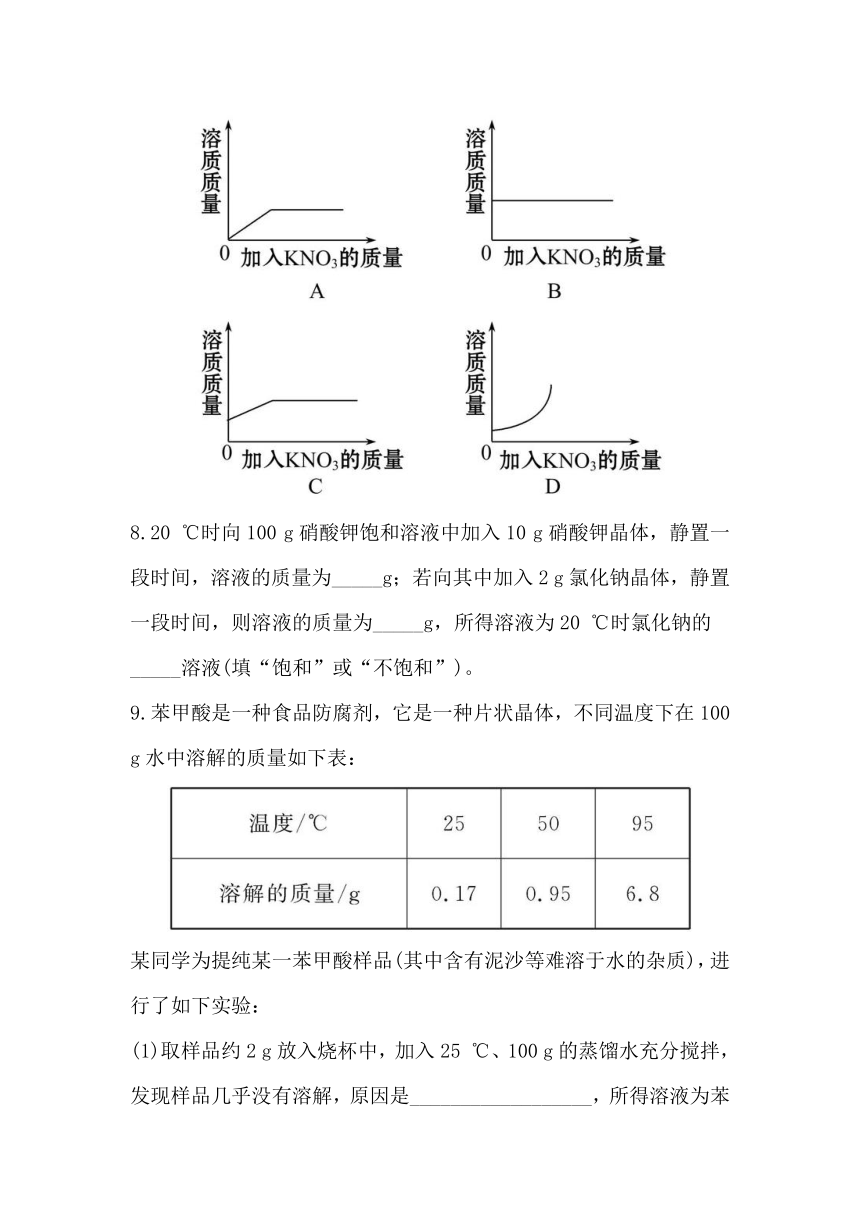
7.(2011·桂林中考)25 ℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中能正确表示此过程溶质质量变化规律的是( )
8.20 ℃时向100 g硝酸钾饱和溶液中加入10 g硝酸钾晶体,静置一段时间,溶液的质量为_____g;若向其中加入2 g氯化钠晶体,静置一段时间,则溶液的质量为_____g,所得溶液为20 ℃时氯化钠的_____溶液(填“饱和”或“不饱和”)。
9.苯甲酸是一种食品防腐剂,它是一种片状晶体,不同温度下在100 g水中溶解的质量如下表:
某同学为提纯某一苯甲酸样品(其中含有泥沙等难溶于水的杂质),进行了如下实验:
(1)取样品约2 g放入烧杯中,加入25 ℃、100 g的蒸馏水充分搅拌,发现样品几乎没有溶解,原因是__________________,所得溶液为苯甲酸的______(填“饱和”或“不饱和”)溶液。
(2)将烧杯放在石棉网上加热。待样品充分溶解后趁热过滤,趁热过滤的目的是_________________________。
(3)将所得滤液缓慢冷却至室温就可使苯甲酸以晶体形式析出。其原因是_________________________。
10.将一块塑料板放入50 ℃的硝酸钾饱和溶液中,塑料板漂浮于液面上(如图所示)。若将溶液降温到20 ℃时,可观察到的现象是______;______。若要使塑料板上浮,应采用的方法是_______________(忽略该过程中溶液体积的变化)。
11.A、B、C、D四个烧杯分别盛有质量相等的同种溶剂,在相同的温度下,向4个烧杯中加入20 g、15 g、10 g、5 g的某溶质,充分溶解后,如图所示,回答下列各题。(填序号)
(1)______中盛的一定是饱和溶液;______中盛的可能是饱和溶液;______中盛的一定是不饱和溶液。
(2)在一定温度下,在A、B中分别加入相同质量的水,B中固体刚好溶解,A中固体是否也全溶?_________________________________________________。
知能提升
1.20 ℃时,将不同质量的食盐固体分别放入100 g水中,充分溶解后过滤,所得溶液质量与加入食盐质量的对应关系如下表。其中所得溶液属于饱和溶液的是( )
2.在一个烧杯中盛有饱和硝酸钾溶液和少量硝酸钾晶体,现有四种方法:①向烧杯中加水;②用玻璃棒搅拌;③将溶液加热;④加入同体积的饱和食盐水。其中不能使硝酸钾晶体再溶解的是( )
A.②④ B.② C.①③ D.④
3.有两瓶t ℃的硝酸钾溶液,一瓶为饱和溶液,另一瓶为不饱和溶液,下列实验操作中,无法区分这两瓶溶液的是( )
A.分别降低温度
B.各加入少量硝酸钾晶体,振荡
C.各加入一定量的水,振荡
D.恒温下,分别蒸发少量水
4.能证明某KCl溶液在20 ℃时已经达到饱和状态的方法是( )
A.温度不变时,向该溶液中加入少量水,结果溶液变稀
B.温度不变时,向该溶液中加入少量KCl晶体,晶体不再溶解
C.取少量该溶液升温,无KCl晶体析出
D.取少量该溶液,降温至10 ℃时,有KCl晶体析出
5.把盛有饱和硝酸钾溶液(内含有少量未溶解的KNO3 晶体)的试管与一U形管连通,U形管内盛有水,并将试管插在盛水的烧杯中(如右图)。
(1)如果往烧杯中缓慢加入硝酸铵晶体,此时试管里的KNO3晶体的量会______,U形管中液面变化是________________________________
_________________。
(2)如果往烧杯中缓慢加入NaOH固体,此时试管内KNO3溶液的量会______,
U形管中液面的变化是______________________________________________。
(3)硝酸钾在一定量的水中溶解的质量随温度变化的情况为_______________。
U形管液面的变化说明了____________________________________________。
6.请根据题意,选择下列词语填空:“饱和、不饱和、浓、稀、多、少、一定、不一定”。
已知:20 ℃时,100 g水中最多溶解食盐和熟石灰的质量分别为36 g和0.17 g,现有甲、乙两只烧杯各盛50 g水,分别进行如下实验:
(1)在甲烧杯中加入15 g食盐,充分搅拌后,得到溶液甲,则甲为______溶液。由于此溶液中溶质含量较______,所以属于______溶液。
(2)在乙烧杯中加入0.1 g熟石灰,充分搅拌后得浑浊的液体,过滤得到溶液乙,则乙为______溶液。由于此溶液中溶质含量较______,所以属于______溶液。
由实验可知,对于不同溶质来说,浓溶液______是饱和溶液,稀溶液______是不饱和溶液。
拓展创新
某兴趣小组利用家中的材料研究影响物质溶解性的因素,实验步骤设计如下:
Ⅰ.称取六份冰糖和一份食盐,每10 g为一份,并将其中五份冰糖研磨成粉末。
Ⅱ.按照下表进行实验(实验所需仪器略)
请你对他们的实验设计进行分析:
(1)根据上述设计,你认为他们准备研究的影响因素是___________________,其中不影响物质溶解性的因素是_____________________________________。
(2)根据第四组实验与前三组实验的比较,你可以得到的结论是__________。
答案解析
基础达标
1.【解析】选C。对于饱和溶液来说,是指在条件一定的情况下不能再溶解该溶质的溶液,而不是不能溶解所有物质的溶液;溶液饱和与否和溶液的浓稀没有必然的关系。
2.【解析】选B。倒出的溶液还可溶解少量的食盐,说明溶液变为不饱和溶液,且溶液比原来变稀;由于黄瓜中的部分水分进入溶液,溶剂的质量增加。
3.【解析】选C。降低温度会使接近饱和的硝酸钾溶液变为饱和溶液,题中四种物质中只有硝酸铵溶于水时才会使溶液的温度降低。
4.【解析】选C。已知硝酸钾是一种溶解度随温度升高而增大的物质,采用加溶质、蒸发溶剂、降低温度的方法,都能使接近饱和的硝酸钾溶液变成饱和溶液。
5.【解析】选D。Ca(OH)2溶液是无色溶液;由于100 mL水中加入少量的Ca(OH)2还不能完全溶解,说明该溶液中只溶有少量的溶质,属于稀溶液,因为溶液中有不溶的Ca(OH)2存在,说明该溶液已达到饱和。
6.【解析】选A。由于搅拌后加热前的溶液中有未溶解的蔗糖,故此时的溶液应是饱和溶液;由题中信息无法确定加热后的溶液能否继续溶解蔗糖,故无法确定此时溶液是否饱和。
7.【解析】选C。由于是向不饱和KNO3溶液中加入KNO3固体,故不选A;随着不断加KNO3固体,溶质的质量不断增加,当达到饱和之后,溶质质量不变,正确的图像是C。
8.【解析】硝酸钾的饱和溶液不能溶解硝酸钾晶体,但可溶解氯化钠晶体。但因溶解的氯化钠的量很少,故为NaCl的不饱和溶液。
答案:100 102 不饱和
9.【解析】由于苯甲酸在25 ℃、100 g的蒸馏水中仅能溶解0.17 g,故发现样品几乎没有溶解,由于有没溶解的苯甲酸,故溶液属于饱和溶液;趁热过滤是为了防止温度下降后苯甲酸析出,从而被过滤出来;滤液缓慢冷却至室温时,由于苯甲酸在水中溶解的质量减小,故会以晶体的形式析出。
答案:(1)常温下,苯甲酸在水中溶解的质量很小 饱和
(2)减少过滤时苯甲酸的损失
(3)苯甲酸在水中溶解的质量随温度降低而减小
10.【解析】硝酸钾饱和溶液在降低温度时会析出晶体;由于溶液的质量减小,因此其密度减小,根据浮力公式,排开水的体积增大,塑料板也随之下沉。硝酸钾饱和溶液只是不能溶解硝酸钾,可向其中加入其他的溶质,从而增大溶液的质量,其密度也会随之增大,塑料板排开水的体积减小,导致塑料板上浮,另外也可采用升高温度后,加入硝酸钾的方法增大溶液的密度。
答案:硝酸钾晶体析出 塑料板下沉
向溶液中加入食盐等物质(或升高温度后,加入硝酸钾等)
11.【解析】(1)分析图示可以看出,A、B烧杯中溶质没有完全溶解,说明溶液已达到饱和,C烧杯中没有固体剩余,溶液可能饱和,也可能不饱和,D烧杯中溶解的溶质的量比C烧杯中溶解的溶质的量少。因此,不管C烧杯中的溶液是否达到饱和,D中所盛溶液一定是不饱和溶液。
(2)A烧杯中所加的溶质的量比B烧杯中多5 g,加入相同质量的水,B中固体恰好溶解时,A中固体应有剩余。
答案:(1)A、B C D (2)不全溶
知能提升
1.【解析】选D。四个实验中的水的质量都是100 g。由D项中实验可知,20 ℃时,100 g水中最多只溶解36 g食盐,即有4 g未溶解的食盐,因此所得溶液饱和;而前三个实验中加入食盐的质量均小于36 g,即所得溶液均不饱和。
2.【解析】选B。由题意知,烧杯中盛有饱和硝酸钾溶液和少量硝酸钾晶体,向烧杯中加水和将溶液加热,都会使饱和溶液变成不饱和溶液,从而使硝酸钾晶体继续溶解;饱和食盐水是食盐的饱和溶液,不是硝酸钾的饱和溶液,可以继续溶解硝酸钾,故向烧杯中加入同体积的饱和食盐水,可以使硝酸钾晶体再溶解;在温度和溶剂的量不改变的条件下,用玻璃棒搅拌不能使饱和硝酸钾溶液变为不饱和溶液,因此不能使烧杯中的硝酸钾晶体再溶解。
3.【解析】选C。降低温度时,饱和溶液中会析出晶体;加入少量的硝酸钾时,饱和的硝酸钾溶液中不会继续溶解硝酸钾;恒温蒸发少量水时,饱和硝酸钾溶液中会有晶体析出,故A、B、D三种操作均可区别两溶液。由于无论硝酸钾溶液是否饱和,向其中加入水时均无现象,故C操作不能区分两溶液。
4.【解析】选B。无论溶液是否饱和,向其中加入少量水时溶液都会变稀,故方法A不正确;温度不变时,向其中加入该溶质,晶体不再溶解,说明溶液已达到饱和,故方法B正确;由于无论溶液是否饱和,在升高温度时,均不会析出晶体,故方法C不正确;对于接近饱和的不饱和溶液来讲,当温度降到足够低时也会析出晶体,故方法D不正确。
5.【解析】(1)由于硝酸铵溶解于水时液体的温度降低,因而向烧杯内加硝酸铵固体时,烧杯内液体温度降低,试管内饱和硝酸钾溶液会有KNO3晶体析出,由于试管内温度降低,试管内气体分子间隔变小,试管内部气压变小,因而U形管内的液体沿U形管向左移动,造成左侧液面升高,右侧液面下降。(2)由于NaOH固体溶解时液体温度升高,此时试管内的KNO3晶体逐渐溶解,使试管内KNO3溶液的质量增加,U形管内的液体则沿U形管向右侧移动,造成右侧液面升高,左侧液面下降。(3)分析(1)、(2)不难得出结论。
答案:(1)增多 左侧液面比右侧高
(2)增多 右侧液面比左侧高
(3)KNO3溶解的质量随温度升高而增大 气体分子间的间隔随温度升高而增大,随温度降低而减小
6.【解析】100 g水中最多溶解36 g食盐,则50 g水中最多溶解18 g,所以15 g食盐溶到50 g水中得到的是不饱和溶液,但溶质含量较多,是浓溶液;
100 g水中最多溶解0.17 g熟石灰,0.1 g熟石灰加到50 g水中得饱和溶液,但溶质含量较少,所以是稀溶液。
答案:(1)不饱和 多 浓
(2)饱和 少 稀 不一定 不一定
拓展创新
【解析】(1)根据上表可判断第一组中溶剂的种类不同,溶剂的质量与其他各组也不相同,第二组是溶质的颗粒大小不同,第三组是固体的种类不同,第四组与前三组温度不同,因此可知准备研究的影响因素是固体种类、溶质颗粒的大小、温度、溶剂的种类、溶剂的质量;比较上表可知不影响物质溶解性的是溶质颗粒的大小、溶剂的质量。(2)第四组实验比前三组温度高,物质溶解的速率加快。
答案:(1)固体种类、溶质颗粒的大小、温度、溶剂种类、溶剂质量 溶质颗粒的大小、溶剂质量
(2)温度升高溶解速率加快(其他合理答案亦可)
全能训练?梯度升级
基础达标
1.在一定温度下,某物质的饱和溶液一定是( )
A.很浓的溶液
B.很稀的溶液
C.不能溶解该物质的溶液
D.不能再溶解任何物质的溶液
2.取几根洗净的黄瓜,放入水槽中,然后向其中注入饱和食盐水,一段时间后将食盐水倒出。在相同的温度下,发现倒出的溶液还可溶解少量的食盐,这说明倒出的溶液( )
A.是饱和溶液
B.是不饱和溶液
C.倒出的溶液比原来变浓
D.溶液中溶剂的质量不变
3.室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中(如图所示),欲使硝酸钾溶液变为饱和溶液,可向大烧杯中加入的固体物质是( )
A.蔗糖 B.氯化钠
C.硝酸铵 D.氢氧化钠
4.下述方法中:①加水,②加硝酸钾,③蒸发水,④冷却,⑤加热但保持溶液质量不变,⑥加饱和硝酸钾溶液。能使接近饱和的硝酸钾溶液由不饱和变为饱和的是( )
A.①②⑤ B.①⑤⑥ C.②③④ D.②④⑥
5.20 ℃时,在一只烧杯中加入100 mL水,放入1 gCa(OH)2固体搅拌,静置,有白色沉淀沉降到烧杯底部,对于上层澄清液体的说法,错误的是( )
A.是无色溶液 B.是稀溶液 C.是饱和溶液 D.是浓溶液
6.20 ℃时,往50 g蔗糖溶液中加入5 g蔗糖固体充分搅拌后,尚有部分固体未溶解,稍加热后固体全部溶解。下列说法正确的是( )
A.搅拌后加热前一定是饱和溶液 B.搅拌后加热前一定是不饱和溶液
C.加热后一定是饱和溶液 D.加热后一定是不饱和溶液
7.(2011·桂林中考)25 ℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中能正确表示此过程溶质质量变化规律的是( )
8.20 ℃时向100 g硝酸钾饱和溶液中加入10 g硝酸钾晶体,静置一段时间,溶液的质量为_____g;若向其中加入2 g氯化钠晶体,静置一段时间,则溶液的质量为_____g,所得溶液为20 ℃时氯化钠的_____溶液(填“饱和”或“不饱和”)。
9.苯甲酸是一种食品防腐剂,它是一种片状晶体,不同温度下在100 g水中溶解的质量如下表:
某同学为提纯某一苯甲酸样品(其中含有泥沙等难溶于水的杂质),进行了如下实验:
(1)取样品约2 g放入烧杯中,加入25 ℃、100 g的蒸馏水充分搅拌,发现样品几乎没有溶解,原因是__________________,所得溶液为苯甲酸的______(填“饱和”或“不饱和”)溶液。
(2)将烧杯放在石棉网上加热。待样品充分溶解后趁热过滤,趁热过滤的目的是_________________________。
(3)将所得滤液缓慢冷却至室温就可使苯甲酸以晶体形式析出。其原因是_________________________。
10.将一块塑料板放入50 ℃的硝酸钾饱和溶液中,塑料板漂浮于液面上(如图所示)。若将溶液降温到20 ℃时,可观察到的现象是______;______。若要使塑料板上浮,应采用的方法是_______________(忽略该过程中溶液体积的变化)。
11.A、B、C、D四个烧杯分别盛有质量相等的同种溶剂,在相同的温度下,向4个烧杯中加入20 g、15 g、10 g、5 g的某溶质,充分溶解后,如图所示,回答下列各题。(填序号)
(1)______中盛的一定是饱和溶液;______中盛的可能是饱和溶液;______中盛的一定是不饱和溶液。
(2)在一定温度下,在A、B中分别加入相同质量的水,B中固体刚好溶解,A中固体是否也全溶?_________________________________________________。
知能提升
1.20 ℃时,将不同质量的食盐固体分别放入100 g水中,充分溶解后过滤,所得溶液质量与加入食盐质量的对应关系如下表。其中所得溶液属于饱和溶液的是( )
2.在一个烧杯中盛有饱和硝酸钾溶液和少量硝酸钾晶体,现有四种方法:①向烧杯中加水;②用玻璃棒搅拌;③将溶液加热;④加入同体积的饱和食盐水。其中不能使硝酸钾晶体再溶解的是( )
A.②④ B.② C.①③ D.④
3.有两瓶t ℃的硝酸钾溶液,一瓶为饱和溶液,另一瓶为不饱和溶液,下列实验操作中,无法区分这两瓶溶液的是( )
A.分别降低温度
B.各加入少量硝酸钾晶体,振荡
C.各加入一定量的水,振荡
D.恒温下,分别蒸发少量水
4.能证明某KCl溶液在20 ℃时已经达到饱和状态的方法是( )
A.温度不变时,向该溶液中加入少量水,结果溶液变稀
B.温度不变时,向该溶液中加入少量KCl晶体,晶体不再溶解
C.取少量该溶液升温,无KCl晶体析出
D.取少量该溶液,降温至10 ℃时,有KCl晶体析出
5.把盛有饱和硝酸钾溶液(内含有少量未溶解的KNO3 晶体)的试管与一U形管连通,U形管内盛有水,并将试管插在盛水的烧杯中(如右图)。
(1)如果往烧杯中缓慢加入硝酸铵晶体,此时试管里的KNO3晶体的量会______,U形管中液面变化是________________________________
_________________。
(2)如果往烧杯中缓慢加入NaOH固体,此时试管内KNO3溶液的量会______,
U形管中液面的变化是______________________________________________。
(3)硝酸钾在一定量的水中溶解的质量随温度变化的情况为_______________。
U形管液面的变化说明了____________________________________________。
6.请根据题意,选择下列词语填空:“饱和、不饱和、浓、稀、多、少、一定、不一定”。
已知:20 ℃时,100 g水中最多溶解食盐和熟石灰的质量分别为36 g和0.17 g,现有甲、乙两只烧杯各盛50 g水,分别进行如下实验:
(1)在甲烧杯中加入15 g食盐,充分搅拌后,得到溶液甲,则甲为______溶液。由于此溶液中溶质含量较______,所以属于______溶液。
(2)在乙烧杯中加入0.1 g熟石灰,充分搅拌后得浑浊的液体,过滤得到溶液乙,则乙为______溶液。由于此溶液中溶质含量较______,所以属于______溶液。
由实验可知,对于不同溶质来说,浓溶液______是饱和溶液,稀溶液______是不饱和溶液。
拓展创新
某兴趣小组利用家中的材料研究影响物质溶解性的因素,实验步骤设计如下:
Ⅰ.称取六份冰糖和一份食盐,每10 g为一份,并将其中五份冰糖研磨成粉末。
Ⅱ.按照下表进行实验(实验所需仪器略)
请你对他们的实验设计进行分析:
(1)根据上述设计,你认为他们准备研究的影响因素是___________________,其中不影响物质溶解性的因素是_____________________________________。
(2)根据第四组实验与前三组实验的比较,你可以得到的结论是__________。
答案解析
基础达标
1.【解析】选C。对于饱和溶液来说,是指在条件一定的情况下不能再溶解该溶质的溶液,而不是不能溶解所有物质的溶液;溶液饱和与否和溶液的浓稀没有必然的关系。
2.【解析】选B。倒出的溶液还可溶解少量的食盐,说明溶液变为不饱和溶液,且溶液比原来变稀;由于黄瓜中的部分水分进入溶液,溶剂的质量增加。
3.【解析】选C。降低温度会使接近饱和的硝酸钾溶液变为饱和溶液,题中四种物质中只有硝酸铵溶于水时才会使溶液的温度降低。
4.【解析】选C。已知硝酸钾是一种溶解度随温度升高而增大的物质,采用加溶质、蒸发溶剂、降低温度的方法,都能使接近饱和的硝酸钾溶液变成饱和溶液。
5.【解析】选D。Ca(OH)2溶液是无色溶液;由于100 mL水中加入少量的Ca(OH)2还不能完全溶解,说明该溶液中只溶有少量的溶质,属于稀溶液,因为溶液中有不溶的Ca(OH)2存在,说明该溶液已达到饱和。
6.【解析】选A。由于搅拌后加热前的溶液中有未溶解的蔗糖,故此时的溶液应是饱和溶液;由题中信息无法确定加热后的溶液能否继续溶解蔗糖,故无法确定此时溶液是否饱和。
7.【解析】选C。由于是向不饱和KNO3溶液中加入KNO3固体,故不选A;随着不断加KNO3固体,溶质的质量不断增加,当达到饱和之后,溶质质量不变,正确的图像是C。
8.【解析】硝酸钾的饱和溶液不能溶解硝酸钾晶体,但可溶解氯化钠晶体。但因溶解的氯化钠的量很少,故为NaCl的不饱和溶液。
答案:100 102 不饱和
9.【解析】由于苯甲酸在25 ℃、100 g的蒸馏水中仅能溶解0.17 g,故发现样品几乎没有溶解,由于有没溶解的苯甲酸,故溶液属于饱和溶液;趁热过滤是为了防止温度下降后苯甲酸析出,从而被过滤出来;滤液缓慢冷却至室温时,由于苯甲酸在水中溶解的质量减小,故会以晶体的形式析出。
答案:(1)常温下,苯甲酸在水中溶解的质量很小 饱和
(2)减少过滤时苯甲酸的损失
(3)苯甲酸在水中溶解的质量随温度降低而减小
10.【解析】硝酸钾饱和溶液在降低温度时会析出晶体;由于溶液的质量减小,因此其密度减小,根据浮力公式,排开水的体积增大,塑料板也随之下沉。硝酸钾饱和溶液只是不能溶解硝酸钾,可向其中加入其他的溶质,从而增大溶液的质量,其密度也会随之增大,塑料板排开水的体积减小,导致塑料板上浮,另外也可采用升高温度后,加入硝酸钾的方法增大溶液的密度。
答案:硝酸钾晶体析出 塑料板下沉
向溶液中加入食盐等物质(或升高温度后,加入硝酸钾等)
11.【解析】(1)分析图示可以看出,A、B烧杯中溶质没有完全溶解,说明溶液已达到饱和,C烧杯中没有固体剩余,溶液可能饱和,也可能不饱和,D烧杯中溶解的溶质的量比C烧杯中溶解的溶质的量少。因此,不管C烧杯中的溶液是否达到饱和,D中所盛溶液一定是不饱和溶液。
(2)A烧杯中所加的溶质的量比B烧杯中多5 g,加入相同质量的水,B中固体恰好溶解时,A中固体应有剩余。
答案:(1)A、B C D (2)不全溶
知能提升
1.【解析】选D。四个实验中的水的质量都是100 g。由D项中实验可知,20 ℃时,100 g水中最多只溶解36 g食盐,即有4 g未溶解的食盐,因此所得溶液饱和;而前三个实验中加入食盐的质量均小于36 g,即所得溶液均不饱和。
2.【解析】选B。由题意知,烧杯中盛有饱和硝酸钾溶液和少量硝酸钾晶体,向烧杯中加水和将溶液加热,都会使饱和溶液变成不饱和溶液,从而使硝酸钾晶体继续溶解;饱和食盐水是食盐的饱和溶液,不是硝酸钾的饱和溶液,可以继续溶解硝酸钾,故向烧杯中加入同体积的饱和食盐水,可以使硝酸钾晶体再溶解;在温度和溶剂的量不改变的条件下,用玻璃棒搅拌不能使饱和硝酸钾溶液变为不饱和溶液,因此不能使烧杯中的硝酸钾晶体再溶解。
3.【解析】选C。降低温度时,饱和溶液中会析出晶体;加入少量的硝酸钾时,饱和的硝酸钾溶液中不会继续溶解硝酸钾;恒温蒸发少量水时,饱和硝酸钾溶液中会有晶体析出,故A、B、D三种操作均可区别两溶液。由于无论硝酸钾溶液是否饱和,向其中加入水时均无现象,故C操作不能区分两溶液。
4.【解析】选B。无论溶液是否饱和,向其中加入少量水时溶液都会变稀,故方法A不正确;温度不变时,向其中加入该溶质,晶体不再溶解,说明溶液已达到饱和,故方法B正确;由于无论溶液是否饱和,在升高温度时,均不会析出晶体,故方法C不正确;对于接近饱和的不饱和溶液来讲,当温度降到足够低时也会析出晶体,故方法D不正确。
5.【解析】(1)由于硝酸铵溶解于水时液体的温度降低,因而向烧杯内加硝酸铵固体时,烧杯内液体温度降低,试管内饱和硝酸钾溶液会有KNO3晶体析出,由于试管内温度降低,试管内气体分子间隔变小,试管内部气压变小,因而U形管内的液体沿U形管向左移动,造成左侧液面升高,右侧液面下降。(2)由于NaOH固体溶解时液体温度升高,此时试管内的KNO3晶体逐渐溶解,使试管内KNO3溶液的质量增加,U形管内的液体则沿U形管向右侧移动,造成右侧液面升高,左侧液面下降。(3)分析(1)、(2)不难得出结论。
答案:(1)增多 左侧液面比右侧高
(2)增多 右侧液面比左侧高
(3)KNO3溶解的质量随温度升高而增大 气体分子间的间隔随温度升高而增大,随温度降低而减小
6.【解析】100 g水中最多溶解36 g食盐,则50 g水中最多溶解18 g,所以15 g食盐溶到50 g水中得到的是不饱和溶液,但溶质含量较多,是浓溶液;
100 g水中最多溶解0.17 g熟石灰,0.1 g熟石灰加到50 g水中得饱和溶液,但溶质含量较少,所以是稀溶液。
答案:(1)不饱和 多 浓
(2)饱和 少 稀 不一定 不一定
拓展创新
【解析】(1)根据上表可判断第一组中溶剂的种类不同,溶剂的质量与其他各组也不相同,第二组是溶质的颗粒大小不同,第三组是固体的种类不同,第四组与前三组温度不同,因此可知准备研究的影响因素是固体种类、溶质颗粒的大小、温度、溶剂的种类、溶剂的质量;比较上表可知不影响物质溶解性的是溶质颗粒的大小、溶剂的质量。(2)第四组实验比前三组温度高,物质溶解的速率加快。
答案:(1)固体种类、溶质颗粒的大小、温度、溶剂种类、溶剂质量 溶质颗粒的大小、溶剂质量
(2)温度升高溶解速率加快(其他合理答案亦可)
同课章节目录
