人教版九年级化学下册第九单元课题2 溶解度梯度能力训练
文档属性
| 名称 | 人教版九年级化学下册第九单元课题2 溶解度梯度能力训练 |

|
|
| 格式 | zip | ||
| 文件大小 | 299.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-03-17 21:05:23 | ||
图片预览


文档简介
课题2 溶解度
全能训练?梯度升级
基础达标
1.(2011·淄博中考)如图是某物质的溶解度曲线,60 ℃时,取100 g水配制成该物质的饱和溶液,当温度降低至30 ℃时所得溶液的质量为( )
A.130 g B.140 g C.160 g D.180 g
2.将0.5 g某物质在20 ℃时溶于10 g水中即达到饱和,则一般把这种物质的溶解性判定为( )
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
3.在其他条件不变的情况下,将某物质的不饱和溶液变为饱和溶液,最可靠的方法是( )
A.升高温度 B.加入溶质
C.降低温度 D.倒出溶剂
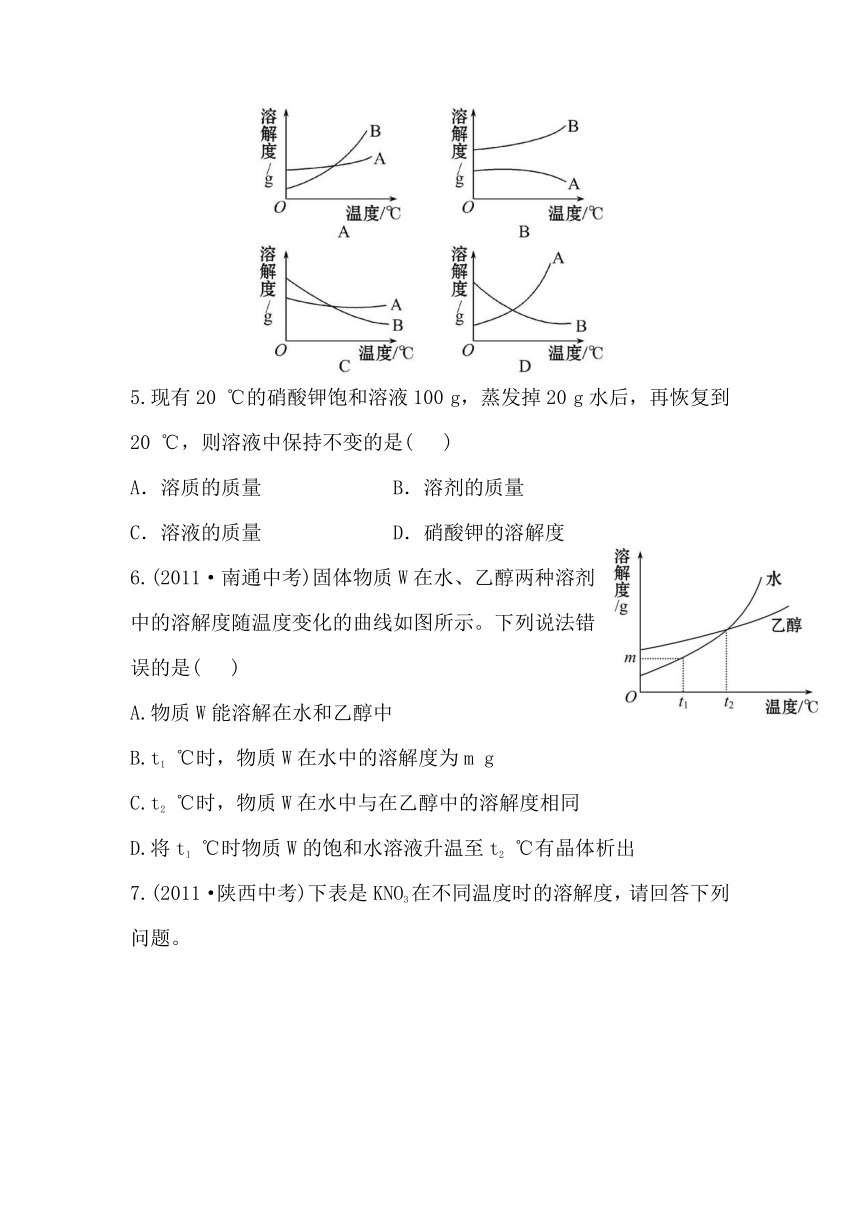
4.现有A、B两种物质在室温下的饱和溶液,升高温度后,A溶液有晶体析出,而B溶液还可以再溶解B晶体。则能正确表示A、B两物质溶解度曲线的是( )
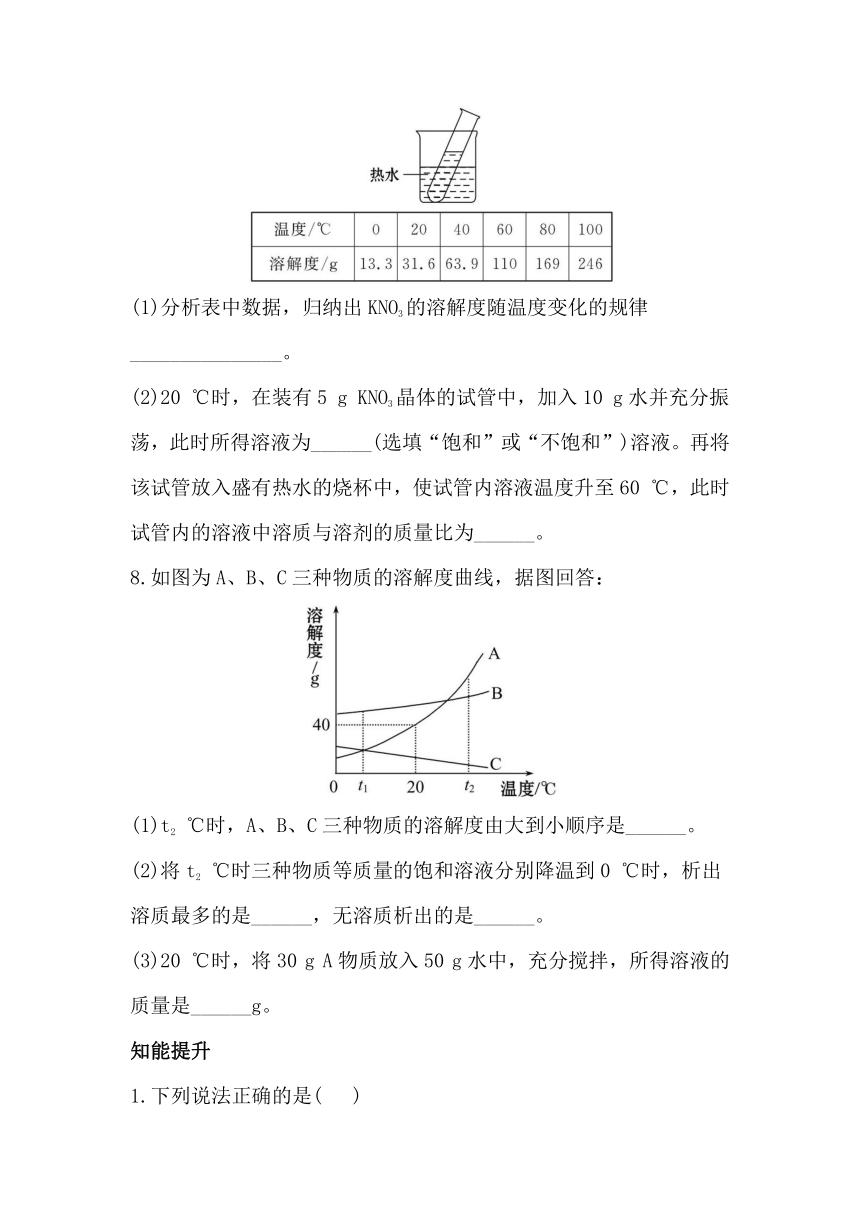
5.现有20 ℃的硝酸钾饱和溶液100 g,蒸发掉20 g水后,再恢复到20 ℃,则溶液中保持不变的是( )
A.溶质的质量 B.溶剂的质量
C.溶液的质量 D.硝酸钾的溶解度
6.(2011·南通中考)固体物质W在水、乙醇两种溶剂中的溶解度随温度变化的曲线如图所示。下列说法错误的是( )
A.物质W能溶解在水和乙醇中
B.t1 ℃时,物质W在水中的溶解度为m g
C.t2 ℃时,物质W在水中与在乙醇中的溶解度相同
D.将t1 ℃时物质W的饱和水溶液升温至t2 ℃有晶体析出
7.(2011·陕西中考)下表是KNO3在不同温度时的溶解度,请回答下列问题。
(1)分析表中数据,归纳出KNO3的溶解度随温度变化的规律_______________。
(2)20 ℃时,在装有5 g KNO3晶体的试管中,加入10 g水并充分振荡,此时所得溶液为______(选填“饱和”或“不饱和”)溶液。再将该试管放入盛有热水的烧杯中,使试管内溶液温度升至60 ℃,此时试管内的溶液中溶质与溶剂的质量比为______。
8.如图为A、B、C三种物质的溶解度曲线,据图回答:
(1)t2 ℃时,A、B、C三种物质的溶解度由大到小顺序是______。
(2)将t2 ℃时三种物质等质量的饱和溶液分别降温到0 ℃时,析出溶质最多的是______,无溶质析出的是______。
(3)20 ℃时,将30 g A物质放入50 g水中,充分搅拌,所得溶液的质量是______g。
知能提升
1.下列说法正确的是( )
A.降低温度能使任何不饱和溶液转化为饱和溶液
B.气体的溶解度与温度、压强和水的用量有关
C.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
D.汽油作溶剂可以去除衣物上的油污
2.(2011·成都中考)某小组用20 mL一次性注射器吸取10 mL 某碳酸型饮料并用胶头封闭注射器针孔,分别进行了如图实验。下列分析不合理的是( )
A.该实验用于探究压强对气体在水中溶解度的影响
B.图Ⅰ:用力向外拉动注射器,管中有许多小气泡出现
C.图Ⅱ:用力向里推注射器,压强增大,气体在水中的溶解度减小
D.该实验装置的优点是密封性好,压强较易改变
3.常温下,在两只各盛有100 mL水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,结果如图所示。下列说法正确的是( )
A.甲溶液是不饱和溶液
B.常温下,甲、乙两种物质的溶解度相同
C.升高温度,剩余的甲固体一定能继续溶解
D.乙溶液可能是饱和溶液,也可能是不饱和溶液
4.如图是A、B两种物质的溶解度曲线。在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅拌后都加热到t2 ℃。下列说法正确的是( )
A.t1℃时,A、B两物质的溶解度相等,两杯溶液均是不饱和溶液
B.t1℃时,A、B两物质的溶解度相等,A溶液为饱和溶液,B溶液为不饱和溶液
C.t2℃时,A的溶解度比B的溶解度大,两杯溶液均是不饱和溶液
D.t2℃时,A的溶解度比B的溶解度大,A溶液为不饱和溶液,B溶液为饱和溶液
5.(2011·益阳中考)NH4Cl的溶解度如下:
在20 ℃条件下,一种NH4Cl溶液甲,发生如下变化:
请回答:
(1)一定为饱和溶液是______溶液,不能确定为饱和溶液的是______溶液。
(2)要把40 ℃时的NH4Cl饱和溶液转化为不饱和溶液可采取的措施是______________________。
拓展创新
KNO3和KCl在不同温度时的溶解度如表所示。请回答下列问题:
(1)依据上表数据,绘制KNO3和KCl的溶解度曲线,右图中能表示KNO3溶解度曲线的是______。(填“m”或“n”)
(2)由表中数据分析可知, KNO3和KCl在某一温度时具有相同的溶解度x,则x的取值范围是______。
(3)10 ℃时,131 g 饱和KCl溶液中含KCl的质量为______。
答案解析
基础达标
1.【解析】选B。根据该物质的溶解度曲线,60 ℃时该物质的饱和溶液温度降低至30 ℃时,溶液仍为饱和溶液,并且30 ℃时该物质的溶解度是40 g,所以在60 ℃ 100 g水配制成该物质的饱和溶液降低至30 ℃时溶液的质量为100 g
+40 g=140 g。
2.【解析】选B。由于20 ℃时,10 g水中最多能溶解0.5 g该物质,则100 g水中最多能溶解5 g,即20 ℃时该物质的溶解度为5 g,介于1~10 g之间,故属可溶物质。
3.【解析】选B。对于溶解度随温度的升高而升高的物质,可采用降低温度的方法;对于溶解度随温度的升高而降低的物质,可采用升高温度的方法;将不饱和溶液倒出溶剂的同时,也将溶质倒出,剩余溶液仍不饱和。故选B。
4.【解析】选B。从题中所给信息可知,A物质的溶解度是随温度的升高而减小的,B物质的溶解度是随温度升高而增大的,故只有B项中图像符合题意。
5.【解析】选D。硝酸钾饱和溶液蒸发水再恢复至原温度时会析出晶体,故溶质、溶液、溶剂的质量均变小;由于温度不变,故硝酸钾的溶解度不变。
6.【解析】选D。W能溶解在水和乙醇中是正确的;由溶解度曲线图可判断t1 ℃时W在水中的溶解度是m g,B正确;t2 ℃时两曲线相交于一点,可知W在水中和在乙醇中溶解度相等,C正确;由t1 ℃升温至t2 ℃,W在水中的溶解度增加,饱和溶液会变成不饱和溶液,不会析出固体,所以D说法是不正确的。
7.【解析】(1)从表中的数据可以看出,硝酸钾的溶解度随着温度的升高而增大;(2)20 ℃时,硝酸钾的溶解度为31.6 g,说明10 g水中最多溶解3.16 g硝酸钾,将5 g KNO3晶体加入10 g水中,只溶解3.16 g,得到饱和溶液。升高到60 ℃,硝酸钾的溶解度变为110 g,10 g水中最多可溶解11 g硝酸钾,所以5 g KNO3会全部溶解在10 g水中,溶液中溶质和溶剂的质量比为5 g∶10 g=1:2。
答案:(1)随温度的升高而增大 (2)饱和 1∶2
8.【解析】(2)等质量的饱和溶液分别降温时,溶解度随温度降低而减小且受温度影响大的物质,析出的晶体多;(3)20 ℃时,A物质的溶解度是40 g,即
100 g水中最多能溶解40 g A物质,因此50 g水中最多能溶解20 g的A物质,所得溶液的质量是20 g+50 g=70 g。
答案:(1)A>B>C (2)A C (3)70
知能提升
1.【解析】选D。降低温度只能使溶解度随温度升高而变大的物质由不饱和溶液变为饱和溶液,A错;气体的溶解度是指在一定温度下和压强在101 kPa时,气体溶解在1体积水里达到饱和状态时的气体体积,其与温度和压强有关,但与水的用量无关,B错;对于不同溶质而言,饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液,溶液的浓稀与是否饱和没有必然联系,C错;汽油是常见的有机溶剂,油污能够溶于汽油而被除去,D正确。
2.【解析】选C。本题考查实验设计:压强对气体在水中溶解度的影响;向外拉动注射器时,其中的气体压强减小,CO2在水中的溶解度减小,部分CO2逸出;向里推动注射器时,其中的气体压强增大,CO2在水中的溶解度增大;只有实验装置的气密性好,压强才易改变,实验现象因此会较明显。
3.【解析】选D。相同温度下,相同质量的溶剂中加入相同质量的两种溶质,甲有固体剩余,乙无固体剩余,说明甲溶液已达饱和,两种物质的溶解度不同。乙溶液可能达饱和,也可能不饱和。升高温度,甲固体不一定能继续溶解,因为不知道温度会怎样影响甲的溶解度。
4.【解析】选D。由溶解度曲线图知,t1℃时,A、B两物质的溶解度相等,都是b克,因此在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅拌后,A溶液为不饱和溶液,B溶液刚好为饱和溶液;t2℃时,A物质的溶解度比B的溶解度大,而B物质的溶解度随温度升高而逐渐降低,因此,A、B两溶液升温到t2℃时,B溶液有晶体析出,仍是饱和溶液。
5.【解析】(1)溶液甲恒温蒸发10克水后,无晶体析出,那么得到的溶液乙有可能是饱和溶液也有可能是不饱和溶液,不能确定;但是可以确定溶液甲为不饱和溶液。溶液乙再恒温蒸发10克水后,有4克晶体析出,得到的溶液丙一定是饱和溶液。(2)因为氯化铵的溶解度随温度的升高而增大,因此将其饱和溶液转化为不饱和溶液,可以采用增加水或者升高温度的方法。
答案:(1)丙 乙 (2)增加水或升高温度
拓展创新
【解析】(1)由表中数据可以看出,KNO3和KCl中,KNO3的溶解度受温度的影响较大,所以,能表示KNO3溶解度曲线的是m;(2)在20~30 ℃之间,KNO3和KCl的溶解度可能相等;(3)10 ℃时,KCl的溶解度为31.0 g,说明100 g水中溶解31.0 g KCl达到饱和,所得饱和溶液的质量是131 g。
答案:(1)m (2)34.0 g
全能训练?梯度升级
基础达标
1.(2011·淄博中考)如图是某物质的溶解度曲线,60 ℃时,取100 g水配制成该物质的饱和溶液,当温度降低至30 ℃时所得溶液的质量为( )
A.130 g B.140 g C.160 g D.180 g
2.将0.5 g某物质在20 ℃时溶于10 g水中即达到饱和,则一般把这种物质的溶解性判定为( )
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
3.在其他条件不变的情况下,将某物质的不饱和溶液变为饱和溶液,最可靠的方法是( )
A.升高温度 B.加入溶质
C.降低温度 D.倒出溶剂
4.现有A、B两种物质在室温下的饱和溶液,升高温度后,A溶液有晶体析出,而B溶液还可以再溶解B晶体。则能正确表示A、B两物质溶解度曲线的是( )
5.现有20 ℃的硝酸钾饱和溶液100 g,蒸发掉20 g水后,再恢复到20 ℃,则溶液中保持不变的是( )
A.溶质的质量 B.溶剂的质量
C.溶液的质量 D.硝酸钾的溶解度
6.(2011·南通中考)固体物质W在水、乙醇两种溶剂中的溶解度随温度变化的曲线如图所示。下列说法错误的是( )
A.物质W能溶解在水和乙醇中
B.t1 ℃时,物质W在水中的溶解度为m g
C.t2 ℃时,物质W在水中与在乙醇中的溶解度相同
D.将t1 ℃时物质W的饱和水溶液升温至t2 ℃有晶体析出
7.(2011·陕西中考)下表是KNO3在不同温度时的溶解度,请回答下列问题。
(1)分析表中数据,归纳出KNO3的溶解度随温度变化的规律_______________。
(2)20 ℃时,在装有5 g KNO3晶体的试管中,加入10 g水并充分振荡,此时所得溶液为______(选填“饱和”或“不饱和”)溶液。再将该试管放入盛有热水的烧杯中,使试管内溶液温度升至60 ℃,此时试管内的溶液中溶质与溶剂的质量比为______。
8.如图为A、B、C三种物质的溶解度曲线,据图回答:
(1)t2 ℃时,A、B、C三种物质的溶解度由大到小顺序是______。
(2)将t2 ℃时三种物质等质量的饱和溶液分别降温到0 ℃时,析出溶质最多的是______,无溶质析出的是______。
(3)20 ℃时,将30 g A物质放入50 g水中,充分搅拌,所得溶液的质量是______g。
知能提升
1.下列说法正确的是( )
A.降低温度能使任何不饱和溶液转化为饱和溶液
B.气体的溶解度与温度、压强和水的用量有关
C.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
D.汽油作溶剂可以去除衣物上的油污
2.(2011·成都中考)某小组用20 mL一次性注射器吸取10 mL 某碳酸型饮料并用胶头封闭注射器针孔,分别进行了如图实验。下列分析不合理的是( )
A.该实验用于探究压强对气体在水中溶解度的影响
B.图Ⅰ:用力向外拉动注射器,管中有许多小气泡出现
C.图Ⅱ:用力向里推注射器,压强增大,气体在水中的溶解度减小
D.该实验装置的优点是密封性好,压强较易改变
3.常温下,在两只各盛有100 mL水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,结果如图所示。下列说法正确的是( )
A.甲溶液是不饱和溶液
B.常温下,甲、乙两种物质的溶解度相同
C.升高温度,剩余的甲固体一定能继续溶解
D.乙溶液可能是饱和溶液,也可能是不饱和溶液
4.如图是A、B两种物质的溶解度曲线。在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅拌后都加热到t2 ℃。下列说法正确的是( )
A.t1℃时,A、B两物质的溶解度相等,两杯溶液均是不饱和溶液
B.t1℃时,A、B两物质的溶解度相等,A溶液为饱和溶液,B溶液为不饱和溶液
C.t2℃时,A的溶解度比B的溶解度大,两杯溶液均是不饱和溶液
D.t2℃时,A的溶解度比B的溶解度大,A溶液为不饱和溶液,B溶液为饱和溶液
5.(2011·益阳中考)NH4Cl的溶解度如下:
在20 ℃条件下,一种NH4Cl溶液甲,发生如下变化:
请回答:
(1)一定为饱和溶液是______溶液,不能确定为饱和溶液的是______溶液。
(2)要把40 ℃时的NH4Cl饱和溶液转化为不饱和溶液可采取的措施是______________________。
拓展创新
KNO3和KCl在不同温度时的溶解度如表所示。请回答下列问题:
(1)依据上表数据,绘制KNO3和KCl的溶解度曲线,右图中能表示KNO3溶解度曲线的是______。(填“m”或“n”)
(2)由表中数据分析可知, KNO3和KCl在某一温度时具有相同的溶解度x,则x的取值范围是______。
(3)10 ℃时,131 g 饱和KCl溶液中含KCl的质量为______。
答案解析
基础达标
1.【解析】选B。根据该物质的溶解度曲线,60 ℃时该物质的饱和溶液温度降低至30 ℃时,溶液仍为饱和溶液,并且30 ℃时该物质的溶解度是40 g,所以在60 ℃ 100 g水配制成该物质的饱和溶液降低至30 ℃时溶液的质量为100 g
+40 g=140 g。
2.【解析】选B。由于20 ℃时,10 g水中最多能溶解0.5 g该物质,则100 g水中最多能溶解5 g,即20 ℃时该物质的溶解度为5 g,介于1~10 g之间,故属可溶物质。
3.【解析】选B。对于溶解度随温度的升高而升高的物质,可采用降低温度的方法;对于溶解度随温度的升高而降低的物质,可采用升高温度的方法;将不饱和溶液倒出溶剂的同时,也将溶质倒出,剩余溶液仍不饱和。故选B。
4.【解析】选B。从题中所给信息可知,A物质的溶解度是随温度的升高而减小的,B物质的溶解度是随温度升高而增大的,故只有B项中图像符合题意。
5.【解析】选D。硝酸钾饱和溶液蒸发水再恢复至原温度时会析出晶体,故溶质、溶液、溶剂的质量均变小;由于温度不变,故硝酸钾的溶解度不变。
6.【解析】选D。W能溶解在水和乙醇中是正确的;由溶解度曲线图可判断t1 ℃时W在水中的溶解度是m g,B正确;t2 ℃时两曲线相交于一点,可知W在水中和在乙醇中溶解度相等,C正确;由t1 ℃升温至t2 ℃,W在水中的溶解度增加,饱和溶液会变成不饱和溶液,不会析出固体,所以D说法是不正确的。
7.【解析】(1)从表中的数据可以看出,硝酸钾的溶解度随着温度的升高而增大;(2)20 ℃时,硝酸钾的溶解度为31.6 g,说明10 g水中最多溶解3.16 g硝酸钾,将5 g KNO3晶体加入10 g水中,只溶解3.16 g,得到饱和溶液。升高到60 ℃,硝酸钾的溶解度变为110 g,10 g水中最多可溶解11 g硝酸钾,所以5 g KNO3会全部溶解在10 g水中,溶液中溶质和溶剂的质量比为5 g∶10 g=1:2。
答案:(1)随温度的升高而增大 (2)饱和 1∶2
8.【解析】(2)等质量的饱和溶液分别降温时,溶解度随温度降低而减小且受温度影响大的物质,析出的晶体多;(3)20 ℃时,A物质的溶解度是40 g,即
100 g水中最多能溶解40 g A物质,因此50 g水中最多能溶解20 g的A物质,所得溶液的质量是20 g+50 g=70 g。
答案:(1)A>B>C (2)A C (3)70
知能提升
1.【解析】选D。降低温度只能使溶解度随温度升高而变大的物质由不饱和溶液变为饱和溶液,A错;气体的溶解度是指在一定温度下和压强在101 kPa时,气体溶解在1体积水里达到饱和状态时的气体体积,其与温度和压强有关,但与水的用量无关,B错;对于不同溶质而言,饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液,溶液的浓稀与是否饱和没有必然联系,C错;汽油是常见的有机溶剂,油污能够溶于汽油而被除去,D正确。
2.【解析】选C。本题考查实验设计:压强对气体在水中溶解度的影响;向外拉动注射器时,其中的气体压强减小,CO2在水中的溶解度减小,部分CO2逸出;向里推动注射器时,其中的气体压强增大,CO2在水中的溶解度增大;只有实验装置的气密性好,压强才易改变,实验现象因此会较明显。
3.【解析】选D。相同温度下,相同质量的溶剂中加入相同质量的两种溶质,甲有固体剩余,乙无固体剩余,说明甲溶液已达饱和,两种物质的溶解度不同。乙溶液可能达饱和,也可能不饱和。升高温度,甲固体不一定能继续溶解,因为不知道温度会怎样影响甲的溶解度。
4.【解析】选D。由溶解度曲线图知,t1℃时,A、B两物质的溶解度相等,都是b克,因此在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅拌后,A溶液为不饱和溶液,B溶液刚好为饱和溶液;t2℃时,A物质的溶解度比B的溶解度大,而B物质的溶解度随温度升高而逐渐降低,因此,A、B两溶液升温到t2℃时,B溶液有晶体析出,仍是饱和溶液。
5.【解析】(1)溶液甲恒温蒸发10克水后,无晶体析出,那么得到的溶液乙有可能是饱和溶液也有可能是不饱和溶液,不能确定;但是可以确定溶液甲为不饱和溶液。溶液乙再恒温蒸发10克水后,有4克晶体析出,得到的溶液丙一定是饱和溶液。(2)因为氯化铵的溶解度随温度的升高而增大,因此将其饱和溶液转化为不饱和溶液,可以采用增加水或者升高温度的方法。
答案:(1)丙 乙 (2)增加水或升高温度
拓展创新
【解析】(1)由表中数据可以看出,KNO3和KCl中,KNO3的溶解度受温度的影响较大,所以,能表示KNO3溶解度曲线的是m;(2)在20~30 ℃之间,KNO3和KCl的溶解度可能相等;(3)10 ℃时,KCl的溶解度为31.0 g,说明100 g水中溶解31.0 g KCl达到饱和,所得饱和溶液的质量是131 g。
答案:(1)m (2)34.0 g
同课章节目录
