2022年人教版化学九年级(下)第九单元 溶液练习(word版 含答案)
文档属性
| 名称 | 2022年人教版化学九年级(下)第九单元 溶液练习(word版 含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 739.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-02 07:48:17 | ||
图片预览




文档简介
2022春人教化学九年级(下)第九单元 溶液练习含答案
一、选择题。
1、属于溶液的是( )
A.汽水 B.蒸馏水 C.牛奶 D.豆浆
2、下列关于溶液的说法正确的是( )
A.溶液具有均一性、稳定性
B.长期放置后不会分层的液体一定是溶液
C.溶质都是固体
D.医用酒精是乙醇溶液,乙醇作溶剂
3、0 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是 ( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.第一组所得溶液是不饱和溶液
4、推理是研究和学习化学的重要方法。以下说法正确的是( )
A.甲烷和乙醇的燃烧产物都是二氧化碳和水,则甲烷和乙醇都是由碳、氢两种元素组成的碳氢化合物
B.洗涤剂除去衣服上的油污是利用了乳化作用,则汽油除去衣服上的油污也是利用了乳化作用
C.二氧化碳使饱和石灰水变浑浊是化学变化,则升温使饱和石灰水变浑浊也是化学变化
D.元素的种类是由质子数决定的,则质子数相同的原子属于同种元素
5、下表是氯化钠和硝酸钾在不同温度时的溶解度。以下说法正确的是( )
温度/℃ 10 20 30 40 50 60
溶解度/g NaCl 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 20.9 31.6 45.8 63.9 85.5 110
A.20℃时将20g KNO3加入到50g水中,能得到70g溶液
B.KNO3的溶解度比NaCl的溶解度大
C.60℃时将210g KNO3饱和溶液降温至20℃,溶液质量变为131.6g
D.20℃时将40g NaCl加入到100g水中,再升温至60℃可形成不饱和溶液
6、如图所示,向小试管中分别加入一定量的下列物质,U形管内的液面几乎保持不变的是( )
A.氢氧化钠固体 B.氯化钠晶体 C.硝酸铵晶体 D.生石灰
7、闻名中外的青岛啤酒内溶有一定量的二氧化碳,打开瓶盖,你会发现啤酒会自动喷出,喝了啤酒后又会打嗝儿,这说明气体在水中的溶解度与压强和温度有关。下列说法正确的是( )
A.压强越小,气体的溶解度越大
B.压强越小,气体的溶解度越小
C.温度升高,气体的溶解度增大
D.温度降低,气体的溶解度减小
8、甲、乙两种物质的溶解度曲线如右图所示。下列叙述正确的是( )
A. t3℃时,将甲的饱和溶液变为不饱和溶液,可采取降温的方法
B. t2℃时,甲和乙的溶液各100 g,其溶质的质量一定相等
C. t1℃时,将甲、乙的饱和溶液各蒸发掉10g水,析出甲的质量大
D. 分别将100 g甲、乙的饱和溶液从t3℃降到t1℃,析出甲的质量大
9、进行“一定溶质质量分数的氯化钠溶液的配制”实验活动时常出现以下错误操作,其中不影响所配溶液浓度的是( )
10、将下列物质加入足量的水中,能形成无色透明溶液的是
( )
A.汽油 B.面粉 C.小苏打 D.硫酸铜
11、如图所示是甲、乙、丙三种固体物质的溶解度曲线。 下列说法正确的是( )
A.三种物质的溶解度都随温度的升高而增大
B.t2℃时,甲物质的溶解度是60g
C.将t2℃的甲、乙、丙三种物质的饱和溶液降温到t1℃,所得的溶液仍然是饱和溶液的是甲和乙
D.t1℃时,50g甲放入50g水中充分搅拌可得溶液100g
12、在反应A+3B═2C+3D中,已知A和B的相对分子质量之比为5:6,2.5g A与一定量的B恰好完全反应,生成3.5g D,则反应中B和C的质量比为( )
A. 2:1 B. 9:8 C. 3:2 D. 4:7
13、实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是( )
A.实验的步骤为计算、称取、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
二、填空题。
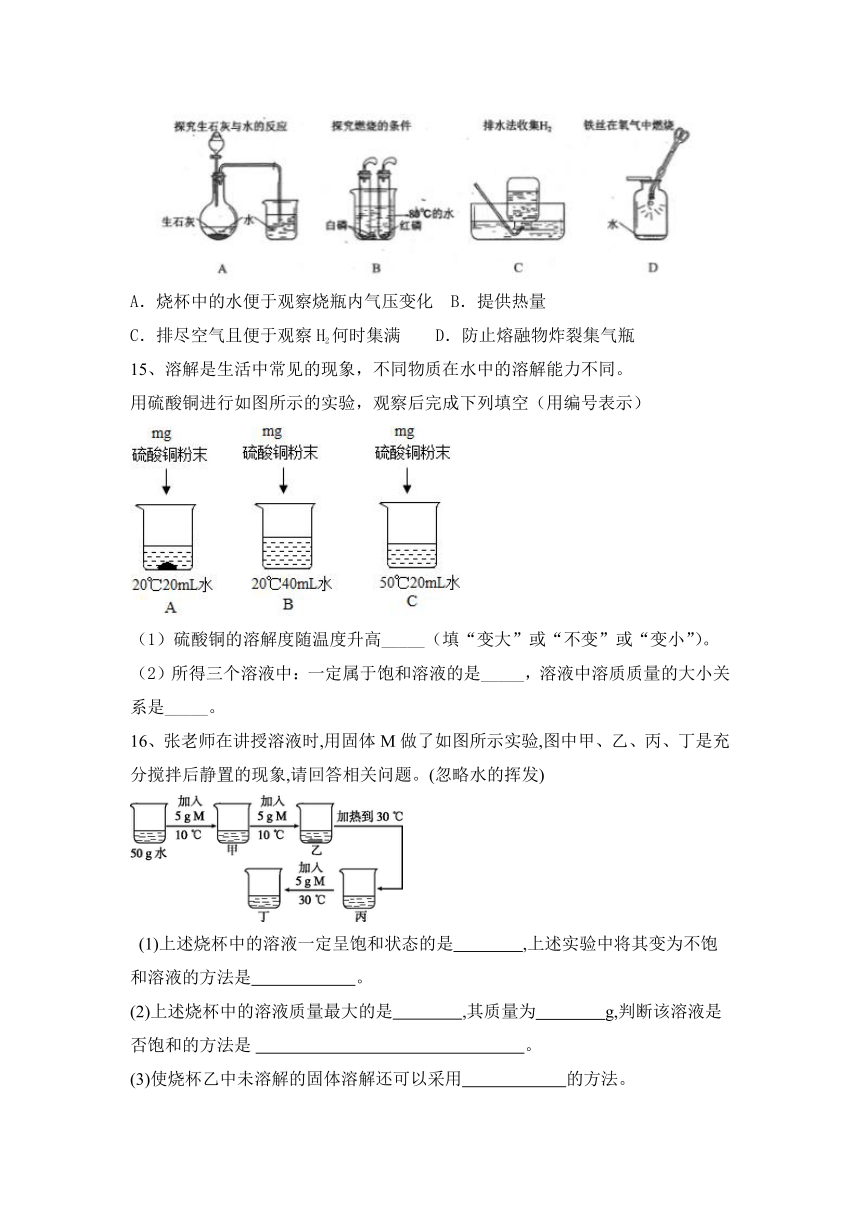
14、研究“水”可从其组成、结构、性质及用途等角度展开。
①水的组成
I.宏观现象:如图玻璃管a、b中产生气体的体积比约为_____,检验b中气体的现象是_____;
II.微观分析:该反应中发生分解的微粒名称是___________;
III.符号表达:电解水的化学方程式为___________________。
②水的性质
I.将少量淀粉加入水中,充分搅拌后可形成_______(填“溶液”、“悬浊液”、“乳浊液”);
II.沿海地区温差比内陆小的主要原因是___________。
③水的用途
I.碘与镁在常温下化合速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
II.下列实验中,对水的作用分析有错误的是_________(填字母)
A.烧杯中的水便于观察烧瓶内气压变化 B.提供热量
C.排尽空气且便于观察H2何时集满 D.防止熔融物炸裂集气瓶
15、溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
用硫酸铜进行如图所示的实验,观察后完成下列填空(用编号表示)
(1)硫酸铜的溶解度随温度升高_____(填“变大”或“不变”或“变小”)。
(2)所得三个溶液中:一定属于饱和溶液的是_____,溶液中溶质质量的大小关系是_____。
16、张老师在讲授溶液时,用固体M做了如图所示实验,图中甲、乙、丙、丁是充分搅拌后静置的现象,请回答相关问题。(忽略水的挥发)
(1)上述烧杯中的溶液一定呈饱和状态的是 ,上述实验中将其变为不饱和溶液的方法是 。
(2)上述烧杯中的溶液质量最大的是 ,其质量为 g,判断该溶液是否饱和的方法是 。
(3)使烧杯乙中未溶解的固体溶解还可以采用 的方法。
17、为从尿液中检验是否患有糖尿病,医院要配制8%的CuSO4溶液。现欲用16g无水CuSO4固体来配制溶液,可配制成8%的CuSO4溶液 g ,需水 mL (水的密度为1g/cm3)。
配制时需要用到的六种主要仪器的名称是:
、 、 、 、 、 。
18、向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤,如下图所示.
资料:A的溶解度如下表所示.
温度/℃ 20 30 40 50 60
溶解度/g 37.2 41.4 45.8 50.4 55.2
(1)溶液①~⑤中属于饱和溶液的是__________(填序号,以下同).
(2)溶质质量分数相等的溶液是__________.
(3)溶质质量分数最小的溶液是__________.
(4)有固体存在的溶液是__________.
19、如图所示是化学试剂瓶上的标签。取10 mL该硫酸可配制成9.8%的稀硫酸质量为_____g,配制9.8%的稀硫酸的操作___________; 如果量水时仰视刻度,其他操作都正确,则最后配制的溶液质量分数___9.8% (填“>”“<”或“=”)。
20、在日常生活和工农业生产中,溶液有着广泛应用,比如:氯碱工业用到的是饱和食盐水,医疗上使用的则是0.9%的生理盐水。请按照设计完成以下实验。
实验用品:氯化钠溶液、氯化钠、硝酸钾、蒸馏水、烧杯、试管、玻璃棒、药匙。
(1)探究实验一:澄清透明的氯化钠溶液是不是饱和溶液。
实验步骤 取一支试管,倒入约5 mL氯化钠溶液,用药匙加入少量氯化钠固体,振荡并观察现象
实验现象 氯化钠固体溶解
实验结论
(2)探究实验二:将不饱和氯化钠溶液变为饱和溶液。
实验步骤 实验现象 实验结论
氯化钠不饱和溶液变为饱和溶液
(3)探究实验三:探究氯化钠饱和溶液还能否溶解硝酸钾。
实验步骤 实验现象 实验结论
硝酸钾固体溶解
三、实验题。
21、某化学实验小组的同学要配制100g质量分数为10%的氯化钠溶液,下面是他们配制溶液的实验操作示意图:
(1)该实验正确的操作顺序为___________________。(填序号)
(2)同学们在称量氯化钠质量时,右盘未放纸片,则结果会导致所得溶液中溶质的质量分数 ________。(填“偏大”或“偏小”或“不变”)
(3)在用托盘天平称取氯化钠的过程中,发现指针偏向分度盘的右侧,同学们接下来的操作应该是________________________________。
(4)同学们量取水的体积如图2所示,则该小组同学实际量取水的体积为________mL(取整数).若其他的操作都正确,则结果配制的溶液的质量分数 _________(填“偏大”或“偏小”或“不变”)。
四、计算题。
22、课外活动小组的同学为确定某硫酸钠和氢氧化钠固体混合物中硫酸钠的含量,他们取10g该固体混合物与98g质量分数为10%的稀硫酸恰好完全反应。求:
(1)原混合物中硫酸钠的质量分数;
(2)反应后所得溶液中溶质的质量分数。
2022春人教化学九年级(下)第九单元 溶液练习含答案
一、选择题。
1、属于溶液的是( )
A.汽水 B.蒸馏水 C.牛奶 D.豆浆
【答案】A。
2、下列关于溶液的说法正确的是( )
A.溶液具有均一性、稳定性
B.长期放置后不会分层的液体一定是溶液
C.溶质都是固体
D.医用酒精是乙醇溶液,乙醇作溶剂
【答案】A
3、0 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是 ( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.第一组所得溶液是不饱和溶液
【答案】A
4、推理是研究和学习化学的重要方法。以下说法正确的是( )
A.甲烷和乙醇的燃烧产物都是二氧化碳和水,则甲烷和乙醇都是由碳、氢两种元素组成的碳氢化合物
B.洗涤剂除去衣服上的油污是利用了乳化作用,则汽油除去衣服上的油污也是利用了乳化作用
C.二氧化碳使饱和石灰水变浑浊是化学变化,则升温使饱和石灰水变浑浊也是化学变化
D.元素的种类是由质子数决定的,则质子数相同的原子属于同种元素
【答案】D
5、下表是氯化钠和硝酸钾在不同温度时的溶解度。以下说法正确的是( )
温度/℃ 10 20 30 40 50 60
溶解度/g NaCl 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 20.9 31.6 45.8 63.9 85.5 110
A.20℃时将20g KNO3加入到50g水中,能得到70g溶液
B.KNO3的溶解度比NaCl的溶解度大
C.60℃时将210g KNO3饱和溶液降温至20℃,溶液质量变为131.6g
D.20℃时将40g NaCl加入到100g水中,再升温至60℃可形成不饱和溶液
【答案】C
6、如图所示,向小试管中分别加入一定量的下列物质,U形管内的液面几乎保持不变的是( )
A.氢氧化钠固体 B.氯化钠晶体 C.硝酸铵晶体 D.生石灰
【答案】B
7、闻名中外的青岛啤酒内溶有一定量的二氧化碳,打开瓶盖,你会发现啤酒会自动喷出,喝了啤酒后又会打嗝儿,这说明气体在水中的溶解度与压强和温度有关。下列说法正确的是( )
A.压强越小,气体的溶解度越大
B.压强越小,气体的溶解度越小
C.温度升高,气体的溶解度增大
D.温度降低,气体的溶解度减小
【答案】B
8、甲、乙两种物质的溶解度曲线如右图所示。下列叙述正确的是( )
A. t3℃时,将甲的饱和溶液变为不饱和溶液,可采取降温的方法
B. t2℃时,甲和乙的溶液各100 g,其溶质的质量一定相等
C. t1℃时,将甲、乙的饱和溶液各蒸发掉10g水,析出甲的质量大
D. 分别将100 g甲、乙的饱和溶液从t3℃降到t1℃,析出甲的质量大
【答案】D
9、进行“一定溶质质量分数的氯化钠溶液的配制”实验活动时常出现以下错误操作,其中不影响所配溶液浓度的是( )
【答案】D
10、将下列物质加入足量的水中,能形成无色透明溶液的是
( )
A.汽油 B.面粉 C.小苏打 D.硫酸铜
【答案】C。
11、如图所示是甲、乙、丙三种固体物质的溶解度曲线。 下列说法正确的是( )
A.三种物质的溶解度都随温度的升高而增大
B.t2℃时,甲物质的溶解度是60g
C.将t2℃的甲、乙、丙三种物质的饱和溶液降温到t1℃,所得的溶液仍然是饱和溶液的是甲和乙
D.t1℃时,50g甲放入50g水中充分搅拌可得溶液100g
【答案】C
12、在反应A+3B═2C+3D中,已知A和B的相对分子质量之比为5:6,2.5g A与一定量的B恰好完全反应,生成3.5g D,则反应中B和C的质量比为( )
A. 2:1 B. 9:8 C. 3:2 D. 4:7
【答案】B
13、实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是( )
A.实验的步骤为计算、称取、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
【答案】C
二、填空题。
14、研究“水”可从其组成、结构、性质及用途等角度展开。
①水的组成
I.宏观现象:如图玻璃管a、b中产生气体的体积比约为_____,检验b中气体的现象是_____;
II.微观分析:该反应中发生分解的微粒名称是___________;
III.符号表达:电解水的化学方程式为___________________。
②水的性质
I.将少量淀粉加入水中,充分搅拌后可形成_______(填“溶液”、“悬浊液”、“乳浊液”);
II.沿海地区温差比内陆小的主要原因是___________。
③水的用途
I.碘与镁在常温下化合速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
II.下列实验中,对水的作用分析有错误的是_________(填字母)
A.烧杯中的水便于观察烧瓶内气压变化 B.提供热量
C.排尽空气且便于观察H2何时集满 D.防止熔融物炸裂集气瓶
【答案】2:1 打开活塞,带火星的木条靠近管口,木条复燃 水分子 2H2O2H2↑+ O2↑ 悬浊液 水的比热容大 加快化学反应速率 B
15、溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
用硫酸铜进行如图所示的实验,观察后完成下列填空(用编号表示)
(1)硫酸铜的溶解度随温度升高_____(填“变大”或“不变”或“变小”)。
(2)所得三个溶液中:一定属于饱和溶液的是_____,溶液中溶质质量的大小关系是_____。
【答案】变大 A B=C>A
16、张老师在讲授溶液时,用固体M做了如图所示实验,图中甲、乙、丙、丁是充分搅拌后静置的现象,请回答相关问题。(忽略水的挥发)
(1)上述烧杯中的溶液一定呈饱和状态的是 ,上述实验中将其变为不饱和溶液的方法是 。
(2)上述烧杯中的溶液质量最大的是 ,其质量为 g,判断该溶液是否饱和的方法是 。
(3)使烧杯乙中未溶解的固体溶解还可以采用 的方法。
【答案】(1)乙 升高温度
(2)丁 65 再加入少量固体M,观察能否继续溶解(合理即可)
(3)增加溶剂
17、为从尿液中检验是否患有糖尿病,医院要配制8%的CuSO4溶液。现欲用16g无水CuSO4固体来配制溶液,可配制成8%的CuSO4溶液 g ,需水 mL (水的密度为1g/cm3)。
配制时需要用到的六种主要仪器的名称是:
、 、 、 、 、 。
【答案】200 ; 184 。天平、量筒、烧杯、玻璃棒、滴管、药匙
18、向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤,如下图所示.
资料:A的溶解度如下表所示.
温度/℃ 20 30 40 50 60
溶解度/g 37.2 41.4 45.8 50.4 55.2
(1)溶液①~⑤中属于饱和溶液的是__________(填序号,以下同).
(2)溶质质量分数相等的溶液是__________.
(3)溶质质量分数最小的溶液是__________.
(4)有固体存在的溶液是__________.
【答案】②⑤ ④⑤ ① ②
19、如图所示是化学试剂瓶上的标签。取10 mL该硫酸可配制成9.8%的稀硫酸质量为_____g,配制9.8%的稀硫酸的操作___________; 如果量水时仰视刻度,其他操作都正确,则最后配制的溶液质量分数___9.8% (填“>”“<”或“=”)。
【答案】184;用量筒量取浓硫酸和水,把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌;<。
20、在日常生活和工农业生产中,溶液有着广泛应用,比如:氯碱工业用到的是饱和食盐水,医疗上使用的则是0.9%的生理盐水。请按照设计完成以下实验。
实验用品:氯化钠溶液、氯化钠、硝酸钾、蒸馏水、烧杯、试管、玻璃棒、药匙。
(1)探究实验一:澄清透明的氯化钠溶液是不是饱和溶液。
实验步骤 取一支试管,倒入约5 mL氯化钠溶液,用药匙加入少量氯化钠固体,振荡并观察现象
实验现象 氯化钠固体溶解
实验结论
(2)探究实验二:将不饱和氯化钠溶液变为饱和溶液。
实验步骤 实验现象 实验结论
氯化钠不饱和溶液变为饱和溶液
(3)探究实验三:探究氯化钠饱和溶液还能否溶解硝酸钾。
实验步骤 实验现象 实验结论
硝酸钾固体溶解
【答案】(1)该氯化钠溶液不是饱和溶液
(2)向不饱和的氯化钠溶液中不断加入氯化钠固体 开始时固体溶解,后不再溶解
(3)向饱和的氯化钠溶液中加入少量硝酸钾固体 氯化钠饱和溶液还能溶解硝酸钾固体
三、实验题。
21、某化学实验小组的同学要配制100g质量分数为10%的氯化钠溶液,下面是他们配制溶液的实验操作示意图:
(1)该实验正确的操作顺序为___________________。(填序号)
(2)同学们在称量氯化钠质量时,右盘未放纸片,则结果会导致所得溶液中溶质的质量分数 ________。(填“偏大”或“偏小”或“不变”)
(3)在用托盘天平称取氯化钠的过程中,发现指针偏向分度盘的右侧,同学们接下来的操作应该是________________________________。
(4)同学们量取水的体积如图2所示,则该小组同学实际量取水的体积为________mL(取整数).若其他的操作都正确,则结果配制的溶液的质量分数 _________(填“偏大”或“偏小”或“不变”)。
【答案】 ③②①⑤④ 偏小 继续添加氯化钠 92 偏小
四、计算题。
22、课外活动小组的同学为确定某硫酸钠和氢氧化钠固体混合物中硫酸钠的含量,他们取10g该固体混合物与98g质量分数为10%的稀硫酸恰好完全反应。求:
(1)原混合物中硫酸钠的质量分数;
(2)反应后所得溶液中溶质的质量分数。
【答案】(1)原混合物中硫酸钠的质量分数为20%
(2)反应后所得溶液中溶质的质量分数为15%
【解析】(1)设参加反应氢氧化钠质量为x,反应生成硫酸钠的质量为y
2NaOH+ H2SO4═ Na2SO4+2H2O
80 98 142
x 98g×10% y
x=8g y=14.2g
原混合物中硫酸钠的质量分数= ×100%=20%
答:原混合物中硫酸钠的质量分数为20%
(2)反应后所得溶液中溶质的质量=10g﹣8g+14.2g=16.2g,故反应后溶液的质量分数= ×100%=15%
答:反应后所得溶液中溶质的质量分数为15%
一、选择题。
1、属于溶液的是( )
A.汽水 B.蒸馏水 C.牛奶 D.豆浆
2、下列关于溶液的说法正确的是( )
A.溶液具有均一性、稳定性
B.长期放置后不会分层的液体一定是溶液
C.溶质都是固体
D.医用酒精是乙醇溶液,乙醇作溶剂
3、0 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是 ( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.第一组所得溶液是不饱和溶液
4、推理是研究和学习化学的重要方法。以下说法正确的是( )
A.甲烷和乙醇的燃烧产物都是二氧化碳和水,则甲烷和乙醇都是由碳、氢两种元素组成的碳氢化合物
B.洗涤剂除去衣服上的油污是利用了乳化作用,则汽油除去衣服上的油污也是利用了乳化作用
C.二氧化碳使饱和石灰水变浑浊是化学变化,则升温使饱和石灰水变浑浊也是化学变化
D.元素的种类是由质子数决定的,则质子数相同的原子属于同种元素
5、下表是氯化钠和硝酸钾在不同温度时的溶解度。以下说法正确的是( )
温度/℃ 10 20 30 40 50 60
溶解度/g NaCl 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 20.9 31.6 45.8 63.9 85.5 110
A.20℃时将20g KNO3加入到50g水中,能得到70g溶液
B.KNO3的溶解度比NaCl的溶解度大
C.60℃时将210g KNO3饱和溶液降温至20℃,溶液质量变为131.6g
D.20℃时将40g NaCl加入到100g水中,再升温至60℃可形成不饱和溶液
6、如图所示,向小试管中分别加入一定量的下列物质,U形管内的液面几乎保持不变的是( )
A.氢氧化钠固体 B.氯化钠晶体 C.硝酸铵晶体 D.生石灰
7、闻名中外的青岛啤酒内溶有一定量的二氧化碳,打开瓶盖,你会发现啤酒会自动喷出,喝了啤酒后又会打嗝儿,这说明气体在水中的溶解度与压强和温度有关。下列说法正确的是( )
A.压强越小,气体的溶解度越大
B.压强越小,气体的溶解度越小
C.温度升高,气体的溶解度增大
D.温度降低,气体的溶解度减小
8、甲、乙两种物质的溶解度曲线如右图所示。下列叙述正确的是( )
A. t3℃时,将甲的饱和溶液变为不饱和溶液,可采取降温的方法
B. t2℃时,甲和乙的溶液各100 g,其溶质的质量一定相等
C. t1℃时,将甲、乙的饱和溶液各蒸发掉10g水,析出甲的质量大
D. 分别将100 g甲、乙的饱和溶液从t3℃降到t1℃,析出甲的质量大
9、进行“一定溶质质量分数的氯化钠溶液的配制”实验活动时常出现以下错误操作,其中不影响所配溶液浓度的是( )
10、将下列物质加入足量的水中,能形成无色透明溶液的是
( )
A.汽油 B.面粉 C.小苏打 D.硫酸铜
11、如图所示是甲、乙、丙三种固体物质的溶解度曲线。 下列说法正确的是( )
A.三种物质的溶解度都随温度的升高而增大
B.t2℃时,甲物质的溶解度是60g
C.将t2℃的甲、乙、丙三种物质的饱和溶液降温到t1℃,所得的溶液仍然是饱和溶液的是甲和乙
D.t1℃时,50g甲放入50g水中充分搅拌可得溶液100g
12、在反应A+3B═2C+3D中,已知A和B的相对分子质量之比为5:6,2.5g A与一定量的B恰好完全反应,生成3.5g D,则反应中B和C的质量比为( )
A. 2:1 B. 9:8 C. 3:2 D. 4:7
13、实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是( )
A.实验的步骤为计算、称取、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
二、填空题。
14、研究“水”可从其组成、结构、性质及用途等角度展开。
①水的组成
I.宏观现象:如图玻璃管a、b中产生气体的体积比约为_____,检验b中气体的现象是_____;
II.微观分析:该反应中发生分解的微粒名称是___________;
III.符号表达:电解水的化学方程式为___________________。
②水的性质
I.将少量淀粉加入水中,充分搅拌后可形成_______(填“溶液”、“悬浊液”、“乳浊液”);
II.沿海地区温差比内陆小的主要原因是___________。
③水的用途
I.碘与镁在常温下化合速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
II.下列实验中,对水的作用分析有错误的是_________(填字母)
A.烧杯中的水便于观察烧瓶内气压变化 B.提供热量
C.排尽空气且便于观察H2何时集满 D.防止熔融物炸裂集气瓶
15、溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
用硫酸铜进行如图所示的实验,观察后完成下列填空(用编号表示)
(1)硫酸铜的溶解度随温度升高_____(填“变大”或“不变”或“变小”)。
(2)所得三个溶液中:一定属于饱和溶液的是_____,溶液中溶质质量的大小关系是_____。
16、张老师在讲授溶液时,用固体M做了如图所示实验,图中甲、乙、丙、丁是充分搅拌后静置的现象,请回答相关问题。(忽略水的挥发)
(1)上述烧杯中的溶液一定呈饱和状态的是 ,上述实验中将其变为不饱和溶液的方法是 。
(2)上述烧杯中的溶液质量最大的是 ,其质量为 g,判断该溶液是否饱和的方法是 。
(3)使烧杯乙中未溶解的固体溶解还可以采用 的方法。
17、为从尿液中检验是否患有糖尿病,医院要配制8%的CuSO4溶液。现欲用16g无水CuSO4固体来配制溶液,可配制成8%的CuSO4溶液 g ,需水 mL (水的密度为1g/cm3)。
配制时需要用到的六种主要仪器的名称是:
、 、 、 、 、 。
18、向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤,如下图所示.
资料:A的溶解度如下表所示.
温度/℃ 20 30 40 50 60
溶解度/g 37.2 41.4 45.8 50.4 55.2
(1)溶液①~⑤中属于饱和溶液的是__________(填序号,以下同).
(2)溶质质量分数相等的溶液是__________.
(3)溶质质量分数最小的溶液是__________.
(4)有固体存在的溶液是__________.
19、如图所示是化学试剂瓶上的标签。取10 mL该硫酸可配制成9.8%的稀硫酸质量为_____g,配制9.8%的稀硫酸的操作___________; 如果量水时仰视刻度,其他操作都正确,则最后配制的溶液质量分数___9.8% (填“>”“<”或“=”)。
20、在日常生活和工农业生产中,溶液有着广泛应用,比如:氯碱工业用到的是饱和食盐水,医疗上使用的则是0.9%的生理盐水。请按照设计完成以下实验。
实验用品:氯化钠溶液、氯化钠、硝酸钾、蒸馏水、烧杯、试管、玻璃棒、药匙。
(1)探究实验一:澄清透明的氯化钠溶液是不是饱和溶液。
实验步骤 取一支试管,倒入约5 mL氯化钠溶液,用药匙加入少量氯化钠固体,振荡并观察现象
实验现象 氯化钠固体溶解
实验结论
(2)探究实验二:将不饱和氯化钠溶液变为饱和溶液。
实验步骤 实验现象 实验结论
氯化钠不饱和溶液变为饱和溶液
(3)探究实验三:探究氯化钠饱和溶液还能否溶解硝酸钾。
实验步骤 实验现象 实验结论
硝酸钾固体溶解
三、实验题。
21、某化学实验小组的同学要配制100g质量分数为10%的氯化钠溶液,下面是他们配制溶液的实验操作示意图:
(1)该实验正确的操作顺序为___________________。(填序号)
(2)同学们在称量氯化钠质量时,右盘未放纸片,则结果会导致所得溶液中溶质的质量分数 ________。(填“偏大”或“偏小”或“不变”)
(3)在用托盘天平称取氯化钠的过程中,发现指针偏向分度盘的右侧,同学们接下来的操作应该是________________________________。
(4)同学们量取水的体积如图2所示,则该小组同学实际量取水的体积为________mL(取整数).若其他的操作都正确,则结果配制的溶液的质量分数 _________(填“偏大”或“偏小”或“不变”)。
四、计算题。
22、课外活动小组的同学为确定某硫酸钠和氢氧化钠固体混合物中硫酸钠的含量,他们取10g该固体混合物与98g质量分数为10%的稀硫酸恰好完全反应。求:
(1)原混合物中硫酸钠的质量分数;
(2)反应后所得溶液中溶质的质量分数。
2022春人教化学九年级(下)第九单元 溶液练习含答案
一、选择题。
1、属于溶液的是( )
A.汽水 B.蒸馏水 C.牛奶 D.豆浆
【答案】A。
2、下列关于溶液的说法正确的是( )
A.溶液具有均一性、稳定性
B.长期放置后不会分层的液体一定是溶液
C.溶质都是固体
D.医用酒精是乙醇溶液,乙醇作溶剂
【答案】A
3、0 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是 ( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.第一组所得溶液是不饱和溶液
【答案】A
4、推理是研究和学习化学的重要方法。以下说法正确的是( )
A.甲烷和乙醇的燃烧产物都是二氧化碳和水,则甲烷和乙醇都是由碳、氢两种元素组成的碳氢化合物
B.洗涤剂除去衣服上的油污是利用了乳化作用,则汽油除去衣服上的油污也是利用了乳化作用
C.二氧化碳使饱和石灰水变浑浊是化学变化,则升温使饱和石灰水变浑浊也是化学变化
D.元素的种类是由质子数决定的,则质子数相同的原子属于同种元素
【答案】D
5、下表是氯化钠和硝酸钾在不同温度时的溶解度。以下说法正确的是( )
温度/℃ 10 20 30 40 50 60
溶解度/g NaCl 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 20.9 31.6 45.8 63.9 85.5 110
A.20℃时将20g KNO3加入到50g水中,能得到70g溶液
B.KNO3的溶解度比NaCl的溶解度大
C.60℃时将210g KNO3饱和溶液降温至20℃,溶液质量变为131.6g
D.20℃时将40g NaCl加入到100g水中,再升温至60℃可形成不饱和溶液
【答案】C
6、如图所示,向小试管中分别加入一定量的下列物质,U形管内的液面几乎保持不变的是( )
A.氢氧化钠固体 B.氯化钠晶体 C.硝酸铵晶体 D.生石灰
【答案】B
7、闻名中外的青岛啤酒内溶有一定量的二氧化碳,打开瓶盖,你会发现啤酒会自动喷出,喝了啤酒后又会打嗝儿,这说明气体在水中的溶解度与压强和温度有关。下列说法正确的是( )
A.压强越小,气体的溶解度越大
B.压强越小,气体的溶解度越小
C.温度升高,气体的溶解度增大
D.温度降低,气体的溶解度减小
【答案】B
8、甲、乙两种物质的溶解度曲线如右图所示。下列叙述正确的是( )
A. t3℃时,将甲的饱和溶液变为不饱和溶液,可采取降温的方法
B. t2℃时,甲和乙的溶液各100 g,其溶质的质量一定相等
C. t1℃时,将甲、乙的饱和溶液各蒸发掉10g水,析出甲的质量大
D. 分别将100 g甲、乙的饱和溶液从t3℃降到t1℃,析出甲的质量大
【答案】D
9、进行“一定溶质质量分数的氯化钠溶液的配制”实验活动时常出现以下错误操作,其中不影响所配溶液浓度的是( )
【答案】D
10、将下列物质加入足量的水中,能形成无色透明溶液的是
( )
A.汽油 B.面粉 C.小苏打 D.硫酸铜
【答案】C。
11、如图所示是甲、乙、丙三种固体物质的溶解度曲线。 下列说法正确的是( )
A.三种物质的溶解度都随温度的升高而增大
B.t2℃时,甲物质的溶解度是60g
C.将t2℃的甲、乙、丙三种物质的饱和溶液降温到t1℃,所得的溶液仍然是饱和溶液的是甲和乙
D.t1℃时,50g甲放入50g水中充分搅拌可得溶液100g
【答案】C
12、在反应A+3B═2C+3D中,已知A和B的相对分子质量之比为5:6,2.5g A与一定量的B恰好完全反应,生成3.5g D,则反应中B和C的质量比为( )
A. 2:1 B. 9:8 C. 3:2 D. 4:7
【答案】B
13、实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是( )
A.实验的步骤为计算、称取、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
【答案】C
二、填空题。
14、研究“水”可从其组成、结构、性质及用途等角度展开。
①水的组成
I.宏观现象:如图玻璃管a、b中产生气体的体积比约为_____,检验b中气体的现象是_____;
II.微观分析:该反应中发生分解的微粒名称是___________;
III.符号表达:电解水的化学方程式为___________________。
②水的性质
I.将少量淀粉加入水中,充分搅拌后可形成_______(填“溶液”、“悬浊液”、“乳浊液”);
II.沿海地区温差比内陆小的主要原因是___________。
③水的用途
I.碘与镁在常温下化合速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
II.下列实验中,对水的作用分析有错误的是_________(填字母)
A.烧杯中的水便于观察烧瓶内气压变化 B.提供热量
C.排尽空气且便于观察H2何时集满 D.防止熔融物炸裂集气瓶
【答案】2:1 打开活塞,带火星的木条靠近管口,木条复燃 水分子 2H2O2H2↑+ O2↑ 悬浊液 水的比热容大 加快化学反应速率 B
15、溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
用硫酸铜进行如图所示的实验,观察后完成下列填空(用编号表示)
(1)硫酸铜的溶解度随温度升高_____(填“变大”或“不变”或“变小”)。
(2)所得三个溶液中:一定属于饱和溶液的是_____,溶液中溶质质量的大小关系是_____。
【答案】变大 A B=C>A
16、张老师在讲授溶液时,用固体M做了如图所示实验,图中甲、乙、丙、丁是充分搅拌后静置的现象,请回答相关问题。(忽略水的挥发)
(1)上述烧杯中的溶液一定呈饱和状态的是 ,上述实验中将其变为不饱和溶液的方法是 。
(2)上述烧杯中的溶液质量最大的是 ,其质量为 g,判断该溶液是否饱和的方法是 。
(3)使烧杯乙中未溶解的固体溶解还可以采用 的方法。
【答案】(1)乙 升高温度
(2)丁 65 再加入少量固体M,观察能否继续溶解(合理即可)
(3)增加溶剂
17、为从尿液中检验是否患有糖尿病,医院要配制8%的CuSO4溶液。现欲用16g无水CuSO4固体来配制溶液,可配制成8%的CuSO4溶液 g ,需水 mL (水的密度为1g/cm3)。
配制时需要用到的六种主要仪器的名称是:
、 、 、 、 、 。
【答案】200 ; 184 。天平、量筒、烧杯、玻璃棒、滴管、药匙
18、向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤,如下图所示.
资料:A的溶解度如下表所示.
温度/℃ 20 30 40 50 60
溶解度/g 37.2 41.4 45.8 50.4 55.2
(1)溶液①~⑤中属于饱和溶液的是__________(填序号,以下同).
(2)溶质质量分数相等的溶液是__________.
(3)溶质质量分数最小的溶液是__________.
(4)有固体存在的溶液是__________.
【答案】②⑤ ④⑤ ① ②
19、如图所示是化学试剂瓶上的标签。取10 mL该硫酸可配制成9.8%的稀硫酸质量为_____g,配制9.8%的稀硫酸的操作___________; 如果量水时仰视刻度,其他操作都正确,则最后配制的溶液质量分数___9.8% (填“>”“<”或“=”)。
【答案】184;用量筒量取浓硫酸和水,把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌;<。
20、在日常生活和工农业生产中,溶液有着广泛应用,比如:氯碱工业用到的是饱和食盐水,医疗上使用的则是0.9%的生理盐水。请按照设计完成以下实验。
实验用品:氯化钠溶液、氯化钠、硝酸钾、蒸馏水、烧杯、试管、玻璃棒、药匙。
(1)探究实验一:澄清透明的氯化钠溶液是不是饱和溶液。
实验步骤 取一支试管,倒入约5 mL氯化钠溶液,用药匙加入少量氯化钠固体,振荡并观察现象
实验现象 氯化钠固体溶解
实验结论
(2)探究实验二:将不饱和氯化钠溶液变为饱和溶液。
实验步骤 实验现象 实验结论
氯化钠不饱和溶液变为饱和溶液
(3)探究实验三:探究氯化钠饱和溶液还能否溶解硝酸钾。
实验步骤 实验现象 实验结论
硝酸钾固体溶解
【答案】(1)该氯化钠溶液不是饱和溶液
(2)向不饱和的氯化钠溶液中不断加入氯化钠固体 开始时固体溶解,后不再溶解
(3)向饱和的氯化钠溶液中加入少量硝酸钾固体 氯化钠饱和溶液还能溶解硝酸钾固体
三、实验题。
21、某化学实验小组的同学要配制100g质量分数为10%的氯化钠溶液,下面是他们配制溶液的实验操作示意图:
(1)该实验正确的操作顺序为___________________。(填序号)
(2)同学们在称量氯化钠质量时,右盘未放纸片,则结果会导致所得溶液中溶质的质量分数 ________。(填“偏大”或“偏小”或“不变”)
(3)在用托盘天平称取氯化钠的过程中,发现指针偏向分度盘的右侧,同学们接下来的操作应该是________________________________。
(4)同学们量取水的体积如图2所示,则该小组同学实际量取水的体积为________mL(取整数).若其他的操作都正确,则结果配制的溶液的质量分数 _________(填“偏大”或“偏小”或“不变”)。
【答案】 ③②①⑤④ 偏小 继续添加氯化钠 92 偏小
四、计算题。
22、课外活动小组的同学为确定某硫酸钠和氢氧化钠固体混合物中硫酸钠的含量,他们取10g该固体混合物与98g质量分数为10%的稀硫酸恰好完全反应。求:
(1)原混合物中硫酸钠的质量分数;
(2)反应后所得溶液中溶质的质量分数。
【答案】(1)原混合物中硫酸钠的质量分数为20%
(2)反应后所得溶液中溶质的质量分数为15%
【解析】(1)设参加反应氢氧化钠质量为x,反应生成硫酸钠的质量为y
2NaOH+ H2SO4═ Na2SO4+2H2O
80 98 142
x 98g×10% y
x=8g y=14.2g
原混合物中硫酸钠的质量分数= ×100%=20%
答:原混合物中硫酸钠的质量分数为20%
(2)反应后所得溶液中溶质的质量=10g﹣8g+14.2g=16.2g,故反应后溶液的质量分数= ×100%=15%
答:反应后所得溶液中溶质的质量分数为15%
同课章节目录
