高中化学>>新课标人教版>>必修2>>第一章 物质结构 元素周期律>>第二节 元素周期律
文档属性
| 名称 | 高中化学>>新课标人教版>>必修2>>第一章 物质结构 元素周期律>>第二节 元素周期律 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-03-19 20:50:52 | ||
图片预览



文档简介
课件31张PPT。第二节 元素周期律第一课时
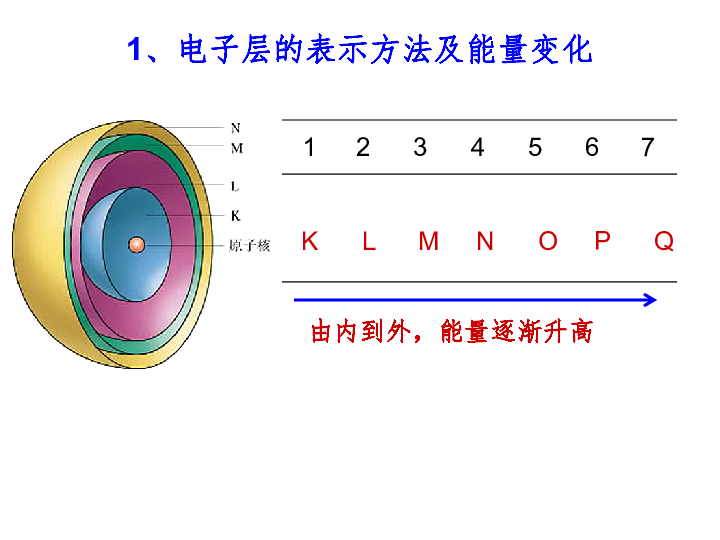
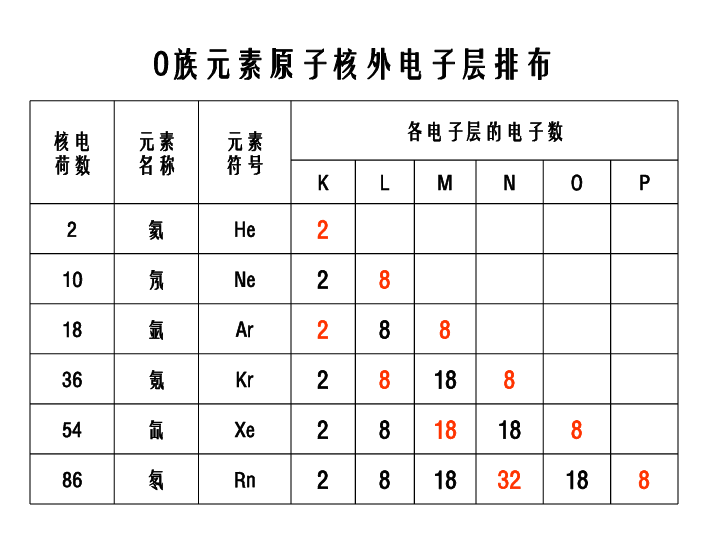
原子核外电子的排布1、电子层的表示方法及能量变化K L M N O P Q由内到外,能量逐渐升高总结出原子核外电子排布规律阅读课本P13 表1-22、原子核外电子的排布规律
(1) 电子总是尽量先排布在能量_______的电子层里,然后由里向外,依次排布在能量逐步_______的电子层
(2)各电子层最多能容纳_______个电子(n为电子层数)。
(3)最外层电子数不超过_____个(当K层为最外层时不超过____个)。
(4)次外层电子数不超过18个,倒数第三层不超过32个
最低2n282升高 以上各项是相互联系的,不能孤立地理解应用其中的某一部分。3、核外电子排布的表示方法
—原子结构示意图法原子核→核内质子数→K层→L层→ 结构示意图是用小圆圈和圆圈内的符号及数字表示原子核及质子数,弧线表示电子层,弧线上的数字表示该电子层上的电子数。K
层
上
的
电
子
数
↓
L
层
上
的
电
子
数
↓
(1)原子中无中子的原子:
(2)最外层有1个电子的元素:
(3)最外层有2个电子的元素:
(4)最外层等于次外层电子数的元素:
(5 )最外层电子数是次外层电子数2倍的元素:
(6)最外层电子数是次外层电子数3倍的元素:
(7)最外层电子数是次外层电子数4倍的元素:
※(8)氩原子电子层结构相同的阳离子是:
与氩原子电子层结构相同的阴离子是:
(9)核外有10个电子的粒子:
分子:
阳离子:
阴离子:
H、Li、Na、KHe、Be Mg、CaBe、ArCONeK+;Ca2+S2- ;Cl-
CH4;NH3;H2O;HF;NeNH4+; H3O+;Na+;Mg2+;Al3+
O2-;F-;OH-分组讨论:总结1至20号原子结构的特殊性小结1、原子核外电子的排布规律
2、原子核外电子排布的表示方法
原子结构示意图
3、熟记1-20号元素的原子结构示意图作业布置将同步学案检测评价
做到作业纸上元素周期律
第二课时
探究元素的原子结构和主要化合价及原子半径 的变化规律探究一完成课本P14表格
填写1-18号元素的元素符号与原子结构示意图 (一)同周期元素从左到右元素原子的最外层电子排布的变化规律是什么?
探究思考?元素核外电子排布情况123882周期性 (二)同周期元素从左到右元素原子半径变化规律是什么?
探究思考元素原子半径数据LiBeBCONFNeNaMgAlSiSPClAr逐渐减小逐渐减小周期性 规律:
同周期从左到右,原子半径逐渐减小(稀有气体元素除外)
同主族从上到下,原子半径逐渐增大。一些元素原子半径规律性变化示意图 越大越小越大⑵电子层数相同时,再看核电荷数,
核电荷数越多,则半径⑶电子层数和核电荷数都相同
(同种元素)时,再看核外电子数
(或最外层电子数),核外电子数
(或最外层电子数越多),
则半径微粒半径大小比较规律⑴最外层电子数相同时看电子层数,电子层数越多,
则半径一般情况下(稀有气体除外):如 Li Na K Rb CsI Br Cl F<<<<>>>>如 Na Mg Al >F O N C <<<如 Cl Cl- < (三)同周期元素从左到右元素化合价的变化规律是什么?
探究思考观察3~9、11~17号元素的最高正化合价与最低化合价。 每隔一定数目,元素的最高正价重复出现由+1到+7递增,最低负价由-4到-1递增的变化。(稀有气体元素除外) 观察与思考:化合价的递变规律结论3:随着核电荷数的递增,元素的主要化合价呈周
期性变化。元素化合价与最外层电子排布的关系 观察元素最高正价、最低负价与元素原子的核外电子排布的联系? 金属元素和非金属元素化合价的特点?总结 ①主族元素最高正价 =原子最外层电子数=主族序数
②非金属最高正价 + ︱最低负价︳ = 81
2
3大→小+1 →0+1→ +5
- 4→ - 1→ 0随着原子序数的递增,元素原子的电子层排布、原子半径、化合价呈现周期性变化。核外电子排布、原子半径和元素化合价的变化大→小+1→ +7
- 4→ - 1→ 0结论金属性:元素原子失电子的能力(还原能力)非金属性:元素原子得电子的能力(氧化能力)元素的金属性、非金属性是否也呈现周期性变化?注意:金属性(非金属性)的强弱只与原子失(得)电子的能力大小有关,与失(得)电子的多少无关。想一想:同周期元素金属性、非金属性
的变化规律探究二探究活动一 Na、Mg、Al金属性强弱比较
探究活动二 Si、P、S、Cl非金属性强弱的比较
总结 同周期元素性质的递变规律同周期元素随着原子序数的递增,
元素的金属性逐渐减弱,非金属性逐渐增强为什么?原子半径 核电荷数原子失电子能力逐渐 得电子能力逐渐同周期元素 从左到右原子核对最外层电子的吸引力减小
增大增强减弱增强元素周期律元素的性质随着原子序数的递增而呈现周期性的变化(1)内容:(2)实质:元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果。随着原子序数的递增
1、元素原子的最外层电子排布呈现周期性的变化
2、元素的主要化合价呈现周期性的变化
3、元素的原子半径呈现周期性的变化
4、元素的金属性、非金属性呈现周期性的变化课堂小结元素周期律内容实质 作业布置同步学案P13
检测评价10--12题做到作业纸上
原子核外电子的排布1、电子层的表示方法及能量变化K L M N O P Q由内到外,能量逐渐升高总结出原子核外电子排布规律阅读课本P13 表1-22、原子核外电子的排布规律
(1) 电子总是尽量先排布在能量_______的电子层里,然后由里向外,依次排布在能量逐步_______的电子层
(2)各电子层最多能容纳_______个电子(n为电子层数)。
(3)最外层电子数不超过_____个(当K层为最外层时不超过____个)。
(4)次外层电子数不超过18个,倒数第三层不超过32个
最低2n282升高 以上各项是相互联系的,不能孤立地理解应用其中的某一部分。3、核外电子排布的表示方法
—原子结构示意图法原子核→核内质子数→K层→L层→ 结构示意图是用小圆圈和圆圈内的符号及数字表示原子核及质子数,弧线表示电子层,弧线上的数字表示该电子层上的电子数。K
层
上
的
电
子
数
↓
L
层
上
的
电
子
数
↓
(1)原子中无中子的原子:
(2)最外层有1个电子的元素:
(3)最外层有2个电子的元素:
(4)最外层等于次外层电子数的元素:
(5 )最外层电子数是次外层电子数2倍的元素:
(6)最外层电子数是次外层电子数3倍的元素:
(7)最外层电子数是次外层电子数4倍的元素:
※(8)氩原子电子层结构相同的阳离子是:
与氩原子电子层结构相同的阴离子是:
(9)核外有10个电子的粒子:
分子:
阳离子:
阴离子:
H、Li、Na、KHe、Be Mg、CaBe、ArCONeK+;Ca2+S2- ;Cl-
CH4;NH3;H2O;HF;NeNH4+; H3O+;Na+;Mg2+;Al3+
O2-;F-;OH-分组讨论:总结1至20号原子结构的特殊性小结1、原子核外电子的排布规律
2、原子核外电子排布的表示方法
原子结构示意图
3、熟记1-20号元素的原子结构示意图作业布置将同步学案检测评价
做到作业纸上元素周期律
第二课时
探究元素的原子结构和主要化合价及原子半径 的变化规律探究一完成课本P14表格
填写1-18号元素的元素符号与原子结构示意图 (一)同周期元素从左到右元素原子的最外层电子排布的变化规律是什么?
探究思考?元素核外电子排布情况123882周期性 (二)同周期元素从左到右元素原子半径变化规律是什么?
探究思考元素原子半径数据LiBeBCONFNeNaMgAlSiSPClAr逐渐减小逐渐减小周期性 规律:
同周期从左到右,原子半径逐渐减小(稀有气体元素除外)
同主族从上到下,原子半径逐渐增大。一些元素原子半径规律性变化示意图 越大越小越大⑵电子层数相同时,再看核电荷数,
核电荷数越多,则半径⑶电子层数和核电荷数都相同
(同种元素)时,再看核外电子数
(或最外层电子数),核外电子数
(或最外层电子数越多),
则半径微粒半径大小比较规律⑴最外层电子数相同时看电子层数,电子层数越多,
则半径一般情况下(稀有气体除外):如 Li Na K Rb CsI Br Cl F<<<<>>>>如 Na Mg Al >F O N C <<<如 Cl Cl- < (三)同周期元素从左到右元素化合价的变化规律是什么?
探究思考观察3~9、11~17号元素的最高正化合价与最低化合价。 每隔一定数目,元素的最高正价重复出现由+1到+7递增,最低负价由-4到-1递增的变化。(稀有气体元素除外) 观察与思考:化合价的递变规律结论3:随着核电荷数的递增,元素的主要化合价呈周
期性变化。元素化合价与最外层电子排布的关系 观察元素最高正价、最低负价与元素原子的核外电子排布的联系? 金属元素和非金属元素化合价的特点?总结 ①主族元素最高正价 =原子最外层电子数=主族序数
②非金属最高正价 + ︱最低负价︳ = 81
2
3大→小+1 →0+1→ +5
- 4→ - 1→ 0随着原子序数的递增,元素原子的电子层排布、原子半径、化合价呈现周期性变化。核外电子排布、原子半径和元素化合价的变化大→小+1→ +7
- 4→ - 1→ 0结论金属性:元素原子失电子的能力(还原能力)非金属性:元素原子得电子的能力(氧化能力)元素的金属性、非金属性是否也呈现周期性变化?注意:金属性(非金属性)的强弱只与原子失(得)电子的能力大小有关,与失(得)电子的多少无关。想一想:同周期元素金属性、非金属性
的变化规律探究二探究活动一 Na、Mg、Al金属性强弱比较
探究活动二 Si、P、S、Cl非金属性强弱的比较
总结 同周期元素性质的递变规律同周期元素随着原子序数的递增,
元素的金属性逐渐减弱,非金属性逐渐增强为什么?原子半径 核电荷数原子失电子能力逐渐 得电子能力逐渐同周期元素 从左到右原子核对最外层电子的吸引力减小
增大增强减弱增强元素周期律元素的性质随着原子序数的递增而呈现周期性的变化(1)内容:(2)实质:元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果。随着原子序数的递增
1、元素原子的最外层电子排布呈现周期性的变化
2、元素的主要化合价呈现周期性的变化
3、元素的原子半径呈现周期性的变化
4、元素的金属性、非金属性呈现周期性的变化课堂小结元素周期律内容实质 作业布置同步学案P13
检测评价10--12题做到作业纸上
