4.2氧气(第1课时氧气的制取)课件-八年级化学鲁教版(五四学制)全一册(19张PPT)
文档属性
| 名称 | 4.2氧气(第1课时氧气的制取)课件-八年级化学鲁教版(五四学制)全一册(19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-03 08:31:07 | ||
图片预览






文档简介
(共19张PPT)
4.2氧气
第1课时 氧气的制取
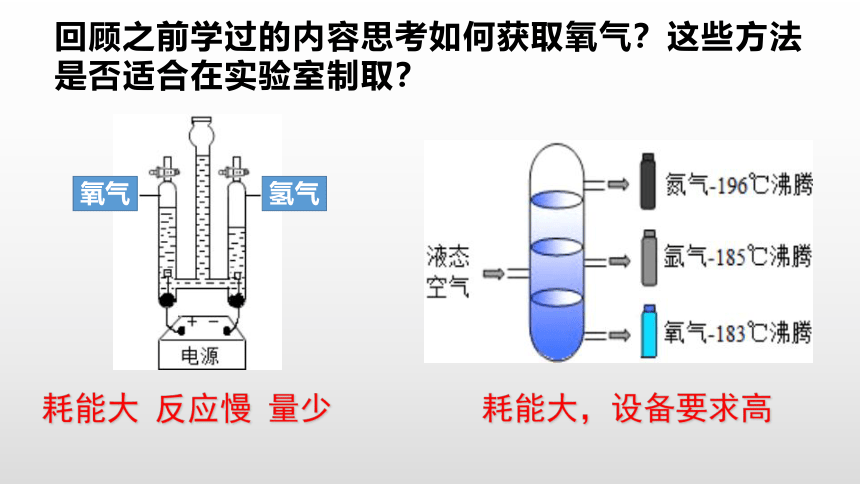
回顾之前学过的内容思考如何获取氧气?这些方法是否适合在实验室制取?
氢气
氧气
耗能大 反应慢 量少
耗能大,设备要求高
01
实验室制取气体
的思路分析
学习目标:学会实验室制取气体的一般思路和方法。
氯化钠
(NaCl)
高锰酸钾
(KMnO4)
过氧化氢
(H2O2)
甲烷
(CH4)
氯酸钾
(KClO3)
原料中必须含有所需的氧元素
制取氧气,药品中必须含有氧元素
O
O
O
√
√
√
×
×
自主学习:阅读课本P85 活动天地4-2,思考并回答课本上的三个问题,限时2分钟。
气体发生装置的选择:
选择发生装置的依据:反应物状态与反应条件
反应物状态
反应条件
固态
液态+固态
加热
不加热
排水集气法
排空气集气法
①
②
气体收集装置的选择:
不易溶于水
且不与水反应
密度比空气大
密度比空气小
向上排空气法
向下排空气法
气体的密度与溶解性
反应原理
发生和收集装置
实验步骤
环保安全
反应物:必须含有氧元素
原料易得,条件易控制,装置易装配,操作安全,节能环保
发生装置:由反应物的状态及反应条件决定
收集装置:由气体的密度及溶解性决定
“绿色化学”,建设资源节约型、环境友好型社会
制取气体思路分析
注意事项、检验与验满
02
实验室制取氧气
学习目标:掌握实验室制取氧气的方法;
练习使用坐庄法,学会倾听与赞美。
根据提示信息,选择适合实验室制取氧气的药品及发生装置、收集装置,并说明理由
氧气不易溶于水、不与水反应、密度比空气大
气体
气体
小组讨论:坐庄法3min
合作要求:
1.由组长坐庄,庄主邀请组员发言,并对每一个成员的发言进行赞美,不发言的同学认真倾听。
2.C在听取了所有成员的意见后,然后进行汇总。
3.随机提问进行展示。
反应物
反应条件
√
反应原理
表达式:过氧化氢(H2O2) 水(H2O)+氧气(O2)
二氧化锰
自主学习课本P86 催化剂
“一变”:只改变化学反应速率;
“两不变”:催化剂本身的质量和化学性质在化学反应前后都不变。
催化作用:催化剂在化学反应中所起的作用叫催化作用。
发生装置
固液不加热型
收集装置
排水法或
向上排空气法
反应物状态:液态(固态催化剂)
反应条件: 不加热
气体性质: 氧气不易溶于水且不与水反应,
且氧气密度大于空气
发生和
收集装置
检验装置气密性
装入药品
打开分液漏斗的活塞,观察现象
收集气体
5
4
3
2
1
组装实验仪器
有气泡的产生
锥形瓶、分液漏斗、
双孔橡皮塞、导管、
集气瓶、弹簧夹、橡胶管
先固后液
排水法/
向上排空气法
实验步骤
检验与验满
检验方法:将带火星的木条伸入集气瓶中,如果木条复燃,证明
该气体是氧气。
检满方法:①排水法:当集气瓶口处有大气泡冒出时,证明已集满。
②向上排空气法:将带火星的木条放在集气瓶口,如果木条复燃,
证明已集满。
注意事项
通过分液漏斗加入过氧化氢:便于控制反应速率;节约药品
①用排水法收集:要等看到气泡连续、均匀冒出后再收集。
②用向上排空气法收集:导气管应伸到集气瓶底部,以便排净集气瓶内的空气。
氧气的密度大于空气(32>29),所以瓶口盖上玻璃片应正放在桌面上
课堂小结
当堂检测
完成学案当堂检测
作业
必做:同步84页课时1
选做:查阅资料,学习如何用高锰酸钾制取氧气
4.2氧气
第1课时 氧气的制取
回顾之前学过的内容思考如何获取氧气?这些方法是否适合在实验室制取?
氢气
氧气
耗能大 反应慢 量少
耗能大,设备要求高
01
实验室制取气体
的思路分析
学习目标:学会实验室制取气体的一般思路和方法。
氯化钠
(NaCl)
高锰酸钾
(KMnO4)
过氧化氢
(H2O2)
甲烷
(CH4)
氯酸钾
(KClO3)
原料中必须含有所需的氧元素
制取氧气,药品中必须含有氧元素
O
O
O
√
√
√
×
×
自主学习:阅读课本P85 活动天地4-2,思考并回答课本上的三个问题,限时2分钟。
气体发生装置的选择:
选择发生装置的依据:反应物状态与反应条件
反应物状态
反应条件
固态
液态+固态
加热
不加热
排水集气法
排空气集气法
①
②
气体收集装置的选择:
不易溶于水
且不与水反应
密度比空气大
密度比空气小
向上排空气法
向下排空气法
气体的密度与溶解性
反应原理
发生和收集装置
实验步骤
环保安全
反应物:必须含有氧元素
原料易得,条件易控制,装置易装配,操作安全,节能环保
发生装置:由反应物的状态及反应条件决定
收集装置:由气体的密度及溶解性决定
“绿色化学”,建设资源节约型、环境友好型社会
制取气体思路分析
注意事项、检验与验满
02
实验室制取氧气
学习目标:掌握实验室制取氧气的方法;
练习使用坐庄法,学会倾听与赞美。
根据提示信息,选择适合实验室制取氧气的药品及发生装置、收集装置,并说明理由
氧气不易溶于水、不与水反应、密度比空气大
气体
气体
小组讨论:坐庄法3min
合作要求:
1.由组长坐庄,庄主邀请组员发言,并对每一个成员的发言进行赞美,不发言的同学认真倾听。
2.C在听取了所有成员的意见后,然后进行汇总。
3.随机提问进行展示。
反应物
反应条件
√
反应原理
表达式:过氧化氢(H2O2) 水(H2O)+氧气(O2)
二氧化锰
自主学习课本P86 催化剂
“一变”:只改变化学反应速率;
“两不变”:催化剂本身的质量和化学性质在化学反应前后都不变。
催化作用:催化剂在化学反应中所起的作用叫催化作用。
发生装置
固液不加热型
收集装置
排水法或
向上排空气法
反应物状态:液态(固态催化剂)
反应条件: 不加热
气体性质: 氧气不易溶于水且不与水反应,
且氧气密度大于空气
发生和
收集装置
检验装置气密性
装入药品
打开分液漏斗的活塞,观察现象
收集气体
5
4
3
2
1
组装实验仪器
有气泡的产生
锥形瓶、分液漏斗、
双孔橡皮塞、导管、
集气瓶、弹簧夹、橡胶管
先固后液
排水法/
向上排空气法
实验步骤
检验与验满
检验方法:将带火星的木条伸入集气瓶中,如果木条复燃,证明
该气体是氧气。
检满方法:①排水法:当集气瓶口处有大气泡冒出时,证明已集满。
②向上排空气法:将带火星的木条放在集气瓶口,如果木条复燃,
证明已集满。
注意事项
通过分液漏斗加入过氧化氢:便于控制反应速率;节约药品
①用排水法收集:要等看到气泡连续、均匀冒出后再收集。
②用向上排空气法收集:导气管应伸到集气瓶底部,以便排净集气瓶内的空气。
氧气的密度大于空气(32>29),所以瓶口盖上玻璃片应正放在桌面上
课堂小结
当堂检测
完成学案当堂检测
作业
必做:同步84页课时1
选做:查阅资料,学习如何用高锰酸钾制取氧气
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
