《化学反应的方向》示范课课件
图片预览





文档简介
(共26张PPT)
设计实验:如何由NaOH溶液制备NaCl溶液
化学反应的方向
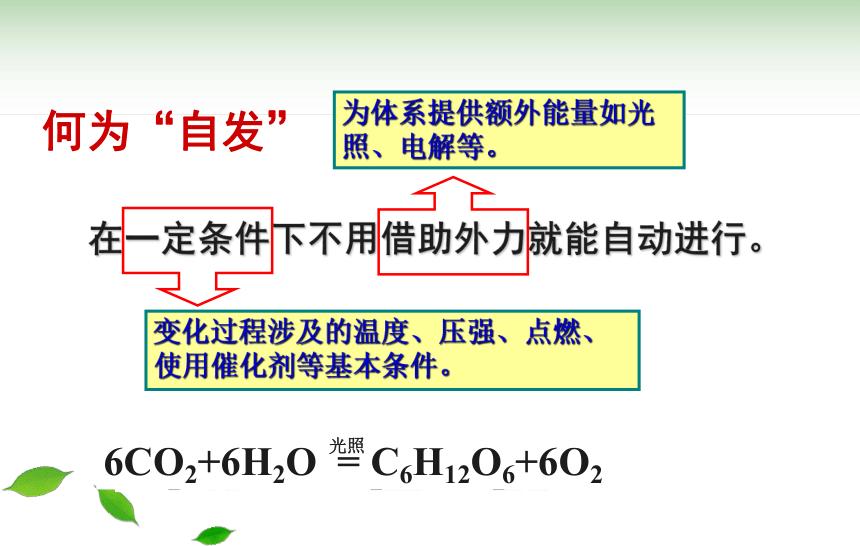
何为“自发”
在一定条件下不用借助外力就能自动进行。
变化过程涉及的温度、压强、点燃、
使用催化剂等基本条件。
为体系提供额外能量如光照、电解等。
6CO2+6H2O = C6H12O6+6O2
光照
水从高处流向低处
热由高温物体传向低温物体
自发过程的趋势:
体系趋于从高能状态转化为低能状态(能量越低越稳定)
放热反应在一定条件下可以自发,那么吸热反应可以自发吗?
请说说下列反应属于吸热还是放热反应?
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)
铁生锈:2Fe(s)+3/2O2(g)= Fe2O3(s)
△H<0
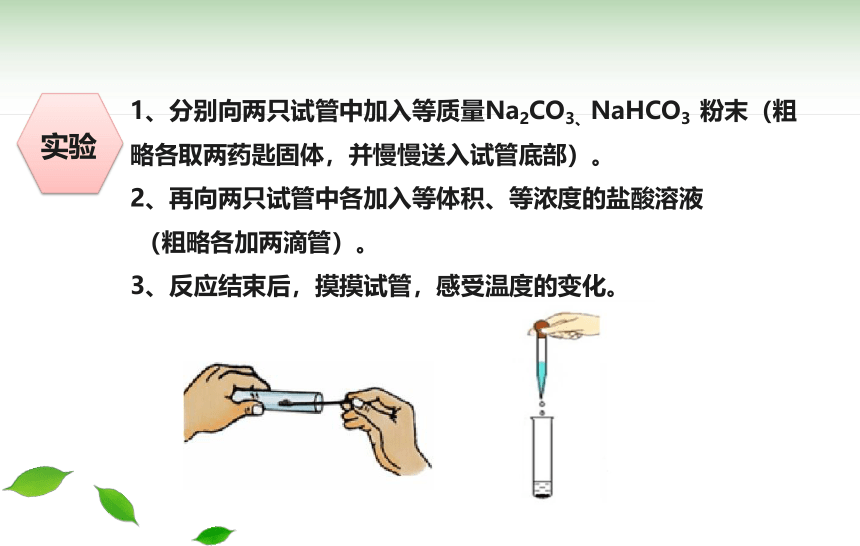
实验
1、分别向两只试管中加入等质量Na2CO3、NaHCO3 粉末(粗略各取两药匙固体,并慢慢送入试管底部)。
2、再向两只试管中各加入等体积、等浓度的盐酸溶液
(粗略各加两滴管)。
3、反应结束后,摸摸试管,感受温度的变化。
能量
反应过程
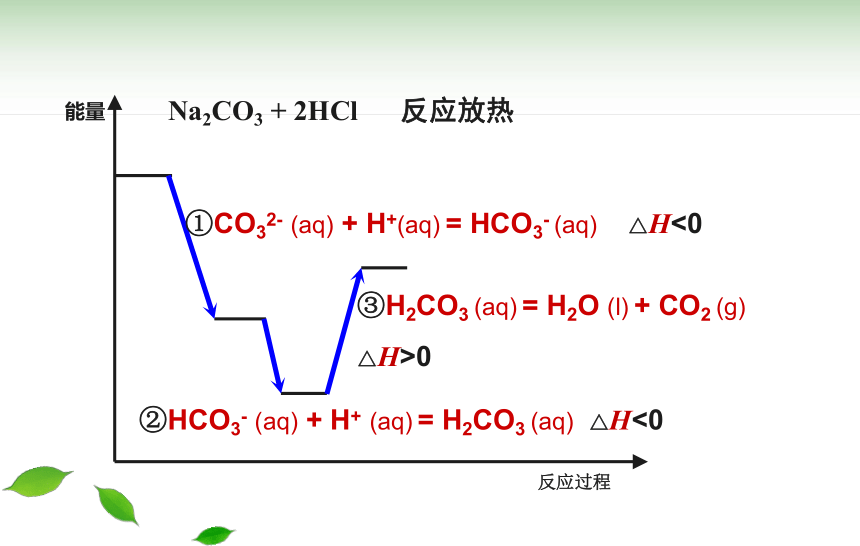
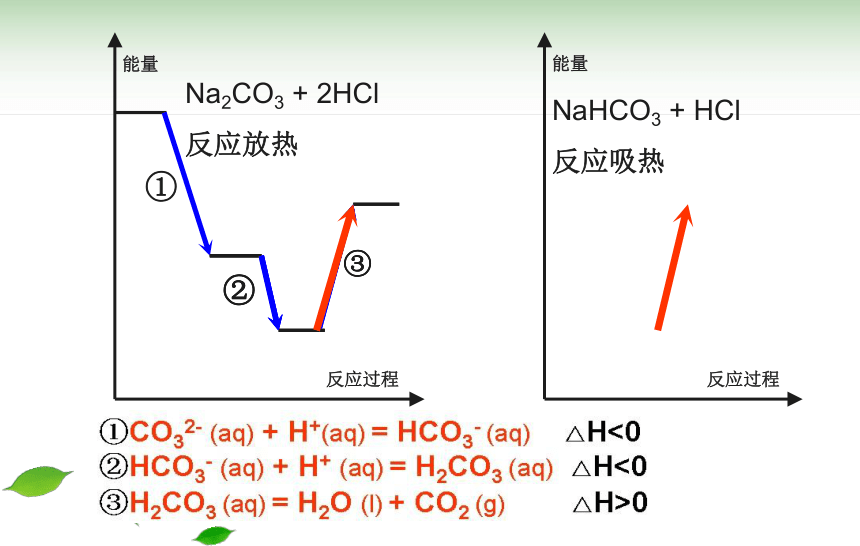
Na2CO3 + 2HCl 反应放热
①CO32- (aq) + H+(aq) = HCO3- (aq) △H<0
②HCO3- (aq) + H+ (aq) = H2CO3 (aq) △H<0
③H2CO3 (aq) = H2O (l) + CO2 (g)
△H>0
NaHCO3 + HCl
反应吸热
反应过程
能量
②
③
能量
反应过程
Na2CO3 + 2HCl
反应放热
①
②
③
自发过程的两大变化趋势
(1)趋于从高能转化为低能。
(2)趋于从有序到无序。
实验:向氢氧化钠溶液中滴加酚酞
熵是所有
科学定律
的第一定律
二:熵判据
1.熵是体系混乱度的量度,即熵是用来描述体系的混乱度。
符号用S表示,单位: J mol-1 K-1 。
2.化学反应趋向于熵增加的过程,即△S>0的反应是自发的。
…………
体系熵值变化的规律
(1)根据状态 S(s)(2)化学反应中,生成物中气体分子数越多,熵值越大
CO2 + C === 2CO
高温
解释NaHCO3+HCl这个吸热反应能自发进行的原因
Na + KCl = NaCl + K
Na (l) + KCl (l) = NaCl (l) + K (g)
熵拉动的自发反应实例1
已知:KCl 的熔点773℃,氯化钠的熔点804℃
熵增无力
熵增有力
SiO2 (s)+ C(s) Si(s) + CO2(g) △H > 0
熵拉动的自发反应实例2
一定温度、压强下,熵增反应能自发进行,那么熵减的反应
能自发进行吗?
Ag+(aq)+Cl-(aq)=AgCl(s)
2H2(g)+O2(g)= 2H2O(l)
1. Mg(s) + 2HCl(aq) = MgCl2(aq) + H2(g) △H <0
2. CO2(g)+H2O(l)+CaCl2(l)=CaCO3(s)+2HCl(l) △H >0
3. NH3(g)+HCl(g)=NH4Cl(s) △H <0
4. NH4Cl(s)=NH3(g)+HCl(g) △H >0
△S>0
一定自发
△S<0
一定不自发
△S<0
低温下自发
△S>0
高温下自发
判断下列反应的熵值变化:
体系自由能变化△G
(单位KJ/mol)
恒温恒压下,反应的自发性不仅
与焓变、熵变有关,
还与温度有关(常为正值) 。
当△G<0时反应能自发进行
恒温恒压 △G = △H-T△S < 0反应自发进行
类型 △H △S 反应的自发性
1 <0 >0
2 >0 <0
3 <0 <0
4 >0 >0
一定自发
一定不自发
低温下自发
高温下自发
启示:
1、揭示了化学反应分类的新视角
2、从定性到定量角度认识化学反应的自发性
应用
1.理解反应 设计反应
汽车尾气中的主要污染物是NO和CO,它们是现代化城市中的
大气污染物。为了减轻大气污染,人们提出通过以下反应来处理
汽车尾气: 2NO(g)+2CO(g)=N2(g)+2CO2(g)
已知:298K ,100kPa下,ΔH=-746.8KJ·mol -1
ΔS=-197.5J·mol-1·K-1
判断该反应可能自发进行吗?
过程的自发性只能用于判断过程的方向,不能确定过程一定会发生和过程发生的速率。
金红石(主要成分TiO2) 钛棒
TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) △H>0 △S<0
2C(石墨)+O2(g)=2CO(g) △H<0 △S>0
TiO2(s)+2Cl2(g) + 2C(石墨) =TiCl4(l)+2CO(g) △H<0 △S>0
2.工业上“改造”反应
焓判据
熵判据
复合判据
△G = △H-T△S < 0
判断自发
理解反应
设计反应
小 结:
利用“熵增原理”思考:
为了做到“绿色化学”和“零污染”排放,环境是先污染后治理,还是从源头开始控制污染?
薛定谔 著
诺贝尔物理学奖获得者,量子力学之父,提出“生命以负熵为生”等观点。
设计实验:如何由NaOH溶液制备NaCl溶液
化学反应的方向
何为“自发”
在一定条件下不用借助外力就能自动进行。
变化过程涉及的温度、压强、点燃、
使用催化剂等基本条件。
为体系提供额外能量如光照、电解等。
6CO2+6H2O = C6H12O6+6O2
光照
水从高处流向低处
热由高温物体传向低温物体
自发过程的趋势:
体系趋于从高能状态转化为低能状态(能量越低越稳定)
放热反应在一定条件下可以自发,那么吸热反应可以自发吗?
请说说下列反应属于吸热还是放热反应?
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)
铁生锈:2Fe(s)+3/2O2(g)= Fe2O3(s)
△H<0
实验
1、分别向两只试管中加入等质量Na2CO3、NaHCO3 粉末(粗略各取两药匙固体,并慢慢送入试管底部)。
2、再向两只试管中各加入等体积、等浓度的盐酸溶液
(粗略各加两滴管)。
3、反应结束后,摸摸试管,感受温度的变化。
能量
反应过程
Na2CO3 + 2HCl 反应放热
①CO32- (aq) + H+(aq) = HCO3- (aq) △H<0
②HCO3- (aq) + H+ (aq) = H2CO3 (aq) △H<0
③H2CO3 (aq) = H2O (l) + CO2 (g)
△H>0
NaHCO3 + HCl
反应吸热
反应过程
能量
②
③
能量
反应过程
Na2CO3 + 2HCl
反应放热
①
②
③
自发过程的两大变化趋势
(1)趋于从高能转化为低能。
(2)趋于从有序到无序。
实验:向氢氧化钠溶液中滴加酚酞
熵是所有
科学定律
的第一定律
二:熵判据
1.熵是体系混乱度的量度,即熵是用来描述体系的混乱度。
符号用S表示,单位: J mol-1 K-1 。
2.化学反应趋向于熵增加的过程,即△S>0的反应是自发的。
…………
体系熵值变化的规律
(1)根据状态 S(s)
CO2 + C === 2CO
高温
解释NaHCO3+HCl这个吸热反应能自发进行的原因
Na + KCl = NaCl + K
Na (l) + KCl (l) = NaCl (l) + K (g)
熵拉动的自发反应实例1
已知:KCl 的熔点773℃,氯化钠的熔点804℃
熵增无力
熵增有力
SiO2 (s)+ C(s) Si(s) + CO2(g) △H > 0
熵拉动的自发反应实例2
一定温度、压强下,熵增反应能自发进行,那么熵减的反应
能自发进行吗?
Ag+(aq)+Cl-(aq)=AgCl(s)
2H2(g)+O2(g)= 2H2O(l)
1. Mg(s) + 2HCl(aq) = MgCl2(aq) + H2(g) △H <0
2. CO2(g)+H2O(l)+CaCl2(l)=CaCO3(s)+2HCl(l) △H >0
3. NH3(g)+HCl(g)=NH4Cl(s) △H <0
4. NH4Cl(s)=NH3(g)+HCl(g) △H >0
△S>0
一定自发
△S<0
一定不自发
△S<0
低温下自发
△S>0
高温下自发
判断下列反应的熵值变化:
体系自由能变化△G
(单位KJ/mol)
恒温恒压下,反应的自发性不仅
与焓变、熵变有关,
还与温度有关(常为正值) 。
当△G<0时反应能自发进行
恒温恒压 △G = △H-T△S < 0反应自发进行
类型 △H △S 反应的自发性
1 <0 >0
2 >0 <0
3 <0 <0
4 >0 >0
一定自发
一定不自发
低温下自发
高温下自发
启示:
1、揭示了化学反应分类的新视角
2、从定性到定量角度认识化学反应的自发性
应用
1.理解反应 设计反应
汽车尾气中的主要污染物是NO和CO,它们是现代化城市中的
大气污染物。为了减轻大气污染,人们提出通过以下反应来处理
汽车尾气: 2NO(g)+2CO(g)=N2(g)+2CO2(g)
已知:298K ,100kPa下,ΔH=-746.8KJ·mol -1
ΔS=-197.5J·mol-1·K-1
判断该反应可能自发进行吗?
过程的自发性只能用于判断过程的方向,不能确定过程一定会发生和过程发生的速率。
金红石(主要成分TiO2) 钛棒
TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) △H>0 △S<0
2C(石墨)+O2(g)=2CO(g) △H<0 △S>0
TiO2(s)+2Cl2(g) + 2C(石墨) =TiCl4(l)+2CO(g) △H<0 △S>0
2.工业上“改造”反应
焓判据
熵判据
复合判据
△G = △H-T△S < 0
判断自发
理解反应
设计反应
小 结:
利用“熵增原理”思考:
为了做到“绿色化学”和“零污染”排放,环境是先污染后治理,还是从源头开始控制污染?
薛定谔 著
诺贝尔物理学奖获得者,量子力学之父,提出“生命以负熵为生”等观点。
