《化学反应的方向》公开课课件
文档属性
| 名称 | 《化学反应的方向》公开课课件 |  | |
| 格式 | zip | ||
| 文件大小 | 1015.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-05 17:56:01 | ||
图片预览








文档简介
(共32张PPT)
化学反应的方向
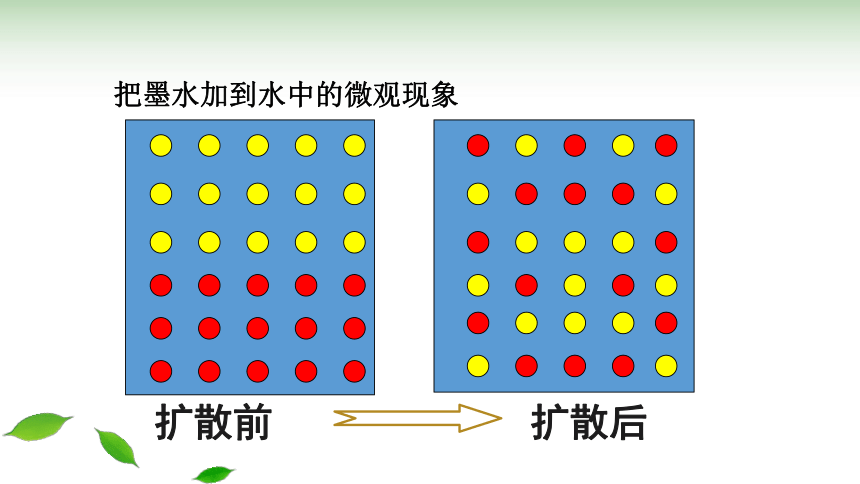
1.把墨水加到水中,看看发生了什么变化?
科学实验一
墨水自动地扩散到水中使溶液变得均匀
一、自发过程
自发过程:在一定的温度和压强下,
不借助外力作用就能自动进行的过程。
扩散前
扩散后
把墨水加到水中的微观现象
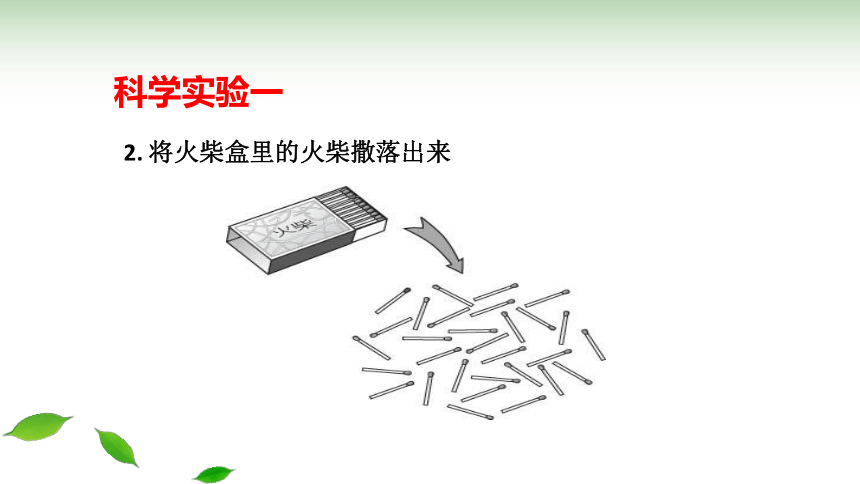
2. 将火柴盒里的火柴撒落出来
科学实验一
2.将火柴盒里的火柴撒落出来
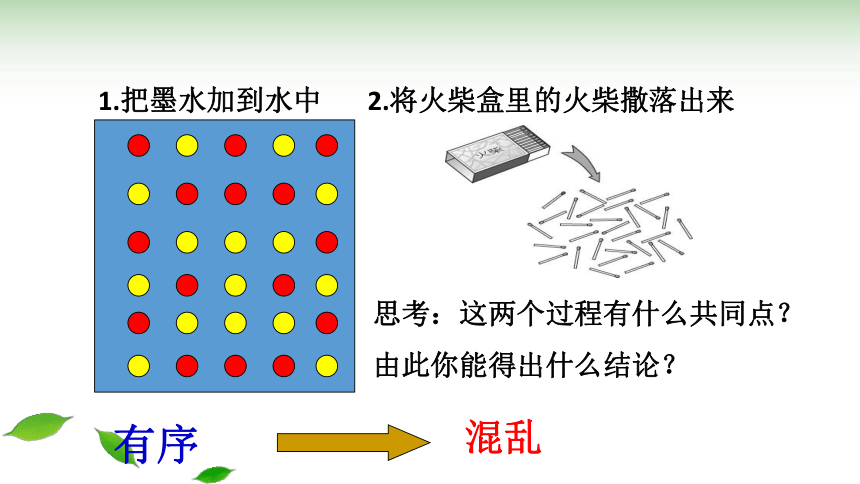
思考:这两个过程有什么共同点?
由此你能得出什么结论?
有序
混乱
1.把墨水加到水中
二、熵判据
影响能否自发进行的因素:体系的混乱度。
1、熵(S)——描述体系混乱度的物理量
2、熵判据:体系趋向于由有序状态转变为无序状态,即混乱度增加( △S>0),且△S越大,越有利于反应自发进行。
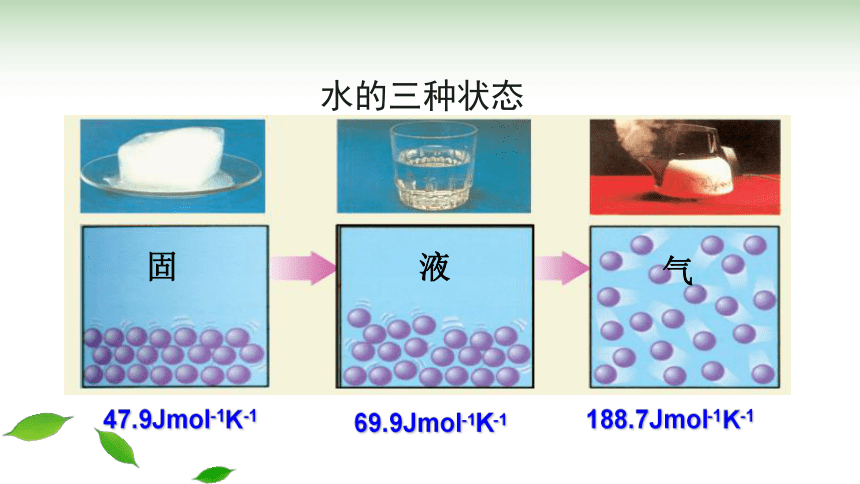
水的三种状态
气
液
固
69.9Jmol-1K-1
47.9Jmol-1K-1
188.7Jmol-1K-1
熵增的主要因素
1、同一物质的熵值大小:
S(气) S(液) S(固)
3 、固体的溶解、 墨水在水中的扩散和气体的扩散过程都是混乱度 的过程
2、产生气体的反应和气体的物质的量增加的反应都是体系熵值 的反应。
>
>
增加( △ S>0)
增加( △ S>0)
思考与交流一
(一)自发反应一定需要△S>0 吗?
自发反应一定是熵增加的反应吗?
3Cl2(g)+8NH3(g)===N2(g)+6NH4Cl(s)
△S<0
Cl2与NH3反应
结论:△S > 0有利于反应自发进行, 自发反应不一定需要△S > 0。
熵变是判断反应能否自发进行的一个影响因素,但不是唯一因素。
以下化学反应能自发进行吗?
2H2(g)+O2(g)= 2H2O(l) △H=-572kJ/mol
2Na(s)+2H2O(l)=2NaOH(aq)+H2(g) △H=-368kJ/mol
2Fe(s)+3/2O2(g)= Fe2O3(s) △H=-824kJ/mol
NaOH(aq)+HCl(aq)=NaCl(aq)+ H2O(l) △H=-56kJ/mol
从能量角度分析自发反应有何共同特点?
三、焓判据
焓判据(能量判据):
体系趋向于从高能状态转变为低能状态(△H<0)。
思考与交流二
(一)为什么绝大多数自发反应会朝着放热的方向进行?
(二)自发反应一定需要△H<0 吗?
能量越低越稳定
2NH4Cl(s)+Ba(OH)2·8 H2O(s)
=NH3(g)+BaCl2(s)+10H2O(l)
△H ﹥ 0 吸热反应
Ba(OH)2·8H2O(s)与NH4Cl(s)的反应。
科学实验二
△H < 0有利于反应自发进行,但自发反应不一定需要△H < 0。
焓变是判断反应能否自发进行的另一个因素,但也不是唯一因素。
【结论】
四、复合判据——自由能变化
△G=△H-T△S (kJ/mol)
△ G<0,反应可自发进行
△ G=0,反应到达平衡状态
△ G>0,反应不能自发进行
(G是自由能,T是热力学温度,恒为正值)
△ H △ S △G 反应的自发性
< 0 > 0
> 0 < 0
< 0 < 0
> 0 > 0
△G=△H-T △S(T恒为正值)
?
?
< 0 任何温度自发
> 0 任何温度都不自发
△ H △ S △G 反应的自发性
< 0 > 0
> 0 < 0
< 0 < 0
> 0 > 0
△G=△H-T △S(T恒为正值)
< 0 任何温度自发
> 0 任何温度都不自发
高温 >0
低温 <0
高温 <0
低温 >0
高温自发
低温自发
C(石墨) === C(金刚石)
已知:在298K、101KPa下,该反应的
△ H = +1.895 kJ/mol, △ S= -3.363J/(mol·K)。
△G=△H-T△S>0,不能自发。
石墨可以变成金刚石?
不能自发的反应就一定不能进行吗?
石墨可以变成金刚石?
反应的自发性只能用于判断反应的方向,不能确定反应是否一定会发生。
石墨在5-6万大气压及摄氏1000至2000度高温下,再用金属铁、钴、镍等做催化剂,可使石墨转变成金刚石。
游戏模式:以小组为单位参与,分数累计,得分最高组颁发奖品!
游戏一规则:
1.由“幸运转转盘”随机决定哪个小组先答,发言人做答,一旦答题不能更改,答题时间为20秒。
2.答对每题10分,答错或超时扣10分。
3.答对后可以继续答题(最多答两题),答错或超时终止答题,终止答题后要指定下一题由哪个小组答题。
1. 下列说法正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.反应速率快的一定是自发进行的
C.自发反应在恰当条件下才能实现
D.非自发反应在任何条件下都不能实现
C
2、下列过程是非自发的是∶( )
A、水由高处向低处流; B、天然气的燃烧;
C、铁在潮湿空气中生锈; D、室温下水结成冰。
D
3、25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ/mol,自发进行的原因是∶( )
A、是吸热反应; B、是放热反应;
C、是熵减少的反应;D、熵增大效应大于能量效应。
D
4. 下列反应中,熵减小的是( )
A. (NH4 )2CO3(s)=NH4HCO3(s)+NH3(g)
B. 2N2O5(g)=4NO2(g)+O2(g)
C. MgCO3(s)=MgO(s)+CO2(g)
D. 2CO(g)=2C(s)+O2(g)
D
5. 已知反应2C(g)====A(g)+2B(g) H<0,下列说法正确的是( )
A. 仅常温下反应可以自发进行
B. 仅高温下反应可以自发进行
C. 任何温度下反应均可以自发进行
D. 任何温度下反应均难以自发进行
C
颁奖典礼
总结与收获分享
课外讨论
汽车尾气的主要污染物是一氧化氮以及燃烧不完全所产生的一氧化碳,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,有人提出通过
2NO(g) + 2CO(g) === N2(g) + 2CO2(g) 来处理汽车尾气。你们能否判断这一方案在常温常压下是否可行?理论依据是什么?
已知室温(298K、101KPa)下:
△H = - 113.0 KJ·mol-1
△S = -143.5 J·mol-1·K-1
谢谢各位专家评委!
化学反应的方向
1.把墨水加到水中,看看发生了什么变化?
科学实验一
墨水自动地扩散到水中使溶液变得均匀
一、自发过程
自发过程:在一定的温度和压强下,
不借助外力作用就能自动进行的过程。
扩散前
扩散后
把墨水加到水中的微观现象
2. 将火柴盒里的火柴撒落出来
科学实验一
2.将火柴盒里的火柴撒落出来
思考:这两个过程有什么共同点?
由此你能得出什么结论?
有序
混乱
1.把墨水加到水中
二、熵判据
影响能否自发进行的因素:体系的混乱度。
1、熵(S)——描述体系混乱度的物理量
2、熵判据:体系趋向于由有序状态转变为无序状态,即混乱度增加( △S>0),且△S越大,越有利于反应自发进行。
水的三种状态
气
液
固
69.9Jmol-1K-1
47.9Jmol-1K-1
188.7Jmol-1K-1
熵增的主要因素
1、同一物质的熵值大小:
S(气) S(液) S(固)
3 、固体的溶解、 墨水在水中的扩散和气体的扩散过程都是混乱度 的过程
2、产生气体的反应和气体的物质的量增加的反应都是体系熵值 的反应。
>
>
增加( △ S>0)
增加( △ S>0)
思考与交流一
(一)自发反应一定需要△S>0 吗?
自发反应一定是熵增加的反应吗?
3Cl2(g)+8NH3(g)===N2(g)+6NH4Cl(s)
△S<0
Cl2与NH3反应
结论:△S > 0有利于反应自发进行, 自发反应不一定需要△S > 0。
熵变是判断反应能否自发进行的一个影响因素,但不是唯一因素。
以下化学反应能自发进行吗?
2H2(g)+O2(g)= 2H2O(l) △H=-572kJ/mol
2Na(s)+2H2O(l)=2NaOH(aq)+H2(g) △H=-368kJ/mol
2Fe(s)+3/2O2(g)= Fe2O3(s) △H=-824kJ/mol
NaOH(aq)+HCl(aq)=NaCl(aq)+ H2O(l) △H=-56kJ/mol
从能量角度分析自发反应有何共同特点?
三、焓判据
焓判据(能量判据):
体系趋向于从高能状态转变为低能状态(△H<0)。
思考与交流二
(一)为什么绝大多数自发反应会朝着放热的方向进行?
(二)自发反应一定需要△H<0 吗?
能量越低越稳定
2NH4Cl(s)+Ba(OH)2·8 H2O(s)
=NH3(g)+BaCl2(s)+10H2O(l)
△H ﹥ 0 吸热反应
Ba(OH)2·8H2O(s)与NH4Cl(s)的反应。
科学实验二
△H < 0有利于反应自发进行,但自发反应不一定需要△H < 0。
焓变是判断反应能否自发进行的另一个因素,但也不是唯一因素。
【结论】
四、复合判据——自由能变化
△G=△H-T△S (kJ/mol)
△ G<0,反应可自发进行
△ G=0,反应到达平衡状态
△ G>0,反应不能自发进行
(G是自由能,T是热力学温度,恒为正值)
△ H △ S △G 反应的自发性
< 0 > 0
> 0 < 0
< 0 < 0
> 0 > 0
△G=△H-T △S(T恒为正值)
?
?
< 0 任何温度自发
> 0 任何温度都不自发
△ H △ S △G 反应的自发性
< 0 > 0
> 0 < 0
< 0 < 0
> 0 > 0
△G=△H-T △S(T恒为正值)
< 0 任何温度自发
> 0 任何温度都不自发
高温 >0
低温 <0
高温 <0
低温 >0
高温自发
低温自发
C(石墨) === C(金刚石)
已知:在298K、101KPa下,该反应的
△ H = +1.895 kJ/mol, △ S= -3.363J/(mol·K)。
△G=△H-T△S>0,不能自发。
石墨可以变成金刚石?
不能自发的反应就一定不能进行吗?
石墨可以变成金刚石?
反应的自发性只能用于判断反应的方向,不能确定反应是否一定会发生。
石墨在5-6万大气压及摄氏1000至2000度高温下,再用金属铁、钴、镍等做催化剂,可使石墨转变成金刚石。
游戏模式:以小组为单位参与,分数累计,得分最高组颁发奖品!
游戏一规则:
1.由“幸运转转盘”随机决定哪个小组先答,发言人做答,一旦答题不能更改,答题时间为20秒。
2.答对每题10分,答错或超时扣10分。
3.答对后可以继续答题(最多答两题),答错或超时终止答题,终止答题后要指定下一题由哪个小组答题。
1. 下列说法正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.反应速率快的一定是自发进行的
C.自发反应在恰当条件下才能实现
D.非自发反应在任何条件下都不能实现
C
2、下列过程是非自发的是∶( )
A、水由高处向低处流; B、天然气的燃烧;
C、铁在潮湿空气中生锈; D、室温下水结成冰。
D
3、25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ/mol,自发进行的原因是∶( )
A、是吸热反应; B、是放热反应;
C、是熵减少的反应;D、熵增大效应大于能量效应。
D
4. 下列反应中,熵减小的是( )
A. (NH4 )2CO3(s)=NH4HCO3(s)+NH3(g)
B. 2N2O5(g)=4NO2(g)+O2(g)
C. MgCO3(s)=MgO(s)+CO2(g)
D. 2CO(g)=2C(s)+O2(g)
D
5. 已知反应2C(g)====A(g)+2B(g) H<0,下列说法正确的是( )
A. 仅常温下反应可以自发进行
B. 仅高温下反应可以自发进行
C. 任何温度下反应均可以自发进行
D. 任何温度下反应均难以自发进行
C
颁奖典礼
总结与收获分享
课外讨论
汽车尾气的主要污染物是一氧化氮以及燃烧不完全所产生的一氧化碳,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,有人提出通过
2NO(g) + 2CO(g) === N2(g) + 2CO2(g) 来处理汽车尾气。你们能否判断这一方案在常温常压下是否可行?理论依据是什么?
已知室温(298K、101KPa)下:
△H = - 113.0 KJ·mol-1
△S = -143.5 J·mol-1·K-1
谢谢各位专家评委!
