2022年中考化学三轮复习题型突破训练四 图象分析(原卷+解析)
文档属性
| 名称 | 2022年中考化学三轮复习题型突破训练四 图象分析(原卷+解析) |  | |
| 格式 | docx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-05 10:21:09 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
题型四 图像分析
1.下列图像能正确反映对应变化关系的是( )
A.水的电解
B.镁在装有空气的密闭容器内燃烧
C.利用足量的一氧化碳还原一定质量的氧化铜
D.向一定质量的稀硫酸中,滴加氢氧化钡溶液至过量
2.下列图像能正确反映其对应变化关系的是( )
A.加热分解一定质量的固体
B.向一定量硝酸银溶液中加入铜粉
C.分别向等质量的镁、铝中加入足量等体积、等浓度的稀盐酸
D.向一定质量的氢氧化钠和氯化钡的混合溶液中滴加稀硫酸
3.下列图像能正确反映其对应变化关系的是( )
A.足量的镁条在充满空气的密闭容器中燃烧
B.向等质量等浓度的稀硫酸中分别加入足量锌粉和铁粉
C.一定质量的浓硫酸长期露置在空气中
D.一定质量的铜丝插入足量的硝酸银溶液中
4.A、B、C、D四种金属中只有C在自然界中以单质的形式存在,把A、B两种金属粉分别放入等质量的稀盐酸中,得到图1所示图像,将D加入到溶液中,得到图2所示图像。下列说法中错误的是( )
A.A、B与稀盐酸反应产生氢气的质量相等
B.D和溶液发生了反应
C.B、C、D三种金属的活动性强弱顺序为B>D>C
D.A、B与稀盐酸反应消耗的盐酸质量相等
5.下列四个图像分别与选项中的操作相对应,其中合理的是( )
A. B. C. D.
6.利用如图1装置探究物质燃烧,点燃蜡烛后立即塞紧橡皮塞,待蜡烛熄灭后,将滴管中的水全部滴入集气瓶中,生石灰遇水放出大量的热,使铝盒中的白磷立即燃烧。如图2是瓶中①二氧化碳和②氧气的含量随时间变化的图像。下列有关说法错误的是( )
A.曲线①是二氧化碳变化,曲线②是氧气变化
B.在至时间段内蜡烛已熄灭而白磷还没有开始燃烧
C.该实验证明了蜡烛燃烧生成的二氧化碳气体仍能支持白磷的燃烧
D.该实验证明了不同物质的燃烧对氧气的质量分数需求不同
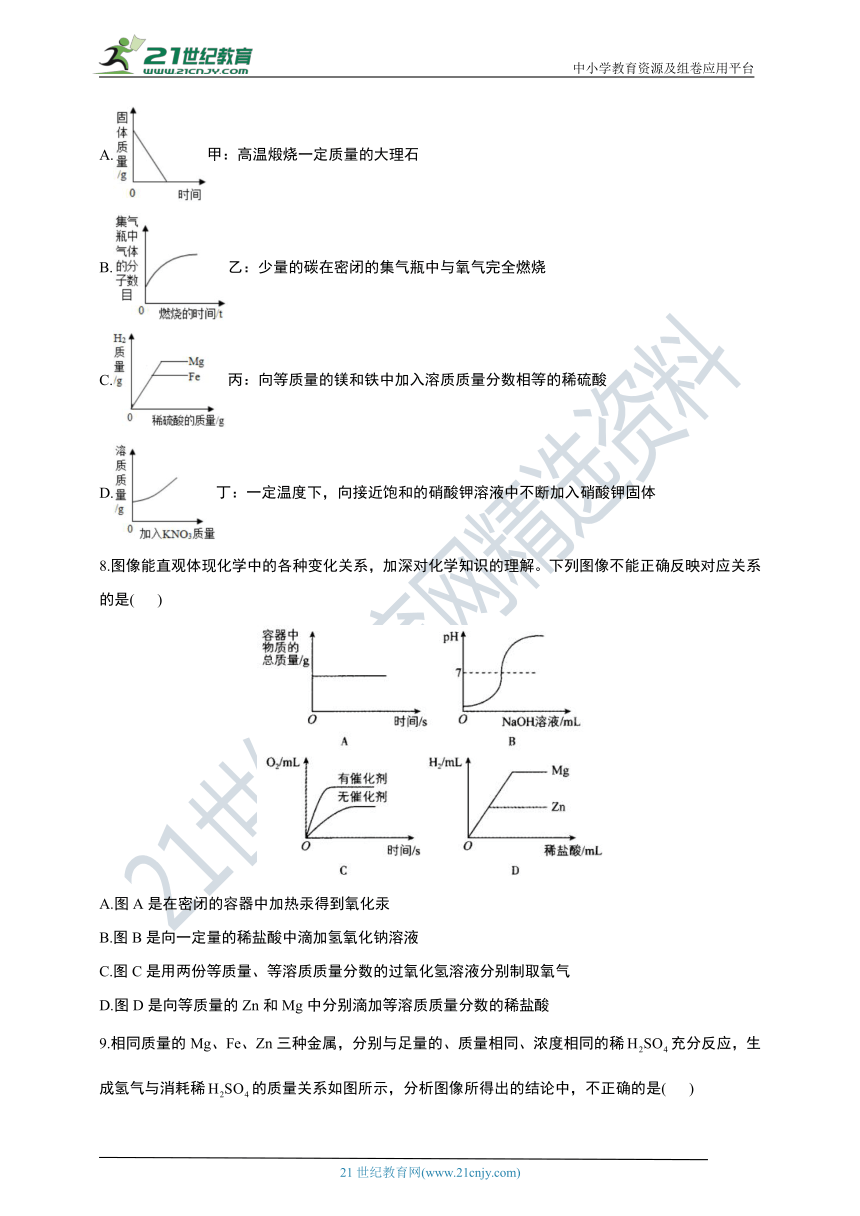
7.下列四个图像能正确反映实验变化关系的是( )
A.甲:高温煅烧一定质量的大理石
B.乙:少量的碳在密闭的集气瓶中与氧气完全燃烧
C.丙:向等质量的镁和铁中加入溶质质量分数相等的稀硫酸
D.丁:一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体
8.图像能直观体现化学中的各种变化关系,加深对化学知识的理解。下列图像不能正确反映对应关系的是( )
A.图A是在密闭的容器中加热汞得到氧化汞
B.图B是向一定量的稀盐酸中滴加氢氧化钠溶液
C.图C是用两份等质量、等溶质质量分数的过氧化氢溶液分别制取氧气
D.图D是向等质量的Zn和Mg中分别滴加等溶质质量分数的稀盐酸
9.相同质量的Mg、Fe、Zn三种金属,分别与足量的、质量相同、浓度相同的稀充分反应,生成氢气与消耗稀的质量关系如图所示,分析图像所得出的结论中,不正确的是( )
A.三种金属的活动性顺序:Mg>Fe>Zn
B.三种金属的相对原子质量:MgC.三种金属消耗稀的质量:Mg>Fe>Zn
D.三种金属与稀反应后溶液的质量:Mg10.将等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图所示,对于该图像的理解正确的组合是( )
①A表示锌与稀硫酸的反应 ,方程式为
②B表示铁与稀硫酸的反应,方程式为
③反应结束后两种金属一定都有剩余
④反应结束后稀硫酸都没有剩余
⑤反应结束后消耗两种金属的质量相等
⑥反应结束后所得溶液质量相等
A.①②③ B.②④⑤⑥ C.③⑤⑥ D.①④
11.某同学在图1三颈瓶中加入一定量的暖宝宝原料(主要成分为铁粉和碳粉),并滴加几滴水,分别用压强、氧气浓度和温度三种数字传感器绘制出数据变化图像如图2所示,则下列说法正确的是( )
A.曲线Ⅰ为氧气变化曲线
B.曲线Ⅱ为温度变化曲线
C.曲线Ⅰ、Ⅱ开始上升是因为铁缓慢氧化放热所致
D.如果暖宝宝原料足量,压强可降至0
12.配制50g质量分数为5%的溶液,作为无土栽培所需的营养液。溶解过程中的质量分数随时间的变化关系如图所示,观察图像,分析形成这种结果的原因是( )
A.所用固体中含有水分
B.用量筒量水时俯视刻度线
C.固体溶解前所用烧杯内有水
D.配好的溶液装瓶时部分液体洒落到试剂瓶外
13.甲、乙、丙三种固体物质的溶解度曲线如图,下列说法正确的是( )
A.将℃时丙的饱和溶液升温到℃,变为不饱和溶液
B.甲的溶液中混有少量的乙,可用降温结晶的方法提纯甲
C.℃,15g甲物质加入50g水中不断搅拌,所得溶液中溶质的质量分数为23.1%
D.将℃时甲、乙、丙的饱和溶液分别降温至℃,所得溶液的溶质质量分数大小顺序是乙>甲=丙
14.如图是的溶解度曲线,下列说法正确的是( )
A.溶液从b点降温到a点,有晶体析出
B.60℃时,b、c点对应的都是饱和溶液
C.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液
D.60℃时,向50g水中加入60g,形成不饱和溶液
15.我省运城盐池盛产芒硝(化学名称为硫酸钠),其溶解度曲线如图所示。下列说法正确的是( )
A.硫酸钠的溶解度随温度的升高而增大
B.40℃时,硫酸钠的溶解度约为50g
C.30℃时,硫酸钠的饱和溶液中溶质的质量分数约为40%
D.50℃时,将硫酸钠饱和溶液降温后所得溶液仍饱和
16.如图为甲、乙、丙三种固体物质的溶解度曲线。下列说法错误的是( )
A. 时,甲和乙的溶解度均为25g
B. 时三种物质的饱和溶液升温到,丙能析出晶体
C. 甲的饱和溶液升温到,溶液中溶质的质量分数为20%
D.时,将20g丙加入到50g水中得到的溶液中溶质质量分数为28.6%
17.向分别装有30g甲、乙物质的a、b烧杯中,各加入50g水,所得溶液的溶质质量分数随温度变化的趋势如图所示,回答下列问题:
(1)将乙物质换成______(填序号),该图像的变化趋势不变。
A. B.NaCl C.
(2)℃时,甲物质的溶解度为______。
(3)下列描述正确的是______(填序号)。
A.在0℃时,乙物质恰好为饱和溶液
B.℃时,甲、乙两物质的溶解度相等
C.℃时,若将mg乙物质加入100g水中,充分溶解,得到(100+m)g的溶液
D.将a、b烧杯,从℃降温至℃,b烧杯所剩固体更少
(4)另取一杯甲的不饱和溶液,若将其变为饱和溶液,下列说法正确的是______(填序号)。
A.溶质质量一定增大 B.溶剂质量一定减少
C.溶质质量分数一定变大 D.溶液质量可能不变
答案以及解析
1.答案:B
解析:水通电分解生成与的质量比为1:8,体积比为2:1,A错误;根据质量守恒定律,反应前后镁元素的质量不变,B正确;利用足量的CO还原一定质量的CuO,CO和CuO反应会生成Cu和,固体质量逐渐减小,但不会减小到0,C错误;向一定质量的稀中,滴加溶液至过量,与发生反应生成沉淀和,沉淀质量逐渐增大,直至稀反应完全,沉淀质量保持不变,D错误。
2.答案:C
解析:加热分解一定质量的固体,的初始质量应为0,随着的分解,的质量逐渐增大,直至反应结束,A错误。向一定量硝酸银溶液中加入铜粉,铜与硝酸银反应生成硝酸铜和银,固体质量从0开始逐渐增大,当硝酸银反应完,继续加入铜粉,固体质量继续增大,但增幅比之前小,B错误。分别向等质量的Mg、Al中加入足量等体积、等浓度的稀盐酸,横轴表示反应时间,纵轴表示生成质量,Mg的金属活动性比Al强,故反应速率更快,即斜率更大,等质量的Mg、Al与足量酸反应,最终Al生成的质量更大,C正确。向一定质量的NaOH和的混合溶液中滴加稀,和结合会产生不溶于酸的白色沉淀,故沉淀一开始就会产生,D错误。
3.答案:B
解析:足量的镁条在充满空气的密闭容器中燃烧,随着反应的进行,固体的质量逐渐增加,直至反应完成,A错误;向等质量等浓度的稀硫酸中分别加入足量锌粉和铁粉,Zn的金属活动性比Fe的强,则相同时间内Zn产生的较Fe多,但因硫酸的质量相等,最终反应结束时,产生的质量相等,B正确;一定质量的浓硫酸长期露置在空气中,随着露置时间的增加,溶液中溶质质量分数逐渐减小,但不会变成零,C错误;一定质量的铜丝插入足量的溶液中,64份质量的Cu可置换出216份质量的Ag,随着反应的进行,溶液的质量逐渐减小,至铜丝完全反应后溶液质量不再改变,D错误。
4.答案:B
解析:由图1可知,A、B与稀盐酸反应产生氢气的质量相等,则二者消耗盐酸的质量也相等,A、D正确;由图2可知,D加入到溶液中,溶液质量不变,说明D不能和反应,即B的金属活动性强于D,四种金属中只有C在自然界中以单质的形式存在,则C的活动性最弱,B错误、C正确。
5.答案:D
解析:电解一定质量的水,所产生氢气与氧气的体积之比为2:1,质量之比为1:8,A选项错误;稀释一定量的氢氧化钾溶液,溶液的pH会逐渐减小,无限接近7,但不会等于7,更不会小于7,B选项错误;浓硫酸敞口放置会吸收空气中的水分,导致溶液质量增大,C选项错误;向稀盐酸和硫酸镁的混合溶液中滴加氢氧化钠溶液,氢氧化钠会先与盐酸反应,此过程中无沉淀产生,待盐酸反应完全后,氢氧化钠再与硫酸镁反应产生氢氧化镁沉淀,硫酸镁反应完全后,沉淀质量不再增加,D选项正确。
6.答案:C
解析:A、蜡烛燃烧消耗氧气生成二氧化碳,故曲线①是二氧化碳的变化,曲线②是氧气的变化,正确;B.在至时间段内二氧化碳和氧气的含量基本不变,说明蜡烛已熄灭而白磷还没有开始燃烧,正确;C.二氧化碳并不能支持白磷的燃烧,白磷燃烧需要氧气,这个实验证明白磷燃烧对氧气的质量分数需求较低,错误。D.蜡烛熄灭后,将滴管中的水全部滴入集气瓶中,铝盒中的白磷立即燃烧,这一现象说明不同物质的燃烧对氧气的质量分数需求不同,正确;故选C。
7.答案:C
解析:A、大理石主要成分碳酸钙,碳酸钙高温条件下分解为氧化钙和二氧化碳,所以最终固体质量不为0,错误。B、根据可知,反应前后气体的分子数目不变,错误。C、根据,可知,开始硫酸不足,放出氢气多少由硫酸决定,开始放出的氢气量相同。最终硫酸过量,相同质量的镁、铁镁放出的氢气质量大。当金属完全反应后不再生成氢气。正确。D、一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体,开始有硝酸钾溶解,溶质质量增加,当溶液达到饱和后,无法继续溶解硝酸钾,溶质质量不变。错误。故选C。
8.答案:C
解析:根据质量守恒定律,在密闭容器里加热汞得到氧化汞,容器中物质的总质量保持不变;向一定量的稀盐酸中滴加氢氧化钠溶液,稀盐酸呈酸性,pH小于7,氢氧化钠呈碱性,pH大于7,溶液pH由小于7逐渐变为大于7;催化剂只能改变反应速率,不能改变生成物质量,两份等质量、等溶质质量分数的过氧化氢溶液最后产生的氧气质量应相等;当向等质量的镁和锌中分别滴加溶质质量分数相同的稀盐酸至过量,开始时盐酸少,两种金属生成氢气的质量相等,后随着稀盐酸质量的增加,锌先反应完全,最终镁生成氢气的质量大于锌。
9.答案:A
解析:因为横坐标为稀硫酸质量,故由图中信息不能判断三种金属的活动性顺序,A不正确;等质量的三种金属和稀硫酸反应生成的硫酸盐中,金属元素的化合价都是+2,则生成氢气质量越小,金属的相对原子质量越大,由图中信息可知,生成氢气质量由小到大的顺序是锌、铁、镁,因此三种金属的相对原子质量:MgFe>Zn,C正确;相同质量的Mg、Fe、Zn三种金属与足量稀反应生成氢气质量越大,反应后形成溶液的质量越小,因此三种金属与稀反应后溶液的质量:Mg10.答案:D
解析:①A表示锌与稀硫酸的反应生成硫酸锌和氢气,该反应的化学方程式为:,正确;
②B表示铁与稀硫酸的反应生成硫酸亚铁和氢气,该反应的化学方程式为:,错误;
③锌与稀硫酸反应:,65份的锌置换出2份的氢气, ,56份的铁置换出2份的氢气,故生成等质量的氢气,消耗锌的质量大,可能铁过量,也可能两种金属均过量,错误;
④等质量的锌和铁与质量相等、溶质质量分数相同的稀硫酸分别反应,如果稀硫酸全部过量或其中一种剩余,生成氢气的质量不可能相等,故反应结束后稀硫酸都没有剩余,正确;
⑤由以上分析可知,生成等质量的氢气,消耗两种金属的质量不相等,错误;
⑥由以上分析可知,生成等质量的氢气,消耗两种金属的质量不相等,生成氢气的质量相等,故反应结束后所得溶液质量不相等,错误。
正确的是①④。
故选D。
11.答案:C
解析:通过题中信息可知,暖宝宝原料主要成分为铁粉和碳粉,滴加几滴水后,暖宝宝中的物质发生缓慢氧化,消耗氧气,使氧气浓度降低,会导致容器内气压减小;但缓慢氧化会放出热量,使容器内气体受热膨胀,容器内气压增大,而放热时使气压增大的幅度要大于因氧气消耗而使气压减小的幅度,故在放热过程中容器内气压呈上升趋势,但当反应完成后,温度冷却至室温,容器内气压会低于原来的气压。由于反应消耗了氧气,所以氧气的浓度呈一直下降的趋势;反应过程放出大量热量,温度升高,待反应结束后,设备恢复到室温。
A、铁进行氧化反应放热,容器内温度升高,反应结束后,温度逐渐恢复到室温。曲线Ⅰ中,反应前后数值相等,为温度变化曲线,此选项错误;
B、由分析可知,反应放热导致气压增大的幅度大于氧气被消耗导致气压被减小的幅度,所以容器内气压先升后降,当温度冷却到室温时,容器内气压要比正常低。曲线Ⅱ中数值先增大后减小,为压强变化曲线,此选项错误;
C、根据分析可知,曲线Ⅰ是温度变化曲线、曲线Ⅱ是压强变化曲线;曲线Ⅰ、Ⅱ开始上升是因为铁缓慢氧化放热所致,此选项正确;
D、如果暖宝宝原料足量,压强不能降至0,是因为容器内还有不能被消耗氮气、稀有气体等气体,此选项错误。
故选C。
12.答案:B
解析:配制一定溶质质量分数的溶液,造成所配溶液溶质质量分数偏大的原因是溶质质量偏大或溶剂质量偏小。硝酸钾固体中含有水分,会使溶剂质量偏大,从而导致所配溶液溶质质量分数偏小,A错误;量取水时俯视读数,会使量取的水偏少,从而导致所配溶液溶质质量分数偏大,B正确;硝酸钾固体溶解前烧杯内有水,会使溶剂质量偏大,从而导致所配溶液溶质质量分数偏小,C错误;溶液具有均一性和稳定性,配好的溶液部分洒落到试剂瓶外,不影响溶液中溶质的质量分数,D错误。
13.答案:B
解析:A、因为由图可以得知丙的溶解度随着温度的升高而降低,所以当将饱和溶液丙从℃升到到℃的时候丙溶液中会有晶体析出,但是溶液仍就为饱和溶液。故A错误;B、因为是甲溶液中混有少量的乙,由图可以得知甲溶液的溶解度受温度的影响变化比较大。乙溶液的溶解度受温度的变化很小。所以可以采用降温结晶的方法提纯甲。故B正确;C、由图可以得知℃时,甲物质的溶解度为25。故为100g水中可以溶解25g甲物质。所以50g水中可以溶解12.5g的甲物质。故此时溶液中的溶质质量分数=。故C错误;D、因为由图可以得知甲、乙两种溶液的溶解度随着温度的降低而降低。丙溶液的溶解度随着温度的降低而升高。故当温度从t2℃降到℃时甲溶液和乙溶液仍旧为饱和溶液,但丙溶液此时为不饱和溶液。当温度为℃由图可知此时乙溶液的溶解度最大,故溶质的质量分数最大。甲和丙溶液此时的溶解度都为10。但甲溶液为饱和溶液,丙为不饱和溶液。所以此时溶质质量分数甲大于丙。故溶质的质量分数为乙>甲>丙。故选B。
14.答案:A
解析:
选项 正误 分析
A √ 的溶解度随温度的降低而减小,a点、b点位于曲线上,a点、b点所对应的溶液为的饱和溶液,溶液从b点降温到a点,有晶体析出
B × 60℃时,c点位于曲线下方,对应的是不饱和溶液
C × 将a点的饱和溶液从20℃升温至60℃,的溶解度增大,但没有溶质可溶,溶液变为不饱和溶液
D × 60℃时,的溶解度是110g,所以此温度时,向50g水中加入60g只能溶解55g,形成的是饱和溶液
15.答案:B
解析:由题图可知,硫酸钠的溶解度随温度的升高先增大后减小,A错误;30℃时,硫酸钠的溶解度约为40g,该温度下其饱和溶液中溶质的质量分数约为,C错误;40~50℃时,硫酸钠的溶解度随温度的降低而增大,0~40℃时,硫酸钠的溶解度随温度的降低而减小,故将50℃时硫酸钠的饱和溶液降温后,所得溶液不一定饱和,D错误。
16.答案:D
解析:A、据图可以看出,时,甲和乙的溶解度均为25g,A说法正确;B、丙的溶解度随温度的升高而减小,故时三种物质的饱和溶液升温到,丙能析出晶体,B说法正确;C、时,甲的溶解度为25g,故甲的饱和溶液溶质质量分数: ,升温到,溶液的组成不变,故溶质的质量分数仍然为20%,C说法正确;D、时,丙的溶解度为30g,将20g丙加入到50g水中,只能溶解15g,得到的溶液中溶质质量分数为,D说法错误;故选:D。
17.答案:(1)C
(2)60g
(3)BC
(4)D
解析:(1)由图可知,向分别装有30g甲、乙物质的a、b烧杯中,各加入50g水,一开始乙的溶质质量分数不变,后逐渐减小,说明一开始乙是不饱和溶液,后温度升高,溶解度减小,溶质逐渐析出,故乙的溶解度随温度的升高而减小,甲的溶质质量分数不断增大,说明随着温度升高,溶质不断被溶解,溶解度随温度的升高而增加。硝酸钾、氯化钠的溶解度随温度的升高而增加,氢氧化钙随温度的升高而减小,与乙相符,故选:C。
(2)℃时,50g水刚好溶解30g甲,物质的溶解度为,故填:60g。
(3)A、在0℃时升温,乙物质溶解度减小,但是溶质质量分数不变,说明在0℃时,乙物质为不饱和溶液,A错误。B、由图可知,℃时,甲、乙两物质的溶质质量分数相等,且甲、乙都是饱和溶液,溶解度相等,B正确。C、饱和溶液溶质质量分数一定小于溶解度,故℃时,乙的饱和溶液溶质质量分数m%,溶解度一定大于mg,故将mg乙物质加入100g水中,充分溶解将全部溶解,得到(100+m)g的溶液,C正确。D、将a、b烧杯,从℃降温至℃,a溶质质量分数不变,且溶质全部溶解,b烧杯溶质质量分数增大,但是有固体不溶解,所剩固体更少的是a,D错误。故选:BC。
(4)A.另取一杯甲的不饱和溶液,降低温度将其变为饱和溶液,溶质质量不增大,A错误。B.另取一杯甲的不饱和溶液,降低温度将其变为饱和溶液,溶剂质量不变,B错误。C.另取一杯甲的不饱和溶液,降低温度将其变为饱和溶液,溶质质量分数不变,C错误。D.另取一杯甲的不饱和溶液,降低温度将其变为饱和溶液,溶溶液质量可能不变,D正确。故选:D。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
题型四 图像分析
1.下列图像能正确反映对应变化关系的是( )
A.水的电解
B.镁在装有空气的密闭容器内燃烧
C.利用足量的一氧化碳还原一定质量的氧化铜
D.向一定质量的稀硫酸中,滴加氢氧化钡溶液至过量
2.下列图像能正确反映其对应变化关系的是( )
A.加热分解一定质量的固体
B.向一定量硝酸银溶液中加入铜粉
C.分别向等质量的镁、铝中加入足量等体积、等浓度的稀盐酸
D.向一定质量的氢氧化钠和氯化钡的混合溶液中滴加稀硫酸
3.下列图像能正确反映其对应变化关系的是( )
A.足量的镁条在充满空气的密闭容器中燃烧
B.向等质量等浓度的稀硫酸中分别加入足量锌粉和铁粉
C.一定质量的浓硫酸长期露置在空气中
D.一定质量的铜丝插入足量的硝酸银溶液中
4.A、B、C、D四种金属中只有C在自然界中以单质的形式存在,把A、B两种金属粉分别放入等质量的稀盐酸中,得到图1所示图像,将D加入到溶液中,得到图2所示图像。下列说法中错误的是( )
A.A、B与稀盐酸反应产生氢气的质量相等
B.D和溶液发生了反应
C.B、C、D三种金属的活动性强弱顺序为B>D>C
D.A、B与稀盐酸反应消耗的盐酸质量相等
5.下列四个图像分别与选项中的操作相对应,其中合理的是( )
A. B. C. D.
6.利用如图1装置探究物质燃烧,点燃蜡烛后立即塞紧橡皮塞,待蜡烛熄灭后,将滴管中的水全部滴入集气瓶中,生石灰遇水放出大量的热,使铝盒中的白磷立即燃烧。如图2是瓶中①二氧化碳和②氧气的含量随时间变化的图像。下列有关说法错误的是( )
A.曲线①是二氧化碳变化,曲线②是氧气变化
B.在至时间段内蜡烛已熄灭而白磷还没有开始燃烧
C.该实验证明了蜡烛燃烧生成的二氧化碳气体仍能支持白磷的燃烧
D.该实验证明了不同物质的燃烧对氧气的质量分数需求不同
7.下列四个图像能正确反映实验变化关系的是( )
A.甲:高温煅烧一定质量的大理石
B.乙:少量的碳在密闭的集气瓶中与氧气完全燃烧
C.丙:向等质量的镁和铁中加入溶质质量分数相等的稀硫酸
D.丁:一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体
8.图像能直观体现化学中的各种变化关系,加深对化学知识的理解。下列图像不能正确反映对应关系的是( )
A.图A是在密闭的容器中加热汞得到氧化汞
B.图B是向一定量的稀盐酸中滴加氢氧化钠溶液
C.图C是用两份等质量、等溶质质量分数的过氧化氢溶液分别制取氧气
D.图D是向等质量的Zn和Mg中分别滴加等溶质质量分数的稀盐酸
9.相同质量的Mg、Fe、Zn三种金属,分别与足量的、质量相同、浓度相同的稀充分反应,生成氢气与消耗稀的质量关系如图所示,分析图像所得出的结论中,不正确的是( )
A.三种金属的活动性顺序:Mg>Fe>Zn
B.三种金属的相对原子质量:Mg
D.三种金属与稀反应后溶液的质量:Mg
①A表示锌与稀硫酸的反应 ,方程式为
②B表示铁与稀硫酸的反应,方程式为
③反应结束后两种金属一定都有剩余
④反应结束后稀硫酸都没有剩余
⑤反应结束后消耗两种金属的质量相等
⑥反应结束后所得溶液质量相等
A.①②③ B.②④⑤⑥ C.③⑤⑥ D.①④
11.某同学在图1三颈瓶中加入一定量的暖宝宝原料(主要成分为铁粉和碳粉),并滴加几滴水,分别用压强、氧气浓度和温度三种数字传感器绘制出数据变化图像如图2所示,则下列说法正确的是( )
A.曲线Ⅰ为氧气变化曲线
B.曲线Ⅱ为温度变化曲线
C.曲线Ⅰ、Ⅱ开始上升是因为铁缓慢氧化放热所致
D.如果暖宝宝原料足量,压强可降至0
12.配制50g质量分数为5%的溶液,作为无土栽培所需的营养液。溶解过程中的质量分数随时间的变化关系如图所示,观察图像,分析形成这种结果的原因是( )
A.所用固体中含有水分
B.用量筒量水时俯视刻度线
C.固体溶解前所用烧杯内有水
D.配好的溶液装瓶时部分液体洒落到试剂瓶外
13.甲、乙、丙三种固体物质的溶解度曲线如图,下列说法正确的是( )
A.将℃时丙的饱和溶液升温到℃,变为不饱和溶液
B.甲的溶液中混有少量的乙,可用降温结晶的方法提纯甲
C.℃,15g甲物质加入50g水中不断搅拌,所得溶液中溶质的质量分数为23.1%
D.将℃时甲、乙、丙的饱和溶液分别降温至℃,所得溶液的溶质质量分数大小顺序是乙>甲=丙
14.如图是的溶解度曲线,下列说法正确的是( )
A.溶液从b点降温到a点,有晶体析出
B.60℃时,b、c点对应的都是饱和溶液
C.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液
D.60℃时,向50g水中加入60g,形成不饱和溶液
15.我省运城盐池盛产芒硝(化学名称为硫酸钠),其溶解度曲线如图所示。下列说法正确的是( )
A.硫酸钠的溶解度随温度的升高而增大
B.40℃时,硫酸钠的溶解度约为50g
C.30℃时,硫酸钠的饱和溶液中溶质的质量分数约为40%
D.50℃时,将硫酸钠饱和溶液降温后所得溶液仍饱和
16.如图为甲、乙、丙三种固体物质的溶解度曲线。下列说法错误的是( )
A. 时,甲和乙的溶解度均为25g
B. 时三种物质的饱和溶液升温到,丙能析出晶体
C. 甲的饱和溶液升温到,溶液中溶质的质量分数为20%
D.时,将20g丙加入到50g水中得到的溶液中溶质质量分数为28.6%
17.向分别装有30g甲、乙物质的a、b烧杯中,各加入50g水,所得溶液的溶质质量分数随温度变化的趋势如图所示,回答下列问题:
(1)将乙物质换成______(填序号),该图像的变化趋势不变。
A. B.NaCl C.
(2)℃时,甲物质的溶解度为______。
(3)下列描述正确的是______(填序号)。
A.在0℃时,乙物质恰好为饱和溶液
B.℃时,甲、乙两物质的溶解度相等
C.℃时,若将mg乙物质加入100g水中,充分溶解,得到(100+m)g的溶液
D.将a、b烧杯,从℃降温至℃,b烧杯所剩固体更少
(4)另取一杯甲的不饱和溶液,若将其变为饱和溶液,下列说法正确的是______(填序号)。
A.溶质质量一定增大 B.溶剂质量一定减少
C.溶质质量分数一定变大 D.溶液质量可能不变
答案以及解析
1.答案:B
解析:水通电分解生成与的质量比为1:8,体积比为2:1,A错误;根据质量守恒定律,反应前后镁元素的质量不变,B正确;利用足量的CO还原一定质量的CuO,CO和CuO反应会生成Cu和,固体质量逐渐减小,但不会减小到0,C错误;向一定质量的稀中,滴加溶液至过量,与发生反应生成沉淀和,沉淀质量逐渐增大,直至稀反应完全,沉淀质量保持不变,D错误。
2.答案:C
解析:加热分解一定质量的固体,的初始质量应为0,随着的分解,的质量逐渐增大,直至反应结束,A错误。向一定量硝酸银溶液中加入铜粉,铜与硝酸银反应生成硝酸铜和银,固体质量从0开始逐渐增大,当硝酸银反应完,继续加入铜粉,固体质量继续增大,但增幅比之前小,B错误。分别向等质量的Mg、Al中加入足量等体积、等浓度的稀盐酸,横轴表示反应时间,纵轴表示生成质量,Mg的金属活动性比Al强,故反应速率更快,即斜率更大,等质量的Mg、Al与足量酸反应,最终Al生成的质量更大,C正确。向一定质量的NaOH和的混合溶液中滴加稀,和结合会产生不溶于酸的白色沉淀,故沉淀一开始就会产生,D错误。
3.答案:B
解析:足量的镁条在充满空气的密闭容器中燃烧,随着反应的进行,固体的质量逐渐增加,直至反应完成,A错误;向等质量等浓度的稀硫酸中分别加入足量锌粉和铁粉,Zn的金属活动性比Fe的强,则相同时间内Zn产生的较Fe多,但因硫酸的质量相等,最终反应结束时,产生的质量相等,B正确;一定质量的浓硫酸长期露置在空气中,随着露置时间的增加,溶液中溶质质量分数逐渐减小,但不会变成零,C错误;一定质量的铜丝插入足量的溶液中,64份质量的Cu可置换出216份质量的Ag,随着反应的进行,溶液的质量逐渐减小,至铜丝完全反应后溶液质量不再改变,D错误。
4.答案:B
解析:由图1可知,A、B与稀盐酸反应产生氢气的质量相等,则二者消耗盐酸的质量也相等,A、D正确;由图2可知,D加入到溶液中,溶液质量不变,说明D不能和反应,即B的金属活动性强于D,四种金属中只有C在自然界中以单质的形式存在,则C的活动性最弱,B错误、C正确。
5.答案:D
解析:电解一定质量的水,所产生氢气与氧气的体积之比为2:1,质量之比为1:8,A选项错误;稀释一定量的氢氧化钾溶液,溶液的pH会逐渐减小,无限接近7,但不会等于7,更不会小于7,B选项错误;浓硫酸敞口放置会吸收空气中的水分,导致溶液质量增大,C选项错误;向稀盐酸和硫酸镁的混合溶液中滴加氢氧化钠溶液,氢氧化钠会先与盐酸反应,此过程中无沉淀产生,待盐酸反应完全后,氢氧化钠再与硫酸镁反应产生氢氧化镁沉淀,硫酸镁反应完全后,沉淀质量不再增加,D选项正确。
6.答案:C
解析:A、蜡烛燃烧消耗氧气生成二氧化碳,故曲线①是二氧化碳的变化,曲线②是氧气的变化,正确;B.在至时间段内二氧化碳和氧气的含量基本不变,说明蜡烛已熄灭而白磷还没有开始燃烧,正确;C.二氧化碳并不能支持白磷的燃烧,白磷燃烧需要氧气,这个实验证明白磷燃烧对氧气的质量分数需求较低,错误。D.蜡烛熄灭后,将滴管中的水全部滴入集气瓶中,铝盒中的白磷立即燃烧,这一现象说明不同物质的燃烧对氧气的质量分数需求不同,正确;故选C。
7.答案:C
解析:A、大理石主要成分碳酸钙,碳酸钙高温条件下分解为氧化钙和二氧化碳,所以最终固体质量不为0,错误。B、根据可知,反应前后气体的分子数目不变,错误。C、根据,可知,开始硫酸不足,放出氢气多少由硫酸决定,开始放出的氢气量相同。最终硫酸过量,相同质量的镁、铁镁放出的氢气质量大。当金属完全反应后不再生成氢气。正确。D、一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体,开始有硝酸钾溶解,溶质质量增加,当溶液达到饱和后,无法继续溶解硝酸钾,溶质质量不变。错误。故选C。
8.答案:C
解析:根据质量守恒定律,在密闭容器里加热汞得到氧化汞,容器中物质的总质量保持不变;向一定量的稀盐酸中滴加氢氧化钠溶液,稀盐酸呈酸性,pH小于7,氢氧化钠呈碱性,pH大于7,溶液pH由小于7逐渐变为大于7;催化剂只能改变反应速率,不能改变生成物质量,两份等质量、等溶质质量分数的过氧化氢溶液最后产生的氧气质量应相等;当向等质量的镁和锌中分别滴加溶质质量分数相同的稀盐酸至过量,开始时盐酸少,两种金属生成氢气的质量相等,后随着稀盐酸质量的增加,锌先反应完全,最终镁生成氢气的质量大于锌。
9.答案:A
解析:因为横坐标为稀硫酸质量,故由图中信息不能判断三种金属的活动性顺序,A不正确;等质量的三种金属和稀硫酸反应生成的硫酸盐中,金属元素的化合价都是+2,则生成氢气质量越小,金属的相对原子质量越大,由图中信息可知,生成氢气质量由小到大的顺序是锌、铁、镁,因此三种金属的相对原子质量:Mg
解析:①A表示锌与稀硫酸的反应生成硫酸锌和氢气,该反应的化学方程式为:,正确;
②B表示铁与稀硫酸的反应生成硫酸亚铁和氢气,该反应的化学方程式为:,错误;
③锌与稀硫酸反应:,65份的锌置换出2份的氢气, ,56份的铁置换出2份的氢气,故生成等质量的氢气,消耗锌的质量大,可能铁过量,也可能两种金属均过量,错误;
④等质量的锌和铁与质量相等、溶质质量分数相同的稀硫酸分别反应,如果稀硫酸全部过量或其中一种剩余,生成氢气的质量不可能相等,故反应结束后稀硫酸都没有剩余,正确;
⑤由以上分析可知,生成等质量的氢气,消耗两种金属的质量不相等,错误;
⑥由以上分析可知,生成等质量的氢气,消耗两种金属的质量不相等,生成氢气的质量相等,故反应结束后所得溶液质量不相等,错误。
正确的是①④。
故选D。
11.答案:C
解析:通过题中信息可知,暖宝宝原料主要成分为铁粉和碳粉,滴加几滴水后,暖宝宝中的物质发生缓慢氧化,消耗氧气,使氧气浓度降低,会导致容器内气压减小;但缓慢氧化会放出热量,使容器内气体受热膨胀,容器内气压增大,而放热时使气压增大的幅度要大于因氧气消耗而使气压减小的幅度,故在放热过程中容器内气压呈上升趋势,但当反应完成后,温度冷却至室温,容器内气压会低于原来的气压。由于反应消耗了氧气,所以氧气的浓度呈一直下降的趋势;反应过程放出大量热量,温度升高,待反应结束后,设备恢复到室温。
A、铁进行氧化反应放热,容器内温度升高,反应结束后,温度逐渐恢复到室温。曲线Ⅰ中,反应前后数值相等,为温度变化曲线,此选项错误;
B、由分析可知,反应放热导致气压增大的幅度大于氧气被消耗导致气压被减小的幅度,所以容器内气压先升后降,当温度冷却到室温时,容器内气压要比正常低。曲线Ⅱ中数值先增大后减小,为压强变化曲线,此选项错误;
C、根据分析可知,曲线Ⅰ是温度变化曲线、曲线Ⅱ是压强变化曲线;曲线Ⅰ、Ⅱ开始上升是因为铁缓慢氧化放热所致,此选项正确;
D、如果暖宝宝原料足量,压强不能降至0,是因为容器内还有不能被消耗氮气、稀有气体等气体,此选项错误。
故选C。
12.答案:B
解析:配制一定溶质质量分数的溶液,造成所配溶液溶质质量分数偏大的原因是溶质质量偏大或溶剂质量偏小。硝酸钾固体中含有水分,会使溶剂质量偏大,从而导致所配溶液溶质质量分数偏小,A错误;量取水时俯视读数,会使量取的水偏少,从而导致所配溶液溶质质量分数偏大,B正确;硝酸钾固体溶解前烧杯内有水,会使溶剂质量偏大,从而导致所配溶液溶质质量分数偏小,C错误;溶液具有均一性和稳定性,配好的溶液部分洒落到试剂瓶外,不影响溶液中溶质的质量分数,D错误。
13.答案:B
解析:A、因为由图可以得知丙的溶解度随着温度的升高而降低,所以当将饱和溶液丙从℃升到到℃的时候丙溶液中会有晶体析出,但是溶液仍就为饱和溶液。故A错误;B、因为是甲溶液中混有少量的乙,由图可以得知甲溶液的溶解度受温度的影响变化比较大。乙溶液的溶解度受温度的变化很小。所以可以采用降温结晶的方法提纯甲。故B正确;C、由图可以得知℃时,甲物质的溶解度为25。故为100g水中可以溶解25g甲物质。所以50g水中可以溶解12.5g的甲物质。故此时溶液中的溶质质量分数=。故C错误;D、因为由图可以得知甲、乙两种溶液的溶解度随着温度的降低而降低。丙溶液的溶解度随着温度的降低而升高。故当温度从t2℃降到℃时甲溶液和乙溶液仍旧为饱和溶液,但丙溶液此时为不饱和溶液。当温度为℃由图可知此时乙溶液的溶解度最大,故溶质的质量分数最大。甲和丙溶液此时的溶解度都为10。但甲溶液为饱和溶液,丙为不饱和溶液。所以此时溶质质量分数甲大于丙。故溶质的质量分数为乙>甲>丙。故选B。
14.答案:A
解析:
选项 正误 分析
A √ 的溶解度随温度的降低而减小,a点、b点位于曲线上,a点、b点所对应的溶液为的饱和溶液,溶液从b点降温到a点,有晶体析出
B × 60℃时,c点位于曲线下方,对应的是不饱和溶液
C × 将a点的饱和溶液从20℃升温至60℃,的溶解度增大,但没有溶质可溶,溶液变为不饱和溶液
D × 60℃时,的溶解度是110g,所以此温度时,向50g水中加入60g只能溶解55g,形成的是饱和溶液
15.答案:B
解析:由题图可知,硫酸钠的溶解度随温度的升高先增大后减小,A错误;30℃时,硫酸钠的溶解度约为40g,该温度下其饱和溶液中溶质的质量分数约为,C错误;40~50℃时,硫酸钠的溶解度随温度的降低而增大,0~40℃时,硫酸钠的溶解度随温度的降低而减小,故将50℃时硫酸钠的饱和溶液降温后,所得溶液不一定饱和,D错误。
16.答案:D
解析:A、据图可以看出,时,甲和乙的溶解度均为25g,A说法正确;B、丙的溶解度随温度的升高而减小,故时三种物质的饱和溶液升温到,丙能析出晶体,B说法正确;C、时,甲的溶解度为25g,故甲的饱和溶液溶质质量分数: ,升温到,溶液的组成不变,故溶质的质量分数仍然为20%,C说法正确;D、时,丙的溶解度为30g,将20g丙加入到50g水中,只能溶解15g,得到的溶液中溶质质量分数为,D说法错误;故选:D。
17.答案:(1)C
(2)60g
(3)BC
(4)D
解析:(1)由图可知,向分别装有30g甲、乙物质的a、b烧杯中,各加入50g水,一开始乙的溶质质量分数不变,后逐渐减小,说明一开始乙是不饱和溶液,后温度升高,溶解度减小,溶质逐渐析出,故乙的溶解度随温度的升高而减小,甲的溶质质量分数不断增大,说明随着温度升高,溶质不断被溶解,溶解度随温度的升高而增加。硝酸钾、氯化钠的溶解度随温度的升高而增加,氢氧化钙随温度的升高而减小,与乙相符,故选:C。
(2)℃时,50g水刚好溶解30g甲,物质的溶解度为,故填:60g。
(3)A、在0℃时升温,乙物质溶解度减小,但是溶质质量分数不变,说明在0℃时,乙物质为不饱和溶液,A错误。B、由图可知,℃时,甲、乙两物质的溶质质量分数相等,且甲、乙都是饱和溶液,溶解度相等,B正确。C、饱和溶液溶质质量分数一定小于溶解度,故℃时,乙的饱和溶液溶质质量分数m%,溶解度一定大于mg,故将mg乙物质加入100g水中,充分溶解将全部溶解,得到(100+m)g的溶液,C正确。D、将a、b烧杯,从℃降温至℃,a溶质质量分数不变,且溶质全部溶解,b烧杯溶质质量分数增大,但是有固体不溶解,所剩固体更少的是a,D错误。故选:BC。
(4)A.另取一杯甲的不饱和溶液,降低温度将其变为饱和溶液,溶质质量不增大,A错误。B.另取一杯甲的不饱和溶液,降低温度将其变为饱和溶液,溶剂质量不变,B错误。C.另取一杯甲的不饱和溶液,降低温度将其变为饱和溶液,溶质质量分数不变,C错误。D.另取一杯甲的不饱和溶液,降低温度将其变为饱和溶液,溶溶液质量可能不变,D正确。故选:D。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
