电解质
图片预览




文档简介
课件23张PPT。第2节电解质 观察记录导电导电不导电导电不
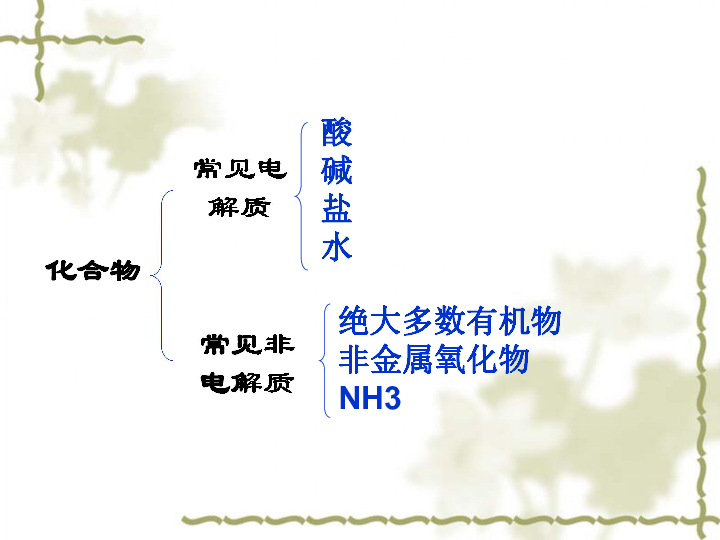
导电导电观察 · 思考导电性实验测定NaCl溶液、砂糖水、盐酸、NaOH溶液、乙醇溶液、醋酸溶液的导电性 实验1 实验2 测定熔融KNO3的导电性导电化合物电解质非电解质在水溶液里或熔融状态下能够导电的化合物在水溶液里和熔融状态下都不导电的化合物一、电解质及其电离1、电解质和非电解质常见电解质常见非电解质化合物酸
碱
盐
水绝大多数有机物
非金属氧化物
NH3判断下列叙述是否正确并说明理由1、铜能导电,铜是电解质。2、硝酸钾溶液能导电,硝酸钾溶液是电解质。3、冰醋酸不导电,但醋酸是电解质。( )×交流 · 研讨电解质本身不一定导电,能导电的物质不一定是电解质。单质和混合物既不是电解质,也不是非电解质。( )( )×交流 · 研讨1、NaCl溶液能导电,NaCl晶体能不能导电?为什么?2、NaCl溶液中为什么有自由移动的Na+和Cl-?不导电。 NaCl溶液中有自由移动的Na+和Cl-,NaCl晶体中虽然有 Na+和Cl-,但不能自由移动,所以不导电。NaCl晶体溶解于水时,在水分子作用下,Na+和Cl-逐渐脱离晶体表面,形成水合钠离子和水合氯离子进入溶液,成为自由移动的离子。交流 · 研讨3、熔融NaCl为什么能导电?NaCl晶体受热熔化时,离解成自由移动的Na+和Cl-。思考:电解质导电的原因?形成自由移动的离子2、电解质的电离(1)电离电解质溶解于水或受热熔化时,离解成能够自由移动的离子的过程。电解质发生电离的条件是什么?
是否需要通电?溶解于水或受热熔化
不需要通电.冲出迷茫2、电解质的电离(1)电离物质溶于水或受热熔化时,离解成能够自由移动的离子的过程称为电离。(“水离”或“熔离”)实验证明:酸在溶解于水时能发生电离,
碱和盐在溶于水或受热融化时能发生电离NaCl二、电离方程式的书写HClNaOHKNO3电离过程,原子团不能拆 = H + + Cl-= Na+ + OH-= Na+ + Cl-= K+ + NO3-元素守恒、电荷守恒第一组:书写电离方程式HNO3HClH2SO4第二组:书写电离方程式KOHBa(OH)2NaOHNa2CO3 (NH4)2SO4 KNO3 第三组:书写电离方程式练习(3)酸碱盐电离时,生成的阳离子全部是H+的化合物。酸 ——碱 ——电离时,生成的阴离子全部是OH-的化合物。盐 ——电离时,能生成金属阳离子(或铵离子)和酸根阴离子的化合物。做一做1、下列属于电解质的是( ) 2、下列电离方程式正确( )A、Al2(SO4)3=2Al+3+3SO42-
B、Na2SO4=Na2++SO42-
C、MgCl2=Mg2++Cl-
D、FeCl3=Fe3++3Cl-
CDA、汞 B、蔗糖 C、熔融KNO3 D、BaCl2溶液3、 a 氯化钠晶体 b 冰醋酸 c 汞
d 硫酸钡 e 蔗糖 f熔融氯化钾 g 二氧化硫 h 硝酸钾溶液
上述物质属于电解质的是
属于非电解质的是
能导电的是a b d fe gc f h4、仅能在水溶液中导电的电解质是( )
A、硫酸钠 B、氢氧化钾 C、二氧化碳 D、硫酸 E、乙醇D5、下列状态的物质,既能导电又属于电解质的是( )
A、氯化镁晶体 B、氯化钠溶液 C、液态氯化氢 D、熔融氢氧化钾D自主学习 在水溶液中能够发生电离的电解质是不是都发生了完全电离?
请设计一个实验来证明你的结论。写出实验设计并分析原因。
(提示:课本P42 知识点击)比较同浓度盐酸和醋酸的导电性电解质的分类在水溶液里完全电离的电解质
在水溶液里部分电离的电解质
完全电离
部分电离离子离子、电解质分子
强酸、强碱、盐、活泼金属氧化物弱酸、弱碱、水
不可逆可逆溶液导电能力的强弱:只取决于相同条件下溶液中自由移动的离子浓度和其所带电荷的多少思考:1、盐酸的导电能力一定比醋酸强吗?冲出迷茫2、溶液导电能力的强弱取决于什么?下列物质中:
1、硫酸 2、蔗糖 3、氨气 4、醋酸 5、铜 6、氨水 7、乙醇 8、二氧化碳 9、石墨 10、碳酸 11、醋酸铵
12、烧碱 13、氯化钠溶液
属于非电解质的是______________
属于电解质的是________________
属于强电解质的是______________
属于弱电解质的是______________2 3 7 81 4 10 11 121 11 124 10硝酸钾溶液中存在的微粒有
醋酸溶液中存在的微粒有K+ NO3- H2O CH3COOH H+ CH3COO- H2O化合物水溶液或熔化状态导电的原因电离定义酸、碱、盐本节内容小结自由移动的离子 程度强电解质弱电解质电离方程式电解质——在水溶液里或熔融状态下能发生电离的化合物非电解质——在水溶液里和熔融状态下都不能发生电离的化合物
导电导电观察 · 思考导电性实验测定NaCl溶液、砂糖水、盐酸、NaOH溶液、乙醇溶液、醋酸溶液的导电性 实验1 实验2 测定熔融KNO3的导电性导电化合物电解质非电解质在水溶液里或熔融状态下能够导电的化合物在水溶液里和熔融状态下都不导电的化合物一、电解质及其电离1、电解质和非电解质常见电解质常见非电解质化合物酸
碱
盐
水绝大多数有机物
非金属氧化物
NH3判断下列叙述是否正确并说明理由1、铜能导电,铜是电解质。2、硝酸钾溶液能导电,硝酸钾溶液是电解质。3、冰醋酸不导电,但醋酸是电解质。( )×交流 · 研讨电解质本身不一定导电,能导电的物质不一定是电解质。单质和混合物既不是电解质,也不是非电解质。( )( )×交流 · 研讨1、NaCl溶液能导电,NaCl晶体能不能导电?为什么?2、NaCl溶液中为什么有自由移动的Na+和Cl-?不导电。 NaCl溶液中有自由移动的Na+和Cl-,NaCl晶体中虽然有 Na+和Cl-,但不能自由移动,所以不导电。NaCl晶体溶解于水时,在水分子作用下,Na+和Cl-逐渐脱离晶体表面,形成水合钠离子和水合氯离子进入溶液,成为自由移动的离子。交流 · 研讨3、熔融NaCl为什么能导电?NaCl晶体受热熔化时,离解成自由移动的Na+和Cl-。思考:电解质导电的原因?形成自由移动的离子2、电解质的电离(1)电离电解质溶解于水或受热熔化时,离解成能够自由移动的离子的过程。电解质发生电离的条件是什么?
是否需要通电?溶解于水或受热熔化
不需要通电.冲出迷茫2、电解质的电离(1)电离物质溶于水或受热熔化时,离解成能够自由移动的离子的过程称为电离。(“水离”或“熔离”)实验证明:酸在溶解于水时能发生电离,
碱和盐在溶于水或受热融化时能发生电离NaCl二、电离方程式的书写HClNaOHKNO3电离过程,原子团不能拆 = H + + Cl-= Na+ + OH-= Na+ + Cl-= K+ + NO3-元素守恒、电荷守恒第一组:书写电离方程式HNO3HClH2SO4第二组:书写电离方程式KOHBa(OH)2NaOHNa2CO3 (NH4)2SO4 KNO3 第三组:书写电离方程式练习(3)酸碱盐电离时,生成的阳离子全部是H+的化合物。酸 ——碱 ——电离时,生成的阴离子全部是OH-的化合物。盐 ——电离时,能生成金属阳离子(或铵离子)和酸根阴离子的化合物。做一做1、下列属于电解质的是( ) 2、下列电离方程式正确( )A、Al2(SO4)3=2Al+3+3SO42-
B、Na2SO4=Na2++SO42-
C、MgCl2=Mg2++Cl-
D、FeCl3=Fe3++3Cl-
CDA、汞 B、蔗糖 C、熔融KNO3 D、BaCl2溶液3、 a 氯化钠晶体 b 冰醋酸 c 汞
d 硫酸钡 e 蔗糖 f熔融氯化钾 g 二氧化硫 h 硝酸钾溶液
上述物质属于电解质的是
属于非电解质的是
能导电的是a b d fe gc f h4、仅能在水溶液中导电的电解质是( )
A、硫酸钠 B、氢氧化钾 C、二氧化碳 D、硫酸 E、乙醇D5、下列状态的物质,既能导电又属于电解质的是( )
A、氯化镁晶体 B、氯化钠溶液 C、液态氯化氢 D、熔融氢氧化钾D自主学习 在水溶液中能够发生电离的电解质是不是都发生了完全电离?
请设计一个实验来证明你的结论。写出实验设计并分析原因。
(提示:课本P42 知识点击)比较同浓度盐酸和醋酸的导电性电解质的分类在水溶液里完全电离的电解质
在水溶液里部分电离的电解质
完全电离
部分电离离子离子、电解质分子
强酸、强碱、盐、活泼金属氧化物弱酸、弱碱、水
不可逆可逆溶液导电能力的强弱:只取决于相同条件下溶液中自由移动的离子浓度和其所带电荷的多少思考:1、盐酸的导电能力一定比醋酸强吗?冲出迷茫2、溶液导电能力的强弱取决于什么?下列物质中:
1、硫酸 2、蔗糖 3、氨气 4、醋酸 5、铜 6、氨水 7、乙醇 8、二氧化碳 9、石墨 10、碳酸 11、醋酸铵
12、烧碱 13、氯化钠溶液
属于非电解质的是______________
属于电解质的是________________
属于强电解质的是______________
属于弱电解质的是______________2 3 7 81 4 10 11 121 11 124 10硝酸钾溶液中存在的微粒有
醋酸溶液中存在的微粒有K+ NO3- H2O CH3COOH H+ CH3COO- H2O化合物水溶液或熔化状态导电的原因电离定义酸、碱、盐本节内容小结自由移动的离子 程度强电解质弱电解质电离方程式电解质——在水溶液里或熔融状态下能发生电离的化合物非电解质——在水溶液里和熔融状态下都不能发生电离的化合物
