实验活动5 不同价态含硫物质的转化 课件 2021-2022学年高一下学期化学人教版(2019)必修第二册(共21页ppt)
文档属性
| 名称 | 实验活动5 不同价态含硫物质的转化 课件 2021-2022学年高一下学期化学人教版(2019)必修第二册(共21页ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-06 00:00:00 | ||
图片预览








文档简介
(共21张PPT)
普通高中教科书·统编版
高中化学 必修下册
实验活动5 不同价态含硫物质的转化
动手做实验
【实验目的】
1.通过实验加深对硫及其化合物性质的认识。
2.应用氧化还原反应原理实现不同价态含硫物质的转化。
【实验器材及试剂】
仪器:试管、托盘天平、量筒、酒精灯、铁架台、试管架、橡胶塞、乳胶管、胶头滴管、玻璃导管、石棉网(或陶土网)、玻璃棒、药匙、棉花、镊子、火柴。
试剂:浓硫酸、铜片、硫粉、铁粉、Na2S溶液、酸性KMnO4溶液、NaOH溶液、H2SO3溶液、品红溶液。
【实验过程和结论】
1.实验步骤
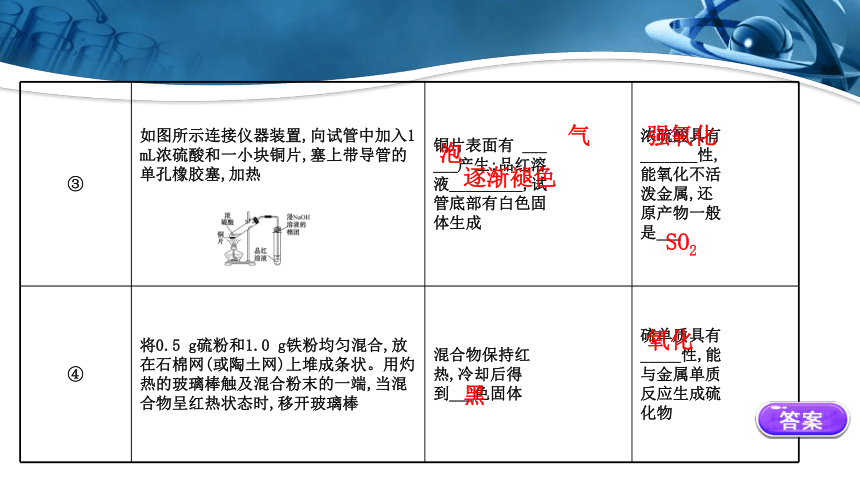
步骤 实验操作 实验现象 实验结论
① 在一支试管中加入1 mL Na2S 溶液,边振荡边向其中滴加 H2SO3溶液,用浸NaOH溶液的棉 团塞住试管口 试管中产 生_____ 色沉淀 Na2S作_____
剂,S被_____;
H2SO3作_____
剂,S被_____
② 在一支试管中加入1 mL Na2S 溶液,边振荡边滴加酸性 KMnO4溶液,用浸NaOH溶液的 棉团塞住试管口 紫红色褪 去,试管 中产生 _____色 沉淀 Na2S中S被
_____
淡黄
还原
氧化
氧化
还原
淡黄
氧化
③ 如图所示连接仪器装置,向试管中加入1 mL浓硫酸和一小块铜片,塞上带导管的单孔橡胶塞,加热 铜片表面有 ___ ___产生;品红溶 液_________,试 管底部有白色固 体生成 浓硫酸具有
_______性,
能氧化不活
泼金属,还
原产物一般
是___
④ 将0.5 g硫粉和1.0 g铁粉均匀混合,放在石棉网(或陶土网)上堆成条状。用灼热的玻璃棒触及混合粉末的一端,当混合物呈红热状态时,移开玻璃棒 混合物保持红 热,冷却后得 到___色固体 硫单质具有
_____性,能
与金属单质
反应生成硫
化物
气
泡
逐渐褪色
强氧化
SO2
黑
氧化
2.铁粉与硫粉在空气中混合燃烧时,可能发生哪些化学反应:Fe+S FeS,S+
O2 SO2, ___________________。
3.实验过程中可能遇到的问题有:①SO2的污染问题:②浓硫酸与铜反应后装置内
出现倒吸;③铁粉与硫粉不反应(铁粉过期失效)等。
3Fe+2O2 Fe3O4
素养再提升
【典例示范】
角度1 硫及其化合物的转化关系应用
【典例1】(2020·甘肃高一检测)海水中主要含有Na+、Cl-、Br-、 等离子,
火力发电时排放的烟气可用海水脱硫,其工艺流程如图所示:
(1)吸收塔中发生的反应有____________;
(2)氧化的主要目的是_________________________________。 写出亚硫酸被氧化的化学反应方程式_____________________________。
【解析】由流程分析可知吸收塔中发生的反应有SO2+H2O H2SO3,天然海水吸
收了含硫烟气后,要用O2进行氧化处理,因为氧气具有氧化性,所以能将H2SO3、
、 等氧化为硫酸,如亚硫酸被氧化的反应为2H2SO3+O2====2H2SO4。
答案:(1)SO2+H2O H2SO3
(2)将H2SO3、 、 等氧化为硫酸
2H2SO3+O2====2H2SO4
角度2 硫的转化与综合实验探究
【典例2】(2020·邯郸高一检测)某学习小组设计制取SO2并验证其部分性质的实验装置图如图(夹持装置省略),下列叙述正确的是 ( )
A.取反应后D中溶液少许,滴加品红溶液,红色褪去,就能说明SO2具有漂白性
B.A装置中比较理想的反应物质是Na2SO3固体和质量分数为10%的硫酸
C.B装置溶液变红色,说明SO2是酸性氧化物;C装置产生白色沉淀的原因为BaCl2+
SO2+H2O BaSO3↓+2HCl
D.关闭弹簧夹a,打开弹簧夹b,用酒精灯在三颈烧瓶下微热,若能观察到C中长导
管口有明显气泡产生,冷却后液体倒吸,就能判断装置A、B部分气密性良好
【解析】选D。A项,氯水中存在次氯酸具有漂白作用,也可以使品红溶液褪色,不能确定一定为二氧化硫的漂白性,故A错误;B项,二氧化硫易溶于水,比较理想的反应物质是亚硫酸钠固体和70%浓硫酸,故B错误;C项,C装置中产生的白色沉淀为BaSO4,错误;D项,检验装置中A、B两部分的气密性,进行的操作是:关闭弹簧夹a,打开弹簧夹b,用酒精灯在三颈烧瓶下微热,观察到C中长导管口有明显气泡产生,冷却后长导管中出现一段水柱,说明该装置气密性良好,故D正确。
【素养提升】
1.(2020·大同高一检测)下列说法正确的是 ( )
A.SO2和SO3都是酸性氧化物,二者的水溶液都是强酸
B.将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化
C.铜与硫化合的产物是CuS
D.富含硫黄的矿物在工业上可用于制造硫酸
【解析】选D。SO2溶于水形成亚硫酸,亚硫酸是弱酸,A项错误;常温下铜片和浓硫酸不反应,加热条件下才反应,B项错误;铜与硫化合的产物是Cu2S,C项错误。
2.下列关于含硫化合物的叙述不正确的是 ( )
A.浓硫酸和Na2SO3反应制取SO2时,浓硫酸只表现酸性
B.SO2能使碘与淀粉的混合溶液由蓝色变为无色,体现出漂白性
C.SO2能与CaO反应,可用生石灰作工业废气的脱硫剂
D.CuS不能直接用金属单质和硫单质反应制得
【解析】选B。A项,反应方程式为Na2SO3+H2SO4 (浓)====Na2SO4+SO2↑+H2O,浓硫酸化合价未发生改变,只表现酸性,A项正确;B项,二氧化硫与碘发生氧化还原反应,二氧化硫表现出还原性,B项错误;C项,SO2能与CaO反应,可用作脱硫剂,C项正确;D项,硫的非金属性较弱,与变价金属化合时,只能生成低价态硫化物,即Cu与硫反应只能生成Cu2S,D项正确。
3.(2020·临沂高一检测)常温下,将SO2气体逐渐通入某溶液,溶液pH随通入SO2气体体积变化如图所示,该溶液是 ( )
A.氨水
B.碳酸钠溶液
C.氢硫酸
D.氯水
【解析】选D。A项,氨水溶液呈碱性,所以V(SO2)=0时,pH大于7,故A错误;B项,碳酸钠溶液呈碱性,所以V(SO2)=0时,pH大于7,故B错误;C项,氢硫酸与二氧化硫反应生成单质硫和水,酸性减弱,所以起始时pH应增大,而不是减小,故C错误;D项,氯水与二氧化硫反应生成盐酸和硫酸,酸性增强,所以pH随二氧化硫的量的增大而减小,符合图示,故D正确。
4.已知X、Y均为有刺激性气味的气体,且几种物质间有以下转化关系,部分产物未标出。请回答下列问题。
(1)写出下列各物质的化学式:
X________、Y________、A________、B________、C______________。
(2)反应①的化学方程式为____________________________________,反应②的离子方程式为____________________________。
【解析】A与硝酸酸化的AgNO3溶液反应产生白色沉淀,A中含Cl-;B与盐酸酸化的
BaCl2溶液反应产生白色沉淀,B中含 ;又根据X、Y均为有刺激性气味的气体,
且X能与Fe反应,则X为Cl2,Y为SO2,A为HCl,B为H2SO4,C为FeCl3。
答案:(1)Cl2 SO2 HCl H2SO4 FeCl3
(2)Cl2+SO2+2H2O====2HCl+H2SO4 2Fe3++SO2+2H2O====2Fe2++ +4H+
普通高中教科书·统编版
高中化学 必修下册
实验活动5 不同价态含硫物质的转化
动手做实验
【实验目的】
1.通过实验加深对硫及其化合物性质的认识。
2.应用氧化还原反应原理实现不同价态含硫物质的转化。
【实验器材及试剂】
仪器:试管、托盘天平、量筒、酒精灯、铁架台、试管架、橡胶塞、乳胶管、胶头滴管、玻璃导管、石棉网(或陶土网)、玻璃棒、药匙、棉花、镊子、火柴。
试剂:浓硫酸、铜片、硫粉、铁粉、Na2S溶液、酸性KMnO4溶液、NaOH溶液、H2SO3溶液、品红溶液。
【实验过程和结论】
1.实验步骤
步骤 实验操作 实验现象 实验结论
① 在一支试管中加入1 mL Na2S 溶液,边振荡边向其中滴加 H2SO3溶液,用浸NaOH溶液的棉 团塞住试管口 试管中产 生_____ 色沉淀 Na2S作_____
剂,S被_____;
H2SO3作_____
剂,S被_____
② 在一支试管中加入1 mL Na2S 溶液,边振荡边滴加酸性 KMnO4溶液,用浸NaOH溶液的 棉团塞住试管口 紫红色褪 去,试管 中产生 _____色 沉淀 Na2S中S被
_____
淡黄
还原
氧化
氧化
还原
淡黄
氧化
③ 如图所示连接仪器装置,向试管中加入1 mL浓硫酸和一小块铜片,塞上带导管的单孔橡胶塞,加热 铜片表面有 ___ ___产生;品红溶 液_________,试 管底部有白色固 体生成 浓硫酸具有
_______性,
能氧化不活
泼金属,还
原产物一般
是___
④ 将0.5 g硫粉和1.0 g铁粉均匀混合,放在石棉网(或陶土网)上堆成条状。用灼热的玻璃棒触及混合粉末的一端,当混合物呈红热状态时,移开玻璃棒 混合物保持红 热,冷却后得 到___色固体 硫单质具有
_____性,能
与金属单质
反应生成硫
化物
气
泡
逐渐褪色
强氧化
SO2
黑
氧化
2.铁粉与硫粉在空气中混合燃烧时,可能发生哪些化学反应:Fe+S FeS,S+
O2 SO2, ___________________。
3.实验过程中可能遇到的问题有:①SO2的污染问题:②浓硫酸与铜反应后装置内
出现倒吸;③铁粉与硫粉不反应(铁粉过期失效)等。
3Fe+2O2 Fe3O4
素养再提升
【典例示范】
角度1 硫及其化合物的转化关系应用
【典例1】(2020·甘肃高一检测)海水中主要含有Na+、Cl-、Br-、 等离子,
火力发电时排放的烟气可用海水脱硫,其工艺流程如图所示:
(1)吸收塔中发生的反应有____________;
(2)氧化的主要目的是_________________________________。 写出亚硫酸被氧化的化学反应方程式_____________________________。
【解析】由流程分析可知吸收塔中发生的反应有SO2+H2O H2SO3,天然海水吸
收了含硫烟气后,要用O2进行氧化处理,因为氧气具有氧化性,所以能将H2SO3、
、 等氧化为硫酸,如亚硫酸被氧化的反应为2H2SO3+O2====2H2SO4。
答案:(1)SO2+H2O H2SO3
(2)将H2SO3、 、 等氧化为硫酸
2H2SO3+O2====2H2SO4
角度2 硫的转化与综合实验探究
【典例2】(2020·邯郸高一检测)某学习小组设计制取SO2并验证其部分性质的实验装置图如图(夹持装置省略),下列叙述正确的是 ( )
A.取反应后D中溶液少许,滴加品红溶液,红色褪去,就能说明SO2具有漂白性
B.A装置中比较理想的反应物质是Na2SO3固体和质量分数为10%的硫酸
C.B装置溶液变红色,说明SO2是酸性氧化物;C装置产生白色沉淀的原因为BaCl2+
SO2+H2O BaSO3↓+2HCl
D.关闭弹簧夹a,打开弹簧夹b,用酒精灯在三颈烧瓶下微热,若能观察到C中长导
管口有明显气泡产生,冷却后液体倒吸,就能判断装置A、B部分气密性良好
【解析】选D。A项,氯水中存在次氯酸具有漂白作用,也可以使品红溶液褪色,不能确定一定为二氧化硫的漂白性,故A错误;B项,二氧化硫易溶于水,比较理想的反应物质是亚硫酸钠固体和70%浓硫酸,故B错误;C项,C装置中产生的白色沉淀为BaSO4,错误;D项,检验装置中A、B两部分的气密性,进行的操作是:关闭弹簧夹a,打开弹簧夹b,用酒精灯在三颈烧瓶下微热,观察到C中长导管口有明显气泡产生,冷却后长导管中出现一段水柱,说明该装置气密性良好,故D正确。
【素养提升】
1.(2020·大同高一检测)下列说法正确的是 ( )
A.SO2和SO3都是酸性氧化物,二者的水溶液都是强酸
B.将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化
C.铜与硫化合的产物是CuS
D.富含硫黄的矿物在工业上可用于制造硫酸
【解析】选D。SO2溶于水形成亚硫酸,亚硫酸是弱酸,A项错误;常温下铜片和浓硫酸不反应,加热条件下才反应,B项错误;铜与硫化合的产物是Cu2S,C项错误。
2.下列关于含硫化合物的叙述不正确的是 ( )
A.浓硫酸和Na2SO3反应制取SO2时,浓硫酸只表现酸性
B.SO2能使碘与淀粉的混合溶液由蓝色变为无色,体现出漂白性
C.SO2能与CaO反应,可用生石灰作工业废气的脱硫剂
D.CuS不能直接用金属单质和硫单质反应制得
【解析】选B。A项,反应方程式为Na2SO3+H2SO4 (浓)====Na2SO4+SO2↑+H2O,浓硫酸化合价未发生改变,只表现酸性,A项正确;B项,二氧化硫与碘发生氧化还原反应,二氧化硫表现出还原性,B项错误;C项,SO2能与CaO反应,可用作脱硫剂,C项正确;D项,硫的非金属性较弱,与变价金属化合时,只能生成低价态硫化物,即Cu与硫反应只能生成Cu2S,D项正确。
3.(2020·临沂高一检测)常温下,将SO2气体逐渐通入某溶液,溶液pH随通入SO2气体体积变化如图所示,该溶液是 ( )
A.氨水
B.碳酸钠溶液
C.氢硫酸
D.氯水
【解析】选D。A项,氨水溶液呈碱性,所以V(SO2)=0时,pH大于7,故A错误;B项,碳酸钠溶液呈碱性,所以V(SO2)=0时,pH大于7,故B错误;C项,氢硫酸与二氧化硫反应生成单质硫和水,酸性减弱,所以起始时pH应增大,而不是减小,故C错误;D项,氯水与二氧化硫反应生成盐酸和硫酸,酸性增强,所以pH随二氧化硫的量的增大而减小,符合图示,故D正确。
4.已知X、Y均为有刺激性气味的气体,且几种物质间有以下转化关系,部分产物未标出。请回答下列问题。
(1)写出下列各物质的化学式:
X________、Y________、A________、B________、C______________。
(2)反应①的化学方程式为____________________________________,反应②的离子方程式为____________________________。
【解析】A与硝酸酸化的AgNO3溶液反应产生白色沉淀,A中含Cl-;B与盐酸酸化的
BaCl2溶液反应产生白色沉淀,B中含 ;又根据X、Y均为有刺激性气味的气体,
且X能与Fe反应,则X为Cl2,Y为SO2,A为HCl,B为H2SO4,C为FeCl3。
答案:(1)Cl2 SO2 HCl H2SO4 FeCl3
(2)Cl2+SO2+2H2O====2HCl+H2SO4 2Fe3++SO2+2H2O====2Fe2++ +4H+
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
