实验活动4 用化学沉淀法去除粗盐中的杂质离课件 2021-2022学年高一化学人教版(2019)必修第二册(共15页ppt)
文档属性
| 名称 | 实验活动4 用化学沉淀法去除粗盐中的杂质离课件 2021-2022学年高一化学人教版(2019)必修第二册(共15页ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 400.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-06 11:20:58 | ||
图片预览






文档简介
(共15张PPT)
实验活动4 用化学沉淀法去除粗盐中的杂质离子
考点一
用化学沉淀法去除粗盐中的杂质离子
1 知识梳理
1.水资源的利用
淡化
循环冷却
蒸馏
离子交换
2.海水中化学资源的开发利用
(1)氯碱工业
①电解NaCl溶液:(写出化学方程式,下同)
_______________________________________________________;
②产物制盐酸:___________________________________;
③制漂白液:_________________________________________。
MgCl2
MgCl2
Br2
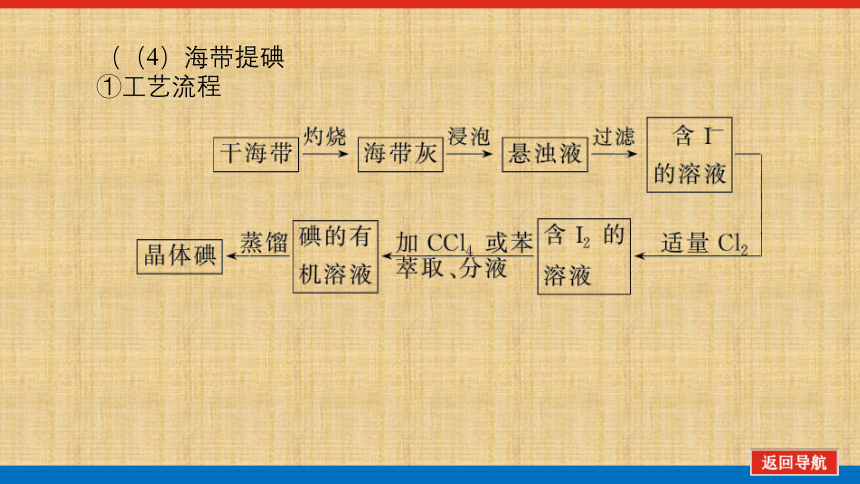
((4)海带提碘
①工艺流程
②两种原理
a.主要的化学原理:_________________________。
b.主要的物理原理:单质碘用CCl4或苯萃取,分液后用蒸馏法将碘与有机溶剂分开。
Cl2+2KI===2KCl+I2
3.海水其他资源的开发利用
(1)从海水中提取核能、开发的重要原料: 。
(2)潮汐能、波浪能是有待开发的新型能源。
铀和重水
[判断] (正确的打“√”,错误的打“×”)
(1)从海水中提取物质都必须通过化学反应才能实现( )
(2)海水淡化的方法有蒸馏法、电渗析法、明矾净化法等( )
(3)实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取( )
(4)海水中提取镁所涉及的化学反应全都是氧化还原反应( )
(5)将氯化镁晶体(MgCl2·6H2O)直接加热可制得无水氯化镁( )
(6)碘是人体必需的微量元素,所以要多吃富含高碘酸的食物( )
×
×
×
×
×
×
[提醒]
海水蒸馏原理装置图及注意事项:
注意以下几点:
(1)温度计水银球的位置是否位于支管口
(2)水流方向是否为自下而上
(3)为防止暴沸应加碎瓷片或沸石
(4)应垫石棉网对蒸馏烧瓶加热
2 对点速练
练点一 提取碘的实验
1.从海带中提取碘的实验过程涉及下列操作,其中正确的是( )
答案:D
解析:灼烧海带应用坩埚,A项错误;过滤时应用玻璃棒引流,B项错误;苯的密度比水的小,萃取了单质碘的苯在上层,应从分液漏斗的上口倒出,C项错误。
2.为了从海带浸取液中提取碘,某同学设计了如图实验方案,下列说法正确的是( )
A.①中反应的离子方程式:2I-+H2O2===I2+2OH-
B.②中分液时含I2的CCl4溶液从分液漏斗上口倒出
C.③中得到的上层溶液中含有I-
D.操作Z的名称是加热
答案:C
解析:A项,反应为酸性环境,①中反应的离子方程式:2I-+2H++H2O2===I2+2H2O,故A错误;B项,四氯化碳比水密度大,在下层,②中分液时含I2的CCl4溶液从分液漏斗下口倒出,故B错误;D项,操作Z的名称是过滤,故D错误。
实验活动4 用化学沉淀法去除粗盐中的杂质离子
考点一
用化学沉淀法去除粗盐中的杂质离子
1 知识梳理
1.水资源的利用
淡化
循环冷却
蒸馏
离子交换
2.海水中化学资源的开发利用
(1)氯碱工业
①电解NaCl溶液:(写出化学方程式,下同)
_______________________________________________________;
②产物制盐酸:___________________________________;
③制漂白液:_________________________________________。
MgCl2
MgCl2
Br2
((4)海带提碘
①工艺流程
②两种原理
a.主要的化学原理:_________________________。
b.主要的物理原理:单质碘用CCl4或苯萃取,分液后用蒸馏法将碘与有机溶剂分开。
Cl2+2KI===2KCl+I2
3.海水其他资源的开发利用
(1)从海水中提取核能、开发的重要原料: 。
(2)潮汐能、波浪能是有待开发的新型能源。
铀和重水
[判断] (正确的打“√”,错误的打“×”)
(1)从海水中提取物质都必须通过化学反应才能实现( )
(2)海水淡化的方法有蒸馏法、电渗析法、明矾净化法等( )
(3)实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取( )
(4)海水中提取镁所涉及的化学反应全都是氧化还原反应( )
(5)将氯化镁晶体(MgCl2·6H2O)直接加热可制得无水氯化镁( )
(6)碘是人体必需的微量元素,所以要多吃富含高碘酸的食物( )
×
×
×
×
×
×
[提醒]
海水蒸馏原理装置图及注意事项:
注意以下几点:
(1)温度计水银球的位置是否位于支管口
(2)水流方向是否为自下而上
(3)为防止暴沸应加碎瓷片或沸石
(4)应垫石棉网对蒸馏烧瓶加热
2 对点速练
练点一 提取碘的实验
1.从海带中提取碘的实验过程涉及下列操作,其中正确的是( )
答案:D
解析:灼烧海带应用坩埚,A项错误;过滤时应用玻璃棒引流,B项错误;苯的密度比水的小,萃取了单质碘的苯在上层,应从分液漏斗的上口倒出,C项错误。
2.为了从海带浸取液中提取碘,某同学设计了如图实验方案,下列说法正确的是( )
A.①中反应的离子方程式:2I-+H2O2===I2+2OH-
B.②中分液时含I2的CCl4溶液从分液漏斗上口倒出
C.③中得到的上层溶液中含有I-
D.操作Z的名称是加热
答案:C
解析:A项,反应为酸性环境,①中反应的离子方程式:2I-+2H++H2O2===I2+2H2O,故A错误;B项,四氯化碳比水密度大,在下层,②中分液时含I2的CCl4溶液从分液漏斗下口倒出,故B错误;D项,操作Z的名称是过滤,故D错误。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
