高三化学专题复习二 常见无机物
图片预览

文档简介
高三化学专题复习二 常见无机物(1)
【考点要求】元素及其化合物知识的考查范畴来源于必修一、必修二和选修四等课本内容。
(1)了解常见非金属(H、C、N、O、S、Si、Cl等)及其化合物的主要性质和重要应用。
(2)认识化学在海水、金属矿物等自然资源综合利用和实现物质间转化等方面的实际应用。 [11考纲:(4)认识化学在海水、金属矿物等自然资源综合利用方面的重要作用。]
【教学过程】
非金属及其化合物
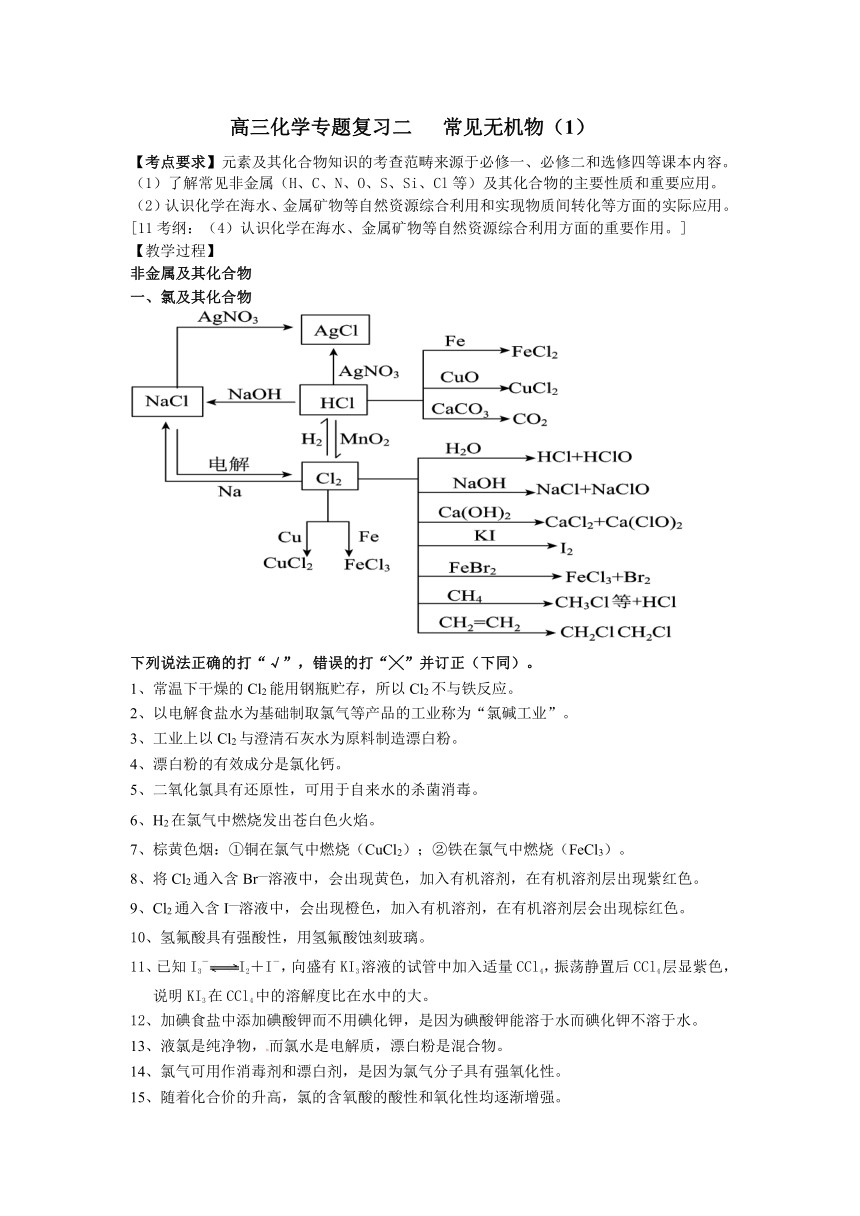
一、氯及其化合物
下列说法正确的打“√”,错误的打“╳”并订正(下同)。
1、常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应。
2、以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”。
3、工业上以Cl2与澄清石灰水为原料制造漂白粉。
4、漂白粉的有效成分是氯化钙。
5、二氧化氯具有还原性,可用于自来水的杀菌消毒。
6、H2在氯气中燃烧发出苍白色火焰。
7、棕黄色烟:①铜在氯气中燃烧(CuCl2);②铁在氯气中燃烧(FeCl3)。
8、将Cl2通入含Br—溶液中,会出现黄色,加入有机溶剂,在有机溶剂层出现紫红色。
9、Cl2通入含I—溶液中,会出现橙色,加入有机溶剂,在有机溶剂层会出现棕红色。
10、氢氟酸具有强酸性,用氢氟酸蚀刻玻璃。
11、已知I3-I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大。
12、加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水。
13、液氯是纯净物,而氯水是电解质,漂白粉是混合物。
14、氯气可用作消毒剂和漂白剂,是因为氯气分子具有强氧化性。
15、随着化合价的升高,氯的含氧酸的酸性和氧化性均逐渐增强。
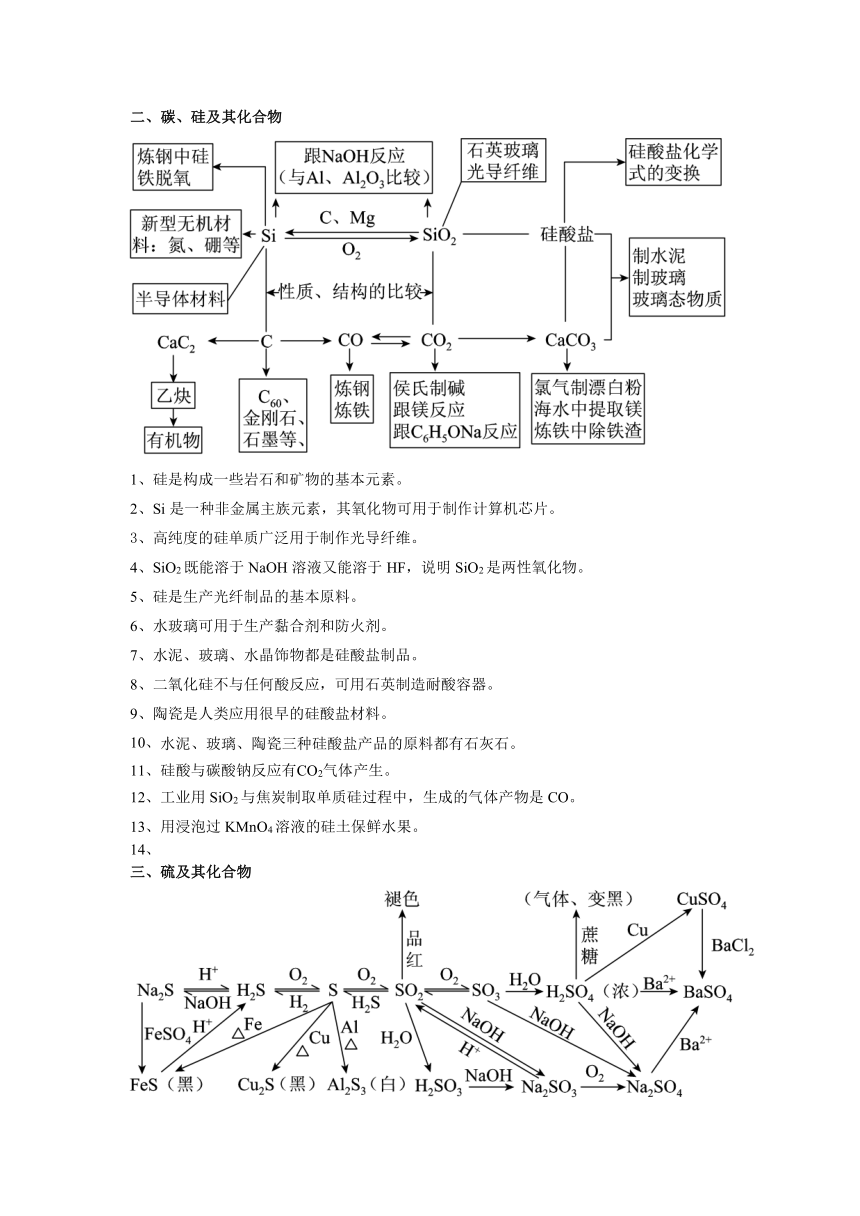
二、碳、硅及其化合物
1、硅是构成一些岩石和矿物的基本元素。
2、Si是一种非金属主族元素,其氧化物可用于制作计算机芯片。
3、高纯度的硅单质广泛用于制作光导纤维。
4、SiO2既能溶于NaOH溶液又能溶于HF,说明SiO2是两性氧化物。
5、硅是生产光纤制品的基本原料。
6、水玻璃可用于生产黏合剂和防火剂。
7、水泥、玻璃、水晶饰物都是硅酸盐制品。
8、二氧化硅不与任何酸反应,可用石英制造耐酸容器。
9、陶瓷是人类应用很早的硅酸盐材料。
10、水泥、玻璃、陶瓷三种硅酸盐产品的原料都有石灰石。
11、硅酸与碳酸钠反应有CO2气体产生。
12、工业用SiO2与焦炭制取单质硅过程中,生成的气体产物是CO。
13、用浸泡过KMnO4溶液的硅土保鲜水果。
14、
三、硫及其化合物
1、SO2 具有氧化性,可用于漂白纸浆。
2、SO2气体具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色。
3、二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气。
4、除去干燥CO2中混有的少量SO2,可将混合气体依次通过酸性KMnO4溶液、浓硫酸。
5、SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力。
6、SO2具有漂白性,可使酸性高锰酸钾溶液褪色。
7、用SO2熏蒸粉丝等食品使其增白。
8、在某溶液中加入盐酸酸化的BaCl2溶液,如果生成白色沉淀,则原溶液中一定有SO42—。
9、向燃煤中加石灰石进行脱硫处理,最终得到硫酸钙。
10、在医疗上可用碳酸钡作检查肠胃的内服药剂,俗称“钡餐”。
11、硫在空气中燃烧的产物是SO2,在纯净氧气中燃烧的产物是SO3
12、浓硫酸能干燥SO2等气体,说明浓硫酸具有吸水性。
13、二氧化硫和氯气均可使有色物褪色且漂白原理相同。
四、氮及其化合物
1、N2与O2在放电时反应生成NO,此反应用于工业上制硝酸
2、氮的氧化物会造成硝酸型酸雨、光化学烟雾、破坏臭氧层等环境问题。
3、氨气是一种碱性气体,可用P2O5或无水CaCl2干燥。
4、氨气具有氧化性,用浓氨水检验氯气管道是否泄漏
5、NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏
6、在某盐溶液中加入浓NaOH溶液,加热后如果生成气体使湿润的红色石蕊试纸变蓝,
则原溶液一定是铵盐溶液
7、浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
【巩固练习】
1.下列物质的转化在给定条件下能实现的是
① SO2H2SO3 H2SO4 ② NH3NO2HNO3
③ CaCl2CaCO3CaO ④ NaAlO2 (aq)Al(OH)3Al2O3
A.②③ B.①④ C.②④ D.③④
2.向FeCl3和BaCl2的混合液中通入过量SO2,有白色沉淀产生。下列说法正确的是
A.白色沉淀为BaSO3 B.该实验表明FeCl3有还原性
C.反应后溶液酸性增强 D.反应后向溶液中滴加KSCN溶液,显血红色
3.下列描述违背化学原理的是
A.NaHCO3溶液与NaAlO2溶液混合会产生白色沉淀,说明HCO3-比Al(OH)3更易电离出H+
B.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性
C.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成有色产物
D. 在KI溶液中加入氯化银,一段时间后沉淀变成黄色,说明同温下Ksp(AgI)< Ksp(AgCl)
4.下列根据实验操作和现象所得出的结论不正确的是
选项
实验操作
实验现象
结 论
A
测定等浓度的Na2CO3和Na2SO3 溶液的pH
前者pH比后者的大
非金属性:S>C
B
SO2通入酸性高锰酸钾溶液
高锰酸钾溶液褪色
SO2具有漂白性
C
溴乙烷与NaOH溶液共热后,加HNO3酸化的AgNO3溶液
出现淡黄色沉淀
溴乙烷发生了水解
D
向等浓度的KBr、KI混合液中滴加AgNO3溶液
先出现黄色沉淀
Ksp(AgBr)> Ksp(AgI)
5.下列实验现象可用同一原理解释的是
A.品红溶液中分别通入SO2和Cl2,品红均褪色
B.溴水分别滴入植物油和裂化汽油中,溴水均褪色
C.鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出
D.分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结
高三化学专题复习三 常见无机物(2)
【考点要求】元素及其化合物知识的考查范畴来源于必修一、必修二和选修四等课本内容。
(1)理解并能应用常见金属的活动顺序。
(2)了解常见金属(如Na、Al、Fe、Cu等)及其重要化合物的主要性质和重要应用。
(3)了解金属材料在生产和生活中的重要应用。认识常见无机物在生产中的应用和对生态环境的影响。
【教学过程】
金属及其化合物
一、钠及其化合物
1、金属钠具有强的还原性,可利用钠和TiCl4溶液反应制取金属Ti。
2、钠在敞口容器中长期存放和在空气中燃烧的产物都是Na2O2。
3、用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2
反应是放热反应。
4、滴有酚酞的碳酸氢钠溶液呈浅红色,微热后红色加深,是因为碳酸氢钠分解生成了
碳酸钠。
5、Na2O2具有强氧化性,可用作呼吸面具、潜艇的供氧剂。
6、.Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒。
7、NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂。
8、25℃,NaHCO3在水中的溶解度比Na2CO3的大。
9、锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去。
10、联合制碱法是将二氧化碳和氨气通入饱和氯化钠溶液中生成碳酸钠。
二、铝及其化合物
1、Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品。
2、氧化铝熔点很高,可用作制造高温耐火材料,如制耐火砖、坩埚等。
3、铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝。
4、常温下浓硫酸能是铝发生钝化,可在常温下作用铝制贮藏贮运浓硫酸。
5、铝制容器可以贮运稀硝酸。
6、明矾能水解生成Al(OH)3 胶体,可用作净水剂。
7、自来水厂可用明矾对水进行消毒杀菌。
8、常温下,铝能被浓硝酸钝化,可用铝槽车运输浓硝酸。
9、MgO的熔点很高,可用于制作耐高温材料。
10、镁在空气中和纯净氧气中燃烧的产物都只有MgO。
11、Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹。
12、氯化铝受热易升华,加压下加热得到的熔融氯化铝不导电,故氯化铝是共价化合物
三、铁及其化合物
1、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物。
2、向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体。
3、取少量溶液X,向其中加入适量新制氨水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+。
4、氢氧化铁胶体具有很强的吸附性,可用于除去水中的所有杂质。
5、Fe2O3可用作外墙涂料。
6、FeCl3 溶液能与Cu 反应,可用于蚀刻印刷电路。
7、K2FeO4具有强还原性,可用于自来水的杀菌消毒。
8、K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于净化自来水并杀菌消毒。
9、自来水厂可用硫酸铁对水进行消毒杀菌。
10、铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸。
11、Zn具有还原性和导电性,可用作锌锰干电池的负极材料。
12、粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强。
13、铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀。
有机化合物
1、糖类、油脂、蛋白质在一定条件下均可以水解。
2、盐析可提纯蛋白质并保持其生理活性。
3、石油分馏可获得乙烯、丙烯和丁二烯。
4、石油的催化裂化及裂解可以得到较多的轻质油和气态烯烃。
5、向溴水中滴入植物油,振荡后,油层显无色,说明溴不溶于油脂。
6、室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚。
7、蛋白质溶液中加入浓的硫酸钠溶液,有沉淀析出,这种作用称为变性。
8、检验蔗糖水解产物具有还原性:在蔗糖水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液并水浴加热。
9、福尔马林用于浸泡生物标本和水产品保鲜。
【巩固练习】
1.下列实验的解释或结论不正确的是
选项
实验
解释或结论
A.
向某溶液中加入NaOH并微热,产生能使湿润的红色石蕊试纸变蓝的气体
原溶液中一定存在NH4+
B.
铜粉不能溶于冷的浓硫酸
铜在冷的浓硫酸中发生钝化
C.
用激光笔照射水玻璃溶液,有丁达尔现象
SiO32—水解生成硅酸胶体
D.
向FeC12溶液中通入C12,溶液由浅绿色变为黄色
C12的氧化性比FeC13的强
2 .甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,满足图示转化关系的是
甲
乙
丙
戊
①
NH3
O2
NO
H2O
②
Fe
H2O
H2
Fe2O3
③
Al2O3
NaOH溶液
Na AlO2溶液
过量CO2
④
Na2O2
CO2
O2
Na
A.①③ B.②③ C.②④ D.①④
3.下列描述违背化学原理的是
A.NaHCO3溶液与NaAlO2溶液混合会产生白色沉淀,说明HCO3-比Al(OH)3更易电离出H+
B.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性
C.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成有色产物
D. 在KI溶液中加入氯化银,一段时间后沉淀变成黄色,说明同温下Ksp(AgI)< Ksp(AgCl)
4. 下列物质的制备与工业生产相符的是
①NH3 NO HNO3
②浓HCl Cl2 漂白粉
③ MgCl2(aq) 无水MgCl2 Mg
④ 饱和NaCl(aq) NaHCO3 Na2CO3
⑤ 铝土矿 NaAlO2溶液 Al(OH)3 Al2O3 Al
A.①④⑤ B.①③⑤ C.②③④ D.②④⑤
5.下列实验操作、现象与结论对应关系正确的是
选项
实验操作
实验现象
结 论
A
向某溶液中先滴加盐酸无现象,再滴加BaCl2溶液
有白色沉淀
生成
原溶液中含有SO42-
B
向AgCl沉淀中滴入稀KI溶液
白色沉淀
变黄
AgI比AgCl
更难溶
C
向无水乙醇中加入浓H2SO4,加热至170°C,将产生的气体通入酸性KMnO4溶液
紫红色褪去
使溶液褪色的气体一定是乙烯
D
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热
无砖红色
沉淀生成
淀粉没有水解生
成葡萄糖
6.下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向FeC12溶液中通入适量C12
溶液由浅绿
色变为黄色
C12的氧化性比FeC13的强
B
淀粉溶液在硫酸存在下水解一段时间后直接与银氨溶液混合
无银镜出现
淀粉没有水解
C
向澄清石灰水中通入某种气体
出现白色沉淀
该气体一定是CO2
D
BaSO4固体加入饱和Na2CO3溶液中,过滤,向滤渣中加入盐酸
有气体生成
7、写出下列离子的检验方法。
SO42-:
NH4+:
含Fe2+、Fe3+的混合液:
【考点要求】元素及其化合物知识的考查范畴来源于必修一、必修二和选修四等课本内容。
(1)了解常见非金属(H、C、N、O、S、Si、Cl等)及其化合物的主要性质和重要应用。
(2)认识化学在海水、金属矿物等自然资源综合利用和实现物质间转化等方面的实际应用。 [11考纲:(4)认识化学在海水、金属矿物等自然资源综合利用方面的重要作用。]
【教学过程】
非金属及其化合物
一、氯及其化合物
下列说法正确的打“√”,错误的打“╳”并订正(下同)。
1、常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应。
2、以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”。
3、工业上以Cl2与澄清石灰水为原料制造漂白粉。
4、漂白粉的有效成分是氯化钙。
5、二氧化氯具有还原性,可用于自来水的杀菌消毒。
6、H2在氯气中燃烧发出苍白色火焰。
7、棕黄色烟:①铜在氯气中燃烧(CuCl2);②铁在氯气中燃烧(FeCl3)。
8、将Cl2通入含Br—溶液中,会出现黄色,加入有机溶剂,在有机溶剂层出现紫红色。
9、Cl2通入含I—溶液中,会出现橙色,加入有机溶剂,在有机溶剂层会出现棕红色。
10、氢氟酸具有强酸性,用氢氟酸蚀刻玻璃。
11、已知I3-I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大。
12、加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水。
13、液氯是纯净物,而氯水是电解质,漂白粉是混合物。
14、氯气可用作消毒剂和漂白剂,是因为氯气分子具有强氧化性。
15、随着化合价的升高,氯的含氧酸的酸性和氧化性均逐渐增强。
二、碳、硅及其化合物
1、硅是构成一些岩石和矿物的基本元素。
2、Si是一种非金属主族元素,其氧化物可用于制作计算机芯片。
3、高纯度的硅单质广泛用于制作光导纤维。
4、SiO2既能溶于NaOH溶液又能溶于HF,说明SiO2是两性氧化物。
5、硅是生产光纤制品的基本原料。
6、水玻璃可用于生产黏合剂和防火剂。
7、水泥、玻璃、水晶饰物都是硅酸盐制品。
8、二氧化硅不与任何酸反应,可用石英制造耐酸容器。
9、陶瓷是人类应用很早的硅酸盐材料。
10、水泥、玻璃、陶瓷三种硅酸盐产品的原料都有石灰石。
11、硅酸与碳酸钠反应有CO2气体产生。
12、工业用SiO2与焦炭制取单质硅过程中,生成的气体产物是CO。
13、用浸泡过KMnO4溶液的硅土保鲜水果。
14、
三、硫及其化合物
1、SO2 具有氧化性,可用于漂白纸浆。
2、SO2气体具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色。
3、二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气。
4、除去干燥CO2中混有的少量SO2,可将混合气体依次通过酸性KMnO4溶液、浓硫酸。
5、SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力。
6、SO2具有漂白性,可使酸性高锰酸钾溶液褪色。
7、用SO2熏蒸粉丝等食品使其增白。
8、在某溶液中加入盐酸酸化的BaCl2溶液,如果生成白色沉淀,则原溶液中一定有SO42—。
9、向燃煤中加石灰石进行脱硫处理,最终得到硫酸钙。
10、在医疗上可用碳酸钡作检查肠胃的内服药剂,俗称“钡餐”。
11、硫在空气中燃烧的产物是SO2,在纯净氧气中燃烧的产物是SO3
12、浓硫酸能干燥SO2等气体,说明浓硫酸具有吸水性。
13、二氧化硫和氯气均可使有色物褪色且漂白原理相同。
四、氮及其化合物
1、N2与O2在放电时反应生成NO,此反应用于工业上制硝酸
2、氮的氧化物会造成硝酸型酸雨、光化学烟雾、破坏臭氧层等环境问题。
3、氨气是一种碱性气体,可用P2O5或无水CaCl2干燥。
4、氨气具有氧化性,用浓氨水检验氯气管道是否泄漏
5、NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏
6、在某盐溶液中加入浓NaOH溶液,加热后如果生成气体使湿润的红色石蕊试纸变蓝,
则原溶液一定是铵盐溶液
7、浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
【巩固练习】
1.下列物质的转化在给定条件下能实现的是
① SO2H2SO3 H2SO4 ② NH3NO2HNO3
③ CaCl2CaCO3CaO ④ NaAlO2 (aq)Al(OH)3Al2O3
A.②③ B.①④ C.②④ D.③④
2.向FeCl3和BaCl2的混合液中通入过量SO2,有白色沉淀产生。下列说法正确的是
A.白色沉淀为BaSO3 B.该实验表明FeCl3有还原性
C.反应后溶液酸性增强 D.反应后向溶液中滴加KSCN溶液,显血红色
3.下列描述违背化学原理的是
A.NaHCO3溶液与NaAlO2溶液混合会产生白色沉淀,说明HCO3-比Al(OH)3更易电离出H+
B.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性
C.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成有色产物
D. 在KI溶液中加入氯化银,一段时间后沉淀变成黄色,说明同温下Ksp(AgI)< Ksp(AgCl)
4.下列根据实验操作和现象所得出的结论不正确的是
选项
实验操作
实验现象
结 论
A
测定等浓度的Na2CO3和Na2SO3 溶液的pH
前者pH比后者的大
非金属性:S>C
B
SO2通入酸性高锰酸钾溶液
高锰酸钾溶液褪色
SO2具有漂白性
C
溴乙烷与NaOH溶液共热后,加HNO3酸化的AgNO3溶液
出现淡黄色沉淀
溴乙烷发生了水解
D
向等浓度的KBr、KI混合液中滴加AgNO3溶液
先出现黄色沉淀
Ksp(AgBr)> Ksp(AgI)
5.下列实验现象可用同一原理解释的是
A.品红溶液中分别通入SO2和Cl2,品红均褪色
B.溴水分别滴入植物油和裂化汽油中,溴水均褪色
C.鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出
D.分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结
高三化学专题复习三 常见无机物(2)
【考点要求】元素及其化合物知识的考查范畴来源于必修一、必修二和选修四等课本内容。
(1)理解并能应用常见金属的活动顺序。
(2)了解常见金属(如Na、Al、Fe、Cu等)及其重要化合物的主要性质和重要应用。
(3)了解金属材料在生产和生活中的重要应用。认识常见无机物在生产中的应用和对生态环境的影响。
【教学过程】
金属及其化合物
一、钠及其化合物
1、金属钠具有强的还原性,可利用钠和TiCl4溶液反应制取金属Ti。
2、钠在敞口容器中长期存放和在空气中燃烧的产物都是Na2O2。
3、用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2
反应是放热反应。
4、滴有酚酞的碳酸氢钠溶液呈浅红色,微热后红色加深,是因为碳酸氢钠分解生成了
碳酸钠。
5、Na2O2具有强氧化性,可用作呼吸面具、潜艇的供氧剂。
6、.Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒。
7、NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂。
8、25℃,NaHCO3在水中的溶解度比Na2CO3的大。
9、锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去。
10、联合制碱法是将二氧化碳和氨气通入饱和氯化钠溶液中生成碳酸钠。
二、铝及其化合物
1、Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品。
2、氧化铝熔点很高,可用作制造高温耐火材料,如制耐火砖、坩埚等。
3、铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝。
4、常温下浓硫酸能是铝发生钝化,可在常温下作用铝制贮藏贮运浓硫酸。
5、铝制容器可以贮运稀硝酸。
6、明矾能水解生成Al(OH)3 胶体,可用作净水剂。
7、自来水厂可用明矾对水进行消毒杀菌。
8、常温下,铝能被浓硝酸钝化,可用铝槽车运输浓硝酸。
9、MgO的熔点很高,可用于制作耐高温材料。
10、镁在空气中和纯净氧气中燃烧的产物都只有MgO。
11、Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹。
12、氯化铝受热易升华,加压下加热得到的熔融氯化铝不导电,故氯化铝是共价化合物
三、铁及其化合物
1、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物。
2、向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体。
3、取少量溶液X,向其中加入适量新制氨水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+。
4、氢氧化铁胶体具有很强的吸附性,可用于除去水中的所有杂质。
5、Fe2O3可用作外墙涂料。
6、FeCl3 溶液能与Cu 反应,可用于蚀刻印刷电路。
7、K2FeO4具有强还原性,可用于自来水的杀菌消毒。
8、K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于净化自来水并杀菌消毒。
9、自来水厂可用硫酸铁对水进行消毒杀菌。
10、铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸。
11、Zn具有还原性和导电性,可用作锌锰干电池的负极材料。
12、粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强。
13、铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀。
有机化合物
1、糖类、油脂、蛋白质在一定条件下均可以水解。
2、盐析可提纯蛋白质并保持其生理活性。
3、石油分馏可获得乙烯、丙烯和丁二烯。
4、石油的催化裂化及裂解可以得到较多的轻质油和气态烯烃。
5、向溴水中滴入植物油,振荡后,油层显无色,说明溴不溶于油脂。
6、室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚。
7、蛋白质溶液中加入浓的硫酸钠溶液,有沉淀析出,这种作用称为变性。
8、检验蔗糖水解产物具有还原性:在蔗糖水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液并水浴加热。
9、福尔马林用于浸泡生物标本和水产品保鲜。
【巩固练习】
1.下列实验的解释或结论不正确的是
选项
实验
解释或结论
A.
向某溶液中加入NaOH并微热,产生能使湿润的红色石蕊试纸变蓝的气体
原溶液中一定存在NH4+
B.
铜粉不能溶于冷的浓硫酸
铜在冷的浓硫酸中发生钝化
C.
用激光笔照射水玻璃溶液,有丁达尔现象
SiO32—水解生成硅酸胶体
D.
向FeC12溶液中通入C12,溶液由浅绿色变为黄色
C12的氧化性比FeC13的强
2 .甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,满足图示转化关系的是
甲
乙
丙
戊
①
NH3
O2
NO
H2O
②
Fe
H2O
H2
Fe2O3
③
Al2O3
NaOH溶液
Na AlO2溶液
过量CO2
④
Na2O2
CO2
O2
Na
A.①③ B.②③ C.②④ D.①④
3.下列描述违背化学原理的是
A.NaHCO3溶液与NaAlO2溶液混合会产生白色沉淀,说明HCO3-比Al(OH)3更易电离出H+
B.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性
C.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成有色产物
D. 在KI溶液中加入氯化银,一段时间后沉淀变成黄色,说明同温下Ksp(AgI)< Ksp(AgCl)
4. 下列物质的制备与工业生产相符的是
①NH3 NO HNO3
②浓HCl Cl2 漂白粉
③ MgCl2(aq) 无水MgCl2 Mg
④ 饱和NaCl(aq) NaHCO3 Na2CO3
⑤ 铝土矿 NaAlO2溶液 Al(OH)3 Al2O3 Al
A.①④⑤ B.①③⑤ C.②③④ D.②④⑤
5.下列实验操作、现象与结论对应关系正确的是
选项
实验操作
实验现象
结 论
A
向某溶液中先滴加盐酸无现象,再滴加BaCl2溶液
有白色沉淀
生成
原溶液中含有SO42-
B
向AgCl沉淀中滴入稀KI溶液
白色沉淀
变黄
AgI比AgCl
更难溶
C
向无水乙醇中加入浓H2SO4,加热至170°C,将产生的气体通入酸性KMnO4溶液
紫红色褪去
使溶液褪色的气体一定是乙烯
D
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热
无砖红色
沉淀生成
淀粉没有水解生
成葡萄糖
6.下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向FeC12溶液中通入适量C12
溶液由浅绿
色变为黄色
C12的氧化性比FeC13的强
B
淀粉溶液在硫酸存在下水解一段时间后直接与银氨溶液混合
无银镜出现
淀粉没有水解
C
向澄清石灰水中通入某种气体
出现白色沉淀
该气体一定是CO2
D
BaSO4固体加入饱和Na2CO3溶液中,过滤,向滤渣中加入盐酸
有气体生成
7、写出下列离子的检验方法。
SO42-:
NH4+:
含Fe2+、Fe3+的混合液:
同课章节目录
