化学:第1章《认识化学科学》复习课件(鲁科版必修1)
文档属性
| 名称 | 化学:第1章《认识化学科学》复习课件(鲁科版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 609.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-03-29 00:00:00 | ||
图片预览






文档简介
课件18张PPT。第一章 认识化学科学
1 化学是创造性的、实用的科学
2 化学科学的形成发展
3 化学科学的探索空间一.走进化学科学化学的定义 化学就是在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。
化学的特征就是认识分子和制造分子,它是一门具有创造性的、实用的科学。化学科学的形成发展古代化学
近代化学
近代化学的发展里程碑
(1)1661年,英国化学家、物理学家波义耳提出化学元素的概念,标志着近代化学的诞生。
(2)1771年,法国化学家拉瓦锡建立燃烧现象的氧化学说,使近代化学取得了革命性的进步。
(3)1803年,英国物理学家、化学家道尔顿提出原子学说,为近代化学的发展奠定了坚实的基础。
(4)1869年,俄国化学家门捷列夫发现元素周期律,把化学元素及其化合物纳入一个统一的理论体系。
现代化学二、研究物质性质的方法和程序1 研究物质性质的基本方法观察法实验法分类法比较法2 研究物质性质的基本程序观察物质的外观性质预测物质性质实验和观察解释及结论发现特殊现象,
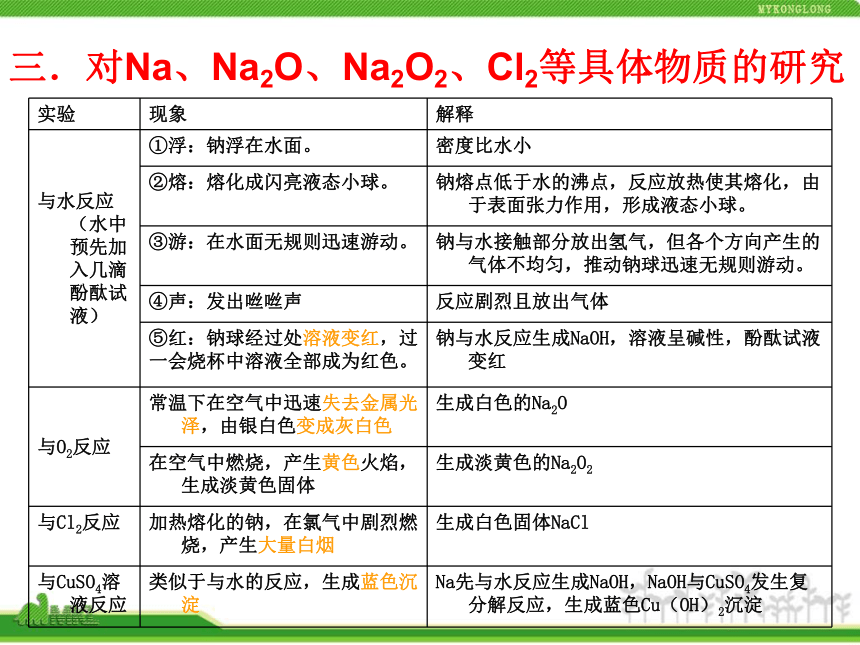
提出新问题三.对Na、Na2O、Na2O2、Cl2等具体物质的研究 2. Na2O、Na2O2的化学性质实验探究3.氯气的化学性质实验探究4.氯水成分的实验探究四个概念的解析化学中常用的物理量—物质的量物质的质量(g)气体的体积
(标况)(L)物质的量(mol)气体物质
的分子数物质的
微粒数溶质的
质量( g )溶质的
微粒数物质的量浓度(mol/L)溶质的质量分数溶质的物质的量
(mol)摩尔质量(g/mol)摩尔质量(g/mol)NANANA溶液体积(L)摩尔体积(L/mol)气体密度(g/L)溶质的摩尔质量、密度一定体积溶液的配制(1)常用主要的仪器
(2)主要操作
(3)误差分析主要操作1 计算
2 量取
3 溶解和冷却
4 转移
5 洗涤
6 旋摇
7 定容
8 摇匀
9 装瓶
1 计算过程要精确
2 固体药品要称取
液体药品要量取
3 溶解之后要冷却
4 转移用玻璃棒,放在容量瓶刻度线下
5 洗涤2~3次,洗涤液也要注入容量瓶中
6 旋摇,晃动底部,是初步的混匀
7 定容要平视,最后用胶头滴灌加至刻度线
8 摇匀要上下反复
9 容量瓶中的溶液要及时转移
1. 物质的量:表示微观粒子的数目,符号:n, 单位:mol, 计算n=N/NA
注意适用范围为微观粒子(分子、原子、离子等),使用
时必须注明具体的化学式。
2. 摩尔质量与气体摩尔体积:
(1)摩尔质量:符号:M,单位:g.mol-1,物质的摩尔质量在数值上
与相对分子质量或相对原子质量相等。
(2)气体摩尔体积:符号:Vm,单位:L.mol-1。
① 标准状况下(0℃或273K,101Kpa),1mol任何气体的体积约为22.4L(适用范围为气体,包括混合气体)
② Vm=22.4 L.mol-1(STP)
★ 摩尔质量(M= )与气体摩尔体积(Vm= )的单位均
可由定义式推导出来。
n=N/NA=m/M=v/Vm 使用时一定要注意适用范围
3. 物质的量浓度:符号: CB,单位:mol.L-1 (定义式CB=n/v)11.有关计算公式:稀释定律(溶质不变): C1V1=C2V2
12.物质的量用于化学方程式的计算(课本P25交流研讨)13.一定物质的量浓度溶液的配制(稀释)
操作步骤:计算、称量(量取)、溶解、冷却、转移、洗涤、
定容 、摇匀
误差分析(实验报告册P15)误差分析:原理C = n / V,其中n = m(溶质的质量) / M(溶质的摩尔质量)
1 化学是创造性的、实用的科学
2 化学科学的形成发展
3 化学科学的探索空间一.走进化学科学化学的定义 化学就是在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。
化学的特征就是认识分子和制造分子,它是一门具有创造性的、实用的科学。化学科学的形成发展古代化学
近代化学
近代化学的发展里程碑
(1)1661年,英国化学家、物理学家波义耳提出化学元素的概念,标志着近代化学的诞生。
(2)1771年,法国化学家拉瓦锡建立燃烧现象的氧化学说,使近代化学取得了革命性的进步。
(3)1803年,英国物理学家、化学家道尔顿提出原子学说,为近代化学的发展奠定了坚实的基础。
(4)1869年,俄国化学家门捷列夫发现元素周期律,把化学元素及其化合物纳入一个统一的理论体系。
现代化学二、研究物质性质的方法和程序1 研究物质性质的基本方法观察法实验法分类法比较法2 研究物质性质的基本程序观察物质的外观性质预测物质性质实验和观察解释及结论发现特殊现象,
提出新问题三.对Na、Na2O、Na2O2、Cl2等具体物质的研究 2. Na2O、Na2O2的化学性质实验探究3.氯气的化学性质实验探究4.氯水成分的实验探究四个概念的解析化学中常用的物理量—物质的量物质的质量(g)气体的体积
(标况)(L)物质的量(mol)气体物质
的分子数物质的
微粒数溶质的
质量( g )溶质的
微粒数物质的量浓度(mol/L)溶质的质量分数溶质的物质的量
(mol)摩尔质量(g/mol)摩尔质量(g/mol)NANANA溶液体积(L)摩尔体积(L/mol)气体密度(g/L)溶质的摩尔质量、密度一定体积溶液的配制(1)常用主要的仪器
(2)主要操作
(3)误差分析主要操作1 计算
2 量取
3 溶解和冷却
4 转移
5 洗涤
6 旋摇
7 定容
8 摇匀
9 装瓶
1 计算过程要精确
2 固体药品要称取
液体药品要量取
3 溶解之后要冷却
4 转移用玻璃棒,放在容量瓶刻度线下
5 洗涤2~3次,洗涤液也要注入容量瓶中
6 旋摇,晃动底部,是初步的混匀
7 定容要平视,最后用胶头滴灌加至刻度线
8 摇匀要上下反复
9 容量瓶中的溶液要及时转移
1. 物质的量:表示微观粒子的数目,符号:n, 单位:mol, 计算n=N/NA
注意适用范围为微观粒子(分子、原子、离子等),使用
时必须注明具体的化学式。
2. 摩尔质量与气体摩尔体积:
(1)摩尔质量:符号:M,单位:g.mol-1,物质的摩尔质量在数值上
与相对分子质量或相对原子质量相等。
(2)气体摩尔体积:符号:Vm,单位:L.mol-1。
① 标准状况下(0℃或273K,101Kpa),1mol任何气体的体积约为22.4L(适用范围为气体,包括混合气体)
② Vm=22.4 L.mol-1(STP)
★ 摩尔质量(M= )与气体摩尔体积(Vm= )的单位均
可由定义式推导出来。
n=N/NA=m/M=v/Vm 使用时一定要注意适用范围
3. 物质的量浓度:符号: CB,单位:mol.L-1 (定义式CB=n/v)11.有关计算公式:稀释定律(溶质不变): C1V1=C2V2
12.物质的量用于化学方程式的计算(课本P25交流研讨)13.一定物质的量浓度溶液的配制(稀释)
操作步骤:计算、称量(量取)、溶解、冷却、转移、洗涤、
定容 、摇匀
误差分析(实验报告册P15)误差分析:原理C = n / V,其中n = m(溶质的质量) / M(溶质的摩尔质量)
