化学:1.3《物质的量及其单位——摩尔》课件(鲁科版必修1)
文档属性
| 名称 | 化学:1.3《物质的量及其单位——摩尔》课件(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 155.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-03-29 12:46:18 | ||
图片预览






文档简介
课件16张PPT。 第3节 化学中常用的
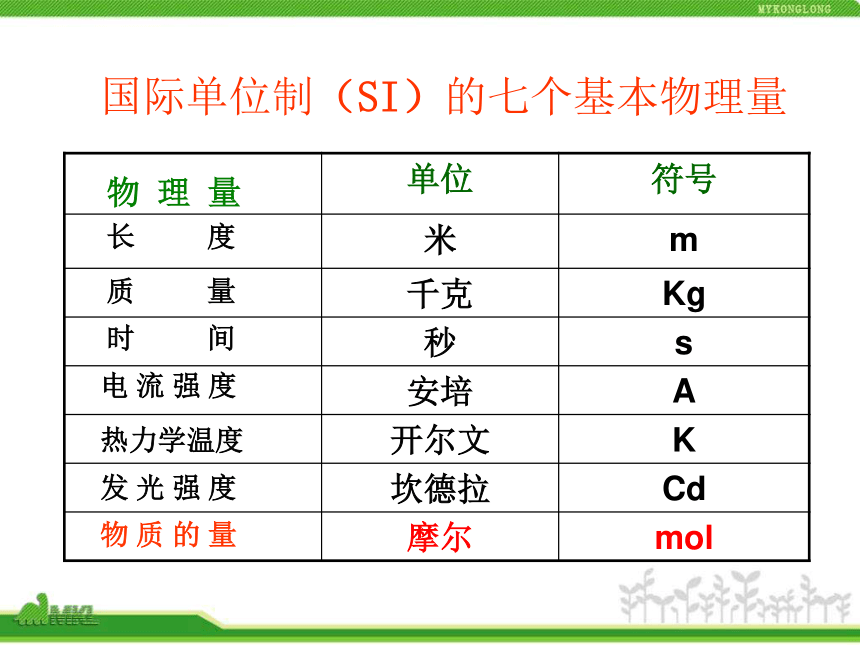
物理量—物质的量第一课时联想·质疑 水是大家非常熟悉的物质,它是由水分子构成的。一滴水(约0.05ml)大约含有1.7万亿个水分子。如果一个个地去数,即使分秒不停,一个人一生也无法完成这项工作。那么,怎样才能既科学又方便地知道一定量水中含有多少个水分子呢?(难见、难称量)2 H2 + O2 2H2O粒子个数比 :质 量 比 :2124g 32g36g微观粒子宏观物质(可见、可称量)物质的量::::物质的量是把微观粒子和宏观物质联系起来的一座桥梁点燃国际单位制(SI)的七个基本物理量物 理 量长 度质 量时 间电 流 强 度热力学温度发 光 强 度物 质 的 量一、物质的量及其单位 —— 摩尔物质的量(n) :是表示物质所含粒子多少的物 理量。
物质的量 是一个专有名词,由四个字组成 ,是一个 整体,不能分割,也不可加字、减字。 硫酸 的 物质的量 能简化为 硫酸的量 吗?
能不能写成 硫酸的质量或 硫酸的数量? 交流·研讨11、概念 摩尔:物质的量 的单位。摩尔 简称 摩,符号 mol 将 12g
所含的碳原子数定义为 1 mol。
1 mol 物质含有 阿伏加德罗常数(符号为NA )个粒子,数量为 6.02×1023mol -1 。12C(原子核里含 6个质子和 6个中子的碳原子)2、单位思 考为什么不用“个”作单位?一滴水里大约含1.67×1021个水分子。 摩尔,来源于拉丁文moles,愿意是大量和堆积的意思。于是1971年,由41个国家代表参加的第14届国际计量大会决定物质的量的单位为摩尔。
(1)摩尔是七个物理量之一。
(2)摩尔是物质的质量单位。
(3) 1摩尔大米含有 6.02×1023个米粒。物质的量 是七个基本物理量之一 ,
摩尔是物质的量的单位 。 摩尔是物质的量的单位物质的量只适用于微观粒子,不能用来说明宏观物质。交流·研讨2下面叙述是否正确?3、n、 N、NA的关系(1)1mol碳原子含有 个碳原子
(2)0.3mol硫酸分子含有 个硫酸分子
(3)10mol钠离子含有 个钠离子
(4)6mol电子含有 个电子
(5)0.5mol中子含有 个中子 1×NA
0.3×NA
10×NA
6×NA
0.5×NA物质的量是表示微粒的集体,可以用分数或小数表示。
物质的量(n)== 微粒数目(N)阿伏加德罗常数(NA) 1 摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子? H2O 11 molNA2HO212NANA1 mol2 mol 结论:不同层次粒子之间的物质的量关系应根据组成而定。微粒个数微粒集团物质的量交流·研讨3(1)1 mol Na2SO4含有 mol Na+ 2 mol SO42- 1个氧原子 (2) 0.5 mol Na2SO4含有 mol Na+ 1mol SO42- 0.5物质的量 (n)= 物质所含粒子数目 (N)阿伏加德罗常数 (NA)个氧原子2×6.02×10234×6.02×1023交流·研讨4 (3) 0.1 mol KClO3 和 0.1 mol KClO 中所含粒子
数相等的是 ( ) (A) 钾离子 (B)氯离子
(C) 氯原子 (D)氧原子 A C KClO3 = K+ + ClO3-KClO = K+ + ClO-小 结 (1) 一个概念及单位:物质的量 摩尔一个常数和数值:阿伏加德罗常数 6.02×1023mol-1(2) 三个关系:概念和单位;n 、 N 、 NA;不同层次粒子间
物质的量的关系物质的量粒子数 NANA前进(3)注意二点: ①用摩尔必须指明粒子的名称
②只能用于微观粒子÷物质的量 (n)
物质所含粒子数目 (N) 阿伏加德罗常数 (NA)
=这是我们本节学习的第一个公式:切记!切记!返回作 业 (1) 2 mol H2SO4 含 个 H2SO4 分子,可电离出 mol
H+ ,可电离出 mol SO42-,共含 个原子。
(2) 3.01×1023 个氯离子中含质子 摩尔,含电子 个。(3)1molNa变成Na+失去 mol电子.
(4)沉淀1molBa2+需要 molSO42-.
物理量—物质的量第一课时联想·质疑 水是大家非常熟悉的物质,它是由水分子构成的。一滴水(约0.05ml)大约含有1.7万亿个水分子。如果一个个地去数,即使分秒不停,一个人一生也无法完成这项工作。那么,怎样才能既科学又方便地知道一定量水中含有多少个水分子呢?(难见、难称量)2 H2 + O2 2H2O粒子个数比 :质 量 比 :2124g 32g36g微观粒子宏观物质(可见、可称量)物质的量::::物质的量是把微观粒子和宏观物质联系起来的一座桥梁点燃国际单位制(SI)的七个基本物理量物 理 量长 度质 量时 间电 流 强 度热力学温度发 光 强 度物 质 的 量一、物质的量及其单位 —— 摩尔物质的量(n) :是表示物质所含粒子多少的物 理量。
物质的量 是一个专有名词,由四个字组成 ,是一个 整体,不能分割,也不可加字、减字。 硫酸 的 物质的量 能简化为 硫酸的量 吗?
能不能写成 硫酸的质量或 硫酸的数量? 交流·研讨11、概念 摩尔:物质的量 的单位。摩尔 简称 摩,符号 mol 将 12g
所含的碳原子数定义为 1 mol。
1 mol 物质含有 阿伏加德罗常数(符号为NA )个粒子,数量为 6.02×1023mol -1 。12C(原子核里含 6个质子和 6个中子的碳原子)2、单位思 考为什么不用“个”作单位?一滴水里大约含1.67×1021个水分子。 摩尔,来源于拉丁文moles,愿意是大量和堆积的意思。于是1971年,由41个国家代表参加的第14届国际计量大会决定物质的量的单位为摩尔。
(1)摩尔是七个物理量之一。
(2)摩尔是物质的质量单位。
(3) 1摩尔大米含有 6.02×1023个米粒。物质的量 是七个基本物理量之一 ,
摩尔是物质的量的单位 。 摩尔是物质的量的单位物质的量只适用于微观粒子,不能用来说明宏观物质。交流·研讨2下面叙述是否正确?3、n、 N、NA的关系(1)1mol碳原子含有 个碳原子
(2)0.3mol硫酸分子含有 个硫酸分子
(3)10mol钠离子含有 个钠离子
(4)6mol电子含有 个电子
(5)0.5mol中子含有 个中子 1×NA
0.3×NA
10×NA
6×NA
0.5×NA物质的量是表示微粒的集体,可以用分数或小数表示。
物质的量(n)== 微粒数目(N)阿伏加德罗常数(NA) 1 摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子? H2O 11 molNA2HO212NANA1 mol2 mol 结论:不同层次粒子之间的物质的量关系应根据组成而定。微粒个数微粒集团物质的量交流·研讨3(1)1 mol Na2SO4含有 mol Na+ 2 mol SO42- 1个氧原子 (2) 0.5 mol Na2SO4含有 mol Na+ 1mol SO42- 0.5物质的量 (n)= 物质所含粒子数目 (N)阿伏加德罗常数 (NA)个氧原子2×6.02×10234×6.02×1023交流·研讨4 (3) 0.1 mol KClO3 和 0.1 mol KClO 中所含粒子
数相等的是 ( ) (A) 钾离子 (B)氯离子
(C) 氯原子 (D)氧原子 A C KClO3 = K+ + ClO3-KClO = K+ + ClO-小 结 (1) 一个概念及单位:物质的量 摩尔一个常数和数值:阿伏加德罗常数 6.02×1023mol-1(2) 三个关系:概念和单位;n 、 N 、 NA;不同层次粒子间
物质的量的关系物质的量粒子数 NANA前进(3)注意二点: ①用摩尔必须指明粒子的名称
②只能用于微观粒子÷物质的量 (n)
物质所含粒子数目 (N) 阿伏加德罗常数 (NA)
=这是我们本节学习的第一个公式:切记!切记!返回作 业 (1) 2 mol H2SO4 含 个 H2SO4 分子,可电离出 mol
H+ ,可电离出 mol SO42-,共含 个原子。
(2) 3.01×1023 个氯离子中含质子 摩尔,含电子 个。(3)1molNa变成Na+失去 mol电子.
(4)沉淀1molBa2+需要 molSO42-.
