化学:4.2.2《铝 金属材料》课件(鲁科版必修1)
文档属性
| 名称 | 化学:4.2.2《铝 金属材料》课件(鲁科版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-03-29 00:00:00 | ||
图片预览







文档简介
课件26张PPT。第2节铝 金属材料第二课时下面是治疗胃酸过多症的药物
胃舒平的说明书:【别名】 复方氢氧化铝 ,胃舒平
【外文名】Compound Aluminium Hyclroxide
【主要成分】氢氧化铝
【用法及用量】成人口服:2~4片/次,一日3~4次。
【作用与用途】本品有中和胃酸、减少胃液分泌和解痉止疼作用,用于胃溃疡用胃酸过多症
【注意事项】本品应饭前服用或胃疼发作时嚼碎服用。 请说出氢氧化铝的类别,并判断氢氧化铝的溶解性 。实验探究: 制备Al(OH)3 现在有下列试剂,请设计实验方案制 备氢氧化铝。
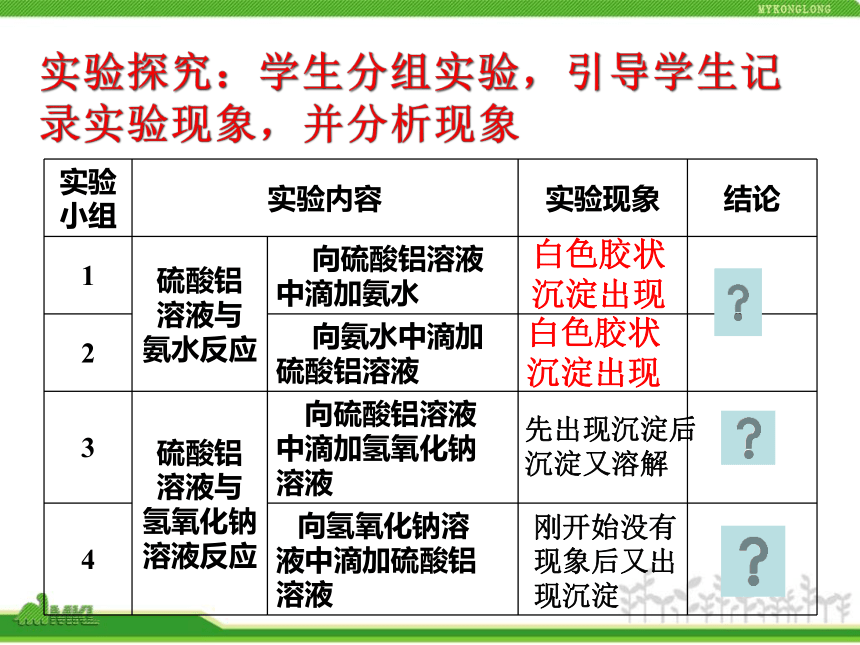
试剂:硫酸铝溶液、氨水、氢氧化钠溶液、稀盐酸。 实验方案:(1)用硫酸铝溶液与氢氧化钠溶液反应。(2)用硫酸铝溶液与氨水反应 想一想 两套实验方案似乎都可行,请问:如果药品的滴加顺序不一样,会不会对实验结果有影响?实验探究:学生分组实验,引导学生记录实验现象,并分析现象白色胶状
沉淀出现白色胶状
沉淀出现先出现沉淀后
沉淀又溶解刚开始没有
现象后又出
现沉淀Al2(SO4)3+6NH3·H2O = 2Al(OH)3↓+3(NH4)2SO4 Al3++3NH3·H2O = Al(OH)3↓+3NH+4 先沉淀说明生成了Al(OH)3,再溶解说明Al(OH)3与NaOH反应了。Al(OH)3+NaOH = Na[Al(OH)4]Al(OH)3+OH- = [Al(OH)4]- 由于刚开始滴加的硫酸铝量少,生成的氢氧化铝也比较少,与试管中多余的氢氧化钠反应了。 Al(OH)3既能与盐酸反应,又能与氢氧化钠溶液反应,这种既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物——两性氢氧化物。 大家已经知道氢氧化铝属于碱,那么它应该可以与酸反应。讨论:1.氢氧化铝能否与所有的碱溶液反应?
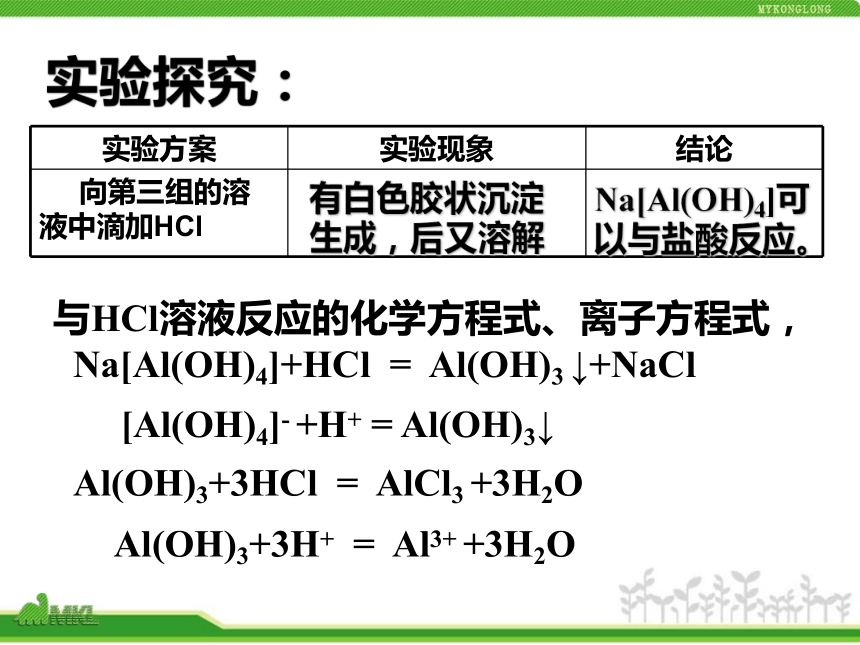
2.氢氧化铝能否与所有的酸溶液反应?实验探究:结论:氢氧化铝沉淀不能与碳酸、氨水等弱酸、弱碱反应,一般与强酸、强碱溶液反应。白色胶状沉淀不溶解氢氧化铝不能与碳酸反应。实验探究:[Al(OH)4]- +H+ = Al(OH)3↓与HCl溶液反应的化学方程式、离子方程式,Na[Al(OH)4]+HCl = Al(OH)3 ↓+NaClAl(OH)3+3HCl = AlCl3 +3H2OAl(OH)3+3H+ = Al3+ +3H2O有白色胶状沉淀生成,后又溶解Na[Al(OH)4]可以与盐酸反应。Al3+Al(OH)3[Al(OH)4]-+ OH-H+ ++ OH-H+ +(二)氧化铝Al2O31、 Al2O3物理性质 氧化铝是白色、不溶于水的固体,熔点高,是一种较好的耐火材料。天然产的无色氧化铝晶体叫刚玉,其硬度仅次于金刚石。完成化学反应方程式和离子方程式 与HCl溶液反应的化学方程式、离子方程式,Al2O3+6HCl = 2AlCl3 +3H2OAl2O3+6H+ = 2Al3+ + 3H2O与NaOH溶液反应的化学方程式、离子方程式,Al2O3+2NaOH + 3H2O = 2Na[Al(OH)4]Al2O3+2OH- + 3H2O = 2[Al(OH)4]-结论:Al2O3既能与NaOH溶液反应,生成盐和水;又能与盐酸溶液反应,生成盐和水,这样的氧化物为两性氧化物。 生活中的化学通常用明矾(KAl(SO4)2·12H2O)作净水剂 原理是:铝离子在溶液中可以与水发生微弱的反应,生成有很大表面积的氢氧化铝,可以吸附水中的悬浮杂质而形成沉淀。吃油条的利弊
油条的制作过程:首先是发面,即用鲜酵母或老面(酵面)与面粉一起加水揉和,使面团发酵到一定程度后,再加入适量纯碱、食盐和明矾进行揉和,然后切成厚1厘米,长10厘米左右的条状物,把每两条上下叠好,用窄木条在中间压一下,旋转后拉长放入热油锅里去炸,使膨胀成一根又松、又脆、又黄、又香的油条。
当面团里出现游离的氢氧化钠时,原料中的明矾就立即跟它发生了反应,使游离的氢氧化钠经成了氢氧化铝。氢氧化铝的凝胶液或干燥凝胶,在医疗上用作抗酸药,能中和胃酸、保护溃疡面,用于治疗胃酸过多症、胃溃疡和十二指肠溃疡等。常见的治胃病药“胃舒平”的主要成分就是氢氧化铝,因此,有的中医处方中谈到:油条对胃酸有抑制作用,并且对某些胃病的一定的疗效。但是摄入过多的铝元素对身体有一定的危害。生活中的化学 氧化铝的天然存在形式 铝土矿
由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成 刚 玉
氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂(SiC)(蓝宝石、红宝石是刚玉的一种)
自然界中的化学氧化铝坩埚化学与产品耐磨件氧化铝陶瓷异形体铝散热器铝合金及其制品 生活生产中的铝制品 铝合金具有密度小、强度高、塑性好、制造工艺简单、成本低、抗腐蚀能力强等特点。【问题探究】 桌面上有两堆白色粉末,已知它们分别是Al2O3和MgO,你能用什么方法加以鉴别?-请设计方案你能写出相关的化学反应方程式吗?
Al2O3+2NaOH+3H2O=2Na[Al(OH)4] 实战演练1.实验室制备少量氢氧化铝沉淀,用硫酸铝与氨水反应好,还是用硫酸铝与氢氧化钠反应好?为什么?
2.下列物质既能与盐酸反应,又能与氢氧化钠反应的有________________。
A.Fe B.Al C.Fe2O3 D.Al2O3
E.Fe(OH)3 F.Al(OH)3 G.NaHCO3 B、D、F、G实战演练3.对于一瓶氢氧化钠溶液,一瓶氯化铝溶液,不借助其他的试剂,能否将两种溶液区别开来?黑色金属有色金属:铁、锰、铬:除黑色金属以外 钢铁是铁与C(碳)、Si(硅)、Mn(锰)、P(磷)、S(硫)以及少量的其他元素所组成的合金。其中除Fe(铁)外,C的含量对钢铁的机械性能起着主要作用,故统称为铁碳合金。它是工程技术中最重要、用量最大的金属材料。 钢铁金属与金属材料 按含碳的含量的不同,铁碳合金分为钢与生铁两大类,钢是含碳量为0.03%~2%的铁碳合金。
碳钢是最常用的普通钢,冶炼方便、加工容易、价格低廉,而且在多数情况下能满足使用要求,所以应用十分普遍。
按含碳量不同,碳钢又分为低碳钢、中碳钢和高碳钢。随含碳量升高,碳钢的硬度增加、韧性下降 不锈钢 耐空气、蒸汽、水等弱腐蚀介质和酸、碱、盐等化学浸蚀性介质腐蚀的钢。又称不锈耐酸钢。 所有金属都和大气中的氧气进行反应,在表面形成氧化膜。不幸的是,在普通碳钢上形成的氧化铁继续进行氧化,使锈蚀不断扩大,最终形成孔洞。可以利用油漆或耐氧化的金属(例如,锌,镍和铬)进行电镀来保证碳钢表面,但是,正如人们所知道的那样,这种保护仅是一种薄膜。如果保护层被破坏,下面的钢便开始锈蚀 实际应用中,常将耐弱腐蚀介质腐蚀的钢称为不锈钢,而将耐化学介质腐蚀的钢称为耐酸钢。由于两者在化学成分上的差异,前者不一定耐化学介质腐蚀,而后者则一般均具有不锈性。不锈钢的耐蚀性取决于钢中所含的合金元素。铬是使不锈钢获得耐蚀性的基本元素,当钢中含铬量达到1.2%左右时,铬与腐蚀介质中的氧作用,在钢表面形成一层很薄的氧化膜( 自钝化膜),可阻止钢的基体进一步腐蚀。除铬外,常用的合金元素还有镍、钼、钛、铌、铜、氮等,以满足各种用途对不锈钢组织和性能的要求。 银 元素符号:Ag 元素 延展性仅次于金,能压成薄片,拉成细丝。1克银可以拉成1800米长的细丝, 银的特征氧化数为+1,其化学性质比铜差,常温下,甚至加热时也不与水和空气中... 符号Au,原子序数79,黄赤色,质地软,用牙齿可以咬变形:黄金。金子。金币。
化学性质非常稳定的原因是,金原子的最外层的三个电子之间的相互作用非常紧密,原子体积被压缩,电子不容易被氧化剂夺取,金是除稀有气体元素以外化学性质最稳定的元素. 金 以一价和二价为主的金属元素,有延性和展性,是热和电最佳导体之一, 铜是人类发现最早的金属之一,也是最好的纯金属之一,稍硬、极坚韧、耐磨损。还有很好的延展性。导热和导电性能较好。铜和它的一些合金有较好的耐腐蚀能力,在干燥的空气里很稳定。但在潮湿的空气里在其表面可以生成一层绿色的碱式碳酸铜[Cu2(OH)2CO3],这叫铜绿。 铜2Cu+O2+H2O+CO2== Cu2(OH)2CO3CuOCu2OCu2SO4·5H2O粉末Cu2SO4·5H2OCu2SO44CuO==2Cu2O+O2高温Cu2SO4·5H2O==Cu2SO4+5H2O
【外文名】Compound Aluminium Hyclroxide
【主要成分】氢氧化铝
【用法及用量】成人口服:2~4片/次,一日3~4次。
【作用与用途】本品有中和胃酸、减少胃液分泌和解痉止疼作用,用于胃溃疡用胃酸过多症
【注意事项】本品应饭前服用或胃疼发作时嚼碎服用。 请说出氢氧化铝的类别,并判断氢氧化铝的溶解性 。实验探究: 制备Al(OH)3 现在有下列试剂,请设计实验方案制 备氢氧化铝。
试剂:硫酸铝溶液、氨水、氢氧化钠溶液、稀盐酸。 实验方案:(1)用硫酸铝溶液与氢氧化钠溶液反应。(2)用硫酸铝溶液与氨水反应 想一想 两套实验方案似乎都可行,请问:如果药品的滴加顺序不一样,会不会对实验结果有影响?实验探究:学生分组实验,引导学生记录实验现象,并分析现象白色胶状
沉淀出现白色胶状
沉淀出现先出现沉淀后
沉淀又溶解刚开始没有
现象后又出
现沉淀Al2(SO4)3+6NH3·H2O = 2Al(OH)3↓+3(NH4)2SO4 Al3++3NH3·H2O = Al(OH)3↓+3NH+4 先沉淀说明生成了Al(OH)3,再溶解说明Al(OH)3与NaOH反应了。Al(OH)3+NaOH = Na[Al(OH)4]Al(OH)3+OH- = [Al(OH)4]- 由于刚开始滴加的硫酸铝量少,生成的氢氧化铝也比较少,与试管中多余的氢氧化钠反应了。 Al(OH)3既能与盐酸反应,又能与氢氧化钠溶液反应,这种既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物——两性氢氧化物。 大家已经知道氢氧化铝属于碱,那么它应该可以与酸反应。讨论:1.氢氧化铝能否与所有的碱溶液反应?
2.氢氧化铝能否与所有的酸溶液反应?实验探究:结论:氢氧化铝沉淀不能与碳酸、氨水等弱酸、弱碱反应,一般与强酸、强碱溶液反应。白色胶状沉淀不溶解氢氧化铝不能与碳酸反应。实验探究:[Al(OH)4]- +H+ = Al(OH)3↓与HCl溶液反应的化学方程式、离子方程式,Na[Al(OH)4]+HCl = Al(OH)3 ↓+NaClAl(OH)3+3HCl = AlCl3 +3H2OAl(OH)3+3H+ = Al3+ +3H2O有白色胶状沉淀生成,后又溶解Na[Al(OH)4]可以与盐酸反应。Al3+Al(OH)3[Al(OH)4]-+ OH-H+ ++ OH-H+ +(二)氧化铝Al2O31、 Al2O3物理性质 氧化铝是白色、不溶于水的固体,熔点高,是一种较好的耐火材料。天然产的无色氧化铝晶体叫刚玉,其硬度仅次于金刚石。完成化学反应方程式和离子方程式 与HCl溶液反应的化学方程式、离子方程式,Al2O3+6HCl = 2AlCl3 +3H2OAl2O3+6H+ = 2Al3+ + 3H2O与NaOH溶液反应的化学方程式、离子方程式,Al2O3+2NaOH + 3H2O = 2Na[Al(OH)4]Al2O3+2OH- + 3H2O = 2[Al(OH)4]-结论:Al2O3既能与NaOH溶液反应,生成盐和水;又能与盐酸溶液反应,生成盐和水,这样的氧化物为两性氧化物。 生活中的化学通常用明矾(KAl(SO4)2·12H2O)作净水剂 原理是:铝离子在溶液中可以与水发生微弱的反应,生成有很大表面积的氢氧化铝,可以吸附水中的悬浮杂质而形成沉淀。吃油条的利弊
油条的制作过程:首先是发面,即用鲜酵母或老面(酵面)与面粉一起加水揉和,使面团发酵到一定程度后,再加入适量纯碱、食盐和明矾进行揉和,然后切成厚1厘米,长10厘米左右的条状物,把每两条上下叠好,用窄木条在中间压一下,旋转后拉长放入热油锅里去炸,使膨胀成一根又松、又脆、又黄、又香的油条。
当面团里出现游离的氢氧化钠时,原料中的明矾就立即跟它发生了反应,使游离的氢氧化钠经成了氢氧化铝。氢氧化铝的凝胶液或干燥凝胶,在医疗上用作抗酸药,能中和胃酸、保护溃疡面,用于治疗胃酸过多症、胃溃疡和十二指肠溃疡等。常见的治胃病药“胃舒平”的主要成分就是氢氧化铝,因此,有的中医处方中谈到:油条对胃酸有抑制作用,并且对某些胃病的一定的疗效。但是摄入过多的铝元素对身体有一定的危害。生活中的化学 氧化铝的天然存在形式 铝土矿
由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成 刚 玉
氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂(SiC)(蓝宝石、红宝石是刚玉的一种)
自然界中的化学氧化铝坩埚化学与产品耐磨件氧化铝陶瓷异形体铝散热器铝合金及其制品 生活生产中的铝制品 铝合金具有密度小、强度高、塑性好、制造工艺简单、成本低、抗腐蚀能力强等特点。【问题探究】 桌面上有两堆白色粉末,已知它们分别是Al2O3和MgO,你能用什么方法加以鉴别?-请设计方案你能写出相关的化学反应方程式吗?
Al2O3+2NaOH+3H2O=2Na[Al(OH)4] 实战演练1.实验室制备少量氢氧化铝沉淀,用硫酸铝与氨水反应好,还是用硫酸铝与氢氧化钠反应好?为什么?
2.下列物质既能与盐酸反应,又能与氢氧化钠反应的有________________。
A.Fe B.Al C.Fe2O3 D.Al2O3
E.Fe(OH)3 F.Al(OH)3 G.NaHCO3 B、D、F、G实战演练3.对于一瓶氢氧化钠溶液,一瓶氯化铝溶液,不借助其他的试剂,能否将两种溶液区别开来?黑色金属有色金属:铁、锰、铬:除黑色金属以外 钢铁是铁与C(碳)、Si(硅)、Mn(锰)、P(磷)、S(硫)以及少量的其他元素所组成的合金。其中除Fe(铁)外,C的含量对钢铁的机械性能起着主要作用,故统称为铁碳合金。它是工程技术中最重要、用量最大的金属材料。 钢铁金属与金属材料 按含碳的含量的不同,铁碳合金分为钢与生铁两大类,钢是含碳量为0.03%~2%的铁碳合金。
碳钢是最常用的普通钢,冶炼方便、加工容易、价格低廉,而且在多数情况下能满足使用要求,所以应用十分普遍。
按含碳量不同,碳钢又分为低碳钢、中碳钢和高碳钢。随含碳量升高,碳钢的硬度增加、韧性下降 不锈钢 耐空气、蒸汽、水等弱腐蚀介质和酸、碱、盐等化学浸蚀性介质腐蚀的钢。又称不锈耐酸钢。 所有金属都和大气中的氧气进行反应,在表面形成氧化膜。不幸的是,在普通碳钢上形成的氧化铁继续进行氧化,使锈蚀不断扩大,最终形成孔洞。可以利用油漆或耐氧化的金属(例如,锌,镍和铬)进行电镀来保证碳钢表面,但是,正如人们所知道的那样,这种保护仅是一种薄膜。如果保护层被破坏,下面的钢便开始锈蚀 实际应用中,常将耐弱腐蚀介质腐蚀的钢称为不锈钢,而将耐化学介质腐蚀的钢称为耐酸钢。由于两者在化学成分上的差异,前者不一定耐化学介质腐蚀,而后者则一般均具有不锈性。不锈钢的耐蚀性取决于钢中所含的合金元素。铬是使不锈钢获得耐蚀性的基本元素,当钢中含铬量达到1.2%左右时,铬与腐蚀介质中的氧作用,在钢表面形成一层很薄的氧化膜( 自钝化膜),可阻止钢的基体进一步腐蚀。除铬外,常用的合金元素还有镍、钼、钛、铌、铜、氮等,以满足各种用途对不锈钢组织和性能的要求。 银 元素符号:Ag 元素 延展性仅次于金,能压成薄片,拉成细丝。1克银可以拉成1800米长的细丝, 银的特征氧化数为+1,其化学性质比铜差,常温下,甚至加热时也不与水和空气中... 符号Au,原子序数79,黄赤色,质地软,用牙齿可以咬变形:黄金。金子。金币。
化学性质非常稳定的原因是,金原子的最外层的三个电子之间的相互作用非常紧密,原子体积被压缩,电子不容易被氧化剂夺取,金是除稀有气体元素以外化学性质最稳定的元素. 金 以一价和二价为主的金属元素,有延性和展性,是热和电最佳导体之一, 铜是人类发现最早的金属之一,也是最好的纯金属之一,稍硬、极坚韧、耐磨损。还有很好的延展性。导热和导电性能较好。铜和它的一些合金有较好的耐腐蚀能力,在干燥的空气里很稳定。但在潮湿的空气里在其表面可以生成一层绿色的碱式碳酸铜[Cu2(OH)2CO3],这叫铜绿。 铜2Cu+O2+H2O+CO2== Cu2(OH)2CO3CuOCu2OCu2SO4·5H2O粉末Cu2SO4·5H2OCu2SO44CuO==2Cu2O+O2高温Cu2SO4·5H2O==Cu2SO4+5H2O
