2021-2022学年人教版化学九年级下册 第九单元 溶液的 检测题(word版 含答案)
文档属性
| 名称 | 2021-2022学年人教版化学九年级下册 第九单元 溶液的 检测题(word版 含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 278.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-10 09:12:58 | ||
图片预览

文档简介
第九单元检测题
(时间:60分钟 满分:100分)
相对原子质量:H—1 O—16 Na—23 S—32 Cl—35.5 Ca—40 Fe—56 Ba—137
一、选择题(每小题3分,共30分)
1.(眉山中考)下列有关溶液的说法正确的是( B )
A.长期放置不分层的液体一定是溶液
B.溶质可以是固体,也可以是液体或气体
C.降低饱和溶液的温度,一定有晶体析出
D.配制好的6%的NaCl溶液,装入试剂瓶中时不慎洒漏一部分,浓度减小
2.下列清洗方法中,利用了乳化原理的是( B )
A.用酒精清洗碘渍 B.用洗涤剂清洗油污
C.用汽油清洗油污 D.用醋酸清除水垢
3.向如图装置的试管中加入某物质后,U形管中红墨水液面左高右低,该物质是( C )
A.氢氧化钠
B.二氧化锰
C.硝酸铵
D.氯化钠
4.(泸州月考)浓硫酸和浓盐酸敞口放置一段时间后,其溶液中溶质的质量分数( A )
A.都变小 B.都变大
C.前者变大,后者变小 D.前者变小,后者变大
5.在20 ℃时,某固体物质(不含结晶水)的水溶液经历如下变化,下列说法你认为正确的是( B )
A.溶液甲是饱和溶液
B.20 ℃时,该固体物质的溶解度是40 g
C.溶液丙若蒸发10 g水,析出的晶体一定大于4 g
D.溶液乙溶质的质量分数小于溶液丙溶质的质量分数
6.t ℃时,有100 g质量分数为5%的KNO3溶液,若想将其质量分数变为10%,可采用的方法是( C )
A.等温蒸发掉一半溶剂
B.将原溶液与100 g溶质质量分数为25%的KNO3溶液相混合
C.等温蒸发掉50 g水
D.再加入5 g KNO3
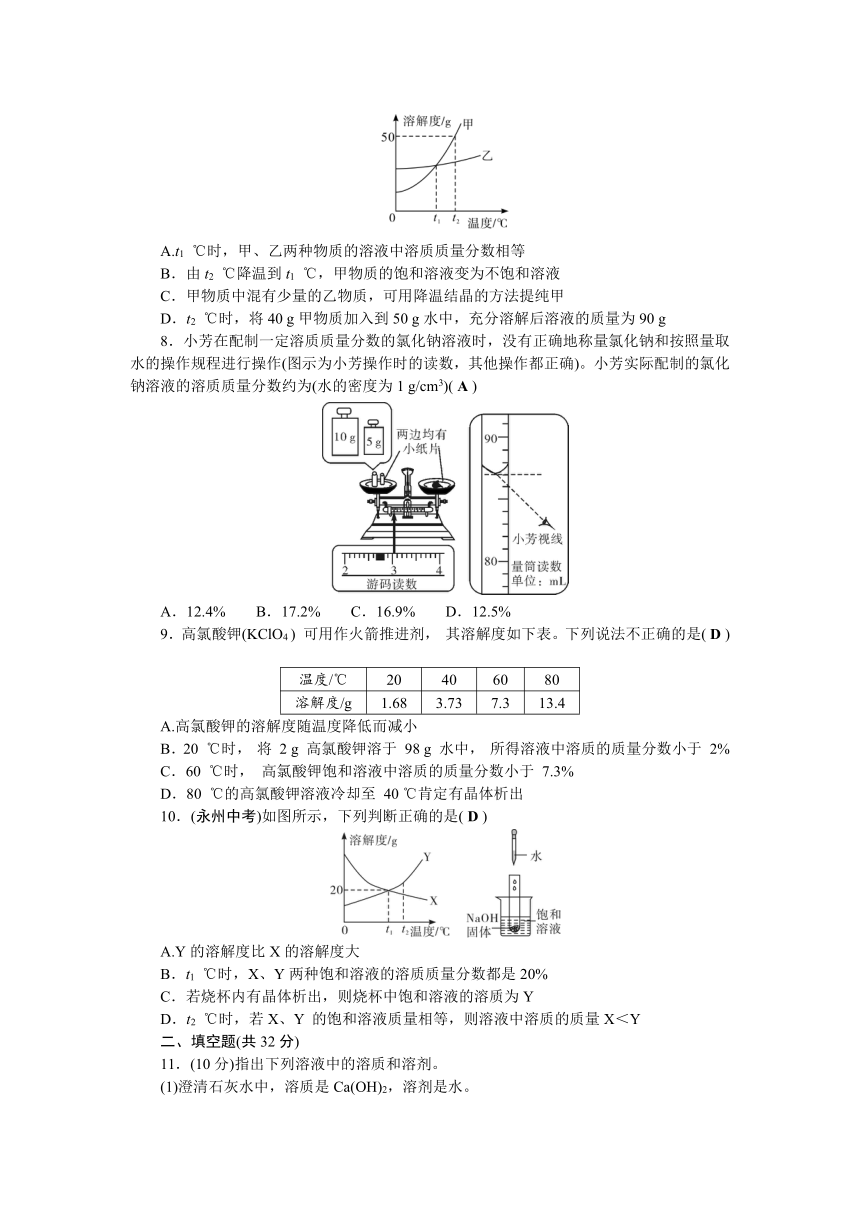
7.(德阳月考)如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是( C )
A.t1 ℃时,甲、乙两种物质的溶液中溶质质量分数相等
B.由t2 ℃降温到t1 ℃,甲物质的饱和溶液变为不饱和溶液
C.甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲
D.t2 ℃时,将40 g甲物质加入到50 g水中,充分溶解后溶液的质量为90 g
8.小芳在配制一定溶质质量分数的氯化钠溶液时,没有正确地称量氯化钠和按照量取水的操作规程进行操作(图示为小芳操作时的读数,其他操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数约为(水的密度为1 g/cm3)( A )
A.12.4% B.17.2% C.16.9% D.12.5%
9.高氯酸钾(KClO4 ) 可用作火箭推进剂, 其溶解度如下表。下列说法不正确的是( D )
温度/℃ 20 40 60 80
溶解度/g 1.68 3.73 7.3 13.4
A.高氯酸钾的溶解度随温度降低而减小
B.20 ℃时, 将 2 g 高氯酸钾溶于 98 g 水中, 所得溶液中溶质的质量分数小于 2%
C.60 ℃时, 高氯酸钾饱和溶液中溶质的质量分数小于 7.3%
D.80 ℃的高氯酸钾溶液冷却至 40 ℃肯定有晶体析出
10.(永州中考)如图所示,下列判断正确的是( D )
A.Y的溶解度比X的溶解度大
B.t1 ℃时,X、Y两种饱和溶液的溶质质量分数都是20%
C.若烧杯内有晶体析出,则烧杯中饱和溶液的溶质为Y
D.t2 ℃时,若X、Y 的饱和溶液质量相等,则溶液中溶质的质量X<Y
二、填空题(共32分)
11.(10分)指出下列溶液中的溶质和溶剂。
(1)澄清石灰水中,溶质是Ca(OH)2,溶剂是水。
(2)医用酒精溶液中,溶质是酒精,溶剂是水。
(3)白磷溶解在二硫化碳液体中所得的溶液里,溶质是白磷,溶剂是二硫化碳。
(4)锌和稀硫酸恰好完全反应后的溶液里,溶质是硫酸锌,溶剂是水。
(5)5%的氯化钠注射液,溶质是NaCl,溶剂是水。
12.(4分)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下:
温度/℃ 20 30 50 60 80
溶解度/g
K2CO3 110 114 121 126 139
KNO3 31.6 45.8 85.5 110 169
(1)图中能表示K2CO3溶解度曲线的是乙(填“甲”或“乙”)。
(2)在20 ℃时,将20 g的KNO3加入到50 g的水中,充分搅拌,得到溶液的质量为65.8g。
(3)在t ℃时,K2CO3饱和溶液的溶质质量分数(w1)和KNO3饱和溶液的溶质质量分数(w2)的大小关系:w1 =(填“>”“<”或“=”)w2。
(4)在不改变溶液质量的情况下,要使一定量接近饱和的KNO3溶液变为饱和溶液的方法是降低温度。
13.(12分)(东营中考)硝酸钾、氯化钾的溶解度曲线如图1所示。
(1)P点的含义是t1 ℃时,硝酸钾和氯化钾的溶解度相同。
(2)当温度小于t1 ℃时,氯化钾的溶解度大于硝酸钾的溶解度。
(3)t2 ℃时,分别将30 g硝酸钾和氯化钾加入到50 g水中,充分溶解后一定形成饱和溶液的是氯化钾,其溶液的溶质质量分数为28.6%(结果精确到0.1%)。
(4)图2是有关硝酸钾溶液的实验操作及变化情况。若保持溶液的质量不变,操作Ⅰ为降低温度。
(5)下列有关说法不正确的是C。
A.①与②的溶质质量可能相等
B.②与③的溶质质量分数一定相等
C.等温度、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D.等温度、等质量的硝酸钾和氯化钾饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
14.(6分)如图所示,一物体悬挂在饱和氯化钠溶液中,在恒温条件下向烧杯内溶液中分别加入下列物质(悬挂物不参与反应)。说明弹簧秤读数变化情况。(均填“变大”“不变”或“变小”)
(1)如果加入氯化钠晶体,弹簧秤读数不变。
(2)如果加入蒸馏水,弹簧秤读数变大。
(3)如果加入KNO3晶体,弹簧秤读数变小。
三、实验探究题(共30分)
15.(12分)学完溶液知识后,小川回家用蔗糖、碳酸钙、植物油、洗涤剂、水相互混合做了几个小实验。
(1)在同一条件下,蔗糖易溶于水,难溶于植物油,碳酸钙不能溶于水,也不溶于植物油。由此说明物质的溶解能力与溶质的性质和溶剂的性质有关。
(2)除(1)中的因素外,你认为固体物质的溶解能力还与外界条件温度有关。小川在设计实验方案验证(2)中假设时,在选择了溶质和溶剂种类的前提下,你认为在实验中还需要控制的变量有溶剂的量。
(3)一天,小川不小心将碘酒洒在衣服上,他妈妈立即用水和洗洁精洗衣服,但怎么也洗不掉这些斑点,还是小川给妈妈出了个好主意。你认为小川应该采用的方法是将有斑点的部分浸在酒精中;这种方法和用洗洁精除油污的方法比较,在原理上有什么不同?酒精除去斑点是使污渍溶于酒精中,形成的是溶液;而洗洁精除去油污是洗洁精使油污以细小的液滴分散到水中形成稳定的乳浊液。
16.(18分)实验员王老师要配制80 g质量分数为10%的NaOH溶液供同学们使用,如图表示了他的实验操作过程。
回答下列问题:
(1)写出仪器的名称:①药匙,②烧杯。
(2)B操作中有一处错误是氢氧化钠应该放在烧杯中称量,应称NaOH的质量是8g,称量过程中若指针偏左,应进行的操作是减少左盘中的NaOH。
(3)仪器③的规格应是100 mL(填“50 mL”或“100 mL”),量取水时除仪器③外,还需要的一种仪器是胶头滴管。
(4)E操作中④的作用是用于搅拌,加快溶解速率。
(5)下列错误操作可能导致溶质的质量分数偏小的是①②③(填序号)。
①B操作中砝码与NaOH放颠倒了(1 g以下用游码)
②C操作中使用的烧杯内壁有水
③用量筒量水时仰视凹液面最低处读数
④F操作中溶液洒落
四、计算题(共8分)
17.(8分)向盛有28 g氯化钡和氯化钠固体混合物的烧杯中加入273.3 g水,固体完全溶解。再逐滴加入一定质量分数的硫酸钠溶液,反应过程中生成沉淀的质量与所加硫酸钠溶液的质量关系如图所示。(化学方程式:Na2SO4+BaCl2===2NaCl+BaSO4↓)
请计算:
(1)固体混合物中氯化钡的质量。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
解:(1)设固体混合物中氯化钡的质量为x,生成氯化钠的质量为y。
Na2SO4+BaCl2 ===2NaCl+BaSO4↓
208 117 233
x y 23.3 g
=,=
x=20.8 g y=11.7 g
(2)恰好完全反应时,所得溶液中溶质的质量分数为×100%=5%
答:(1)固体混合物中氯化钡的质量为20.8 g;(2)恰好完全反应时,所得溶液中溶质的质量分数为5%。
(时间:60分钟 满分:100分)
相对原子质量:H—1 O—16 Na—23 S—32 Cl—35.5 Ca—40 Fe—56 Ba—137
一、选择题(每小题3分,共30分)
1.(眉山中考)下列有关溶液的说法正确的是( B )
A.长期放置不分层的液体一定是溶液
B.溶质可以是固体,也可以是液体或气体
C.降低饱和溶液的温度,一定有晶体析出
D.配制好的6%的NaCl溶液,装入试剂瓶中时不慎洒漏一部分,浓度减小
2.下列清洗方法中,利用了乳化原理的是( B )
A.用酒精清洗碘渍 B.用洗涤剂清洗油污
C.用汽油清洗油污 D.用醋酸清除水垢
3.向如图装置的试管中加入某物质后,U形管中红墨水液面左高右低,该物质是( C )
A.氢氧化钠
B.二氧化锰
C.硝酸铵
D.氯化钠
4.(泸州月考)浓硫酸和浓盐酸敞口放置一段时间后,其溶液中溶质的质量分数( A )
A.都变小 B.都变大
C.前者变大,后者变小 D.前者变小,后者变大
5.在20 ℃时,某固体物质(不含结晶水)的水溶液经历如下变化,下列说法你认为正确的是( B )
A.溶液甲是饱和溶液
B.20 ℃时,该固体物质的溶解度是40 g
C.溶液丙若蒸发10 g水,析出的晶体一定大于4 g
D.溶液乙溶质的质量分数小于溶液丙溶质的质量分数
6.t ℃时,有100 g质量分数为5%的KNO3溶液,若想将其质量分数变为10%,可采用的方法是( C )
A.等温蒸发掉一半溶剂
B.将原溶液与100 g溶质质量分数为25%的KNO3溶液相混合
C.等温蒸发掉50 g水
D.再加入5 g KNO3
7.(德阳月考)如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是( C )
A.t1 ℃时,甲、乙两种物质的溶液中溶质质量分数相等
B.由t2 ℃降温到t1 ℃,甲物质的饱和溶液变为不饱和溶液
C.甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲
D.t2 ℃时,将40 g甲物质加入到50 g水中,充分溶解后溶液的质量为90 g
8.小芳在配制一定溶质质量分数的氯化钠溶液时,没有正确地称量氯化钠和按照量取水的操作规程进行操作(图示为小芳操作时的读数,其他操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数约为(水的密度为1 g/cm3)( A )
A.12.4% B.17.2% C.16.9% D.12.5%
9.高氯酸钾(KClO4 ) 可用作火箭推进剂, 其溶解度如下表。下列说法不正确的是( D )
温度/℃ 20 40 60 80
溶解度/g 1.68 3.73 7.3 13.4
A.高氯酸钾的溶解度随温度降低而减小
B.20 ℃时, 将 2 g 高氯酸钾溶于 98 g 水中, 所得溶液中溶质的质量分数小于 2%
C.60 ℃时, 高氯酸钾饱和溶液中溶质的质量分数小于 7.3%
D.80 ℃的高氯酸钾溶液冷却至 40 ℃肯定有晶体析出
10.(永州中考)如图所示,下列判断正确的是( D )
A.Y的溶解度比X的溶解度大
B.t1 ℃时,X、Y两种饱和溶液的溶质质量分数都是20%
C.若烧杯内有晶体析出,则烧杯中饱和溶液的溶质为Y
D.t2 ℃时,若X、Y 的饱和溶液质量相等,则溶液中溶质的质量X<Y
二、填空题(共32分)
11.(10分)指出下列溶液中的溶质和溶剂。
(1)澄清石灰水中,溶质是Ca(OH)2,溶剂是水。
(2)医用酒精溶液中,溶质是酒精,溶剂是水。
(3)白磷溶解在二硫化碳液体中所得的溶液里,溶质是白磷,溶剂是二硫化碳。
(4)锌和稀硫酸恰好完全反应后的溶液里,溶质是硫酸锌,溶剂是水。
(5)5%的氯化钠注射液,溶质是NaCl,溶剂是水。
12.(4分)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下:
温度/℃ 20 30 50 60 80
溶解度/g
K2CO3 110 114 121 126 139
KNO3 31.6 45.8 85.5 110 169
(1)图中能表示K2CO3溶解度曲线的是乙(填“甲”或“乙”)。
(2)在20 ℃时,将20 g的KNO3加入到50 g的水中,充分搅拌,得到溶液的质量为65.8g。
(3)在t ℃时,K2CO3饱和溶液的溶质质量分数(w1)和KNO3饱和溶液的溶质质量分数(w2)的大小关系:w1 =(填“>”“<”或“=”)w2。
(4)在不改变溶液质量的情况下,要使一定量接近饱和的KNO3溶液变为饱和溶液的方法是降低温度。
13.(12分)(东营中考)硝酸钾、氯化钾的溶解度曲线如图1所示。
(1)P点的含义是t1 ℃时,硝酸钾和氯化钾的溶解度相同。
(2)当温度小于t1 ℃时,氯化钾的溶解度大于硝酸钾的溶解度。
(3)t2 ℃时,分别将30 g硝酸钾和氯化钾加入到50 g水中,充分溶解后一定形成饱和溶液的是氯化钾,其溶液的溶质质量分数为28.6%(结果精确到0.1%)。
(4)图2是有关硝酸钾溶液的实验操作及变化情况。若保持溶液的质量不变,操作Ⅰ为降低温度。
(5)下列有关说法不正确的是C。
A.①与②的溶质质量可能相等
B.②与③的溶质质量分数一定相等
C.等温度、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D.等温度、等质量的硝酸钾和氯化钾饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
14.(6分)如图所示,一物体悬挂在饱和氯化钠溶液中,在恒温条件下向烧杯内溶液中分别加入下列物质(悬挂物不参与反应)。说明弹簧秤读数变化情况。(均填“变大”“不变”或“变小”)
(1)如果加入氯化钠晶体,弹簧秤读数不变。
(2)如果加入蒸馏水,弹簧秤读数变大。
(3)如果加入KNO3晶体,弹簧秤读数变小。
三、实验探究题(共30分)
15.(12分)学完溶液知识后,小川回家用蔗糖、碳酸钙、植物油、洗涤剂、水相互混合做了几个小实验。
(1)在同一条件下,蔗糖易溶于水,难溶于植物油,碳酸钙不能溶于水,也不溶于植物油。由此说明物质的溶解能力与溶质的性质和溶剂的性质有关。
(2)除(1)中的因素外,你认为固体物质的溶解能力还与外界条件温度有关。小川在设计实验方案验证(2)中假设时,在选择了溶质和溶剂种类的前提下,你认为在实验中还需要控制的变量有溶剂的量。
(3)一天,小川不小心将碘酒洒在衣服上,他妈妈立即用水和洗洁精洗衣服,但怎么也洗不掉这些斑点,还是小川给妈妈出了个好主意。你认为小川应该采用的方法是将有斑点的部分浸在酒精中;这种方法和用洗洁精除油污的方法比较,在原理上有什么不同?酒精除去斑点是使污渍溶于酒精中,形成的是溶液;而洗洁精除去油污是洗洁精使油污以细小的液滴分散到水中形成稳定的乳浊液。
16.(18分)实验员王老师要配制80 g质量分数为10%的NaOH溶液供同学们使用,如图表示了他的实验操作过程。
回答下列问题:
(1)写出仪器的名称:①药匙,②烧杯。
(2)B操作中有一处错误是氢氧化钠应该放在烧杯中称量,应称NaOH的质量是8g,称量过程中若指针偏左,应进行的操作是减少左盘中的NaOH。
(3)仪器③的规格应是100 mL(填“50 mL”或“100 mL”),量取水时除仪器③外,还需要的一种仪器是胶头滴管。
(4)E操作中④的作用是用于搅拌,加快溶解速率。
(5)下列错误操作可能导致溶质的质量分数偏小的是①②③(填序号)。
①B操作中砝码与NaOH放颠倒了(1 g以下用游码)
②C操作中使用的烧杯内壁有水
③用量筒量水时仰视凹液面最低处读数
④F操作中溶液洒落
四、计算题(共8分)
17.(8分)向盛有28 g氯化钡和氯化钠固体混合物的烧杯中加入273.3 g水,固体完全溶解。再逐滴加入一定质量分数的硫酸钠溶液,反应过程中生成沉淀的质量与所加硫酸钠溶液的质量关系如图所示。(化学方程式:Na2SO4+BaCl2===2NaCl+BaSO4↓)
请计算:
(1)固体混合物中氯化钡的质量。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
解:(1)设固体混合物中氯化钡的质量为x,生成氯化钠的质量为y。
Na2SO4+BaCl2 ===2NaCl+BaSO4↓
208 117 233
x y 23.3 g
=,=
x=20.8 g y=11.7 g
(2)恰好完全反应时,所得溶液中溶质的质量分数为×100%=5%
答:(1)固体混合物中氯化钡的质量为20.8 g;(2)恰好完全反应时,所得溶液中溶质的质量分数为5%。
同课章节目录
