2021-2022学年人教版化学九年级上册第七单元燃料及其利用综合测评试卷(word版 带解析)
文档属性
| 名称 | 2021-2022学年人教版化学九年级上册第七单元燃料及其利用综合测评试卷(word版 带解析) |  | |
| 格式 | zip | ||
| 文件大小 | 146.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-11 08:32:54 | ||
图片预览




文档简介
化学九年级上册第七单元燃料及其利用综合测评
考试时间:90分钟;命题人:化学教研组
考生注意:
1、本卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟
2、答卷前,考生务必用0.5毫米黑色签字笔将自己的姓名、班级填写在试卷规定位置上
3、答案必须写在试卷各个题目指定区域内相应的位置,如需改动,先划掉原来的答案,然后再写上新的答案;不准使用涂改液、胶带纸、修正带,不按以上要求作答的答案无效。
第I卷(选择题 30分)
一、单选题(10小题,每小题3分,共计30分)
1、下列标志中,表示“禁止烟火”的是
A. B. C. D.
2、如图是乙醇的分子结构模型,下列说法不正确的是
A.乙醇由乙醇分子构成
B.乙醇分子是由碳、氢、氧三种原子构成
C.乙醇中碳、氢、氧元素的质量比为2:6:1
D.汽油中加入适量乙醇作为汽车燃料,可适当节省石油资源
3、下列说法正确的是
A.室内起火,迅速打开所有门窗通风
B.天然气泄漏,迅速关闭阀门并开窗通风
C.图书馆内,图书发生火灾可以用水基型灭火器进行灭火
D.森林发生火灾,可以用水灭火,是因为降低了可燃物的着火点
4、下列化学变化中吸收热量的是
A.二氧化碳通过高温的碳层 B.红磷在氧气中燃烧
C.生石灰与水反应 D.镁条和稀盐酸反应
5、如图是探究燃烧条件的实验,下列说法正确的是
A.热水的作用是提高白磷和红磷的着火点
B.热水的温度应该不低于红磷的着火点
C.这个实验设计运用了对比的方法
D.水中的白磷没有燃烧而铜片上的白磷燃烧,说明燃烧需要达到可燃物的着火点
6、下列有关燃烧与灭火的说法不正确的是
A.油在锅里着了火,盖上锅盖——隔绝氧气
B.森林灭火时,设置隔离带——隔绝可燃物
C.家具起火,用水扑来灭——降低温度
D.镁条在酒精灯上点燃——提高着火点
7、下列有关碳和碳的氧化物的说法中正确的是
A.金刚石、石墨、C60都是由碳原子构成的,性质相同 B.C与CO2反应放热
C.C、CO都具有还原性和可燃性 D.CO、CO2都有毒
8、强化安全意识,提升安全素养。若高层住宅发生火灾,在着火的初期,正确做法是
A.打开门窗通风 B.拨打电话求救 C.乘坐电梯逃生 D.用灭火器灭火
9、燃烧与人类的生产生活有着密切的联系。下列关于燃烧与灭火的说法正确的是
A.将煤块磨成煤粉可提高煤的燃烧利用率
B.易燃物和易爆物可以与其它物质混存
C.所有物质的燃烧都需要氧气
D.水能够灭火是因为水蒸发吸热,降低了可燃物的着火点
10、从安全的角度考虑,下列做法正确的是
A.夜晚发现家中燃气泄漏,立即开灯检查
B.使用酒精炉时,直接向燃着的炉内添加酒精
C.在山林中遇火灾时,尽量向顺风方向奔跑
D.冬季用煤炉取暖时,要保持良好通风
第Ⅱ卷(非选择题 70分)
二、填空题(5小题,每小题5分,共计25分)
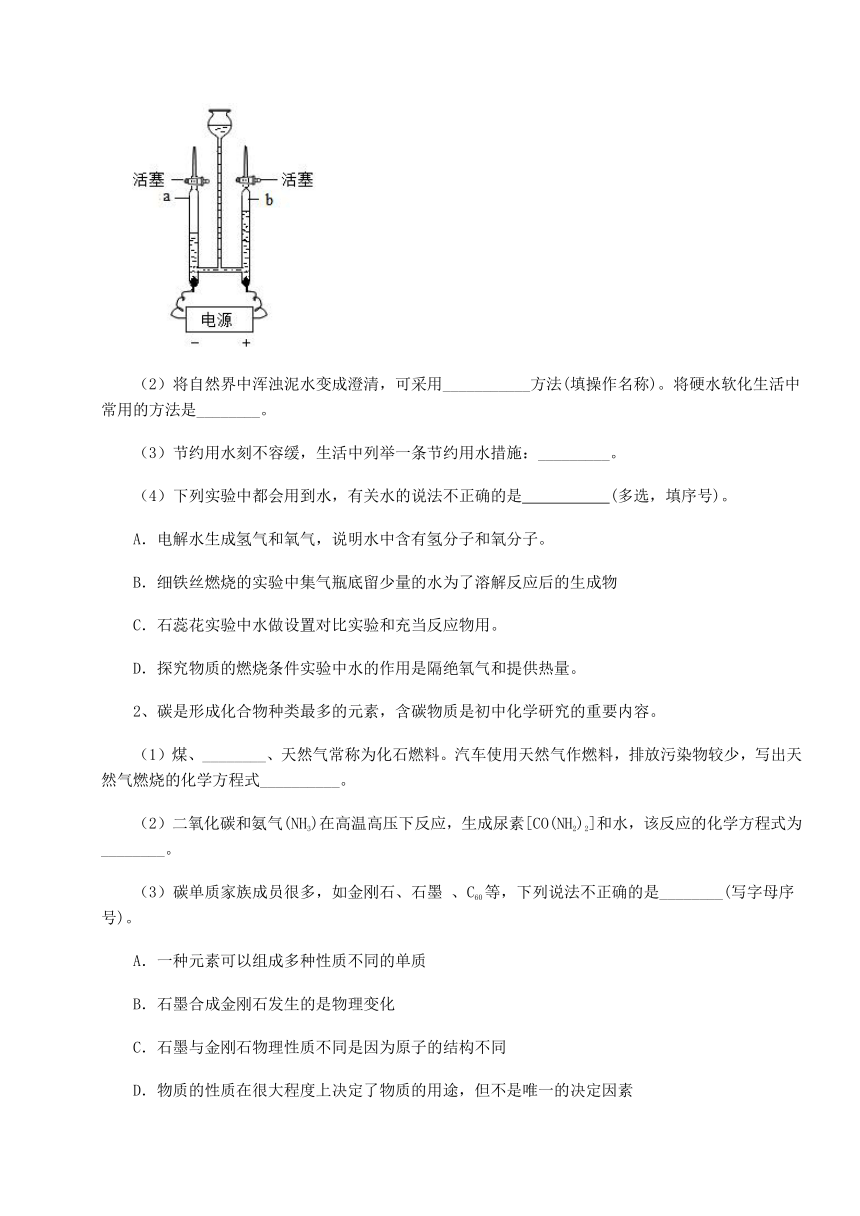
1、水是一种重要的资源,爱护水资源,人人有责。
(1)如图所示,电解水的实验中,正负两极产生气体的质量比为:___________。
(2)将自然界中浑浊泥水变成澄清,可采用___________方法(填操作名称)。将硬水软化生活中常用的方法是________。
(3)节约用水刻不容缓,生活中列举一条节约用水措施:_________。
(4)下列实验中都会用到水,有关水的说法不正确的是 (多选,填序号)。
A.电解水生成氢气和氧气,说明水中含有氢分子和氧分子。
B.细铁丝燃烧的实验中集气瓶底留少量的水为了溶解反应后的生成物
C.石蕊花实验中水做设置对比实验和充当反应物用。
D.探究物质的燃烧条件实验中水的作用是隔绝氧气和提供热量。
2、碳是形成化合物种类最多的元素,含碳物质是初中化学研究的重要内容。
(1)煤、________、天然气常称为化石燃料。汽车使用天然气作燃料,排放污染物较少,写出天然气燃烧的化学方程式__________。
(2)二氧化碳和氨气(NH3)在高温高压下反应,生成尿素[CO(NH2)2]和水,该反应的化学方程式为________。
(3)碳单质家族成员很多,如金刚石、石墨 、C60等,下列说法不正确的是________(写字母序号)。
A.一种元素可以组成多种性质不同的单质
B.石墨合成金刚石发生的是物理变化
C.石墨与金刚石物理性质不同是因为原子的结构不同
D.物质的性质在很大程度上决定了物质的用途,但不是唯一的决定因素
3、化学来源于生活,服务于生活。请回答下列有关化学问题。
(1)化石燃料燃烧产生大量CO2,加剧了大气层的___________效应。
(2)烟花燃烧时发出耀眼的白光,说明烟花中含有的金属为___________。
(3)在一定条件下,5gA物质和7gB物质恰好完全反应,只生成C、D两种物质,若生成C和D的质量比为3:1,则生成C的质量是___________g。
(4)“84”消毒液广泛用于食品工业、家庭、自来水等卫生消毒,其主要成分为次氯酸钠(NaCIO)。次氯酸钠中氯元素的化合价是___________。
(5)在室内不要喷洒高浓度酒精,因为挥发出的酒精蒸气遇到明火易发生燃烧和爆炸。从燃烧的条件分析,明火的作用是___________,酒精完全燃烧的化学方程式是___________。
4、天然气广泛应用于生产生活,其主要成分是甲烷(CH4)。
(1)天然气属于___________(填“可再生”或“不可再生")能源。
(2)室温下,充分燃烧1g天然气和1g煤,产生的CO2及热量的对比如图所示。据图分析,与煤相比,用天然气作燃料的优点有哪些?___________
(3)甲烷和二氧化碳在高温下催化重整(Ni作催化剂)可制得CO和H2.写出该反应的化学方程式___________。
5、能源利用和环境保护一直是人们关注的热点。
(1)化石燃料主要包括煤、石油和________。
(2)可燃冰主要含甲烷水合物,甲烷完全燃烧的化学方程式为______。
(3)某电厂为防止环境污染,用石灰石粉浆来吸收煤燃烧时排放出的二氧化硫,其反应的化学方程式为:2CaCO3+2SO2+O2═2CaSO4+2X,则X的化学式为_____。
三、计算题(3小题,每小题7分,共计21分)
1、哥本哈根气候大会主要议题是二氧化碳排放问题,上海世博会也大力倡导“低碳”生活理念。随着人民生活水平的提高,家庭小轿车的数量不断增加,这些汽车燃料燃烧时向大气中排放了大量的二氧化碳。
汽车所用燃料主要是汽油,汽油的成分复杂,同甲烷(CH4)替代汽油进行计算(含碳量比汽油略低)。公共汽车和小轿车耗油量(均以汽油为燃料)和载客人数如下:
公共汽车
小轿车
百公里耗油量/kg
18
9
平均载客人数/人
30
2
请计算:乘公共汽车行驶一百公里,人均排放二氧化碳 kg;乘小汽车行驶相同距离,人均排放二氧化碳的质量是乘公共汽车的 倍。
通过计算,谈谈为实现“低碳”生活理念,你的做法是什么?(答出两点即可)
2、有CO和CH4的混合气体4.8g,其中碳元素的质量分数为50%,将混合气体和氧气充分反应后,再通过足量的澄清石灰水,若每一步反应均完全,则最终得到的白色沉淀的质量为_______。
3、由于煤燃烧会产生大量的污染,因此在煤中加入适量的生石灰CaO制成供居民取暖的“环保煤”,以减少SO2的排放。燃烧时生石灰吸收SO2的化学方程式如下:
(1)CaSO4中硫元素的化合价为________,其中钙元素与氧元素的质量比为_______。
(2)煤中硫燃烧产生的SO2大量排放到空气中会产生的环境问题是___________,写出产生二氧化硫的化学方程式________。
(3)家庭用煤通常将“煤球”处理成“粉状煤”,这样做的目的是___________。
(4)若该煤厂要处理16吨二氧化硫,根据化学方程式计算,至少需要加入生石灰的质量是多少?
四、实验探究(2小题,每小题12分,共计24分)
1、某化学实验小组用石灰石与稀盐酸反应制取二氧化碳。
(反应原理)(1)反应的化学方程式为______。
(提出问题)影响石灰石与稀盐酸反应速率的因素有哪些?
(猜想)影响石灰石与稀盐酸反应的速率可能有:盐酸的浓度、石灰石的颗粒大小等。
(进行实验)室温下,选用20mL不同浓度的盐酸与1g石灰石进行实验(装置如图所示)。
(处理数据)实验后获得的相关实验数据如表:
实验 编号 盐酸的浓度 (均取20mL) 石灰石固体形状 (均取1g) 二氧化碳体积(mL) (均收集前30s的气体)
甲 4% 粉末状 64.0
乙 4% 块状 40.4
丙 6% 粉末状 98.2
丁 6% 块状 65.3
(2)要比较不同浓度的盐酸对反应速率的影响,应选择的实验编号是______(写1组),由此得到的结论是______。
(3)从上述实验中得出石灰石的颗粒大小对反应速率影响的结论是:石灰石的颗粒越小,反应速率越______(填“快”或“慢”)。
(实验延伸)表是记录生成二氧化碳气体体积和对应的时间的一组实验数据(每间隔4s
读数一次):
时间/s 4 8 12 16 20 24 28 32 36 40
CO2体积/mL 16 22.2 29.4 39.3 50.4 57.6 62 64.7 66 66
(4)从上表数据可以分析得出,到20s后反应速率逐渐变______(填“快”或“慢”),其主要原因是______。
2、某小组同学在用过氧化氢溶液与二氧化锰制取氧气的过程中,发现反应的速度很慢,产生的气泡很少.为此,他们进行了如下探究.
(猜想与假设)
①速度慢 、气泡少可能与过氧化氢溶液的浓度有关.
②速度慢 、气泡少可能与二氧化锰的质量有关.
(进行实验)根据图进行如下实验.
实验 1:用 26mg 二氧化锰与 5mL不同浓度过氧化氢溶液进行实验,压强变化如图 1。
实验2:用 5mL 1.5%过氧化氢溶液与不同质量二氧化锰进行实验,压强变化如图 2。
(解释与结论)
(1)实验 1得到的结论是___________。
(2)实验2的目的是___________。
(3)小组同学在制氧气过程中,发现反应的速度很慢,依据上述实验所得结论,推测其原因可能是___________
-参考答案-
一、单选题
1、B
【详解】
A、图为腐蚀品标志,故选项不符合题意;
B、图为禁止烟火标志,故选项符合题意;
C、图为禁止燃放鞭炮,故选项不符合题意;
D、图为国家节水标志,故选项不符合题意。
故选B。
2、C
【详解】
A. 乙醇由乙醇分子构成,不符合题意;
B. 由分子结构模型可知,乙醇分子是由碳、氢、氧三种原子构成,不符合题意;
C. 乙醇中碳、氢、氧元素的原子个数比为2:6:1,符合题意;
D. 汽油中加入适量乙醇作为汽车燃料,可适当节省石油资源,不符合题意。
故选C。
3、B
【详解】
A、室内起火,若迅速打开所有门窗通风,等于加快空气流通,给燃烧提供更多的氧气,使燃烧更旺,故A选项错误;
B、天然气泄漏,迅速关闭阀门并开窗通风,降低室内天然气的浓度,同时也能降低室内温度,防止燃烧和爆炸的发生,故B选项正确;
C、图书、档案着火,不能用水基型灭火器扑灭,会对图书档案造成二次破坏,应使用灭火时不留痕迹的液态二氧化碳灭火器灭火,故C选项错误;
D、森林发生火灾,用水灭火,是降低温度到着火点以下,不是降低了着火点,故D选项错误;
故选B。
4、A
【详解】
A、二氧化碳和碳在高温条件下生成一氧化碳,吸收热量。
B、红磷燃烧是放热反应,放出热量。
C、生石灰和水反应生成氢氧化钙,放出热量。
D、镁和盐酸反应生成氢气和氯化镁,放出热量。
故选A。
5、C
【详解】
A、热水的作用是提供热量,使温度达到白磷着火点,同时隔绝水中白磷与空气接触。错误。
B、热水的温度应该不低于白磷的着火点。错误。
C、这个实验设计运用了对比的方法,水中白磷与铜片上白磷对比说明燃烧需要与空气接触。铜片上白磷和红磷对比可说明燃烧需要温度需要达到可燃物着火点。正确。
D、水中的白磷没有燃烧而铜片上的白磷燃烧,说明燃烧需要与空气接触。错误。
故选C。
【点睛】
6、D
【详解】
A、油在锅里着了火,盖上锅盖,隔绝了空气可以灭火,说法正确,不符合题意;
B、森林灭火时,设置隔离带,移除了可燃物,说法正确,不符合题意;
C、家具起火,用水扑来灭,将温度降低到了可燃物燃点以下,说法正确,不符合题意;
D、镁条在酒精灯上点燃,温度达到了镁条的燃点,不是提高燃点,说法错误,符合题意。
故选D。
【点睛】
7、C
【详解】
A、由于碳原子的排列方式不同,金刚石、石墨、C60的物理性质有差异,说法不正确;
B、碳和二氧化碳在高温条件下反应生成一氧化碳,该反应是吸热反应,说法不正确;
C、C、CO都具有还原性(夺取氧化物中的氧元素)和可燃性(可以燃烧),说法正确;
D、CO有毒,而CO2无毒,说法不正确。
故选C。
8、D
【详解】
A、室内着火不能打开门窗通风,以防空气流入火势变强,说法错误,不符合题意;
B、在着火的初期,应首先考虑能否采取措施将火扑灭,说法错误,不符合题意;
C、高层住宅发生火灾,不能乘坐电梯逃生,说法错误,不符合题意;
D、高层住宅发生火灾,在着火的初期,可以使用灭火器灭火,说法正确,符合题意;
故选D。
【点睛】
9、A
【详解】
A、将煤块磨成煤粉增大了燃料与氧气的接触面积,促进了燃料的燃烧,可提高煤的燃烧利用率,故选项正确;
B、存放易燃、易爆物时,不能与其他物质混存,也不能堆放得过高过密,故选项错误;
C、不是所有物质的燃烧都需要氧气,如镁能在二氧化碳中燃烧,故选项错误;
D、水能够灭火是因为水蒸发吸热,降低了可燃物的温度,使温度降低到着火点以下而熄灭,故选项错误。
故选:A。
10、D
【详解】
A.夜晚发现家中燃气泄漏,不能立即开灯检查,否则遇到电火花会爆炸,选项做法错误。
B.使用酒精炉时,不能直接向燃着的炉内添加酒精,否则会发生火灾,选项做法错误。
C.在山林中遇火灾时,尽量向逆风方向奔跑,选项做法错误。
D.冬季用煤炉取暖时,要保持良好通风,否则会导致一氧化碳中毒,选项做法正确。
故选:D
二、填空题
1、
(1)8:1
(2) 过滤 煮沸
(3)淘米水洗菜
(4)AB
【分析】
(1)
电解水生成氢气和氧气,该反应的化学方程式为:,正负两极产生气体为氧气和氢气,其质量比为;
(2)
自然界中浑浊泥水变成澄清,是要分离水中的不溶性固体,可采用的方法为过滤。将硬水软化生活中常用的方法是煮沸,可溶性钙、镁化合物在加热时,能形成沉淀。
(3)
节约用水刻不容缓,生活中节约用水措施有淘米水洗菜;洗衣水洗拖把、冲厕所;随手关紧水龙头等。
(4)
A、电解水生成氢气和氧气,说明水中含有氢元素和氧元素,选项错误;
B、细铁丝燃烧的实验中集气瓶底留少量的水为了防止生成的高温熔融物炸裂瓶底,选项错误;
C、石蕊花实验中水做设置对比实验(说明水不能使紫色石蕊试液变红)和充当反应物(二氧化碳和水反应生成碳酸,碳酸显酸性,能使紫色石蕊试液变红)用,选项正确;
D、探究物质的燃烧条件实验中水的作用是隔绝氧气和提供热量,选项正确。
故选AB。
2、
(1) 石油 CH4+2O2CO2+2H2O
(2)CO2+2NH3CO(NH2)2+H2O
(3)BC
【解析】
(1)
化石燃料包括煤、石油和天然气,汽车使用天然气作燃料,天然气的主要成分是甲烷,甲烷燃烧生成二氧化碳和水,燃烧的化学方程式为:CH4+2O2CO2+2H2O。
(2)
二氧化碳和氨气在高温高压下反应生成尿素[CO(NH2)2]和水,该反应的化学方程式为CO2+2NH3CO(NH2)2+H2O。
(3)
A、一种元素可以组成多种性质不同的单质,比如碳元素可以组成金刚石,石墨等单质,金刚石是自然界硬度最大的物质,而石墨质软,不符合题意;
B、石墨与金刚石是两种不同的单质,故石墨合成金刚石发生的是化学变化,符合题意;
C、石墨与金刚石物理性质不同是因为碳原子的排列方式不同造成两种物质的结构不同,符合题意;
D、物质的性质在很大程度上决定了物质的用途,但不是唯一的决定因素还要考虑价格,环保,回收,便利等因素,不符合题意。故选BC。
3、
(1)温室
(2)镁
(3)9
(4)+1
(5) 提供温度,使温度达到酒精的着火点
【解析】
(1)
化石燃料燃烧产生大量CO2,加剧了大气层的温室效应;
(2)
镁条燃烧会发出耀眼的白光,则烟花燃烧时发出耀眼的白光,说明烟花中含有的金属为镁或Mg;
(3)
由题意,在一定条件下,5gA物质和7gB物质恰好完全反应,只生成C、D两种物质,即参加反应的A、B的质量之和等于生成C、D的质量之和,则C、D的质量之和为5g+7g=12g,若生成C和D的质量比为3:1,则生成C的质量是12g× =9g;
(4)
次氯酸钠的化学式为NaClO,在NaClO中钠元素显+1价,氧元素显-2价,设氯元素的化合价为 ,根据在化合物中元素化合价的代数和为0,则(+1)×1+×1+(-2)×1=0,=+1;
(5)
在室内不要喷洒高浓度酒精,因为挥发出的酒精蒸气遇到明火易发生燃烧和爆炸。从燃烧的条件分析,明火的作用是提供温度,使温度达到酒精的着火点,酒精完全燃烧生成水和二氧化碳,反应的化学方程式为 。
4、
(1)不可再生
(2)等质量的甲烷燃烧产生的CO2少,产生的热量高
(3)
【解析】
(1)
煤、石油、天然气属于不可再生能源,故填不可再生;
(2)
由图一可知,燃烧等质量的天然气和煤,天然气燃烧生成的二氧化碳质量小于煤燃烧生成的二氧化碳;由图二可知,等质量的天然气和煤燃烧,天然气放出的热量更多,故填等质量的甲烷燃烧产生的CO2少,产生的热量高;
(3)
甲烷和二氧化碳在高温下催化重整(Ni作催化剂)可制得CO和H2,则化学方程式为;
5、
(1)天然气
(2)CH4+2O2O2+2H2O
(3)CO2
【解析】
(1)
化石燃料包括煤、石油、天然气;
(2)
甲烷在点燃的条件下生成水和二氧化碳,化学方程式为:CH4+2O2O2+2H2O;
(3)
化学反应前后,原子种类和个数均不改变,反应前后钙原子守恒,反应前后硫原子守恒,反应前有2个碳原子,反应后1个X分子中含有1个碳原子,反应前有12个氧原子,反应后2个硫酸钙分子中含有8个氧原子,故1个X分子中含有2个氧原子,故X的化学式为CO2;
三、计算题
1、1.65 7.5 多步行、骑自行车或乘公共汽车,少乘私家车;随手关灯;节约纸张;植树造林减少化石燃料燃烧;使用新的替代能源等合理答案均可。
【详解】
设公共汽车、小轿车行驶一百公里产生的二氧化碳的质量分别为X、Y.
CH4+2O2 CO2+2H2O,CH4+2O2 CO2+2H2O.
16 44 16 44
18kg X 9kg Y
16:44=18kg:X
16:44=9kg:Y
X=49.5kg;Y=24.75kg.
乘公共汽车行驶一百公里,人均排放二氧化碳的质量为:49.5kg÷30=1.65kg.故填:1.65.
乘小汽车行驶相同距离,人均排放二氧化碳的质量为:24.75kg÷2=12.375kg.
乘小汽车行驶相同距离,人均排放二氧化碳的质量是乘公共汽车的倍数为:12.375kg÷1.65kg=7.5倍.故填:7.5.
为实现“低碳”生活理念,人们应该做到:多步行、骑自行车或乘公共汽车,少乘私家车;随手关灯;节约纸张;植树造林减少化石燃料燃烧;使用新的替代能源等.
2、20g
【详解】
根据质量守恒,反应前后元素种类不变质量不变,反应前碳元素质量4.8g50%=2.4g,设碳酸钙质量为x,反应前后碳元素质量不变,故x=2.4g,x=20g,故填:20g。
3、
(1) +6 5:8
(2) 形成酸雨
(3)增大接触面积,使其充分燃烧
(4)解:设至少需要生石灰的质量为x。
x=14t
答:至少需要生石灰的质量为14t。
【解析】
(1)
CaSO4中钙显+2价,氧显-2价,设硫元素的化合价为x,则(+2)+x+(-2)×4=0,解得x=+6。硫酸钙中,钙元素与氧元素的质量比为:40∶(16×4)=5∶8。
(2)
煤中硫燃烧产生的SO2大量排放到空气中,下雨时,二氧化硫和水会反应生成亚硫酸,使得雨水的酸性比正常雨水强,pH<5.6,因此会产生的环境问题是形成酸雨。煤燃烧时,煤中的硫和氧气反应生成二氧化硫,化学方程式为:。
(3)
可燃物与氧气的接触面积越大,燃烧就越充分,因此家庭用煤通常将“煤球”处理成“粉状煤”,这样做的目的是:增大接触面积,使其充分燃烧。
(4)
见答案。
四、实验探究
1、 甲丙(或乙丁) 盐酸浓度越大,反应速率越快(或盐酸浓度越小,反应速率越慢) 快 慢 随着反应的进行,盐酸的浓度逐渐变小(或反应物的量逐渐变少等合理答案)
【详解】
(1)石灰石的主要成分是碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,其化学方程式为:。
(2)要比较不同浓度的盐酸对反应速率的影响,可选择的实验编号是甲丙或乙丁,是因为两组实验除盐酸浓度不同外,其它条件均相同。该实验是以相同时间收集到二氧化碳体积来表示反应速率,相同时间内收集的气体越多,则反应速率越快,通过对比甲丙两组实验,丙组盐酸浓度大,收集的气体多,则反应速率快;通过对比乙丁两组实验,丁组盐酸浓度大,收集的气体多,则反应速率快;所以可以得出结论:盐酸浓度越大,反应速率越快或盐酸浓度越小,反应速率越慢;故分别填:甲丙(或乙丁);盐酸浓度越大,反应速率越快(或盐酸浓度越小,反应速率越慢)。
(3)从上述实验中可知,其它条件相同时,石灰石颗粒越小,相同时间内收集的气体越多,得出石灰石的颗粒大小对反应速率影响的结论是:其它条件相同时,石灰石的颗粒越小,反应速率越快。故填:快。
(4)从表格数据可以分析得出,开始反应的速率大,后来的反应速率小,主要是因为随着反应的进行,反应物被消耗,浓度减小。故分别填:慢;随着反应的进行,盐酸的浓度逐渐变小(或反应物的量逐渐变少等合理答案)。
2、相同质量的二氧化锰,相同体积的过氧化氢溶液的情况下,过氧化氢溶液浓度越大,过氧化氢分解速度越快,产生气泡越多 探究速度慢、气泡少是否与二氧化锰的质量有关 过氧化氢溶液浓度较低或二氧化锰质量较小
【解释与结论】
(1)根据图1可知:相同质量的二氧化锰,相同体积的过氧化氢溶液的情况下,过氧化氢溶液浓度越大,过氧化氢分解速度越快,产生气泡越多;
(2)实验二:二氧化锰质量不同,过氧化氢质量、浓度相同,可以探究速度慢、气泡少是否与二氧化锰的质量有关;
(3)根据实验一二可知过氧化氢浓度越小,反应越慢,二氧化锰质量越少反应越慢,所以发现反应的速度很慢,其原因可能是过氧化氢浓度较低或二氧化锰质量较少。
【点睛】
考试时间:90分钟;命题人:化学教研组
考生注意:
1、本卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟
2、答卷前,考生务必用0.5毫米黑色签字笔将自己的姓名、班级填写在试卷规定位置上
3、答案必须写在试卷各个题目指定区域内相应的位置,如需改动,先划掉原来的答案,然后再写上新的答案;不准使用涂改液、胶带纸、修正带,不按以上要求作答的答案无效。
第I卷(选择题 30分)
一、单选题(10小题,每小题3分,共计30分)
1、下列标志中,表示“禁止烟火”的是
A. B. C. D.
2、如图是乙醇的分子结构模型,下列说法不正确的是
A.乙醇由乙醇分子构成
B.乙醇分子是由碳、氢、氧三种原子构成
C.乙醇中碳、氢、氧元素的质量比为2:6:1
D.汽油中加入适量乙醇作为汽车燃料,可适当节省石油资源
3、下列说法正确的是
A.室内起火,迅速打开所有门窗通风
B.天然气泄漏,迅速关闭阀门并开窗通风
C.图书馆内,图书发生火灾可以用水基型灭火器进行灭火
D.森林发生火灾,可以用水灭火,是因为降低了可燃物的着火点
4、下列化学变化中吸收热量的是
A.二氧化碳通过高温的碳层 B.红磷在氧气中燃烧
C.生石灰与水反应 D.镁条和稀盐酸反应
5、如图是探究燃烧条件的实验,下列说法正确的是
A.热水的作用是提高白磷和红磷的着火点
B.热水的温度应该不低于红磷的着火点
C.这个实验设计运用了对比的方法
D.水中的白磷没有燃烧而铜片上的白磷燃烧,说明燃烧需要达到可燃物的着火点
6、下列有关燃烧与灭火的说法不正确的是
A.油在锅里着了火,盖上锅盖——隔绝氧气
B.森林灭火时,设置隔离带——隔绝可燃物
C.家具起火,用水扑来灭——降低温度
D.镁条在酒精灯上点燃——提高着火点
7、下列有关碳和碳的氧化物的说法中正确的是
A.金刚石、石墨、C60都是由碳原子构成的,性质相同 B.C与CO2反应放热
C.C、CO都具有还原性和可燃性 D.CO、CO2都有毒
8、强化安全意识,提升安全素养。若高层住宅发生火灾,在着火的初期,正确做法是
A.打开门窗通风 B.拨打电话求救 C.乘坐电梯逃生 D.用灭火器灭火
9、燃烧与人类的生产生活有着密切的联系。下列关于燃烧与灭火的说法正确的是
A.将煤块磨成煤粉可提高煤的燃烧利用率
B.易燃物和易爆物可以与其它物质混存
C.所有物质的燃烧都需要氧气
D.水能够灭火是因为水蒸发吸热,降低了可燃物的着火点
10、从安全的角度考虑,下列做法正确的是
A.夜晚发现家中燃气泄漏,立即开灯检查
B.使用酒精炉时,直接向燃着的炉内添加酒精
C.在山林中遇火灾时,尽量向顺风方向奔跑
D.冬季用煤炉取暖时,要保持良好通风
第Ⅱ卷(非选择题 70分)
二、填空题(5小题,每小题5分,共计25分)
1、水是一种重要的资源,爱护水资源,人人有责。
(1)如图所示,电解水的实验中,正负两极产生气体的质量比为:___________。
(2)将自然界中浑浊泥水变成澄清,可采用___________方法(填操作名称)。将硬水软化生活中常用的方法是________。
(3)节约用水刻不容缓,生活中列举一条节约用水措施:_________。
(4)下列实验中都会用到水,有关水的说法不正确的是 (多选,填序号)。
A.电解水生成氢气和氧气,说明水中含有氢分子和氧分子。
B.细铁丝燃烧的实验中集气瓶底留少量的水为了溶解反应后的生成物
C.石蕊花实验中水做设置对比实验和充当反应物用。
D.探究物质的燃烧条件实验中水的作用是隔绝氧气和提供热量。
2、碳是形成化合物种类最多的元素,含碳物质是初中化学研究的重要内容。
(1)煤、________、天然气常称为化石燃料。汽车使用天然气作燃料,排放污染物较少,写出天然气燃烧的化学方程式__________。
(2)二氧化碳和氨气(NH3)在高温高压下反应,生成尿素[CO(NH2)2]和水,该反应的化学方程式为________。
(3)碳单质家族成员很多,如金刚石、石墨 、C60等,下列说法不正确的是________(写字母序号)。
A.一种元素可以组成多种性质不同的单质
B.石墨合成金刚石发生的是物理变化
C.石墨与金刚石物理性质不同是因为原子的结构不同
D.物质的性质在很大程度上决定了物质的用途,但不是唯一的决定因素
3、化学来源于生活,服务于生活。请回答下列有关化学问题。
(1)化石燃料燃烧产生大量CO2,加剧了大气层的___________效应。
(2)烟花燃烧时发出耀眼的白光,说明烟花中含有的金属为___________。
(3)在一定条件下,5gA物质和7gB物质恰好完全反应,只生成C、D两种物质,若生成C和D的质量比为3:1,则生成C的质量是___________g。
(4)“84”消毒液广泛用于食品工业、家庭、自来水等卫生消毒,其主要成分为次氯酸钠(NaCIO)。次氯酸钠中氯元素的化合价是___________。
(5)在室内不要喷洒高浓度酒精,因为挥发出的酒精蒸气遇到明火易发生燃烧和爆炸。从燃烧的条件分析,明火的作用是___________,酒精完全燃烧的化学方程式是___________。
4、天然气广泛应用于生产生活,其主要成分是甲烷(CH4)。
(1)天然气属于___________(填“可再生”或“不可再生")能源。
(2)室温下,充分燃烧1g天然气和1g煤,产生的CO2及热量的对比如图所示。据图分析,与煤相比,用天然气作燃料的优点有哪些?___________
(3)甲烷和二氧化碳在高温下催化重整(Ni作催化剂)可制得CO和H2.写出该反应的化学方程式___________。
5、能源利用和环境保护一直是人们关注的热点。
(1)化石燃料主要包括煤、石油和________。
(2)可燃冰主要含甲烷水合物,甲烷完全燃烧的化学方程式为______。
(3)某电厂为防止环境污染,用石灰石粉浆来吸收煤燃烧时排放出的二氧化硫,其反应的化学方程式为:2CaCO3+2SO2+O2═2CaSO4+2X,则X的化学式为_____。
三、计算题(3小题,每小题7分,共计21分)
1、哥本哈根气候大会主要议题是二氧化碳排放问题,上海世博会也大力倡导“低碳”生活理念。随着人民生活水平的提高,家庭小轿车的数量不断增加,这些汽车燃料燃烧时向大气中排放了大量的二氧化碳。
汽车所用燃料主要是汽油,汽油的成分复杂,同甲烷(CH4)替代汽油进行计算(含碳量比汽油略低)。公共汽车和小轿车耗油量(均以汽油为燃料)和载客人数如下:
公共汽车
小轿车
百公里耗油量/kg
18
9
平均载客人数/人
30
2
请计算:乘公共汽车行驶一百公里,人均排放二氧化碳 kg;乘小汽车行驶相同距离,人均排放二氧化碳的质量是乘公共汽车的 倍。
通过计算,谈谈为实现“低碳”生活理念,你的做法是什么?(答出两点即可)
2、有CO和CH4的混合气体4.8g,其中碳元素的质量分数为50%,将混合气体和氧气充分反应后,再通过足量的澄清石灰水,若每一步反应均完全,则最终得到的白色沉淀的质量为_______。
3、由于煤燃烧会产生大量的污染,因此在煤中加入适量的生石灰CaO制成供居民取暖的“环保煤”,以减少SO2的排放。燃烧时生石灰吸收SO2的化学方程式如下:
(1)CaSO4中硫元素的化合价为________,其中钙元素与氧元素的质量比为_______。
(2)煤中硫燃烧产生的SO2大量排放到空气中会产生的环境问题是___________,写出产生二氧化硫的化学方程式________。
(3)家庭用煤通常将“煤球”处理成“粉状煤”,这样做的目的是___________。
(4)若该煤厂要处理16吨二氧化硫,根据化学方程式计算,至少需要加入生石灰的质量是多少?
四、实验探究(2小题,每小题12分,共计24分)
1、某化学实验小组用石灰石与稀盐酸反应制取二氧化碳。
(反应原理)(1)反应的化学方程式为______。
(提出问题)影响石灰石与稀盐酸反应速率的因素有哪些?
(猜想)影响石灰石与稀盐酸反应的速率可能有:盐酸的浓度、石灰石的颗粒大小等。
(进行实验)室温下,选用20mL不同浓度的盐酸与1g石灰石进行实验(装置如图所示)。
(处理数据)实验后获得的相关实验数据如表:
实验 编号 盐酸的浓度 (均取20mL) 石灰石固体形状 (均取1g) 二氧化碳体积(mL) (均收集前30s的气体)
甲 4% 粉末状 64.0
乙 4% 块状 40.4
丙 6% 粉末状 98.2
丁 6% 块状 65.3
(2)要比较不同浓度的盐酸对反应速率的影响,应选择的实验编号是______(写1组),由此得到的结论是______。
(3)从上述实验中得出石灰石的颗粒大小对反应速率影响的结论是:石灰石的颗粒越小,反应速率越______(填“快”或“慢”)。
(实验延伸)表是记录生成二氧化碳气体体积和对应的时间的一组实验数据(每间隔4s
读数一次):
时间/s 4 8 12 16 20 24 28 32 36 40
CO2体积/mL 16 22.2 29.4 39.3 50.4 57.6 62 64.7 66 66
(4)从上表数据可以分析得出,到20s后反应速率逐渐变______(填“快”或“慢”),其主要原因是______。
2、某小组同学在用过氧化氢溶液与二氧化锰制取氧气的过程中,发现反应的速度很慢,产生的气泡很少.为此,他们进行了如下探究.
(猜想与假设)
①速度慢 、气泡少可能与过氧化氢溶液的浓度有关.
②速度慢 、气泡少可能与二氧化锰的质量有关.
(进行实验)根据图进行如下实验.
实验 1:用 26mg 二氧化锰与 5mL不同浓度过氧化氢溶液进行实验,压强变化如图 1。
实验2:用 5mL 1.5%过氧化氢溶液与不同质量二氧化锰进行实验,压强变化如图 2。
(解释与结论)
(1)实验 1得到的结论是___________。
(2)实验2的目的是___________。
(3)小组同学在制氧气过程中,发现反应的速度很慢,依据上述实验所得结论,推测其原因可能是___________
-参考答案-
一、单选题
1、B
【详解】
A、图为腐蚀品标志,故选项不符合题意;
B、图为禁止烟火标志,故选项符合题意;
C、图为禁止燃放鞭炮,故选项不符合题意;
D、图为国家节水标志,故选项不符合题意。
故选B。
2、C
【详解】
A. 乙醇由乙醇分子构成,不符合题意;
B. 由分子结构模型可知,乙醇分子是由碳、氢、氧三种原子构成,不符合题意;
C. 乙醇中碳、氢、氧元素的原子个数比为2:6:1,符合题意;
D. 汽油中加入适量乙醇作为汽车燃料,可适当节省石油资源,不符合题意。
故选C。
3、B
【详解】
A、室内起火,若迅速打开所有门窗通风,等于加快空气流通,给燃烧提供更多的氧气,使燃烧更旺,故A选项错误;
B、天然气泄漏,迅速关闭阀门并开窗通风,降低室内天然气的浓度,同时也能降低室内温度,防止燃烧和爆炸的发生,故B选项正确;
C、图书、档案着火,不能用水基型灭火器扑灭,会对图书档案造成二次破坏,应使用灭火时不留痕迹的液态二氧化碳灭火器灭火,故C选项错误;
D、森林发生火灾,用水灭火,是降低温度到着火点以下,不是降低了着火点,故D选项错误;
故选B。
4、A
【详解】
A、二氧化碳和碳在高温条件下生成一氧化碳,吸收热量。
B、红磷燃烧是放热反应,放出热量。
C、生石灰和水反应生成氢氧化钙,放出热量。
D、镁和盐酸反应生成氢气和氯化镁,放出热量。
故选A。
5、C
【详解】
A、热水的作用是提供热量,使温度达到白磷着火点,同时隔绝水中白磷与空气接触。错误。
B、热水的温度应该不低于白磷的着火点。错误。
C、这个实验设计运用了对比的方法,水中白磷与铜片上白磷对比说明燃烧需要与空气接触。铜片上白磷和红磷对比可说明燃烧需要温度需要达到可燃物着火点。正确。
D、水中的白磷没有燃烧而铜片上的白磷燃烧,说明燃烧需要与空气接触。错误。
故选C。
【点睛】
6、D
【详解】
A、油在锅里着了火,盖上锅盖,隔绝了空气可以灭火,说法正确,不符合题意;
B、森林灭火时,设置隔离带,移除了可燃物,说法正确,不符合题意;
C、家具起火,用水扑来灭,将温度降低到了可燃物燃点以下,说法正确,不符合题意;
D、镁条在酒精灯上点燃,温度达到了镁条的燃点,不是提高燃点,说法错误,符合题意。
故选D。
【点睛】
7、C
【详解】
A、由于碳原子的排列方式不同,金刚石、石墨、C60的物理性质有差异,说法不正确;
B、碳和二氧化碳在高温条件下反应生成一氧化碳,该反应是吸热反应,说法不正确;
C、C、CO都具有还原性(夺取氧化物中的氧元素)和可燃性(可以燃烧),说法正确;
D、CO有毒,而CO2无毒,说法不正确。
故选C。
8、D
【详解】
A、室内着火不能打开门窗通风,以防空气流入火势变强,说法错误,不符合题意;
B、在着火的初期,应首先考虑能否采取措施将火扑灭,说法错误,不符合题意;
C、高层住宅发生火灾,不能乘坐电梯逃生,说法错误,不符合题意;
D、高层住宅发生火灾,在着火的初期,可以使用灭火器灭火,说法正确,符合题意;
故选D。
【点睛】
9、A
【详解】
A、将煤块磨成煤粉增大了燃料与氧气的接触面积,促进了燃料的燃烧,可提高煤的燃烧利用率,故选项正确;
B、存放易燃、易爆物时,不能与其他物质混存,也不能堆放得过高过密,故选项错误;
C、不是所有物质的燃烧都需要氧气,如镁能在二氧化碳中燃烧,故选项错误;
D、水能够灭火是因为水蒸发吸热,降低了可燃物的温度,使温度降低到着火点以下而熄灭,故选项错误。
故选:A。
10、D
【详解】
A.夜晚发现家中燃气泄漏,不能立即开灯检查,否则遇到电火花会爆炸,选项做法错误。
B.使用酒精炉时,不能直接向燃着的炉内添加酒精,否则会发生火灾,选项做法错误。
C.在山林中遇火灾时,尽量向逆风方向奔跑,选项做法错误。
D.冬季用煤炉取暖时,要保持良好通风,否则会导致一氧化碳中毒,选项做法正确。
故选:D
二、填空题
1、
(1)8:1
(2) 过滤 煮沸
(3)淘米水洗菜
(4)AB
【分析】
(1)
电解水生成氢气和氧气,该反应的化学方程式为:,正负两极产生气体为氧气和氢气,其质量比为;
(2)
自然界中浑浊泥水变成澄清,是要分离水中的不溶性固体,可采用的方法为过滤。将硬水软化生活中常用的方法是煮沸,可溶性钙、镁化合物在加热时,能形成沉淀。
(3)
节约用水刻不容缓,生活中节约用水措施有淘米水洗菜;洗衣水洗拖把、冲厕所;随手关紧水龙头等。
(4)
A、电解水生成氢气和氧气,说明水中含有氢元素和氧元素,选项错误;
B、细铁丝燃烧的实验中集气瓶底留少量的水为了防止生成的高温熔融物炸裂瓶底,选项错误;
C、石蕊花实验中水做设置对比实验(说明水不能使紫色石蕊试液变红)和充当反应物(二氧化碳和水反应生成碳酸,碳酸显酸性,能使紫色石蕊试液变红)用,选项正确;
D、探究物质的燃烧条件实验中水的作用是隔绝氧气和提供热量,选项正确。
故选AB。
2、
(1) 石油 CH4+2O2CO2+2H2O
(2)CO2+2NH3CO(NH2)2+H2O
(3)BC
【解析】
(1)
化石燃料包括煤、石油和天然气,汽车使用天然气作燃料,天然气的主要成分是甲烷,甲烷燃烧生成二氧化碳和水,燃烧的化学方程式为:CH4+2O2CO2+2H2O。
(2)
二氧化碳和氨气在高温高压下反应生成尿素[CO(NH2)2]和水,该反应的化学方程式为CO2+2NH3CO(NH2)2+H2O。
(3)
A、一种元素可以组成多种性质不同的单质,比如碳元素可以组成金刚石,石墨等单质,金刚石是自然界硬度最大的物质,而石墨质软,不符合题意;
B、石墨与金刚石是两种不同的单质,故石墨合成金刚石发生的是化学变化,符合题意;
C、石墨与金刚石物理性质不同是因为碳原子的排列方式不同造成两种物质的结构不同,符合题意;
D、物质的性质在很大程度上决定了物质的用途,但不是唯一的决定因素还要考虑价格,环保,回收,便利等因素,不符合题意。故选BC。
3、
(1)温室
(2)镁
(3)9
(4)+1
(5) 提供温度,使温度达到酒精的着火点
【解析】
(1)
化石燃料燃烧产生大量CO2,加剧了大气层的温室效应;
(2)
镁条燃烧会发出耀眼的白光,则烟花燃烧时发出耀眼的白光,说明烟花中含有的金属为镁或Mg;
(3)
由题意,在一定条件下,5gA物质和7gB物质恰好完全反应,只生成C、D两种物质,即参加反应的A、B的质量之和等于生成C、D的质量之和,则C、D的质量之和为5g+7g=12g,若生成C和D的质量比为3:1,则生成C的质量是12g× =9g;
(4)
次氯酸钠的化学式为NaClO,在NaClO中钠元素显+1价,氧元素显-2价,设氯元素的化合价为 ,根据在化合物中元素化合价的代数和为0,则(+1)×1+×1+(-2)×1=0,=+1;
(5)
在室内不要喷洒高浓度酒精,因为挥发出的酒精蒸气遇到明火易发生燃烧和爆炸。从燃烧的条件分析,明火的作用是提供温度,使温度达到酒精的着火点,酒精完全燃烧生成水和二氧化碳,反应的化学方程式为 。
4、
(1)不可再生
(2)等质量的甲烷燃烧产生的CO2少,产生的热量高
(3)
【解析】
(1)
煤、石油、天然气属于不可再生能源,故填不可再生;
(2)
由图一可知,燃烧等质量的天然气和煤,天然气燃烧生成的二氧化碳质量小于煤燃烧生成的二氧化碳;由图二可知,等质量的天然气和煤燃烧,天然气放出的热量更多,故填等质量的甲烷燃烧产生的CO2少,产生的热量高;
(3)
甲烷和二氧化碳在高温下催化重整(Ni作催化剂)可制得CO和H2,则化学方程式为;
5、
(1)天然气
(2)CH4+2O2O2+2H2O
(3)CO2
【解析】
(1)
化石燃料包括煤、石油、天然气;
(2)
甲烷在点燃的条件下生成水和二氧化碳,化学方程式为:CH4+2O2O2+2H2O;
(3)
化学反应前后,原子种类和个数均不改变,反应前后钙原子守恒,反应前后硫原子守恒,反应前有2个碳原子,反应后1个X分子中含有1个碳原子,反应前有12个氧原子,反应后2个硫酸钙分子中含有8个氧原子,故1个X分子中含有2个氧原子,故X的化学式为CO2;
三、计算题
1、1.65 7.5 多步行、骑自行车或乘公共汽车,少乘私家车;随手关灯;节约纸张;植树造林减少化石燃料燃烧;使用新的替代能源等合理答案均可。
【详解】
设公共汽车、小轿车行驶一百公里产生的二氧化碳的质量分别为X、Y.
CH4+2O2 CO2+2H2O,CH4+2O2 CO2+2H2O.
16 44 16 44
18kg X 9kg Y
16:44=18kg:X
16:44=9kg:Y
X=49.5kg;Y=24.75kg.
乘公共汽车行驶一百公里,人均排放二氧化碳的质量为:49.5kg÷30=1.65kg.故填:1.65.
乘小汽车行驶相同距离,人均排放二氧化碳的质量为:24.75kg÷2=12.375kg.
乘小汽车行驶相同距离,人均排放二氧化碳的质量是乘公共汽车的倍数为:12.375kg÷1.65kg=7.5倍.故填:7.5.
为实现“低碳”生活理念,人们应该做到:多步行、骑自行车或乘公共汽车,少乘私家车;随手关灯;节约纸张;植树造林减少化石燃料燃烧;使用新的替代能源等.
2、20g
【详解】
根据质量守恒,反应前后元素种类不变质量不变,反应前碳元素质量4.8g50%=2.4g,设碳酸钙质量为x,反应前后碳元素质量不变,故x=2.4g,x=20g,故填:20g。
3、
(1) +6 5:8
(2) 形成酸雨
(3)增大接触面积,使其充分燃烧
(4)解:设至少需要生石灰的质量为x。
x=14t
答:至少需要生石灰的质量为14t。
【解析】
(1)
CaSO4中钙显+2价,氧显-2价,设硫元素的化合价为x,则(+2)+x+(-2)×4=0,解得x=+6。硫酸钙中,钙元素与氧元素的质量比为:40∶(16×4)=5∶8。
(2)
煤中硫燃烧产生的SO2大量排放到空气中,下雨时,二氧化硫和水会反应生成亚硫酸,使得雨水的酸性比正常雨水强,pH<5.6,因此会产生的环境问题是形成酸雨。煤燃烧时,煤中的硫和氧气反应生成二氧化硫,化学方程式为:。
(3)
可燃物与氧气的接触面积越大,燃烧就越充分,因此家庭用煤通常将“煤球”处理成“粉状煤”,这样做的目的是:增大接触面积,使其充分燃烧。
(4)
见答案。
四、实验探究
1、 甲丙(或乙丁) 盐酸浓度越大,反应速率越快(或盐酸浓度越小,反应速率越慢) 快 慢 随着反应的进行,盐酸的浓度逐渐变小(或反应物的量逐渐变少等合理答案)
【详解】
(1)石灰石的主要成分是碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,其化学方程式为:。
(2)要比较不同浓度的盐酸对反应速率的影响,可选择的实验编号是甲丙或乙丁,是因为两组实验除盐酸浓度不同外,其它条件均相同。该实验是以相同时间收集到二氧化碳体积来表示反应速率,相同时间内收集的气体越多,则反应速率越快,通过对比甲丙两组实验,丙组盐酸浓度大,收集的气体多,则反应速率快;通过对比乙丁两组实验,丁组盐酸浓度大,收集的气体多,则反应速率快;所以可以得出结论:盐酸浓度越大,反应速率越快或盐酸浓度越小,反应速率越慢;故分别填:甲丙(或乙丁);盐酸浓度越大,反应速率越快(或盐酸浓度越小,反应速率越慢)。
(3)从上述实验中可知,其它条件相同时,石灰石颗粒越小,相同时间内收集的气体越多,得出石灰石的颗粒大小对反应速率影响的结论是:其它条件相同时,石灰石的颗粒越小,反应速率越快。故填:快。
(4)从表格数据可以分析得出,开始反应的速率大,后来的反应速率小,主要是因为随着反应的进行,反应物被消耗,浓度减小。故分别填:慢;随着反应的进行,盐酸的浓度逐渐变小(或反应物的量逐渐变少等合理答案)。
2、相同质量的二氧化锰,相同体积的过氧化氢溶液的情况下,过氧化氢溶液浓度越大,过氧化氢分解速度越快,产生气泡越多 探究速度慢、气泡少是否与二氧化锰的质量有关 过氧化氢溶液浓度较低或二氧化锰质量较小
【解释与结论】
(1)根据图1可知:相同质量的二氧化锰,相同体积的过氧化氢溶液的情况下,过氧化氢溶液浓度越大,过氧化氢分解速度越快,产生气泡越多;
(2)实验二:二氧化锰质量不同,过氧化氢质量、浓度相同,可以探究速度慢、气泡少是否与二氧化锰的质量有关;
(3)根据实验一二可知过氧化氢浓度越小,反应越慢,二氧化锰质量越少反应越慢,所以发现反应的速度很慢,其原因可能是过氧化氢浓度较低或二氧化锰质量较少。
【点睛】
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
