硫和氮的氧化物
图片预览









文档简介
课件35张PPT。第三节 硫和氮的氧化物
第1课时 二氧化硫和三氧化硫
三维目标游离态化合态一、硫(俗称硫黄)1.在自然界中的存在
(1)游离态的硫存在于火山喷口附近或地壳岩层里。
(2)化合态的硫主要以硫化物和硫酸盐的形式存在。(1)氧化性:3.化学性质:(2)还原性:Fe + S FeS2.物理性质:黄色晶体,俗称硫黄,质脆,易研成粉末。不溶于水,微溶于酒精,易溶于CS2。2Cu+S=Cu2S
二氧化硫的性质【P84实验4-7:观察并思考】
1、 实验中原盛有SO2 气体的试管水位有什么变化?说明了什么?
------试管内水位上升;说明SO2易溶水
2、用PH试纸检验试管内水溶液酸碱性。
-------试纸变红色,溶液呈酸性二、二氧化硫
1.物理性质:无色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水。
2.化学性质
(1)与水的反应
SO2+H2O H2SO3(亚硫酸,酸性强于碳酸)
可逆反应:在相同条件下,既能向正反应方向进行、
又能向逆反应方向进行的反应。 思考:将SO2通入NaHCO3溶液中会发生反应吗?少量:SO2+2NaHCO3 == 2CO2+ Na2SO3 + H2O足量:SO2 + NaHCO3 = NaHSO3 +CO2【思考】2H2O 2H2↑ +O2↑ 与 2H2+O2 点燃 2H2O
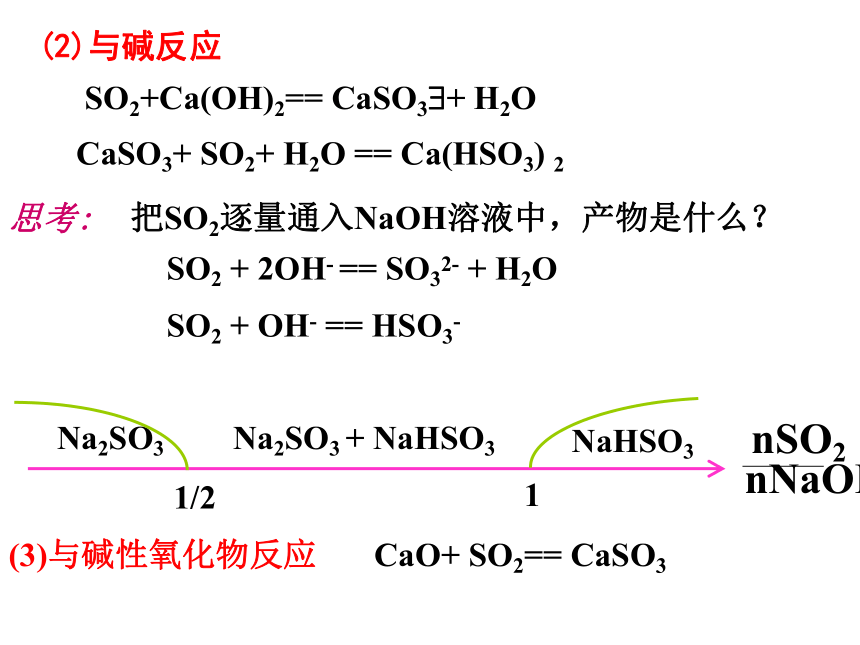
是可逆反应吗?CO2+H2O H2CO3把SO2逐量通入NaOH溶液中,产物是什么? (2)与碱反应 SO2+Ca(OH)2== CaSO3?+ H2OCaSO3+ SO2+ H2O == Ca(HSO3) 2思考:1Na2SO3NaHSO3Na2SO3 + NaHSO3SO2 + 2OH- == SO32- + H2OSO2 + OH- == HSO3-1/2
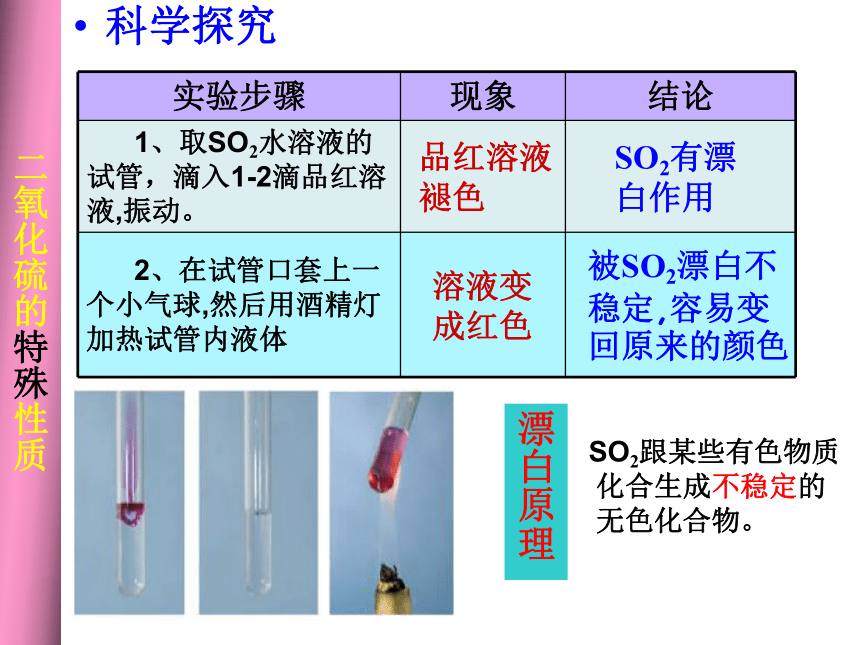
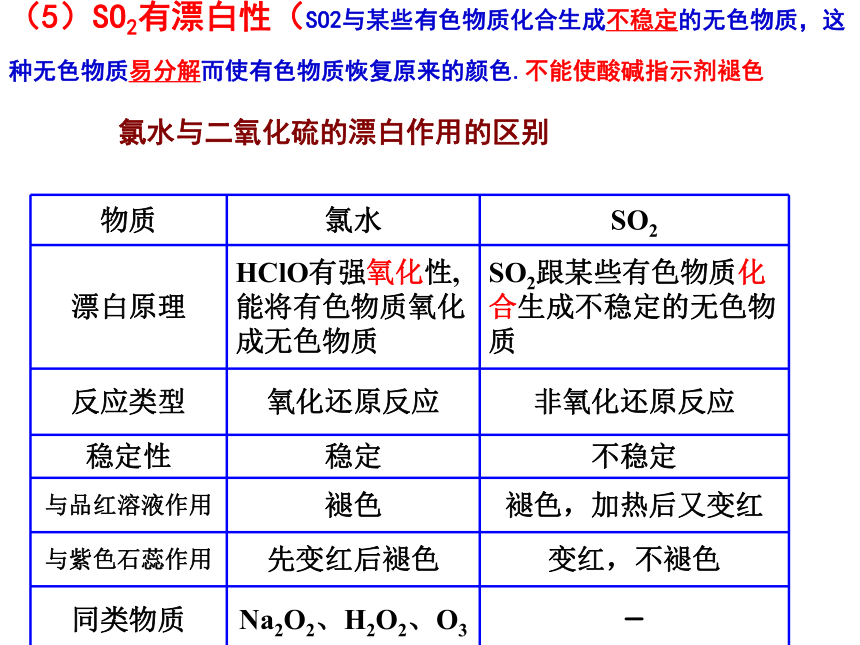
(3)与碱性氧化物反应CaO+ SO2== CaSO3(4)氧化性、还原性a.还原性SO2 + I2 + 2H2O = H2SO4 + 2HISO2 + Br2 + 2H2O = H2SO4 + 2HBr(溴水褪色)SO2 + Cl2 + 2H2O = H2SO4 + 2HCl(工业制硫酸的第二步)5SO2 + 2KMnO4+ 2H2O = K2SO4 + 2MnSO4 + 2H2SO4 (高锰酸钾溶液褪色)b.氧化性(弱)SO2+2H2S=3S?+ 2H2OSO2 + 2 H2S = 3 S + 2 H2O 科学探究品红溶液褪色溶液变成红色SO2有漂白作用被SO2漂白不稳定,容易变回原来的颜色 二氧化硫的特殊性质北京市场黄白两种银耳对比 中央电视台《生活》栏目 氯水与二氧化硫的漂白作用的区别(5)SO2有漂白性(SO2与某些有色物质化合生成不稳定的无色物质,这种无色物质易分解而使有色物质恢复原来的颜色.不能使酸碱指示剂褪色 三、三氧化硫(酸性氧化物)
1.与水反应
SO3+H2O=H2SO4(工业制硫酸的原理)
2.与碱性氧化物或碱反应生成硫酸盐
SO3+CaO=CaSO4
SO3+Ca(OH)2=CaSO4+H2O将SO2依次通过下列实验装置,说出A、B、C、D各装置中的实验现象。 A B C D如何检验某混合气体中含有SO2和CO2? 典例导析
知识点1:二氧化硫的性质
例1 某化学探究性学习小组在学习了二氧化硫的性质后,配制了下表中的溶液,并把足量的SO2分别通入溶液中,现象记录如下。请你帮他们分析,产生该现象体现了H2SO3的何种性质,如何验证或能得出什么结论,请完成下表。 解析 H2SO3能使某些有色溶液褪色,若加热恢复原来的颜色,则体现其漂白作用;若不能恢复原来的颜色,则往往体现其还原性(如与酸性KMnO4、氯水、溴水、碘水等)。从现象看,H2SO3只能使石蕊等酸碱指示剂发生相应的颜色变化,而不能使其褪色。
答案 跟踪练习1 下列叙述中正确的是( )
A.无色有刺激性气味的气体一定是SO2
B.SO2溶于水形成的溶液中,只有H2SO3分子存在
C.SO2在O2中燃烧生成SO3
D.将SO2通入品红溶液,溶液褪色,若将溶液加热煮沸,溶液又变红色
答案 D
知识点2:二氧化硫的漂白性
例2 能证明SO2具有漂白性的是( )
A.酸性KMnO4溶液中通入SO2气体后紫红色消失
B.滴入酚酞的NaOH溶液中通入SO2气体后红色消失
C.品红溶液中通入SO2气体后红色消失
D.溴水中通入SO2气体后橙色消失 解析 SO2气体通入酸性KMnO4溶液后紫红色消失、通入溴水后橙色消失都是利用了SO2的还原性;显红色的NaOH溶液红色消失是因为通入的SO2气体中和了碱;只有SO2气体通入品红溶液后红色消失才能证明SO2具有漂白性。
答案 C
跟踪练习2 Cl2和SO2遇水都具有漂白作用,若将等物质的量的这两种气体混合后通入足量水中,向其中加入品红和BaCl2的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀
④不出现沉淀
A.①② B.①③ C.②③ D.②④ 解析 潮湿的Cl2和SO2都具有漂白作用,但Cl2具有强氧化性,而SO2具有还原性,若同时使用,它们将会发生反应:Cl2+SO2+2H2O=H2SO4+2HCl。所以两者等物质的量混合后会完全失去漂白作用,溶液不会褪色;而生成的H2SO4会和BaCl2反应,生成不溶于水和酸的白色沉淀BaSO4。
答案 C
知识点3:SO2与CO2的鉴别与净化
例3 检验SO2气体中是否混有CO2气体,可采用的方法是( )
A.通过澄清石灰水
B.先通过饱和NaHCO3溶液,再通过澄清石灰水
C.先通过NaOH溶液,再通过澄清石灰水
D.先通过酸性KMnO4溶液,再通过品红溶液,最后通过澄清石灰水 解析 SO2对CO2的检验有干扰作用,因此,在检验CO2之前必须先除去SO2气体,要注意的是还必须检验SO2是否除尽。
答案 D
跟踪练习3 已知亚硫酸的酸性强于碳酸。现有含少量SO2的CO2气体,欲得到干燥纯净的CO2,将气体通过如右图所示的洗气瓶。则①、②两瓶中所装的试剂分别是( )
A.NaOH、浓H2SO4 B.浓H2SO4、NaOH
C.NaHCO3、浓H2SO4 D.浓H2SO4、Na2CO3
答案 C第2课时 二氧化氮和一氧化氮 二氧化硫和
二氧化氮对大气的污染
三维目标
一、二氧化氮和一氧化氮
1.氮气
氮气是一种无色、无味的气体,占空气体积的4/5左右。
在一定条件下,N2和O2反应的化学方程式为
2.一氧化氮
NO是一种无色、无味、难溶于水的有毒气体,常温下NO与空气中的O2化合的化学方程式为
2NO+O2=2NO2。
3.二氧化氮
二氧化氮是一种红棕色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水。溶于水时生成HNO3和NO,工业上利用这一原理制取硝酸:
3NO2+H2O=2HNO3+NO。 二、二氧化硫和二氧化氮对大气的污染
煤、石油和某些金属矿物中含硫或硫的化合物,因此燃烧煤或冶炼金属矿物时,往往会生成二氧化硫。高温条件下,空气中的氮气也参与反应,这是汽车尾气中含有NO的原因。
1.酸雨
大气中的SO2和NO2溶于水后形成酸性溶液,随雨水流下,就有可能成为酸雨。酸雨的pH<5.6。
2.酸雨的形成:排放到空气中的SO2在氧气和水蒸气的共同作用下,形成酸雾,随雨水降落就成为酸雨:,
SO3+H2O=H2SO4。
3.酸雨的危害:直接破坏农作物、森林、草原、使湖泊、土壤酸化,加快建筑物的腐蚀等。
4.酸雨的控制措施:(1)调整能源结构;(2)原煤脱硫技术;(3)改进燃烧技术;(4)对煤燃烧后的烟气脱硫;(5)开发氢能、太阳能、核能等清洁能源;(6)严格控制SO2的排放。雷雨发庄稼! 思考:
在新疆与青海交界处有一山谷,人称“魔鬼谷”。
经常电闪雷鸣,狂风暴雨,把人畜击毙,然而谷内却是牧草茂盛,四季常青。这是为什么?2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO氮的几种重要氧化物思考:二氧化氮是硝酸的酸酐吗?为什么?哪种氧化物是亚硝酸(HNO2)的酸酐?氧化物化合价N2ONON2O3NO2N2O4N2O5+1+2+3+4+4+5----亚硝酐硝酐------------酸酐?注意:酸酐和对应酸中的非金属元素,化合价相同。 三、氮的氧化物溶于水的有关计算问题
氮的氧化物溶于水的几种情况:
(1)NO2或NO2与N2(非O2)的混合气体溶于水
根据3NO2+H2O=2HNO3+NO ①
利用气体体积变化差值进行计算。
(2)NO2和O2的混合气体溶于水
根据4NO2+O2+2H2O=4HNO3 ②
可知:当体积比
V(NO2)∶V(O2) (3)NO和O2的混合气体溶于水
根据4NO+3O2+2H2O=4HNO3 ③
可知:当体积比
V(NO)∶V(O2)
(4)NO、NO2、O2三种种混合气体通入水中
可先按①式求出NO2和H2O反应后生成的NO的体积,再加上原混合气体中NO的体积,即为NO的总体积,再按③式进行计算。 跟踪练习2 将一支装有10 mL NO的大试管倒立于水槽中,然后慢慢通入8 mL O2,下列有关实验最终状态的叙述中正确的是( )
A.试管内气体呈红棕色
B.试管内气体无色,为NO
C.试管内气体无色,体积为1 mL
D.试管内液面上升
解析 根据反应:4NO+3O2+2H2O=4HNO3,10 mL NO须消耗7.5 mL O2方能全部溶于水,故通入的8 mL O2过量,过量的O2为0.5 mL。
答案 D 典例导析
知识点1:NO及NO2的性质
例1 最新研究表明,NO吸收治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究同时证实,NO对SARS病毒有直接的抑制作用。下列关于NO的叙述中正确的是( )
A.NO是一种红棕色气体
B.常温常压下,NO不能与空气中的氧气直接化合
C.含等质量氧元素的NO和CO的物质的量相等
D.NO易溶于水,不能用排水法收集
解析 这是一个“高起点,低落点”的题,NO在治疗SARS上的应用是最新技术成果,本题考查的是NO的性质。NO是一种无色、难溶于水的气体,可以用排水法收集,常温常压下NO可与氧气直接化合生成NO2。
答案 C 跟踪练习1 下列气体无色但有毒的是( )
A.Cl2 B.NO C.NO2 D.CO2
答案 B
知识点2:NO及NO2的有关计算
例2 将12 mL NO2和O2的混合气体通入足量的水中,充分反应后,剩余2 mL气体,计算原混合气体中NO2和O2的体积各为多少毫升?
解析 混合气体溶于水发生如下反应:
4NO2+O2+2H2O=4HNO3。
反应后剩余2 mL气体,气体可能为O2或NO,则: (1)若O2过量,即剩余2 mL O2,故有10 mL NO2和O2的混合气体按上述反应恰好进行了反应,所以V(NO2)=10 mL× =8 mL,V(O2)=12 mL-8 mL=4 mL。
(2)若剩余2 mL NO,即NO2过量。根据反应:3NO2+H2O=2HNO3+NO,过量的NO2应为2 mL×3=6 mL,则有12 mL-6 mL=6 mL的混合气体按总反应恰好进行了反应。所以V(O2)=6 mL× =1.2 mL,V(NO2)=12 mL-1.2 mL=10.8 mL。
答案 NO2为8 mL、O2为4 mL,或O2为1.2 mL、NO2为10.8 mL。 知识点3:环境保护常识
例3 氮氧化物和氟氯烷烃是破坏臭氧层的元凶,其反应原理部分如下:
①O3+NO=NO2+O2、NO2+O=NO+O2;
②CF2Cl2→CF2Cl+Cl、O3+Cl=ClO+O2、ClO+O=Cl+O2。
下列说法中正确的是( )
A.氮氧化物在破坏臭氧层时起氧化剂的作用
B.氟氯烷烃在破坏臭氧层时起反应物的作用
C.氟氯烷烃在破坏臭氧层时起催化剂的作用
D.氟氯烷烃分解产生的Cl原子是破坏臭氧层反应的催化剂 解析 分析氮氧化物破坏臭氧层的各步反应,得出总反应为O3+O2O2,可以看出氮氧化物起催化剂的作用;同样分析氟氯烷烃破坏臭氧层的各步反应,得出总反应为O3+O2O2,即Cl原子是破坏臭氧层时反应的催化剂。
答案 D
跟踪练习3 酸雨给人类带来了种种灾祸,严重地威胁着地球上生命生存的生态环境。下列有关减少或者防止酸雨形成的措施中可行的是( )
①对燃煤进行脱硫 ②对含SO2、NO2的工业废气进行无害处理后,再排放到大气中 ③人工收集雷电作用所产生的氮的氧化物 ④飞机、汽车等交通工具采用清洁燃料,如天然气、甲醇等
A.①②③④ B.①②③ C.①②④ D.①③④
答案 C
第1课时 二氧化硫和三氧化硫
三维目标游离态化合态一、硫(俗称硫黄)1.在自然界中的存在
(1)游离态的硫存在于火山喷口附近或地壳岩层里。
(2)化合态的硫主要以硫化物和硫酸盐的形式存在。(1)氧化性:3.化学性质:(2)还原性:Fe + S FeS2.物理性质:黄色晶体,俗称硫黄,质脆,易研成粉末。不溶于水,微溶于酒精,易溶于CS2。2Cu+S=Cu2S
二氧化硫的性质【P84实验4-7:观察并思考】
1、 实验中原盛有SO2 气体的试管水位有什么变化?说明了什么?
------试管内水位上升;说明SO2易溶水
2、用PH试纸检验试管内水溶液酸碱性。
-------试纸变红色,溶液呈酸性二、二氧化硫
1.物理性质:无色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水。
2.化学性质
(1)与水的反应
SO2+H2O H2SO3(亚硫酸,酸性强于碳酸)
可逆反应:在相同条件下,既能向正反应方向进行、
又能向逆反应方向进行的反应。 思考:将SO2通入NaHCO3溶液中会发生反应吗?少量:SO2+2NaHCO3 == 2CO2+ Na2SO3 + H2O足量:SO2 + NaHCO3 = NaHSO3 +CO2【思考】2H2O 2H2↑ +O2↑ 与 2H2+O2 点燃 2H2O
是可逆反应吗?CO2+H2O H2CO3把SO2逐量通入NaOH溶液中,产物是什么? (2)与碱反应 SO2+Ca(OH)2== CaSO3?+ H2OCaSO3+ SO2+ H2O == Ca(HSO3) 2思考:1Na2SO3NaHSO3Na2SO3 + NaHSO3SO2 + 2OH- == SO32- + H2OSO2 + OH- == HSO3-1/2
(3)与碱性氧化物反应CaO+ SO2== CaSO3(4)氧化性、还原性a.还原性SO2 + I2 + 2H2O = H2SO4 + 2HISO2 + Br2 + 2H2O = H2SO4 + 2HBr(溴水褪色)SO2 + Cl2 + 2H2O = H2SO4 + 2HCl(工业制硫酸的第二步)5SO2 + 2KMnO4+ 2H2O = K2SO4 + 2MnSO4 + 2H2SO4 (高锰酸钾溶液褪色)b.氧化性(弱)SO2+2H2S=3S?+ 2H2OSO2 + 2 H2S = 3 S + 2 H2O 科学探究品红溶液褪色溶液变成红色SO2有漂白作用被SO2漂白不稳定,容易变回原来的颜色 二氧化硫的特殊性质北京市场黄白两种银耳对比 中央电视台《生活》栏目 氯水与二氧化硫的漂白作用的区别(5)SO2有漂白性(SO2与某些有色物质化合生成不稳定的无色物质,这种无色物质易分解而使有色物质恢复原来的颜色.不能使酸碱指示剂褪色 三、三氧化硫(酸性氧化物)
1.与水反应
SO3+H2O=H2SO4(工业制硫酸的原理)
2.与碱性氧化物或碱反应生成硫酸盐
SO3+CaO=CaSO4
SO3+Ca(OH)2=CaSO4+H2O将SO2依次通过下列实验装置,说出A、B、C、D各装置中的实验现象。 A B C D如何检验某混合气体中含有SO2和CO2? 典例导析
知识点1:二氧化硫的性质
例1 某化学探究性学习小组在学习了二氧化硫的性质后,配制了下表中的溶液,并把足量的SO2分别通入溶液中,现象记录如下。请你帮他们分析,产生该现象体现了H2SO3的何种性质,如何验证或能得出什么结论,请完成下表。 解析 H2SO3能使某些有色溶液褪色,若加热恢复原来的颜色,则体现其漂白作用;若不能恢复原来的颜色,则往往体现其还原性(如与酸性KMnO4、氯水、溴水、碘水等)。从现象看,H2SO3只能使石蕊等酸碱指示剂发生相应的颜色变化,而不能使其褪色。
答案 跟踪练习1 下列叙述中正确的是( )
A.无色有刺激性气味的气体一定是SO2
B.SO2溶于水形成的溶液中,只有H2SO3分子存在
C.SO2在O2中燃烧生成SO3
D.将SO2通入品红溶液,溶液褪色,若将溶液加热煮沸,溶液又变红色
答案 D
知识点2:二氧化硫的漂白性
例2 能证明SO2具有漂白性的是( )
A.酸性KMnO4溶液中通入SO2气体后紫红色消失
B.滴入酚酞的NaOH溶液中通入SO2气体后红色消失
C.品红溶液中通入SO2气体后红色消失
D.溴水中通入SO2气体后橙色消失 解析 SO2气体通入酸性KMnO4溶液后紫红色消失、通入溴水后橙色消失都是利用了SO2的还原性;显红色的NaOH溶液红色消失是因为通入的SO2气体中和了碱;只有SO2气体通入品红溶液后红色消失才能证明SO2具有漂白性。
答案 C
跟踪练习2 Cl2和SO2遇水都具有漂白作用,若将等物质的量的这两种气体混合后通入足量水中,向其中加入品红和BaCl2的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀
④不出现沉淀
A.①② B.①③ C.②③ D.②④ 解析 潮湿的Cl2和SO2都具有漂白作用,但Cl2具有强氧化性,而SO2具有还原性,若同时使用,它们将会发生反应:Cl2+SO2+2H2O=H2SO4+2HCl。所以两者等物质的量混合后会完全失去漂白作用,溶液不会褪色;而生成的H2SO4会和BaCl2反应,生成不溶于水和酸的白色沉淀BaSO4。
答案 C
知识点3:SO2与CO2的鉴别与净化
例3 检验SO2气体中是否混有CO2气体,可采用的方法是( )
A.通过澄清石灰水
B.先通过饱和NaHCO3溶液,再通过澄清石灰水
C.先通过NaOH溶液,再通过澄清石灰水
D.先通过酸性KMnO4溶液,再通过品红溶液,最后通过澄清石灰水 解析 SO2对CO2的检验有干扰作用,因此,在检验CO2之前必须先除去SO2气体,要注意的是还必须检验SO2是否除尽。
答案 D
跟踪练习3 已知亚硫酸的酸性强于碳酸。现有含少量SO2的CO2气体,欲得到干燥纯净的CO2,将气体通过如右图所示的洗气瓶。则①、②两瓶中所装的试剂分别是( )
A.NaOH、浓H2SO4 B.浓H2SO4、NaOH
C.NaHCO3、浓H2SO4 D.浓H2SO4、Na2CO3
答案 C第2课时 二氧化氮和一氧化氮 二氧化硫和
二氧化氮对大气的污染
三维目标
一、二氧化氮和一氧化氮
1.氮气
氮气是一种无色、无味的气体,占空气体积的4/5左右。
在一定条件下,N2和O2反应的化学方程式为
2.一氧化氮
NO是一种无色、无味、难溶于水的有毒气体,常温下NO与空气中的O2化合的化学方程式为
2NO+O2=2NO2。
3.二氧化氮
二氧化氮是一种红棕色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水。溶于水时生成HNO3和NO,工业上利用这一原理制取硝酸:
3NO2+H2O=2HNO3+NO。 二、二氧化硫和二氧化氮对大气的污染
煤、石油和某些金属矿物中含硫或硫的化合物,因此燃烧煤或冶炼金属矿物时,往往会生成二氧化硫。高温条件下,空气中的氮气也参与反应,这是汽车尾气中含有NO的原因。
1.酸雨
大气中的SO2和NO2溶于水后形成酸性溶液,随雨水流下,就有可能成为酸雨。酸雨的pH<5.6。
2.酸雨的形成:排放到空气中的SO2在氧气和水蒸气的共同作用下,形成酸雾,随雨水降落就成为酸雨:,
SO3+H2O=H2SO4。
3.酸雨的危害:直接破坏农作物、森林、草原、使湖泊、土壤酸化,加快建筑物的腐蚀等。
4.酸雨的控制措施:(1)调整能源结构;(2)原煤脱硫技术;(3)改进燃烧技术;(4)对煤燃烧后的烟气脱硫;(5)开发氢能、太阳能、核能等清洁能源;(6)严格控制SO2的排放。雷雨发庄稼! 思考:
在新疆与青海交界处有一山谷,人称“魔鬼谷”。
经常电闪雷鸣,狂风暴雨,把人畜击毙,然而谷内却是牧草茂盛,四季常青。这是为什么?2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO氮的几种重要氧化物思考:二氧化氮是硝酸的酸酐吗?为什么?哪种氧化物是亚硝酸(HNO2)的酸酐?氧化物化合价N2ONON2O3NO2N2O4N2O5+1+2+3+4+4+5----亚硝酐硝酐------------酸酐?注意:酸酐和对应酸中的非金属元素,化合价相同。 三、氮的氧化物溶于水的有关计算问题
氮的氧化物溶于水的几种情况:
(1)NO2或NO2与N2(非O2)的混合气体溶于水
根据3NO2+H2O=2HNO3+NO ①
利用气体体积变化差值进行计算。
(2)NO2和O2的混合气体溶于水
根据4NO2+O2+2H2O=4HNO3 ②
可知:当体积比
V(NO2)∶V(O2) (3)NO和O2的混合气体溶于水
根据4NO+3O2+2H2O=4HNO3 ③
可知:当体积比
V(NO)∶V(O2)
(4)NO、NO2、O2三种种混合气体通入水中
可先按①式求出NO2和H2O反应后生成的NO的体积,再加上原混合气体中NO的体积,即为NO的总体积,再按③式进行计算。 跟踪练习2 将一支装有10 mL NO的大试管倒立于水槽中,然后慢慢通入8 mL O2,下列有关实验最终状态的叙述中正确的是( )
A.试管内气体呈红棕色
B.试管内气体无色,为NO
C.试管内气体无色,体积为1 mL
D.试管内液面上升
解析 根据反应:4NO+3O2+2H2O=4HNO3,10 mL NO须消耗7.5 mL O2方能全部溶于水,故通入的8 mL O2过量,过量的O2为0.5 mL。
答案 D 典例导析
知识点1:NO及NO2的性质
例1 最新研究表明,NO吸收治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究同时证实,NO对SARS病毒有直接的抑制作用。下列关于NO的叙述中正确的是( )
A.NO是一种红棕色气体
B.常温常压下,NO不能与空气中的氧气直接化合
C.含等质量氧元素的NO和CO的物质的量相等
D.NO易溶于水,不能用排水法收集
解析 这是一个“高起点,低落点”的题,NO在治疗SARS上的应用是最新技术成果,本题考查的是NO的性质。NO是一种无色、难溶于水的气体,可以用排水法收集,常温常压下NO可与氧气直接化合生成NO2。
答案 C 跟踪练习1 下列气体无色但有毒的是( )
A.Cl2 B.NO C.NO2 D.CO2
答案 B
知识点2:NO及NO2的有关计算
例2 将12 mL NO2和O2的混合气体通入足量的水中,充分反应后,剩余2 mL气体,计算原混合气体中NO2和O2的体积各为多少毫升?
解析 混合气体溶于水发生如下反应:
4NO2+O2+2H2O=4HNO3。
反应后剩余2 mL气体,气体可能为O2或NO,则: (1)若O2过量,即剩余2 mL O2,故有10 mL NO2和O2的混合气体按上述反应恰好进行了反应,所以V(NO2)=10 mL× =8 mL,V(O2)=12 mL-8 mL=4 mL。
(2)若剩余2 mL NO,即NO2过量。根据反应:3NO2+H2O=2HNO3+NO,过量的NO2应为2 mL×3=6 mL,则有12 mL-6 mL=6 mL的混合气体按总反应恰好进行了反应。所以V(O2)=6 mL× =1.2 mL,V(NO2)=12 mL-1.2 mL=10.8 mL。
答案 NO2为8 mL、O2为4 mL,或O2为1.2 mL、NO2为10.8 mL。 知识点3:环境保护常识
例3 氮氧化物和氟氯烷烃是破坏臭氧层的元凶,其反应原理部分如下:
①O3+NO=NO2+O2、NO2+O=NO+O2;
②CF2Cl2→CF2Cl+Cl、O3+Cl=ClO+O2、ClO+O=Cl+O2。
下列说法中正确的是( )
A.氮氧化物在破坏臭氧层时起氧化剂的作用
B.氟氯烷烃在破坏臭氧层时起反应物的作用
C.氟氯烷烃在破坏臭氧层时起催化剂的作用
D.氟氯烷烃分解产生的Cl原子是破坏臭氧层反应的催化剂 解析 分析氮氧化物破坏臭氧层的各步反应,得出总反应为O3+O2O2,可以看出氮氧化物起催化剂的作用;同样分析氟氯烷烃破坏臭氧层的各步反应,得出总反应为O3+O2O2,即Cl原子是破坏臭氧层时反应的催化剂。
答案 D
跟踪练习3 酸雨给人类带来了种种灾祸,严重地威胁着地球上生命生存的生态环境。下列有关减少或者防止酸雨形成的措施中可行的是( )
①对燃煤进行脱硫 ②对含SO2、NO2的工业废气进行无害处理后,再排放到大气中 ③人工收集雷电作用所产生的氮的氧化物 ④飞机、汽车等交通工具采用清洁燃料,如天然气、甲醇等
A.①②③④ B.①②③ C.①②④ D.①③④
答案 C
