湖南省常德市鼎城区2021-2022学年高三下学期期中考试化学试题(Word版含答案)
文档属性
| 名称 | 湖南省常德市鼎城区2021-2022学年高三下学期期中考试化学试题(Word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 511.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-13 00:00:00 | ||
图片预览



文档简介
常德市鼎城区2021-2022学年高三下学期期中考试
化学试题
时间:75分钟 满分:100分
注意事项:
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Ti 48 Cr 52 Fe 56 一、选择题:本题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。
1.中国传统文化博大精深,明代方以智的《物理小识》中有关炼铁的记载:“煤则各处产之,臭者烧熔而闭之成石,再凿而入炉曰礁,可五日不灭火,煎矿煮石,殊为省力。”下列说法中正确的是( )
A.《物理小识》中记载的是以焦炭作为还原剂的方法来炼铁
B.文中说明煤炭作为燃料被普遍使用,煤的主要成分为烃
C.生铁是指含硫、磷、碳量低的铁合金
D.工业上可通过煤的干馏获得乙烯、丙烯等化工原料
2.表示阿伏加德罗常数的值,下列说法正确的是( )
A.7.8 g固体中离子总数为0.4
B.1 mol OH(羟基)所含电子数为10
C.1 mol Fe与足量浓盐酸反应转移电子数为3
D.常温下,1 L.0.1 mol/L溶液中数目小于0.1
3.下列实验中,所选装置或实验设计合理的是( )
A.用图①所示装置可以除去溶液中的杂质
B.用乙醇提取溴水中的溴选择图②所示装置
C.用图③所示装置可以分离乙醇水溶液
D.用图④所示装置可除去中含有的少量HCl
4.可发生水解。下列表示相关微粒的化学用语正确的是( )
A.中子数为8的氧原子: B.的结构式:
C.的结构示意图: D.的电子式:
5.短周期主族元素X、Y、Z、W的原子序数依次增大,X、W同主族:Y、Z同周期;X、Y、Z三种元素形成一种化合物M,常温下,的水溶液。下列说法正确的是( )
A.简单离子半径:YB.Z分别与X、W均可形成具有漂白性的化合物
C.X、Y、Z的非金属性强弱:Y>Z>W
D.X分别与Z、W形成的化合物中,所含化学键类型相同
6.磷酸氯喹可在细胞水平上有效抑制2019-病毒。氯喹是由喹啉通过一系列反应制得的,氯喹和喹啉的结构简式如图。下列关于氯喹和喹啉的说法正确的是( )
A.氯喹的分子式为
B.氯喹分子中三个氮原子不可能处在同一个平面
C.氯喹可以发生加成反应和中和反应
D.喹啉的一氯代物有5种
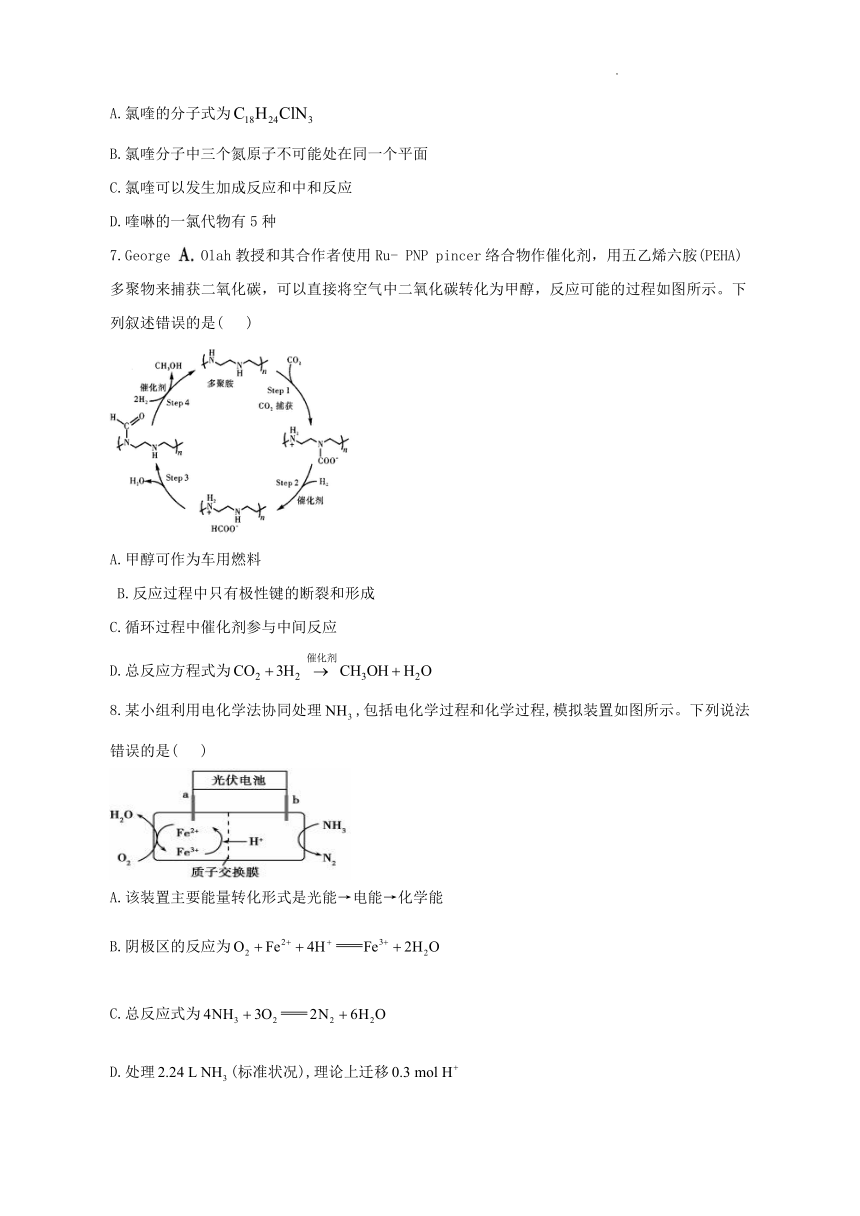
7.George Olah教授和其合作者使用Ru- PNP pincer络合物作催化剂,用五乙烯六胺(PEHA)多聚物来捕获二氧化碳,可以直接将空气中二氧化碳转化为甲醇,反应可能的过程如图所示。下列叙述错误的是( )
A.甲醇可作为车用燃料
B.反应过程中只有极性键的断裂和形成
C.循环过程中催化剂参与中间反应
D.总反应方程式为
8.某小组利用电化学法协同处理,包括电化学过程和化学过程,模拟装置如图所示。下列说法错误的是( )
A.该装置主要能量转化形式是光能→电能→化学能
B.阴极区的反应为
C.总反应式为
D.处理(标准状况),理论上迁移
9.钡盐生产过程中排出大量的钡泥[主要含有等],由该钡泥制取硝酸钡的工艺流程如下:
已知废渣中含有。下列说法错误的是( )
A.“酸溶”时的不溶物成分主要为硅酸和硫酸钡
B.“中和Ⅰ”加入的X可选用
C.为了加快反应速率,“酸溶”时,可采取搅拌、高温等措施
D.废渣经过加工可用来生产油漆或涂料
10.工业生产上用过量烧碱溶液处理某矿物(含),过滤后得到滤液用溶液处理,测得溶液pH和生成的量随加入溶液体积变化的曲线如图,下列有关说法不正确的是( )
A.原液中
B.生成沉淀的离子方程式为
C.a点溶液中存在:
D.a点水的电离程度小于b点水的电离程度
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
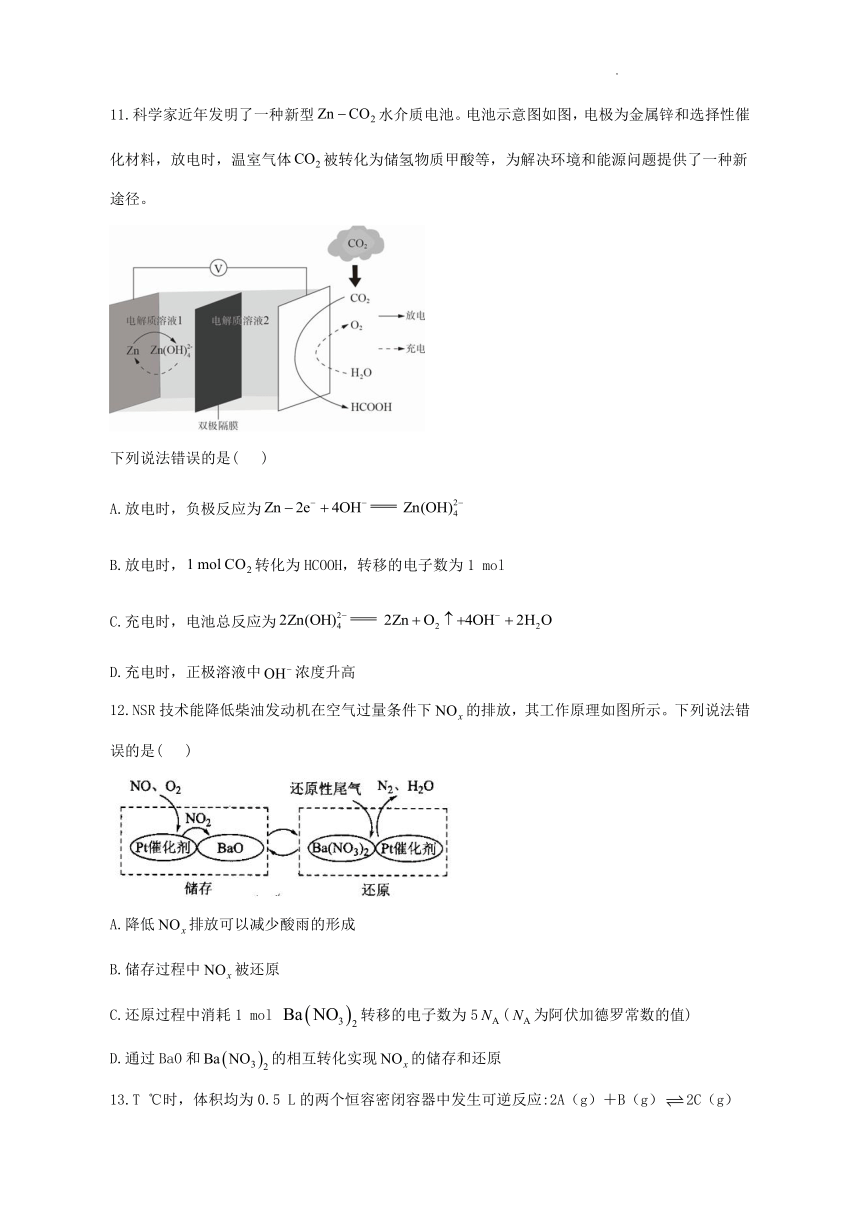
11.科学家近年发明了一种新型水介质电池。电池示意图如图,电极为金属锌和选择性催化材料,放电时,温室气体被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( )
A.放电时,负极反应为
B.放电时,转化为HCOOH,转移的电子数为1 mol
C.充电时,电池总反应为
D.充电时,正极溶液中浓度升高
12.NSR技术能降低柴油发动机在空气过量条件下的排放,其工作原理如图所示。下列说法错误的是( )
A.降低排放可以减少酸雨的形成
B.储存过程中被还原
C.还原过程中消耗1 mol 转移的电子数为5(为阿伏加德罗常数的值)
D.通过BaO和的相互转化实现的储存和还原
13.T ℃时,体积均为0.5 L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g)2C(g)(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如表,下列叙述中正确的是( )
容器编号 起始时各物质的物质的量/mol 达到平衡时体系能量的变化
A B C
① 2 1 0 0.75 Q kJ
② 0.4 0.2 1.6
A.容器②中达到平衡时放出的热量为0.05 Q kJ
B.向容器①中通入氦气,平衡时A的转化率变大
C.其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于
D.容器①②中反应的平衡常数值均为18
14.实验室由胆矾精制五水硫酸铜晶体的流程如下:
已知的溶解度如下表:
温度/℃ 0 20 40 60 80 100
溶解度/g 23.1 32.0 44.6 61.8 83.8 114.0
下列说法错误的是( )
A.溶解应在较低温度下进行
B.蒸发浓缩时选用蒸发皿
C.减压过滤的目的是增加过滤速度,把产物抽干
D.酸化步骤加入溶液的作用是防止水解
15.25℃时,向20 mL 0.1的氨水中滴加浓度为0.1的HCl溶液溶液中和溶液pH的变化曲线如图所示。已知点加入HCl溶液的体积为10 mL,点加入HCl溶液的体积为20 mL。相关说法正确的是( )
A.25℃时氨水的电离常数的数量级为
B.滴定过程中可选用酚酞做指示剂
C.四点中,点时水的电离程度最大
D.点时,
三、非选择题:本题共4小题,共50分。
16.(12分)碱式硫酸铁是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
己知:部分阳离子以氢氧化物形式沉淀时溶液的pH
如表。
沉淀物
开始沉淀 2.3 7.5 3.4
完全沉淀 3.2 9.7 4.4
完成下列填空:
(1)反应Ⅰ后的溶液中存在的阳离子有___________。
(2)加入少量的目的是将溶液的pH调节在_________范围内,从而使溶液中的该工艺中“搅拌”的作用是_________。
(3)反应Ⅱ加入的目的是氧化,反应的离子方程式为_________。在实际生产中,反应Ⅱ常同时通入以减少的用量,若参与反应的有11.2L(标准状况),则相当于节约了_______。
(4)碱式硫酸铁溶于水后产生的可部分水解生成聚合离子,该水解反应的离子方程式为________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有及。为检验所得产品中是否含有,应使用的试剂为_______(选填序号)。
a.氯水 b.KSCN溶液 c.NaOH溶液 d.酸性溶液
17.(12分)硒酸铜晶体的分子式是,淡蓝色晶体。有毒,能溶于水,微溶于丙酮,不溶于醇。80℃开始失水,150220℃失去一个结晶水,265℃成为无水化合物。用于铜和铜合金着色,凯氏定氮催化剂,以及电子、仪表工业等。回答下列问题:
(1)铜元素位于元素周期表的_____________________;基态Se原子的价电子排布式为________________,基态Cu原子与基态Se原子核外未成对电子数之比为_____________________。
(2)硒酸铜由硝酸铜和硒酸作用制取,硒酸酸性与硫酸比较,酸性较强的是________________(填化学式),S、 Se、O电负性由大到小的顺序是_____________________。
(3)硒酸铜中阴离子的空间结构为_______________________。在Cu的d轨道中电子排布成,而不是,原因是___________________________。
(4)熔点为1235℃,红色或暗红色八面立方晶系结晶,几乎不溶于水。的晶体类型是_______________________,熔点的原因是__________________________。
(5)铜的某种氧化物的晶胞如图所示,则该氧化物的化学式为______________,若组成粒子氧、铜的半径分别为,密度为,设阿伏加德罗常数值为,则该晶胞的空间利用率为____________________________(用含的式子表示)。
18.(14分)在工业上经常用水蒸气蒸馏的方法从橙子等水果果皮中收集橙油(主要成分是柠檬烯)。
实验步骤如下:
(1)提取柠檬烯
①将2~3个新鲜橙子皮剪成极小碎片后,投入100 mL烧瓶D中,加入约30 mL水,按照下图安装水蒸气蒸馏装置。
②松开弹簧夹G。加热水蒸气发生器A至水沸腾,当T形管的支管口有大量水蒸气冲出时夹紧弹簧夹G,开启冷却水,水蒸气蒸馏即开始进行。一段时间后可观察到在锥形瓶的馏出液的水面上有一层很薄的油层。
(2)提纯柠檬烯
①将馏出液用10 mL二氯甲烷萃取,萃取3次后合并萃取液,置于装有适量无水硫酸钠的50 mL锥形瓶中。
②将锥形瓶中的溶液倒入50 mL蒸馏瓶中蒸馏。当二氯甲烷基本蒸完后改用水泵减压蒸馏以除去残留的二氯甲烷。最后瓶中只留下少量橙黄色液体,即橙油。
回答下列问题:
(1)直玻璃管C的作用是_____________________。冷凝水从直形冷凝管的___________(填“a”或“b”)口进入。
(2)水蒸气蒸馏时,判断蒸馏结束的方法是________________________;为了防止倒吸,实验停止时应进行的操作是____________________________。
(3)将馏出液用二氯甲烷萃取时用到的主要实验仪器是_____________________________。
(4)无水硫酸钠的作用是______________________________。
(5)二氯甲烷的沸点为39.8℃,提纯柠檬烯时采用________________________加热蒸馏的方法。
19.(12分)H是一种新型香料的主要成分之一,其合成路线如下(部分产物和部分反应条件略去):
已知:①;
②B的核磁共振氢谱显示分子中有6种不同化学环境的氢原子。
请回答下列问题:
(1)的同分异构体中存在顺反异构的有机化合物的名称为_______________。
(2)A的核磁共振氢谱中除苯环上的H外,还显示____________组峰,峰面积比为_______________。
(3)D分子中含氧官能团名称是_____________________,E的结构简式为_______________。
(4) 发生加聚反应的化学方程式为_________________;D和G反应生成H的化学方程式为_____________________。
(5)G的同分异构体中,同时满足下列条件的有__________________种(不考虑立体异构)。
①苯的二取代物
②与溶液发生显色反应
③含“”结构
(6)参照上述合成路线,以丙烯为原料(无机试剂任选),设计制备2,3-丁二醇的合成路线。
常德市鼎城区2021-2022学年高三下学期期中考试
化学试题参考答案
一、选择题:本题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。
1.A 2.D 3.A 4.D 5.B 6.C 7.B 8.B 9.C 10.A
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.BD 12.BC 13.D 14.A 15.D
三、非选择题:本题共4小题,共50分。
16.(12分)(1)(1分)
(2)4.4≤pH<7.5(或4.4~7.5)(2分)沉淀完全而不沉淀;使反应物充分接触,从而加快反应速率(1分)
(3)(2分)139(2分)
(4)(2分)
(5)d(2分)
17.(12分)(1)第四周期ⅠB族(1分)(1分)1:2(1分)
(2)(1分)O>S>Se(1分)
(3)正四面体形(1分)能量相同的原子轨道在全充满、半充满或全空时,体系能量最低、原子较稳定(1分)
(4)离子晶体(1分)离子半径,晶格能比CuS的大(1分)
(5)(1分) (2分)
18.(12分)(1)平衡圆底烧瓶A中压强(1分)a(2分)
(2)馏出液澄清透明(或取少量馏出液滴入水中,无油珠存在)(3分)松开弹簧夹G,然后停止加热(或先把D中的导气管从溶液中移出,再停止加热)(2分)
(3)分液漏斗(2分)
(4)干燥除水(2分) (5)水浴(2分)
19.(12分)(1)2-丁烯(1分) (2)2(1分)1:6(或6:1)(1分)
(3)羟基、羧基(1分)(1分)
(4) (1分)(2分)
(5)12(2分)
(6) (2分)
化学试题
时间:75分钟 满分:100分
注意事项:
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Ti 48 Cr 52 Fe 56 一、选择题:本题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。
1.中国传统文化博大精深,明代方以智的《物理小识》中有关炼铁的记载:“煤则各处产之,臭者烧熔而闭之成石,再凿而入炉曰礁,可五日不灭火,煎矿煮石,殊为省力。”下列说法中正确的是( )
A.《物理小识》中记载的是以焦炭作为还原剂的方法来炼铁
B.文中说明煤炭作为燃料被普遍使用,煤的主要成分为烃
C.生铁是指含硫、磷、碳量低的铁合金
D.工业上可通过煤的干馏获得乙烯、丙烯等化工原料
2.表示阿伏加德罗常数的值,下列说法正确的是( )
A.7.8 g固体中离子总数为0.4
B.1 mol OH(羟基)所含电子数为10
C.1 mol Fe与足量浓盐酸反应转移电子数为3
D.常温下,1 L.0.1 mol/L溶液中数目小于0.1
3.下列实验中,所选装置或实验设计合理的是( )
A.用图①所示装置可以除去溶液中的杂质
B.用乙醇提取溴水中的溴选择图②所示装置
C.用图③所示装置可以分离乙醇水溶液
D.用图④所示装置可除去中含有的少量HCl
4.可发生水解。下列表示相关微粒的化学用语正确的是( )
A.中子数为8的氧原子: B.的结构式:
C.的结构示意图: D.的电子式:
5.短周期主族元素X、Y、Z、W的原子序数依次增大,X、W同主族:Y、Z同周期;X、Y、Z三种元素形成一种化合物M,常温下,的水溶液。下列说法正确的是( )
A.简单离子半径:Y
C.X、Y、Z的非金属性强弱:Y>Z>W
D.X分别与Z、W形成的化合物中,所含化学键类型相同
6.磷酸氯喹可在细胞水平上有效抑制2019-病毒。氯喹是由喹啉通过一系列反应制得的,氯喹和喹啉的结构简式如图。下列关于氯喹和喹啉的说法正确的是( )
A.氯喹的分子式为
B.氯喹分子中三个氮原子不可能处在同一个平面
C.氯喹可以发生加成反应和中和反应
D.喹啉的一氯代物有5种
7.George Olah教授和其合作者使用Ru- PNP pincer络合物作催化剂,用五乙烯六胺(PEHA)多聚物来捕获二氧化碳,可以直接将空气中二氧化碳转化为甲醇,反应可能的过程如图所示。下列叙述错误的是( )
A.甲醇可作为车用燃料
B.反应过程中只有极性键的断裂和形成
C.循环过程中催化剂参与中间反应
D.总反应方程式为
8.某小组利用电化学法协同处理,包括电化学过程和化学过程,模拟装置如图所示。下列说法错误的是( )
A.该装置主要能量转化形式是光能→电能→化学能
B.阴极区的反应为
C.总反应式为
D.处理(标准状况),理论上迁移
9.钡盐生产过程中排出大量的钡泥[主要含有等],由该钡泥制取硝酸钡的工艺流程如下:
已知废渣中含有。下列说法错误的是( )
A.“酸溶”时的不溶物成分主要为硅酸和硫酸钡
B.“中和Ⅰ”加入的X可选用
C.为了加快反应速率,“酸溶”时,可采取搅拌、高温等措施
D.废渣经过加工可用来生产油漆或涂料
10.工业生产上用过量烧碱溶液处理某矿物(含),过滤后得到滤液用溶液处理,测得溶液pH和生成的量随加入溶液体积变化的曲线如图,下列有关说法不正确的是( )
A.原液中
B.生成沉淀的离子方程式为
C.a点溶液中存在:
D.a点水的电离程度小于b点水的电离程度
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.科学家近年发明了一种新型水介质电池。电池示意图如图,电极为金属锌和选择性催化材料,放电时,温室气体被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( )
A.放电时,负极反应为
B.放电时,转化为HCOOH,转移的电子数为1 mol
C.充电时,电池总反应为
D.充电时,正极溶液中浓度升高
12.NSR技术能降低柴油发动机在空气过量条件下的排放,其工作原理如图所示。下列说法错误的是( )
A.降低排放可以减少酸雨的形成
B.储存过程中被还原
C.还原过程中消耗1 mol 转移的电子数为5(为阿伏加德罗常数的值)
D.通过BaO和的相互转化实现的储存和还原
13.T ℃时,体积均为0.5 L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g)2C(g)(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如表,下列叙述中正确的是( )
容器编号 起始时各物质的物质的量/mol 达到平衡时体系能量的变化
A B C
① 2 1 0 0.75 Q kJ
② 0.4 0.2 1.6
A.容器②中达到平衡时放出的热量为0.05 Q kJ
B.向容器①中通入氦气,平衡时A的转化率变大
C.其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于
D.容器①②中反应的平衡常数值均为18
14.实验室由胆矾精制五水硫酸铜晶体的流程如下:
已知的溶解度如下表:
温度/℃ 0 20 40 60 80 100
溶解度/g 23.1 32.0 44.6 61.8 83.8 114.0
下列说法错误的是( )
A.溶解应在较低温度下进行
B.蒸发浓缩时选用蒸发皿
C.减压过滤的目的是增加过滤速度,把产物抽干
D.酸化步骤加入溶液的作用是防止水解
15.25℃时,向20 mL 0.1的氨水中滴加浓度为0.1的HCl溶液溶液中和溶液pH的变化曲线如图所示。已知点加入HCl溶液的体积为10 mL,点加入HCl溶液的体积为20 mL。相关说法正确的是( )
A.25℃时氨水的电离常数的数量级为
B.滴定过程中可选用酚酞做指示剂
C.四点中,点时水的电离程度最大
D.点时,
三、非选择题:本题共4小题,共50分。
16.(12分)碱式硫酸铁是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
己知:部分阳离子以氢氧化物形式沉淀时溶液的pH
如表。
沉淀物
开始沉淀 2.3 7.5 3.4
完全沉淀 3.2 9.7 4.4
完成下列填空:
(1)反应Ⅰ后的溶液中存在的阳离子有___________。
(2)加入少量的目的是将溶液的pH调节在_________范围内,从而使溶液中的该工艺中“搅拌”的作用是_________。
(3)反应Ⅱ加入的目的是氧化,反应的离子方程式为_________。在实际生产中,反应Ⅱ常同时通入以减少的用量,若参与反应的有11.2L(标准状况),则相当于节约了_______。
(4)碱式硫酸铁溶于水后产生的可部分水解生成聚合离子,该水解反应的离子方程式为________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有及。为检验所得产品中是否含有,应使用的试剂为_______(选填序号)。
a.氯水 b.KSCN溶液 c.NaOH溶液 d.酸性溶液
17.(12分)硒酸铜晶体的分子式是,淡蓝色晶体。有毒,能溶于水,微溶于丙酮,不溶于醇。80℃开始失水,150220℃失去一个结晶水,265℃成为无水化合物。用于铜和铜合金着色,凯氏定氮催化剂,以及电子、仪表工业等。回答下列问题:
(1)铜元素位于元素周期表的_____________________;基态Se原子的价电子排布式为________________,基态Cu原子与基态Se原子核外未成对电子数之比为_____________________。
(2)硒酸铜由硝酸铜和硒酸作用制取,硒酸酸性与硫酸比较,酸性较强的是________________(填化学式),S、 Se、O电负性由大到小的顺序是_____________________。
(3)硒酸铜中阴离子的空间结构为_______________________。在Cu的d轨道中电子排布成,而不是,原因是___________________________。
(4)熔点为1235℃,红色或暗红色八面立方晶系结晶,几乎不溶于水。的晶体类型是_______________________,熔点的原因是__________________________。
(5)铜的某种氧化物的晶胞如图所示,则该氧化物的化学式为______________,若组成粒子氧、铜的半径分别为,密度为,设阿伏加德罗常数值为,则该晶胞的空间利用率为____________________________(用含的式子表示)。
18.(14分)在工业上经常用水蒸气蒸馏的方法从橙子等水果果皮中收集橙油(主要成分是柠檬烯)。
实验步骤如下:
(1)提取柠檬烯
①将2~3个新鲜橙子皮剪成极小碎片后,投入100 mL烧瓶D中,加入约30 mL水,按照下图安装水蒸气蒸馏装置。
②松开弹簧夹G。加热水蒸气发生器A至水沸腾,当T形管的支管口有大量水蒸气冲出时夹紧弹簧夹G,开启冷却水,水蒸气蒸馏即开始进行。一段时间后可观察到在锥形瓶的馏出液的水面上有一层很薄的油层。
(2)提纯柠檬烯
①将馏出液用10 mL二氯甲烷萃取,萃取3次后合并萃取液,置于装有适量无水硫酸钠的50 mL锥形瓶中。
②将锥形瓶中的溶液倒入50 mL蒸馏瓶中蒸馏。当二氯甲烷基本蒸完后改用水泵减压蒸馏以除去残留的二氯甲烷。最后瓶中只留下少量橙黄色液体,即橙油。
回答下列问题:
(1)直玻璃管C的作用是_____________________。冷凝水从直形冷凝管的___________(填“a”或“b”)口进入。
(2)水蒸气蒸馏时,判断蒸馏结束的方法是________________________;为了防止倒吸,实验停止时应进行的操作是____________________________。
(3)将馏出液用二氯甲烷萃取时用到的主要实验仪器是_____________________________。
(4)无水硫酸钠的作用是______________________________。
(5)二氯甲烷的沸点为39.8℃,提纯柠檬烯时采用________________________加热蒸馏的方法。
19.(12分)H是一种新型香料的主要成分之一,其合成路线如下(部分产物和部分反应条件略去):
已知:①;
②B的核磁共振氢谱显示分子中有6种不同化学环境的氢原子。
请回答下列问题:
(1)的同分异构体中存在顺反异构的有机化合物的名称为_______________。
(2)A的核磁共振氢谱中除苯环上的H外,还显示____________组峰,峰面积比为_______________。
(3)D分子中含氧官能团名称是_____________________,E的结构简式为_______________。
(4) 发生加聚反应的化学方程式为_________________;D和G反应生成H的化学方程式为_____________________。
(5)G的同分异构体中,同时满足下列条件的有__________________种(不考虑立体异构)。
①苯的二取代物
②与溶液发生显色反应
③含“”结构
(6)参照上述合成路线,以丙烯为原料(无机试剂任选),设计制备2,3-丁二醇的合成路线。
常德市鼎城区2021-2022学年高三下学期期中考试
化学试题参考答案
一、选择题:本题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。
1.A 2.D 3.A 4.D 5.B 6.C 7.B 8.B 9.C 10.A
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.BD 12.BC 13.D 14.A 15.D
三、非选择题:本题共4小题,共50分。
16.(12分)(1)(1分)
(2)4.4≤pH<7.5(或4.4~7.5)(2分)沉淀完全而不沉淀;使反应物充分接触,从而加快反应速率(1分)
(3)(2分)139(2分)
(4)(2分)
(5)d(2分)
17.(12分)(1)第四周期ⅠB族(1分)(1分)1:2(1分)
(2)(1分)O>S>Se(1分)
(3)正四面体形(1分)能量相同的原子轨道在全充满、半充满或全空时,体系能量最低、原子较稳定(1分)
(4)离子晶体(1分)离子半径,晶格能比CuS的大(1分)
(5)(1分) (2分)
18.(12分)(1)平衡圆底烧瓶A中压强(1分)a(2分)
(2)馏出液澄清透明(或取少量馏出液滴入水中,无油珠存在)(3分)松开弹簧夹G,然后停止加热(或先把D中的导气管从溶液中移出,再停止加热)(2分)
(3)分液漏斗(2分)
(4)干燥除水(2分) (5)水浴(2分)
19.(12分)(1)2-丁烯(1分) (2)2(1分)1:6(或6:1)(1分)
(3)羟基、羧基(1分)(1分)
(4) (1分)(2分)
(5)12(2分)
(6) (2分)
同课章节目录
