2.2溶液组成的定量研究 强化习题——苏教版(2020)必修第一册(word版 含解析)
文档属性
| 名称 | 2.2溶液组成的定量研究 强化习题——苏教版(2020)必修第一册(word版 含解析) |
|
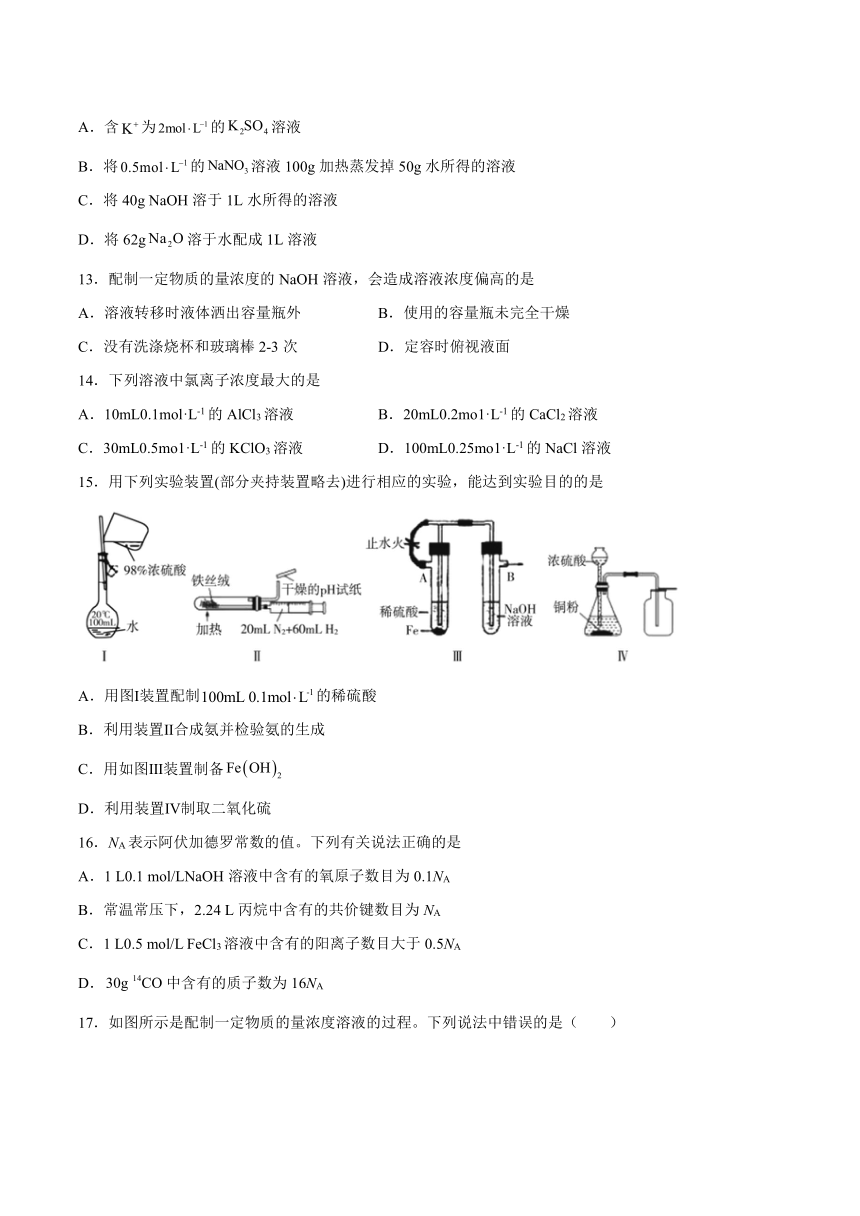
|
| 格式 | docx | ||
| 文件大小 | 637.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-13 00:00:00 | ||
图片预览




文档简介
2.2溶液组成的定量研究——强化习题
一、选择题(共20题)
1.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6gFe和足量的盐酸完全反应失去电子数为0.2NA
B.标准状况下,22.4L水含有NA个H2O分子
C.1 mol L 1 Na2CO3溶液中含有Na+数目为2NA
D.16gO2和O3的混合气体中含分子数目为NA
2.美国UNC化学教授Thomas Meyer等研发了环境友好、安全型的“绿色”引爆炸药,其中一种可表示为Na2R,它保存在水中可以失去活性,爆炸后不会产生危害性残留物。已知10mLNa2R溶液含Na+的数目为2N,该Na2R溶液的物质的量浓度为
A.N×10-2mol/L B.mol/L
C.mol/L D.mol/L
3.标准状况下VLHCl溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为cmol/L,则下列关系中不正确的是
A.ρ=(36.5V+22400)/(22.4+22.4V)
B.ω=36.5c/(1000ρ)
C.ω=36.5V/(36.5V+22400)
D.c=1000Vρ/(36.5V+22400)
4.用2.0mol/L硫酸溶液配制100mL0.50mo/L硫酸溶液,下列仪器中不需要的是
A. B. C. D.
5.下列溶液中Cl-的物质的量浓度最大的是
A.300 mL 3.5 mol/L KCl溶液 B.1000 mL 2.5 mol/L NaCl溶液
C.200 mL 2 mol/L MgCl2溶液 D.300 mL6 mol/L KClO3溶液
6.实验室有质量分数为98%,密度为的浓硫酸,现需配制浓度为,体积为的稀硫酸,则所需浓硫酸的体积为
A. B. C. D.
7.小铭将wgNaCl固体完全溶于1L水中,溶解和电离过程如图所示。下列说法正确的是
A.a离子为Na+,b离子为Cl-
B.溶解和电离过程中,水分子与晶体不存在相互作用
C.所得溶液中c(Na+)等于mol/L
D.若再加入NaCl固体至离子浓度不再变化时,则所得为饱和溶液
8.利用硫酸铜晶体(CuSO4·5H2O)来配制1.0 mol·L-1 CuSO4溶液500 mL,假如其他操作均准确无误,下列情况会引起所配溶液物质的量浓度偏高的是
A.称取硫酸铜晶体80.0 g
B.定容时,俯视观察刻度线
C.移液时,对用于溶解硫酸铜晶体的烧杯没有进行洗涤
D.称量时所使用的砝码有残缺
9.将浓度为的溶液蒸发掉水后,成为随的的溶液,则蒸发后的溶液其物质的量浓度为
A. B.
C. D.
10.用密度为1.40 g/cm3的硫酸溶液逐滴滴入BaCl2溶液中,直到沉淀恰好完全为止。已知所生成的溶液的质量等于原BaCl2溶液的质量,则硫酸溶液的浓度为
A.5.67mol/L B.21.9% C.6.00mol/L D.无法计算
11.将100 mL 0.3 mol·L-1 Na2SO4 溶液和50 mL 0.2 mol·L-1 Al2(SO4)3 溶液混合,溶液中SO的物质的量浓度为(忽略溶液混合后的体积变化)
A.0.5mol/L B.0.4mol/L C.0.3mol/L D.0.2mol/L
12.下列溶液中,溶质的物质的量浓度为的是
A.含为的溶液
B.将的溶液100g加热蒸发掉50g水所得的溶液
C.将40g NaOH溶于1L水所得的溶液
D.将62g溶于水配成1L溶液
13.配制一定物质的量浓度的NaOH溶液,会造成溶液浓度偏高的是
A.溶液转移时液体洒出容量瓶外 B.使用的容量瓶未完全干燥
C.没有洗涤烧杯和玻璃棒2-3次 D.定容时俯视液面
14.下列溶液中氯离子浓度最大的是
A.10mL0.1mol·L-1的AlCl3溶液 B.20mL0.2mo1·L-1的CaCl2溶液
C.30mL0.5mo1·L-1的KClO3溶液 D.100mL0.25mo1·L-1的NaCl溶液
15.用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是
A.用图Ⅰ装置配制的稀硫酸
B.利用装置Ⅱ合成氨并检验氨的生成
C.用如图Ⅲ装置制备
D.利用装置Ⅳ制取二氧化硫
16.NA表示阿伏加德罗常数的值。下列有关说法正确的是
A.1 L0.1 mol/LNaOH溶液中含有的氧原子数目为0.1NA
B.常温常压下,2.24 L丙烷中含有的共价键数目为NA
C.1 L0.5 mol/L FeCl3溶液中含有的阳离子数目大于0.5NA
D.中含有的质子数为16NA
17.如图所示是配制一定物质的量浓度溶液的过程。下列说法中错误的是( )
A.所配制的溶液的物质的量浓度为
B.操作2是将操作1得到的溶液转移到容量瓶中
C.操作4如果仰视,所配得溶液浓度偏高
D.操作5中,定容摇匀后发现液面低于刻度线,要继续加水至刻度线
18.20 ℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是( )
A.25 ℃时,KCl溶液的浓度都大于4.0 mol·L-1
B.此溶液中KCl的质量分数为74.5×4.0/(1.174×1 000)×100%
C.20 ℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,密度一定大于1.174 g·cm-3
19.在0.5 L某浓度的NaCl溶液中含有0.5 mol Na+,对该溶液的说法中不正确的是
A.该溶液的物质的量浓度为1 mol·L-1
B.该溶液中含有58.5 g NaCl
C.配制100 mL该溶液需用5.85 g NaCl
D.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.2 mol
20.下列说法中正确的是
A.已知25%氨水的密度0.91g/cm3,5%氨水的密度为0.98g/cm3,若将上述两溶液等体积混合,所得氨水溶液的质量分数大于15%
B.已知质量分数为98%的硫酸溶液的物质的量的浓度为18.4mol/L,则质量分数为49%的硫酸溶液的物质的量浓度小于9.2mol/L
C.把100mL3mol·L-1的H2SO4溶液与100mLH2O混合后,硫酸的物质的量浓度变为1.5mol·L-1
D.在100g物质的量浓度为18mol/L、密度为1.84g/mL的浓硫酸中加入一定量水稀释成9mol/L的硫酸溶液,则加入的水的体积小于100mL
二、综合题(共4题)
21.硫酸被誉为酸中之王,广泛应用于科学实验、工农业生产。如图是硫酸试剂瓶标签上的部分内容,完成各小题。
(1)标签上遗漏的危险化学品标志是___(从图中选择)
A. B. C. D.
(2)这瓶硫酸物质的量浓度为18.4mol/L,现配制240mL4.6mol/L的稀硫酸,需量取此硫酸___mL。
(3)量取硫酸时,由于操作不慎手上粘上了少量硫酸,处理方法是___。
(4)浓硫酸溶于水发生了电离,写出电离方程式____。
22.下图是某学校实验室从市场买回的试剂标签上的部分内容。
按要求回答下列问题:
(1)硫酸的物质的量浓度为___________ mol·L-1,氨水的物质的量浓度为___________ mol·L-1。
(2)各取5 mL与等质量的水混合后,c(H2SO4)___________9.2 mol·L-1,c(NH3)___________6.45 mol·L-1(填“>”“<”或“=”,下同)。
(3)各取5 mL与等体积水混合后,w(H2SO4)___________49%,w(NH3)___________12.5%。
23.(1)在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为:
________、_________ 、_______。
(2)下列物质:①烧碱 ②液态HCl ③SO3 ④铁片 ⑤石墨 ⑥CO2 ⑦醋酸 ⑧碳酸钙中,
属于电解质的是____________________(填编号,下同),
属于非电解质的是__________________。
24.新的课程理念要求普及科学知识,提高公民素养,让知识走进社会、走进生活,充分体现化学的社会价值,下面是两则生活中的化学知识,请按要求作答:
(1)硅及其化合物在无机非金属材料中一直扮演着主要的角色,则:
①有下列物品或设备:
a.陶瓷餐具 b.门窗玻璃 c.硅太阳能电池 d.水晶镜片
e.计算机芯片 f.石英光导纤维
用到硅单质的是__________(填字母标号,下同)。
所用材料为SiO2或要用到SiO2的是___________。
所用材料为硅酸盐的是___________。
②赏心悦目的雕花玻璃是用下列物质中的一种对玻璃进行刻蚀而制成的,这种物质是________。
A.盐酸 B.氢氟酸 C.烧碱 D.纯碱
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式C6H12O6)的水溶液,其标签上的部分内容如图所示,利用标签所提供的信息,回答下列问题:
①该注射液中葡萄糖的摩尔质量为:_______________
②该注射液中葡萄糖的物质的量浓度为:______________
③如果要配制一定物质的量浓度的葡萄糖溶液250ml,所需仪器除了托盘天平、药匙、烧杯、玻璃棒、胶头滴管外,还缺少的仪器是___________
答案解析部分
1.A
【详解】
A.5.6gFe和足量的盐酸完全反应生成Fe2+,因此失去电子数为0.2NA,故A正确;
B.标准状况下,水是液体,22.4L水的物质的量大于1mol,H2O分子数大于NA个,故B错误;
C.1 mol L 1 Na2CO3溶液,由于体积未知,无法计算物质的量,故C错误;
D.假设16g全部是O2,物质的量为0.5mol,含分子数目为0.5NA,故D错误。
综上所述,答案为A。
2.C
【详解】
钠离子的物质的量为mol,n(Na2R)=0.5n(Na+)=mol;则Na2R溶液的物质的量浓度为=mol/L;
故选C。
3.A
【详解】
A.VL HCl的物质的量==mol,其质量=mol×36.5g/mol=g,1L水的质量=1000mL×1g/mol=1000g,故溶液质量=(+1000)g,由于溶液体积不等于(1+V)L,故ρ≠(36.5V+22400)/(22.4+22.4V),且无法计算溶液的体积,即无法计算密度,A错误;
B.取VL该溶液,则溶质HCl的物质的量n=cVmol,故溶质的质量m(质)=nM=36.5cVg,
VL溶液的质量m(液)=1000VmL×ρg/mL=1000Vρg,ω===,B正确;
C.VL HCl的物质的量==mol,其质量=mol×36.5g/mol=g,1L水的质量=1000mL×1g/mol=1000g,故溶液质量=(+1000)g,则:ω===,C正确;
D.VL HCl的物质的量==mol,其质量=mol×36.5g/mol=g,1L水的质量=1000mL×1g/mol=1000g,故溶液质量=(+1000)g,溶液体积==L,故溶液浓度c==mol/L,D正确;
故答案为:A。
4.C
【详解】
用2.0mol/L硫酸溶液配制100mL0.50mo/L硫酸溶液,稀释前后溶质硫酸的物质的量不变,故有关系式 ,解得V=25.0mL,配制一定物质的量浓度溶液时,需要用量筒量取25.0mL2.0mol/L硫酸溶液并转移至烧杯中,然后加水稀释,冷却至室温,再用玻璃棒引流转移到100mL容量瓶中,用蒸馏水洗涤烧杯和玻璃棒2-3次,将洗涤液也转移到容量瓶中,最后用胶头滴管定容,盖瓶塞摇匀。所以不需要的仪器是分液漏斗,故选C。
5.C
【详解】
A.300 mL 3.5 mol/L KCl溶液中Cl-的物质的量浓度c(Cl-)=3.5 mol/L;
B.1000 mL 2.5 mol/L NaCl溶液中Cl-的物质的量浓度c(Cl-)=2.5 mol/L;
C.200 mL 2 mol/L MgCl2溶液中Cl-的物质的量浓度c(Cl-)=2 mol/L×2=4.0 mol/L;
D.KClO3电离产生K+、,不能电离产生Cl-,故该溶液中Cl-的物质的量浓度c(Cl-)=0 mol/L;
可见Cl-的物质的量浓度最大是4.0 mol/L,故合理选项是C。
6.A
【详解】
先根据算出浓硫酸的物质的量浓度,再根据稀释定律,,,故A符合题意。
综上所述,答案为A。
7.D
【详解】
A.Na+ 核外有2个电子层,Cl-核外有3个电子层,则r(Na+)B.溶解和电离过程中,水分子与晶体间存在静电作用,从而破坏晶体内阴、阳离子间的离子键,B错误;
C.所得溶液中n(Na+)= mol,但由于溶液体积不是1L,所以n(Na+)不等于 mol,C错误;
D.在溶质晶体存在的情况下,离子浓度不变,则所得溶液为饱和溶液,D正确;
故选D。
8.B
【详解】
A.CuSO4 5H2O物质的量为1.0 mol L-1×0.5L=0.50 mol,其质量为250 g mol-1×0.50 mol=125 g,称取80.0 g会使溶质质量不足,从而引起所配溶液物质的量浓度偏低,故A不符合题意;
B.俯视时实际加水量少于应加的水量,即体积偏小,因此物质的量浓度偏高,故B符合题意;
C.此做法会使溶质损失,使所配溶液物质的量浓度偏低,故C不符合题意;
D.称量时所使用的砝码有残缺,会导致溶质的物质的量偏少,物质的量浓度偏低,故D不符合题意。
答案选B。
9.A
【详解】
解:设2A%氢氧化钠溶液的质量为x ,蒸发前后溶质的质量不变,则有(x+wg )×A%=x×2A%,解得x=wg,2A%的氢氧化钠溶液中含有氢氧化钠的物质的量为所得 =;2A%氢氧化钠溶液的物质的量浓度为C== =mol L-1;
故选A。
10.C
【详解】
设硫酸钡的质量为233g,由于硫酸溶液的质量等于硫酸钡的质量,则硫酸溶液的质量为233g;所以硫酸溶液的体积为;设硫酸溶液中溶质的物质的量为x,根据H2SO4+BaCl2=BaSO4↓+2HCl反应关系可知,1:233=x:233,x=1mol;则硫酸溶液的浓度为=6.00mol/L;
故选C。
11.B
【详解】
Na2SO4的物质的量为0.1L×0.3mol/L=0.03mol,则n(SO42 )=0.03mol,Al2(SO4)3的物质的量为:0.05mL×0.2mol/L=0.01mol,则n(SO42 )=3×0.01mol=0.03mol,所以混合后溶液中(SO42 )=0.03mol+0.03mol=0.06mol,混合后溶液的体积可以粗略认为是两溶液混合后体积之和,故硫酸根的物质的量浓度为=0.40mol/L,综上所述故选B。
12.A
【详解】
A.含为的溶液,c()=c()=,选项A正确;
B.饱和溶液,蒸发掉水后,剩余溶液仍为饱和溶液,浓度不变,选项B错误;
C.40gNaOH的物质的量为1mol,溶于1L水中,溶液的体积大于1L,故浓度小于1mol/L,选项C错误;
D.62g的物质的量为1mol,与水反应生成NaOH 2mol,配成1L溶液,浓度为2mol/L,选项D错误;
答案选A。
13.D
【详解】
A. 溶液转移时液体洒出容量瓶外,导致部分溶质损耗,溶质物质的量偏小,溶液浓度偏低,故A不符;
B. 使用的容量瓶未完全干燥,对溶质物质的量和溶液体积都不产生影响,溶液浓度无影响,故B不符;
C. 没有洗涤烧杯和玻璃棒2-3次,导致部分溶质损耗,溶质物质的量偏小,溶液浓度偏低,故C不符;
D. 定容时俯视液面,导致溶液体积偏小,溶液浓度偏高,故D符合;
故选D。
14.B
【详解】
A.10mL0.1mol·L-1的AlCl3溶液中Cl-的物质的量浓度为0.1mol·L-1×3=0.3mol·L-1;
B.20mL0.2mol·L-1的CaCl2溶液中Cl-的物质的量浓度为0.2mol·L-1×2=0.4mol·L-1;
C.30mL0.5mol·L-1的KClO3溶液中含有氯酸根离子,不含有Cl-;
D.100mL0.25mol·L-1的NaCl溶液中Cl-的物质的量浓度为0.25mol·L-1;
综上,Cl-的物质的量浓度最大的是20mL0.2mo1·L-1的CaCl2溶液溶液,故答案选B。
15.C
【详解】
A.不能在容量瓶中直接稀释溶液,A错误;
B.干燥的pH试纸无法检验氨的生成,B错误;
C.氢氧化亚铁遇空气易氧化,需在隔绝空气的条件下制备,C正确;
D.铜与浓硫酸在常温下不反应,D错误;
答案选C。
16.C
【详解】
A.除溶质NaOH中含有O原子外,溶剂水中也含有O原子,故在1 L0.1 mol/LNaOH溶液中含有的氧原子数目大于0.1NA,A错误;
B.丙烷C3H8分子中含有8个共价键,常温常压下,2.24 L丙烷的物质的量小于0.1 mol,因此其中含有的共价键数目小于NA,B错误;
C.1 L0.5 mol/L FeCl3溶液中含有溶质的物质的量是0.5 mol。FeCl3是强酸弱碱盐,在溶液中Fe3+会发生水解反应产生H+,每有 1个Fe3+水解产生3个H+,故其中所含有的阳离子数会增多,C正确;
D.30 g 14CO的物质的量是1 mol,其中含有的质子数为14 NA,D错误;
故合理选项是C。
17.CD
【详解】
A.由图可知,所配溶液的体积为,碳酸钠的物质的量为,所配碳酸钠溶液的浓度为,A正确;
B.将固体碳酸钠溶解,溶液冷却至室温后转移到容量瓶中,操作2是移液,B正确;
C.操作4是定容,若仰视,则所配溶液体积偏大,浓度偏低,C错误;
D.定容摇匀后发现液面低于刻度线,再加水至刻度线,导致所配溶液的体积偏大,所配溶液的浓度偏低,D错误。
答案选CD。
18.AD
【详解】
A、 25 ℃比20 ℃的温度高,升高温度饱和氯化钾的溶解度增大,则饱和溶液的浓度大于4.0 mol/L,与题意不符,A错误;
B、20℃时,饱和KCl溶液的密度为1.174g cm-3,物质的量浓度为4.0mol L-1,根据c=可知,质量分数为w=×100%,B正确;
C、KCl溶液的浓度越大,密度越大,故20℃时,密度小于1.174 g cm-3的KCl溶液是不饱和溶,C正确;
D、若将饱和溶液蒸发,则有KCl晶体析出.再恢复到20℃时,其溶解度不变,溶液仍为饱和溶液,密度仍为1.174g cm-3,D错误;
答案为AD。
19.BD
【详解】
A.溶液的浓度c( NaCl)= =1mol/L,故A不选;
B.氯化钠的质量为0.5mol×58.5g/mol=29.25g,故B选;
C.100ml溶液中含有NaCl的物质的量n=c V=1mol/L×0.1L=0.1mol,需要氯化钠的质量m=0.1mol×58.5g/mol=5.85g,故C不选;
D.100ml溶液中含有NaCl的物质的量n=c V=1mol/L×0.1L=0.1mol,故D选;
故选:BD。
20.BD
【详解】
A.,故A错误;
B.设49%的硫酸溶液的浓度为c,98%的浓硫酸的密度为ρ1,49%的硫酸溶液的密度为ρ2,则18.4mol·L-1=,硫酸溶液的浓度越大,其溶液的密度越大,故ρ1>ρ2,所以<1,所以c<9.2 mol·L-1,故B正确;
C.100mL3mol·L-1的H2SO4溶液与100mLH2O混合后,总体积小于200mL,硫酸的物质的量浓度大于1.5mol·L-1,故C错误;
D.稀释前后溶质的质量不变,设加水的质量为x,则100g×ω1=(100g+x)×ω2,18 mol·L-1的浓硫酸加到一定量的水中稀释成9 mol·L-1的硫酸,由c=及硫酸的浓度越大,密度越大,则ω1>ω2,ω1<2ω2所以< 2,解得x< 100g,又水的密度约为1g/mL ,则加水的体积小于100mL,故D正确;
故选BD。
21.
(1)A
(2)60
(3)用大量水冲洗,再涂上碳酸氢钠
(4)
【分析】
(1)
浓硫酸为强腐蚀性化学试剂,故遗漏的化学标志是腐蚀品,故选A;
(2)
根据稀释公式c稀V稀=c浓V浓,V浓==60mL;
(3)
若在量取过程中,少量浓硫酸不慎沾在手上,用大量水冲洗,再涂上碳酸氢钠;
(4)
硫酸的电离方程式
22.
(1) 18.4 12.9
(2) < >
(3) > <
【解析】
(1)
根据计算,;;
(2)
硫酸的密度大于水,氨水的密度小于水,各取5 mL与等质量的水混合后,所得稀硫酸的体积大于10 mL,稀氨水的体积小于10 mL,故有c(H2SO4)<9.2 mol·L-1,c(NH3)>6.45 mol·L-1;
(3)
5 mL浓硫酸和5 mL浓氨水的质量分别为 1.84 g·cm-3×5 mL=9.2 g、0.88 g·cm-3×5 mL=4.4 g,而5 mL水的质量约为5g,故各取5 mL与等体积的水混合后,w(H2SO4)>49%,w(NH3)<12.5%。
23.0.64moL 0.02moL 0.24moL 1、2、7、8 3、6
【详解】
(1)0.5mol NH4Cl、0.16mol KCl、0.24mol K2SO4中 n(NH4+)=n(NH4Cl)=0.5mol; n( Cl- )=n(NH4Cl)+n( KCl)=0.5mol+0.16mol=0.66mol;
n( K+ )=n( KCl)+2n( K2SO4)=0.16mol+2×0.24mol=0.64mol;
n(SO42-)=n( K2SO4)=0.24mol;
用KCl、NH4Cl、(NH4)2SO4配制, n((NH4)2SO4)=n(SO42-)=0.24mol; n( KCl)=n( K+ )=0.64mol; n(NH4Cl)=n( Cl- )-n( KCl)=0.66mol-0.64mol=0.02mol;
故答案为0.64mol;0.02mol;0.24mol.
(2)电解质是在熔融状态或水溶液中能导电的化合物,包括酸,碱,盐,金属氧化物,水,故属于电解质的是1.2.7.8;
非电解质是在熔融状态和水溶液中均不导电的化合物,包括大多数有机物,非金属氧化物,氨气等,故属于非电解质的是3.6.
24.ce bdf a B 180g/mol 0.3mol/L 250ml容量瓶
【详解】
(1)①硅为良好的半导体材料,可用于制太阳能、计算机芯片,;所用材料为SiO2或要用到SiO2的是:门窗玻璃(原料有二氧化硅、成份含有二氧化硅)、水晶镜片、石英光导纤维;所用材料为硅酸盐的是陶瓷餐具。
因此用到硅单质的是ce;
所用材料为SiO2或要用到SiO2的是bdf;
所用材料为硅酸盐的是a;
②氢氟酸与玻璃中的SiO2会发生反应:SiO2+4HF=SiF4↑+2H2O,因此可用于雕刻赏心悦目的雕花玻璃的是氢氟酸,故合理选项是B。
(2)①当摩尔质量以g/mol为单位时,数值上等于该物质的相对分子质量,葡萄糖相对分子质量是180,所以葡萄糖的摩尔质量是180g/mol;
②根据n=可计算葡萄糖的物质的量n==0.15mol,再由c==3mol/L;
③根据准确配制一定物质的量浓度的溶液需要使用的仪器,可知如果要配制一定物质的量浓度的葡萄糖溶液250ml,所需仪器除了托盘天平、药匙、烧杯、玻璃棒、胶头滴管外,还缺少的仪器是250mL的容量瓶。
一、选择题(共20题)
1.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6gFe和足量的盐酸完全反应失去电子数为0.2NA
B.标准状况下,22.4L水含有NA个H2O分子
C.1 mol L 1 Na2CO3溶液中含有Na+数目为2NA
D.16gO2和O3的混合气体中含分子数目为NA
2.美国UNC化学教授Thomas Meyer等研发了环境友好、安全型的“绿色”引爆炸药,其中一种可表示为Na2R,它保存在水中可以失去活性,爆炸后不会产生危害性残留物。已知10mLNa2R溶液含Na+的数目为2N,该Na2R溶液的物质的量浓度为
A.N×10-2mol/L B.mol/L
C.mol/L D.mol/L
3.标准状况下VLHCl溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为cmol/L,则下列关系中不正确的是
A.ρ=(36.5V+22400)/(22.4+22.4V)
B.ω=36.5c/(1000ρ)
C.ω=36.5V/(36.5V+22400)
D.c=1000Vρ/(36.5V+22400)
4.用2.0mol/L硫酸溶液配制100mL0.50mo/L硫酸溶液,下列仪器中不需要的是
A. B. C. D.
5.下列溶液中Cl-的物质的量浓度最大的是
A.300 mL 3.5 mol/L KCl溶液 B.1000 mL 2.5 mol/L NaCl溶液
C.200 mL 2 mol/L MgCl2溶液 D.300 mL6 mol/L KClO3溶液
6.实验室有质量分数为98%,密度为的浓硫酸,现需配制浓度为,体积为的稀硫酸,则所需浓硫酸的体积为
A. B. C. D.
7.小铭将wgNaCl固体完全溶于1L水中,溶解和电离过程如图所示。下列说法正确的是
A.a离子为Na+,b离子为Cl-
B.溶解和电离过程中,水分子与晶体不存在相互作用
C.所得溶液中c(Na+)等于mol/L
D.若再加入NaCl固体至离子浓度不再变化时,则所得为饱和溶液
8.利用硫酸铜晶体(CuSO4·5H2O)来配制1.0 mol·L-1 CuSO4溶液500 mL,假如其他操作均准确无误,下列情况会引起所配溶液物质的量浓度偏高的是
A.称取硫酸铜晶体80.0 g
B.定容时,俯视观察刻度线
C.移液时,对用于溶解硫酸铜晶体的烧杯没有进行洗涤
D.称量时所使用的砝码有残缺
9.将浓度为的溶液蒸发掉水后,成为随的的溶液,则蒸发后的溶液其物质的量浓度为
A. B.
C. D.
10.用密度为1.40 g/cm3的硫酸溶液逐滴滴入BaCl2溶液中,直到沉淀恰好完全为止。已知所生成的溶液的质量等于原BaCl2溶液的质量,则硫酸溶液的浓度为
A.5.67mol/L B.21.9% C.6.00mol/L D.无法计算
11.将100 mL 0.3 mol·L-1 Na2SO4 溶液和50 mL 0.2 mol·L-1 Al2(SO4)3 溶液混合,溶液中SO的物质的量浓度为(忽略溶液混合后的体积变化)
A.0.5mol/L B.0.4mol/L C.0.3mol/L D.0.2mol/L
12.下列溶液中,溶质的物质的量浓度为的是
A.含为的溶液
B.将的溶液100g加热蒸发掉50g水所得的溶液
C.将40g NaOH溶于1L水所得的溶液
D.将62g溶于水配成1L溶液
13.配制一定物质的量浓度的NaOH溶液,会造成溶液浓度偏高的是
A.溶液转移时液体洒出容量瓶外 B.使用的容量瓶未完全干燥
C.没有洗涤烧杯和玻璃棒2-3次 D.定容时俯视液面
14.下列溶液中氯离子浓度最大的是
A.10mL0.1mol·L-1的AlCl3溶液 B.20mL0.2mo1·L-1的CaCl2溶液
C.30mL0.5mo1·L-1的KClO3溶液 D.100mL0.25mo1·L-1的NaCl溶液
15.用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是
A.用图Ⅰ装置配制的稀硫酸
B.利用装置Ⅱ合成氨并检验氨的生成
C.用如图Ⅲ装置制备
D.利用装置Ⅳ制取二氧化硫
16.NA表示阿伏加德罗常数的值。下列有关说法正确的是
A.1 L0.1 mol/LNaOH溶液中含有的氧原子数目为0.1NA
B.常温常压下,2.24 L丙烷中含有的共价键数目为NA
C.1 L0.5 mol/L FeCl3溶液中含有的阳离子数目大于0.5NA
D.中含有的质子数为16NA
17.如图所示是配制一定物质的量浓度溶液的过程。下列说法中错误的是( )
A.所配制的溶液的物质的量浓度为
B.操作2是将操作1得到的溶液转移到容量瓶中
C.操作4如果仰视,所配得溶液浓度偏高
D.操作5中,定容摇匀后发现液面低于刻度线,要继续加水至刻度线
18.20 ℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是( )
A.25 ℃时,KCl溶液的浓度都大于4.0 mol·L-1
B.此溶液中KCl的质量分数为74.5×4.0/(1.174×1 000)×100%
C.20 ℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,密度一定大于1.174 g·cm-3
19.在0.5 L某浓度的NaCl溶液中含有0.5 mol Na+,对该溶液的说法中不正确的是
A.该溶液的物质的量浓度为1 mol·L-1
B.该溶液中含有58.5 g NaCl
C.配制100 mL该溶液需用5.85 g NaCl
D.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.2 mol
20.下列说法中正确的是
A.已知25%氨水的密度0.91g/cm3,5%氨水的密度为0.98g/cm3,若将上述两溶液等体积混合,所得氨水溶液的质量分数大于15%
B.已知质量分数为98%的硫酸溶液的物质的量的浓度为18.4mol/L,则质量分数为49%的硫酸溶液的物质的量浓度小于9.2mol/L
C.把100mL3mol·L-1的H2SO4溶液与100mLH2O混合后,硫酸的物质的量浓度变为1.5mol·L-1
D.在100g物质的量浓度为18mol/L、密度为1.84g/mL的浓硫酸中加入一定量水稀释成9mol/L的硫酸溶液,则加入的水的体积小于100mL
二、综合题(共4题)
21.硫酸被誉为酸中之王,广泛应用于科学实验、工农业生产。如图是硫酸试剂瓶标签上的部分内容,完成各小题。
(1)标签上遗漏的危险化学品标志是___(从图中选择)
A. B. C. D.
(2)这瓶硫酸物质的量浓度为18.4mol/L,现配制240mL4.6mol/L的稀硫酸,需量取此硫酸___mL。
(3)量取硫酸时,由于操作不慎手上粘上了少量硫酸,处理方法是___。
(4)浓硫酸溶于水发生了电离,写出电离方程式____。
22.下图是某学校实验室从市场买回的试剂标签上的部分内容。
按要求回答下列问题:
(1)硫酸的物质的量浓度为___________ mol·L-1,氨水的物质的量浓度为___________ mol·L-1。
(2)各取5 mL与等质量的水混合后,c(H2SO4)___________9.2 mol·L-1,c(NH3)___________6.45 mol·L-1(填“>”“<”或“=”,下同)。
(3)各取5 mL与等体积水混合后,w(H2SO4)___________49%,w(NH3)___________12.5%。
23.(1)在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为:
________、_________ 、_______。
(2)下列物质:①烧碱 ②液态HCl ③SO3 ④铁片 ⑤石墨 ⑥CO2 ⑦醋酸 ⑧碳酸钙中,
属于电解质的是____________________(填编号,下同),
属于非电解质的是__________________。
24.新的课程理念要求普及科学知识,提高公民素养,让知识走进社会、走进生活,充分体现化学的社会价值,下面是两则生活中的化学知识,请按要求作答:
(1)硅及其化合物在无机非金属材料中一直扮演着主要的角色,则:
①有下列物品或设备:
a.陶瓷餐具 b.门窗玻璃 c.硅太阳能电池 d.水晶镜片
e.计算机芯片 f.石英光导纤维
用到硅单质的是__________(填字母标号,下同)。
所用材料为SiO2或要用到SiO2的是___________。
所用材料为硅酸盐的是___________。
②赏心悦目的雕花玻璃是用下列物质中的一种对玻璃进行刻蚀而制成的,这种物质是________。
A.盐酸 B.氢氟酸 C.烧碱 D.纯碱
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式C6H12O6)的水溶液,其标签上的部分内容如图所示,利用标签所提供的信息,回答下列问题:
①该注射液中葡萄糖的摩尔质量为:_______________
②该注射液中葡萄糖的物质的量浓度为:______________
③如果要配制一定物质的量浓度的葡萄糖溶液250ml,所需仪器除了托盘天平、药匙、烧杯、玻璃棒、胶头滴管外,还缺少的仪器是___________
答案解析部分
1.A
【详解】
A.5.6gFe和足量的盐酸完全反应生成Fe2+,因此失去电子数为0.2NA,故A正确;
B.标准状况下,水是液体,22.4L水的物质的量大于1mol,H2O分子数大于NA个,故B错误;
C.1 mol L 1 Na2CO3溶液,由于体积未知,无法计算物质的量,故C错误;
D.假设16g全部是O2,物质的量为0.5mol,含分子数目为0.5NA,故D错误。
综上所述,答案为A。
2.C
【详解】
钠离子的物质的量为mol,n(Na2R)=0.5n(Na+)=mol;则Na2R溶液的物质的量浓度为=mol/L;
故选C。
3.A
【详解】
A.VL HCl的物质的量==mol,其质量=mol×36.5g/mol=g,1L水的质量=1000mL×1g/mol=1000g,故溶液质量=(+1000)g,由于溶液体积不等于(1+V)L,故ρ≠(36.5V+22400)/(22.4+22.4V),且无法计算溶液的体积,即无法计算密度,A错误;
B.取VL该溶液,则溶质HCl的物质的量n=cVmol,故溶质的质量m(质)=nM=36.5cVg,
VL溶液的质量m(液)=1000VmL×ρg/mL=1000Vρg,ω===,B正确;
C.VL HCl的物质的量==mol,其质量=mol×36.5g/mol=g,1L水的质量=1000mL×1g/mol=1000g,故溶液质量=(+1000)g,则:ω===,C正确;
D.VL HCl的物质的量==mol,其质量=mol×36.5g/mol=g,1L水的质量=1000mL×1g/mol=1000g,故溶液质量=(+1000)g,溶液体积==L,故溶液浓度c==mol/L,D正确;
故答案为:A。
4.C
【详解】
用2.0mol/L硫酸溶液配制100mL0.50mo/L硫酸溶液,稀释前后溶质硫酸的物质的量不变,故有关系式 ,解得V=25.0mL,配制一定物质的量浓度溶液时,需要用量筒量取25.0mL2.0mol/L硫酸溶液并转移至烧杯中,然后加水稀释,冷却至室温,再用玻璃棒引流转移到100mL容量瓶中,用蒸馏水洗涤烧杯和玻璃棒2-3次,将洗涤液也转移到容量瓶中,最后用胶头滴管定容,盖瓶塞摇匀。所以不需要的仪器是分液漏斗,故选C。
5.C
【详解】
A.300 mL 3.5 mol/L KCl溶液中Cl-的物质的量浓度c(Cl-)=3.5 mol/L;
B.1000 mL 2.5 mol/L NaCl溶液中Cl-的物质的量浓度c(Cl-)=2.5 mol/L;
C.200 mL 2 mol/L MgCl2溶液中Cl-的物质的量浓度c(Cl-)=2 mol/L×2=4.0 mol/L;
D.KClO3电离产生K+、,不能电离产生Cl-,故该溶液中Cl-的物质的量浓度c(Cl-)=0 mol/L;
可见Cl-的物质的量浓度最大是4.0 mol/L,故合理选项是C。
6.A
【详解】
先根据算出浓硫酸的物质的量浓度,再根据稀释定律,,,故A符合题意。
综上所述,答案为A。
7.D
【详解】
A.Na+ 核外有2个电子层,Cl-核外有3个电子层,则r(Na+)
C.所得溶液中n(Na+)= mol,但由于溶液体积不是1L,所以n(Na+)不等于 mol,C错误;
D.在溶质晶体存在的情况下,离子浓度不变,则所得溶液为饱和溶液,D正确;
故选D。
8.B
【详解】
A.CuSO4 5H2O物质的量为1.0 mol L-1×0.5L=0.50 mol,其质量为250 g mol-1×0.50 mol=125 g,称取80.0 g会使溶质质量不足,从而引起所配溶液物质的量浓度偏低,故A不符合题意;
B.俯视时实际加水量少于应加的水量,即体积偏小,因此物质的量浓度偏高,故B符合题意;
C.此做法会使溶质损失,使所配溶液物质的量浓度偏低,故C不符合题意;
D.称量时所使用的砝码有残缺,会导致溶质的物质的量偏少,物质的量浓度偏低,故D不符合题意。
答案选B。
9.A
【详解】
解:设2A%氢氧化钠溶液的质量为x ,蒸发前后溶质的质量不变,则有(x+wg )×A%=x×2A%,解得x=wg,2A%的氢氧化钠溶液中含有氢氧化钠的物质的量为所得 =;2A%氢氧化钠溶液的物质的量浓度为C== =mol L-1;
故选A。
10.C
【详解】
设硫酸钡的质量为233g,由于硫酸溶液的质量等于硫酸钡的质量,则硫酸溶液的质量为233g;所以硫酸溶液的体积为;设硫酸溶液中溶质的物质的量为x,根据H2SO4+BaCl2=BaSO4↓+2HCl反应关系可知,1:233=x:233,x=1mol;则硫酸溶液的浓度为=6.00mol/L;
故选C。
11.B
【详解】
Na2SO4的物质的量为0.1L×0.3mol/L=0.03mol,则n(SO42 )=0.03mol,Al2(SO4)3的物质的量为:0.05mL×0.2mol/L=0.01mol,则n(SO42 )=3×0.01mol=0.03mol,所以混合后溶液中(SO42 )=0.03mol+0.03mol=0.06mol,混合后溶液的体积可以粗略认为是两溶液混合后体积之和,故硫酸根的物质的量浓度为=0.40mol/L,综上所述故选B。
12.A
【详解】
A.含为的溶液,c()=c()=,选项A正确;
B.饱和溶液,蒸发掉水后,剩余溶液仍为饱和溶液,浓度不变,选项B错误;
C.40gNaOH的物质的量为1mol,溶于1L水中,溶液的体积大于1L,故浓度小于1mol/L,选项C错误;
D.62g的物质的量为1mol,与水反应生成NaOH 2mol,配成1L溶液,浓度为2mol/L,选项D错误;
答案选A。
13.D
【详解】
A. 溶液转移时液体洒出容量瓶外,导致部分溶质损耗,溶质物质的量偏小,溶液浓度偏低,故A不符;
B. 使用的容量瓶未完全干燥,对溶质物质的量和溶液体积都不产生影响,溶液浓度无影响,故B不符;
C. 没有洗涤烧杯和玻璃棒2-3次,导致部分溶质损耗,溶质物质的量偏小,溶液浓度偏低,故C不符;
D. 定容时俯视液面,导致溶液体积偏小,溶液浓度偏高,故D符合;
故选D。
14.B
【详解】
A.10mL0.1mol·L-1的AlCl3溶液中Cl-的物质的量浓度为0.1mol·L-1×3=0.3mol·L-1;
B.20mL0.2mol·L-1的CaCl2溶液中Cl-的物质的量浓度为0.2mol·L-1×2=0.4mol·L-1;
C.30mL0.5mol·L-1的KClO3溶液中含有氯酸根离子,不含有Cl-;
D.100mL0.25mol·L-1的NaCl溶液中Cl-的物质的量浓度为0.25mol·L-1;
综上,Cl-的物质的量浓度最大的是20mL0.2mo1·L-1的CaCl2溶液溶液,故答案选B。
15.C
【详解】
A.不能在容量瓶中直接稀释溶液,A错误;
B.干燥的pH试纸无法检验氨的生成,B错误;
C.氢氧化亚铁遇空气易氧化,需在隔绝空气的条件下制备,C正确;
D.铜与浓硫酸在常温下不反应,D错误;
答案选C。
16.C
【详解】
A.除溶质NaOH中含有O原子外,溶剂水中也含有O原子,故在1 L0.1 mol/LNaOH溶液中含有的氧原子数目大于0.1NA,A错误;
B.丙烷C3H8分子中含有8个共价键,常温常压下,2.24 L丙烷的物质的量小于0.1 mol,因此其中含有的共价键数目小于NA,B错误;
C.1 L0.5 mol/L FeCl3溶液中含有溶质的物质的量是0.5 mol。FeCl3是强酸弱碱盐,在溶液中Fe3+会发生水解反应产生H+,每有 1个Fe3+水解产生3个H+,故其中所含有的阳离子数会增多,C正确;
D.30 g 14CO的物质的量是1 mol,其中含有的质子数为14 NA,D错误;
故合理选项是C。
17.CD
【详解】
A.由图可知,所配溶液的体积为,碳酸钠的物质的量为,所配碳酸钠溶液的浓度为,A正确;
B.将固体碳酸钠溶解,溶液冷却至室温后转移到容量瓶中,操作2是移液,B正确;
C.操作4是定容,若仰视,则所配溶液体积偏大,浓度偏低,C错误;
D.定容摇匀后发现液面低于刻度线,再加水至刻度线,导致所配溶液的体积偏大,所配溶液的浓度偏低,D错误。
答案选CD。
18.AD
【详解】
A、 25 ℃比20 ℃的温度高,升高温度饱和氯化钾的溶解度增大,则饱和溶液的浓度大于4.0 mol/L,与题意不符,A错误;
B、20℃时,饱和KCl溶液的密度为1.174g cm-3,物质的量浓度为4.0mol L-1,根据c=可知,质量分数为w=×100%,B正确;
C、KCl溶液的浓度越大,密度越大,故20℃时,密度小于1.174 g cm-3的KCl溶液是不饱和溶,C正确;
D、若将饱和溶液蒸发,则有KCl晶体析出.再恢复到20℃时,其溶解度不变,溶液仍为饱和溶液,密度仍为1.174g cm-3,D错误;
答案为AD。
19.BD
【详解】
A.溶液的浓度c( NaCl)= =1mol/L,故A不选;
B.氯化钠的质量为0.5mol×58.5g/mol=29.25g,故B选;
C.100ml溶液中含有NaCl的物质的量n=c V=1mol/L×0.1L=0.1mol,需要氯化钠的质量m=0.1mol×58.5g/mol=5.85g,故C不选;
D.100ml溶液中含有NaCl的物质的量n=c V=1mol/L×0.1L=0.1mol,故D选;
故选:BD。
20.BD
【详解】
A.,故A错误;
B.设49%的硫酸溶液的浓度为c,98%的浓硫酸的密度为ρ1,49%的硫酸溶液的密度为ρ2,则18.4mol·L-1=,硫酸溶液的浓度越大,其溶液的密度越大,故ρ1>ρ2,所以<1,所以c<9.2 mol·L-1,故B正确;
C.100mL3mol·L-1的H2SO4溶液与100mLH2O混合后,总体积小于200mL,硫酸的物质的量浓度大于1.5mol·L-1,故C错误;
D.稀释前后溶质的质量不变,设加水的质量为x,则100g×ω1=(100g+x)×ω2,18 mol·L-1的浓硫酸加到一定量的水中稀释成9 mol·L-1的硫酸,由c=及硫酸的浓度越大,密度越大,则ω1>ω2,ω1<2ω2所以< 2,解得x< 100g,又水的密度约为1g/mL ,则加水的体积小于100mL,故D正确;
故选BD。
21.
(1)A
(2)60
(3)用大量水冲洗,再涂上碳酸氢钠
(4)
【分析】
(1)
浓硫酸为强腐蚀性化学试剂,故遗漏的化学标志是腐蚀品,故选A;
(2)
根据稀释公式c稀V稀=c浓V浓,V浓==60mL;
(3)
若在量取过程中,少量浓硫酸不慎沾在手上,用大量水冲洗,再涂上碳酸氢钠;
(4)
硫酸的电离方程式
22.
(1) 18.4 12.9
(2) < >
(3) > <
【解析】
(1)
根据计算,;;
(2)
硫酸的密度大于水,氨水的密度小于水,各取5 mL与等质量的水混合后,所得稀硫酸的体积大于10 mL,稀氨水的体积小于10 mL,故有c(H2SO4)<9.2 mol·L-1,c(NH3)>6.45 mol·L-1;
(3)
5 mL浓硫酸和5 mL浓氨水的质量分别为 1.84 g·cm-3×5 mL=9.2 g、0.88 g·cm-3×5 mL=4.4 g,而5 mL水的质量约为5g,故各取5 mL与等体积的水混合后,w(H2SO4)>49%,w(NH3)<12.5%。
23.0.64moL 0.02moL 0.24moL 1、2、7、8 3、6
【详解】
(1)0.5mol NH4Cl、0.16mol KCl、0.24mol K2SO4中 n(NH4+)=n(NH4Cl)=0.5mol; n( Cl- )=n(NH4Cl)+n( KCl)=0.5mol+0.16mol=0.66mol;
n( K+ )=n( KCl)+2n( K2SO4)=0.16mol+2×0.24mol=0.64mol;
n(SO42-)=n( K2SO4)=0.24mol;
用KCl、NH4Cl、(NH4)2SO4配制, n((NH4)2SO4)=n(SO42-)=0.24mol; n( KCl)=n( K+ )=0.64mol; n(NH4Cl)=n( Cl- )-n( KCl)=0.66mol-0.64mol=0.02mol;
故答案为0.64mol;0.02mol;0.24mol.
(2)电解质是在熔融状态或水溶液中能导电的化合物,包括酸,碱,盐,金属氧化物,水,故属于电解质的是1.2.7.8;
非电解质是在熔融状态和水溶液中均不导电的化合物,包括大多数有机物,非金属氧化物,氨气等,故属于非电解质的是3.6.
24.ce bdf a B 180g/mol 0.3mol/L 250ml容量瓶
【详解】
(1)①硅为良好的半导体材料,可用于制太阳能、计算机芯片,;所用材料为SiO2或要用到SiO2的是:门窗玻璃(原料有二氧化硅、成份含有二氧化硅)、水晶镜片、石英光导纤维;所用材料为硅酸盐的是陶瓷餐具。
因此用到硅单质的是ce;
所用材料为SiO2或要用到SiO2的是bdf;
所用材料为硅酸盐的是a;
②氢氟酸与玻璃中的SiO2会发生反应:SiO2+4HF=SiF4↑+2H2O,因此可用于雕刻赏心悦目的雕花玻璃的是氢氟酸,故合理选项是B。
(2)①当摩尔质量以g/mol为单位时,数值上等于该物质的相对分子质量,葡萄糖相对分子质量是180,所以葡萄糖的摩尔质量是180g/mol;
②根据n=可计算葡萄糖的物质的量n==0.15mol,再由c==3mol/L;
③根据准确配制一定物质的量浓度的溶液需要使用的仪器,可知如果要配制一定物质的量浓度的葡萄糖溶液250ml,所需仪器除了托盘天平、药匙、烧杯、玻璃棒、胶头滴管外,还缺少的仪器是250mL的容量瓶。
