初高中化学衔接课件
图片预览









文档简介
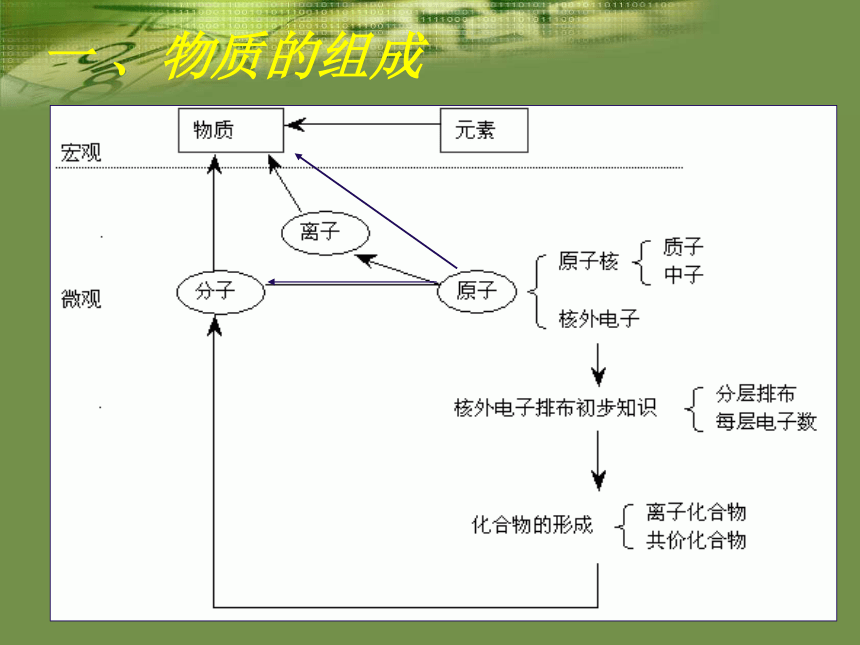
课件42张PPT。初高中化学衔接2012年8月一 、物质的组成注意点一、分子、原子、离子都是构成物质的基本粒子
由分子构成的物质:水、二氧化硫、硫酸等
由原子构成的物质:金刚石、石墨、金属等
由离子构成的物质:多数碱、盐等
二、分子是保持物质化学性质的一种粒子
三、原子是化学变化中的最小粒子
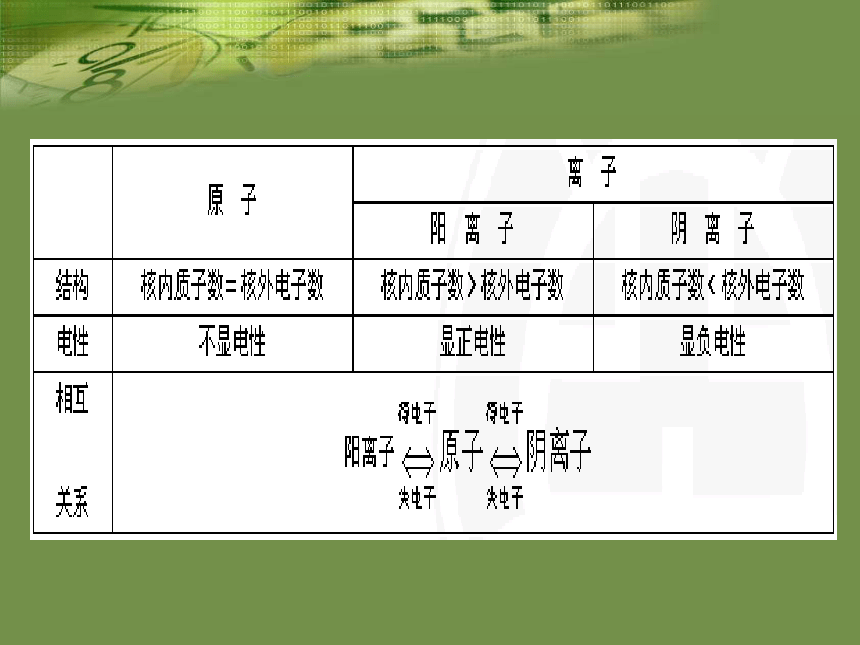
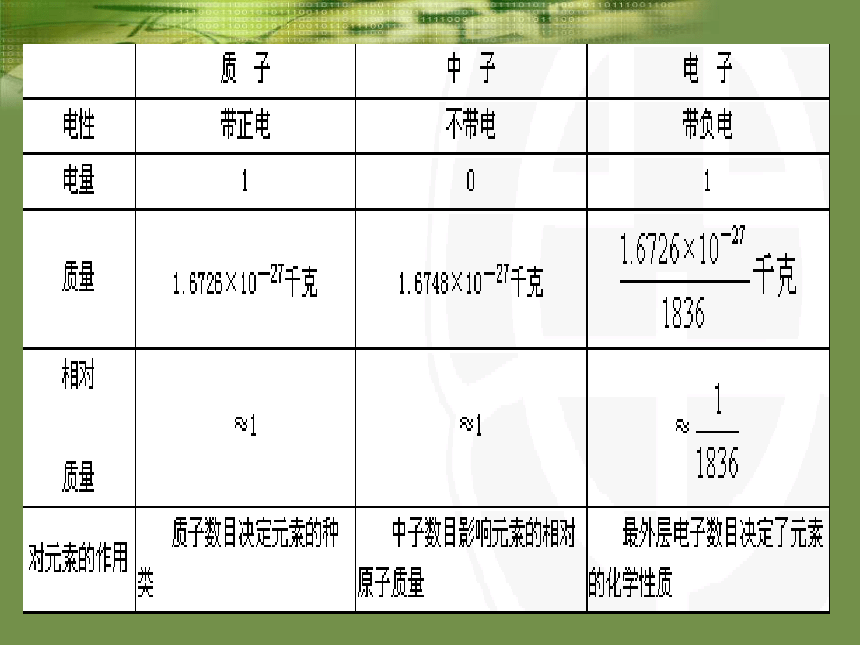
易错易混概念之间的联系与区别 俄罗斯科学家最近合成了核电荷数为114的元素的原子,经测定该原子的相对原子质量为289,则其中质子数与电子数的差是___________。 核外电子排布规律能量最低原则:核外电子总是尽先排布在能量最低的电子层里,然后再由里往外,依次排布在能量逐步升高的电子层里。
排布规律:
a. 各电子层最多容纳的电子数为2n2。
b.最外层电子数目不超过8个(K层为最外层时不超过2个)。
c.次外层电子数目不超过18个,倒数第三层电子数目不超过32个。[练习]分别写出He、Ne、Ar、K、Mg、Al、F、S、P的原子结构示意图。
写出下列离子的离子结构示意图:1996年科学家在宇宙深处发现了H3+离子和H3分子,请回答:
(1)1个H3+离子中有________个质子_________个电子。
(2)构成H3分子的原子的结构示意图是___________(填序号)
(3)H3属于__________。(填混合物或单质或化合物) ●离子化合物:阴阳离子相互作用形成的化合物 例如:NaCl、MgO、K2S、NaOH、Na2SO4等 注意:离子化合物由阴阳离子直接构成,晶体 中不存在分子。 例如:NaCl晶体由Na+和Cl-构成。 ●共价化合物:通过共用电子对形成分子的化合物 形成规律:非金属元素之间形成的化合物一般属共价化合物 例如:HCl、H2O、CO2等元素的存在状态:游离态、化合态二、物质的分类易错、易混概念之间的联系与区别 酸性氧化物:能与碱反应生成盐和水的氧化物
包括:大多数非金属氧化物 如:CO2、SO2、SO3、SiO2、P2O5等
碱性氧化物:能与酸反应生成盐和水的氧化物
包括:大多数金属氧化物如:Na2O、CaO、Fe2O3、CuO、MgO等 1.氧化物分类2.酸分类3.碱分类4.盐分类盐正盐:NaCl CaCO3 BaSO4 Na2CO3 CuSO4
Ba(NO3)2……酸式盐:NaHCO3 NaHSO4 NaHS NaH2PO4
Na2HPO4碱式盐:Cu2(OH)2CO3
含氧酸盐:CaCO3 BaSO4 Ba(NO3)2 NaHCO3
NaHSO4……无氧酸盐:NaCl K2S KI AgCl盐[练习]1、下列物质:①含CaO99%的生石灰 ②CaO刚好与水反应的生成物 ③水银 ④浓盐酸 ⑤含铁70%的三氧化二铁,用编号填入下列空格:属混合物的是 ,属单质的是 ,
属化合物的是 。
2、从H、C、O、Na四种元素种,选择适当的元素,按要求写出各物质的化学式。
①金属单质 、非金属单质 ;
②酸性氧化物 、碱性氧化物 ;
③酸 、碱 、盐 。.“垃圾是放错了位置的资源”,应该分类回收,生活中废弃的铁锅、铅制易拉罐,铜导线等可以归为一类加以回收,它们属于( ) A、氧化物 B、盐
C、金属或合金 D、碱 三、物质的性质和变化 物理性质
酸、碱、盐的溶解性
钾钠铵硝皆可溶、盐酸盐不溶银亚汞; 硫酸盐不溶钡和铅、碳磷酸盐多不溶。 多数酸溶碱少溶、只有钾钠氨钡溶。化学性质
1金属的化学性质
2 碱性氧化物通性
3 酸性氧化物通性
4.盐的通性
5. 酸的通性
6.碱的通性
1.金属的化学性质: (1)与非金属反应: (2)与酸反应: (3)与盐溶液反应: 金属活动顺序表应用: 在金属活动顺序表中,只有排在氢前面的金属才能置换出酸中的氢 (金属越活泼,反应越剧烈) ②在金属活动顺序表中,排在前面的金属一般能把排在后面的金属从它们的盐溶液中置换出来 2 .碱性氧化物通性 (1)与酸反应:Na2O + 2HCl = 2NaCl + H2O (2)与水反应:CaO + H2O = Ca(OH)2 (3)与酸性氧化物:Na2O + CO2 = Na2CO3 注意:一般可溶性的碱对应的碱性氧化物才能与水反应 (常见的有:Na2O 、K2O、 CaO、BaO) 3 .酸性氧化物通性 (1)与碱反应:CO2 + Ca(OH)2 = CaCO3 + H2O (2)与水反应:CO2 + H2O = H2 CO3 (3)与碱性氧化物反应:K2O + CO2 = K2CO3 注意:大多数酸性氧化物能与水反应生成相应的酸,但SiO2不能与水反应
先介绍电离的概念
酸:电离产生的阳离子全都是氢离子
HCl == H+ +Cl-
H2SO4 == 2H+ + SO42-
因为酸的溶液中都含有氢离子所以酸具有相同的化学性质
酸的化学性质实质是溶液中氢离子和酸根离子的性质 4 酸的通性碱:电离产生的阴离子全都是氢氧根离子
NaOH == Na+ +OH-
Ca(OH)2 == Ca2+ +2OH-
因为碱的溶液中都含有氢氧根离子所以碱具有相同的化学性质
碱的化学性质实质是溶液中金属离子和氢氧根离子的性质 5 碱的通性6.盐的通性
与酸反应
酸与盐反应的一般规律:
强酸 + 弱酸盐 = 强酸盐 + 弱酸
②与碱反应
注意:碱和盐反应不仅要求生成物中有沉淀、气体、水三者之一,还要求反应物均溶于水
③与盐反应
注意:盐和盐反应不仅要求生成物中有沉淀、气体、水三者之一,还要求反应物均溶于水
④与金属反应 下列物质的用途与该物质的物理性质有关的是( ) A、用硫酸除去金属表面的锈
B、用一氧化碳冶炼生铁 C、用氢气作高能燃料
D、用干冰进行人工降雨
下列自然现象的过程中,存在化学变化的是( ) A、冰雪融化 B、形成酸雨 C、发生沙尘暴天气 D、二氧化碳物质使地球表面气温升高 [练习]写出化学方程式并注明基本反应类型
1、铁丝在点燃的条件下在氧气中剧烈燃烧
2、氢氧化钡与硫酸钠反应
3、氢气能使氧化铜发生还原反应生成铜
4、硫酸氢铵受热易分解
5、一氧化碳还原氧化铁四、化学用语 写出由碳、氢、氧、钠中的某些元素组成的符合下列要求的物质的化学式:
(1)常用作还原剂的气态化合物:_____________;
(2)酸性氧化物______________ ;
(3)碱性氧化物________________;(4)正盐___________;
(5)酸式盐_______________。 判断下列化学符号中数字“2”所表示的意义,将其序号填在相应的横线上: ①Ca2+ ②NO2 ③2NO ④ +2
MgO (1)表示分子个数的是_____________; (2)表示一个离子所带电荷数的是___________; (3)表示元素化合价的是__________________; (4)表示一个分子中所含原子个数的是______________。 8、下列各组物质中:①C12O7、HClO3;②SO2、H2SO4;③NO、HNO2;④SiO2、H2SiO3;⑤Mn2O7、HMnO4;⑥CO2、 H2C2O4;⑦NO2、HNO2;⑧A12O3、HAlO2,前者是后者的 酸酐,正确的是( )。
A、①②③⑥ B.②③⑤⑦
C.④⑤ D.①③④⑧
[解析] HClO3的酸酐是C12O5,H2SO4的酸酐是SO3,
HNO2的酸酐是N2O3,H2C2O3的酸酐是C2O3,
A12O3为金属氧化物,是两性氧化物。 C
由分子构成的物质:水、二氧化硫、硫酸等
由原子构成的物质:金刚石、石墨、金属等
由离子构成的物质:多数碱、盐等
二、分子是保持物质化学性质的一种粒子
三、原子是化学变化中的最小粒子
易错易混概念之间的联系与区别 俄罗斯科学家最近合成了核电荷数为114的元素的原子,经测定该原子的相对原子质量为289,则其中质子数与电子数的差是___________。 核外电子排布规律能量最低原则:核外电子总是尽先排布在能量最低的电子层里,然后再由里往外,依次排布在能量逐步升高的电子层里。
排布规律:
a. 各电子层最多容纳的电子数为2n2。
b.最外层电子数目不超过8个(K层为最外层时不超过2个)。
c.次外层电子数目不超过18个,倒数第三层电子数目不超过32个。[练习]分别写出He、Ne、Ar、K、Mg、Al、F、S、P的原子结构示意图。
写出下列离子的离子结构示意图:1996年科学家在宇宙深处发现了H3+离子和H3分子,请回答:
(1)1个H3+离子中有________个质子_________个电子。
(2)构成H3分子的原子的结构示意图是___________(填序号)
(3)H3属于__________。(填混合物或单质或化合物) ●离子化合物:阴阳离子相互作用形成的化合物 例如:NaCl、MgO、K2S、NaOH、Na2SO4等 注意:离子化合物由阴阳离子直接构成,晶体 中不存在分子。 例如:NaCl晶体由Na+和Cl-构成。 ●共价化合物:通过共用电子对形成分子的化合物 形成规律:非金属元素之间形成的化合物一般属共价化合物 例如:HCl、H2O、CO2等元素的存在状态:游离态、化合态二、物质的分类易错、易混概念之间的联系与区别 酸性氧化物:能与碱反应生成盐和水的氧化物
包括:大多数非金属氧化物 如:CO2、SO2、SO3、SiO2、P2O5等
碱性氧化物:能与酸反应生成盐和水的氧化物
包括:大多数金属氧化物如:Na2O、CaO、Fe2O3、CuO、MgO等 1.氧化物分类2.酸分类3.碱分类4.盐分类盐正盐:NaCl CaCO3 BaSO4 Na2CO3 CuSO4
Ba(NO3)2……酸式盐:NaHCO3 NaHSO4 NaHS NaH2PO4
Na2HPO4碱式盐:Cu2(OH)2CO3
含氧酸盐:CaCO3 BaSO4 Ba(NO3)2 NaHCO3
NaHSO4……无氧酸盐:NaCl K2S KI AgCl盐[练习]1、下列物质:①含CaO99%的生石灰 ②CaO刚好与水反应的生成物 ③水银 ④浓盐酸 ⑤含铁70%的三氧化二铁,用编号填入下列空格:属混合物的是 ,属单质的是 ,
属化合物的是 。
2、从H、C、O、Na四种元素种,选择适当的元素,按要求写出各物质的化学式。
①金属单质 、非金属单质 ;
②酸性氧化物 、碱性氧化物 ;
③酸 、碱 、盐 。.“垃圾是放错了位置的资源”,应该分类回收,生活中废弃的铁锅、铅制易拉罐,铜导线等可以归为一类加以回收,它们属于( ) A、氧化物 B、盐
C、金属或合金 D、碱 三、物质的性质和变化 物理性质
酸、碱、盐的溶解性
钾钠铵硝皆可溶、盐酸盐不溶银亚汞; 硫酸盐不溶钡和铅、碳磷酸盐多不溶。 多数酸溶碱少溶、只有钾钠氨钡溶。化学性质
1金属的化学性质
2 碱性氧化物通性
3 酸性氧化物通性
4.盐的通性
5. 酸的通性
6.碱的通性
1.金属的化学性质: (1)与非金属反应: (2)与酸反应: (3)与盐溶液反应: 金属活动顺序表应用: 在金属活动顺序表中,只有排在氢前面的金属才能置换出酸中的氢 (金属越活泼,反应越剧烈) ②在金属活动顺序表中,排在前面的金属一般能把排在后面的金属从它们的盐溶液中置换出来 2 .碱性氧化物通性 (1)与酸反应:Na2O + 2HCl = 2NaCl + H2O (2)与水反应:CaO + H2O = Ca(OH)2 (3)与酸性氧化物:Na2O + CO2 = Na2CO3 注意:一般可溶性的碱对应的碱性氧化物才能与水反应 (常见的有:Na2O 、K2O、 CaO、BaO) 3 .酸性氧化物通性 (1)与碱反应:CO2 + Ca(OH)2 = CaCO3 + H2O (2)与水反应:CO2 + H2O = H2 CO3 (3)与碱性氧化物反应:K2O + CO2 = K2CO3 注意:大多数酸性氧化物能与水反应生成相应的酸,但SiO2不能与水反应
先介绍电离的概念
酸:电离产生的阳离子全都是氢离子
HCl == H+ +Cl-
H2SO4 == 2H+ + SO42-
因为酸的溶液中都含有氢离子所以酸具有相同的化学性质
酸的化学性质实质是溶液中氢离子和酸根离子的性质 4 酸的通性碱:电离产生的阴离子全都是氢氧根离子
NaOH == Na+ +OH-
Ca(OH)2 == Ca2+ +2OH-
因为碱的溶液中都含有氢氧根离子所以碱具有相同的化学性质
碱的化学性质实质是溶液中金属离子和氢氧根离子的性质 5 碱的通性6.盐的通性
与酸反应
酸与盐反应的一般规律:
强酸 + 弱酸盐 = 强酸盐 + 弱酸
②与碱反应
注意:碱和盐反应不仅要求生成物中有沉淀、气体、水三者之一,还要求反应物均溶于水
③与盐反应
注意:盐和盐反应不仅要求生成物中有沉淀、气体、水三者之一,还要求反应物均溶于水
④与金属反应 下列物质的用途与该物质的物理性质有关的是( ) A、用硫酸除去金属表面的锈
B、用一氧化碳冶炼生铁 C、用氢气作高能燃料
D、用干冰进行人工降雨
下列自然现象的过程中,存在化学变化的是( ) A、冰雪融化 B、形成酸雨 C、发生沙尘暴天气 D、二氧化碳物质使地球表面气温升高 [练习]写出化学方程式并注明基本反应类型
1、铁丝在点燃的条件下在氧气中剧烈燃烧
2、氢氧化钡与硫酸钠反应
3、氢气能使氧化铜发生还原反应生成铜
4、硫酸氢铵受热易分解
5、一氧化碳还原氧化铁四、化学用语 写出由碳、氢、氧、钠中的某些元素组成的符合下列要求的物质的化学式:
(1)常用作还原剂的气态化合物:_____________;
(2)酸性氧化物______________ ;
(3)碱性氧化物________________;(4)正盐___________;
(5)酸式盐_______________。 判断下列化学符号中数字“2”所表示的意义,将其序号填在相应的横线上: ①Ca2+ ②NO2 ③2NO ④ +2
MgO (1)表示分子个数的是_____________; (2)表示一个离子所带电荷数的是___________; (3)表示元素化合价的是__________________; (4)表示一个分子中所含原子个数的是______________。 8、下列各组物质中:①C12O7、HClO3;②SO2、H2SO4;③NO、HNO2;④SiO2、H2SiO3;⑤Mn2O7、HMnO4;⑥CO2、 H2C2O4;⑦NO2、HNO2;⑧A12O3、HAlO2,前者是后者的 酸酐,正确的是( )。
A、①②③⑥ B.②③⑤⑦
C.④⑤ D.①③④⑧
[解析] HClO3的酸酐是C12O5,H2SO4的酸酐是SO3,
HNO2的酸酐是N2O3,H2C2O3的酸酐是C2O3,
A12O3为金属氧化物,是两性氧化物。 C
