湖南省株洲市攸县2021-2022学年高三下学期期中考试化学试题(Word版含答案)
文档属性
| 名称 | 湖南省株洲市攸县2021-2022学年高三下学期期中考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 648.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-15 16:31:46 | ||
图片预览


文档简介
株洲市攸县2021-2022学年高三下学期期中考试
化学试题
(时间:75分钟 满分:100分)
注意事项:
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量: H1 C12 O16 N14 Na23 A127 Ca40
一、选择题:本题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。
1、下列关于物质的表述不正确的是( )
A.港珠澳大桥采用超高分子量聚乙烯纤维吊绳,其商品名为“力纶”是有机高分子化合物
B.3D打印钛合金材料用于航天航空尖端领域是利用了钛合金密度小强度大等特点
C.位于贵州省平塘县的中国天眼FAST使用的SiC是一种无机非金属材料
D.泰国银饰和土耳其彩瓷是“一带一路”沿线国家的特色产品,其主要成分均为金属材料
2、NA代表阿伏加德罗常数的值。下列说法错误的是( )
A.1mol SO2与3mol O2反应生成的SO3分子数为NA
B.在标准状况下,22.4L NH3分子中含共用电子对数为3NA
C.100g质量分数为46%的HCOOH溶液中含氢原子数为8NA
D.1L 0.5mol·L-1葡萄糖溶液中含葡萄糖分子数为0.5NA
3、下列有关有机化合物(a) (b) (c)的说法正确的是( )
A.(a)(b)(c)均能与溴水发生化学反应
B.(b)二氯代物有两种
C.(a)(b)(c)互为同分异构体
D.(a)中所有原子可能共平面
4、已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是其最内层电子数的3倍。下列说法不正确的是( )
A.原子半径:Z>W>R
B.对应的氢化物的热稳定性:R>W
C.W与X、W与Z形成的化合物的化学键类型完全相同
D.Y的最高价氧化物对应的水化物是弱酸
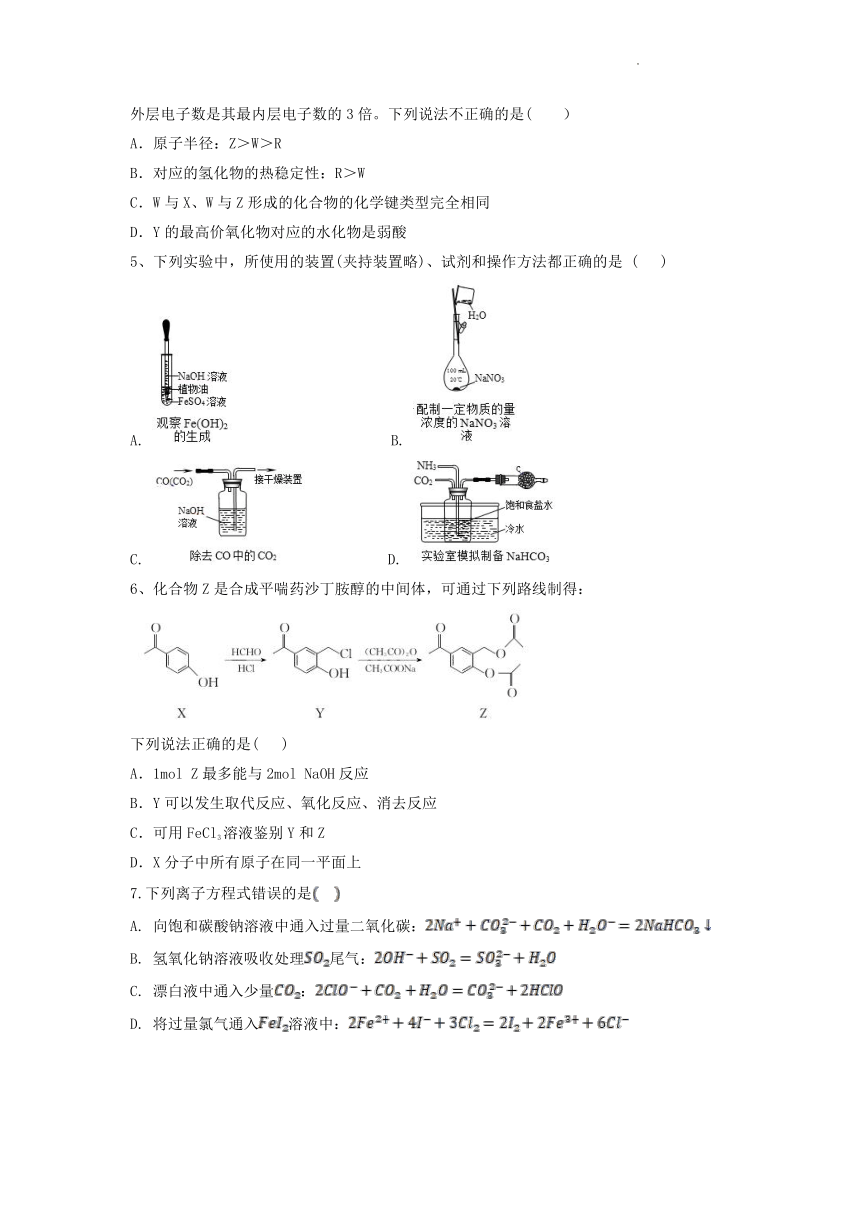
5、下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是 ( )
A. B.
C. D.
6、化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:
下列说法正确的是( )
A.1mol Z最多能与2mol NaOH反应
B.Y可以发生取代反应、氧化反应、消去反应
C.可用FeCl3溶液鉴别Y和Z
D.X分子中所有原子在同一平面上
7.下列离子方程式错误的是
A. 向饱和碳酸钠溶液中通入过量二氧化碳:
B. 氢氧化钠溶液吸收处理尾气:
C. 漂白液中通入少量:
D. 将过量氯气通入溶液中:
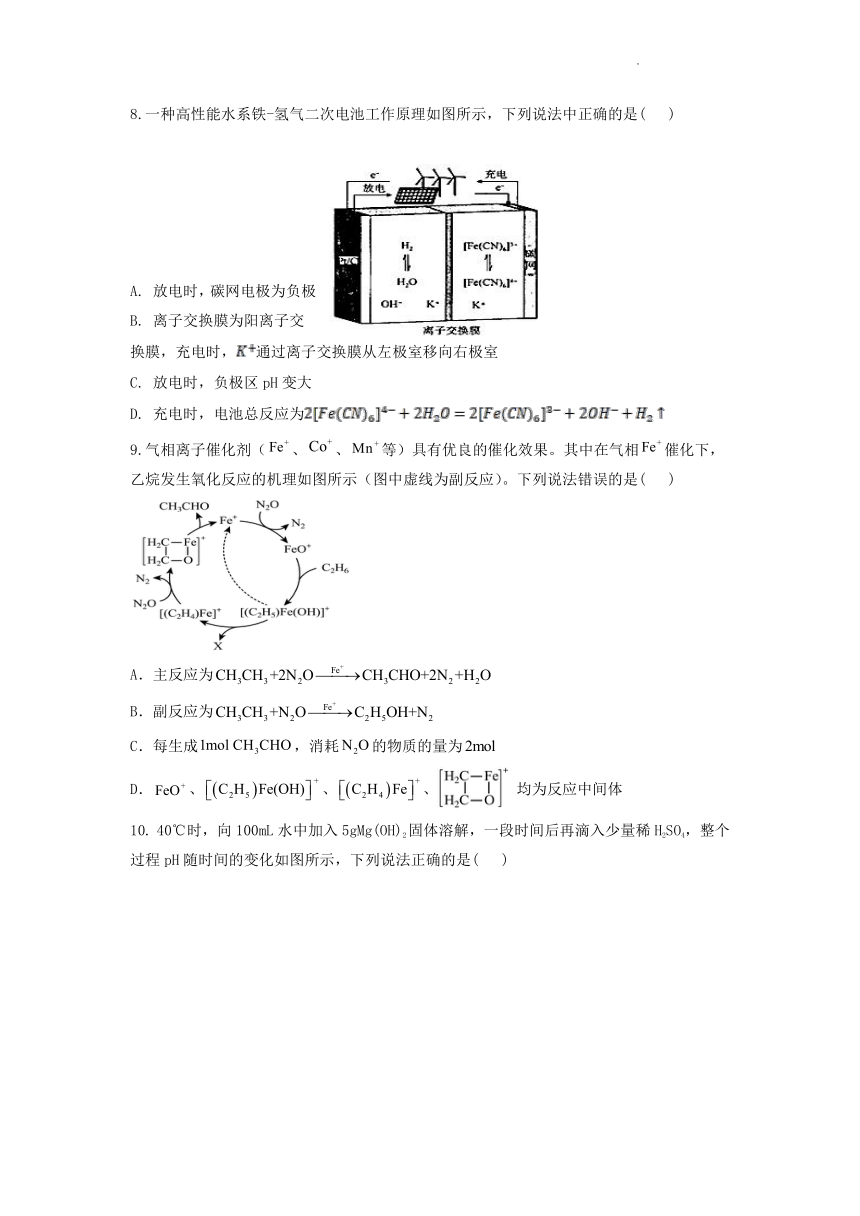
8.一种高性能水系铁-氢气二次电池工作原理如图所示,下列说法中正确的是( )
A. 放电时,碳网电极为负极
B. 离子交换膜为阳离子交换膜,充电时,通过离子交换膜从左极室移向右极室
C. 放电时,负极区pH变大
D. 充电时,电池总反应为
9.气相离子催化剂(、、等)具有优良的催化效果。其中在气相催化下,乙烷发生氧化反应的机理如图所示(图中虚线为副反应)。下列说法错误的是( )
A.主反应为
B.副反应为
C.每生成,消耗的物质的量为
D.、、、 均为反应中间体
10. 40℃时,向100mL水中加入5gMg(OH)2固体溶解,一段时间后再滴入少量稀H2SO4,整个过程pH随时间的变化如图所示,下列说法正确的是( )
A. a→b段,由水电离出的c(OH-)逐渐增大
B. c→e段的变化符合勒夏特列原理
C. b点时,溶液中的c(OH-)=1.0×10-4.09
D. e点处,离子浓度大小顺序为c()>c(Mg2+)>c(OH-)>c(H+)
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.以高杂质碳酸锂含Ca、Mg杂质为原料制备电池级碳酸锂的工艺流程如图。已知EDTA对,杂质离子有很好的络合效果;的溶解度随温度升高而降低,且在乙醇中溶解度小。下列说法错误的是( )
A. 氢化过程需通入过量的,发生的主要反应方程式为:
B. 操作1为过滤,实验室进行该操作时使用的玻璃仪器为漏斗、玻璃棒、烧杯
C. 氢化阶段应控制反应温度为高温,利于反应进行,加快反应速率
D. 操作1中,提高碳酸锂回收率的方法有升高温度和加入乙醇溶剂
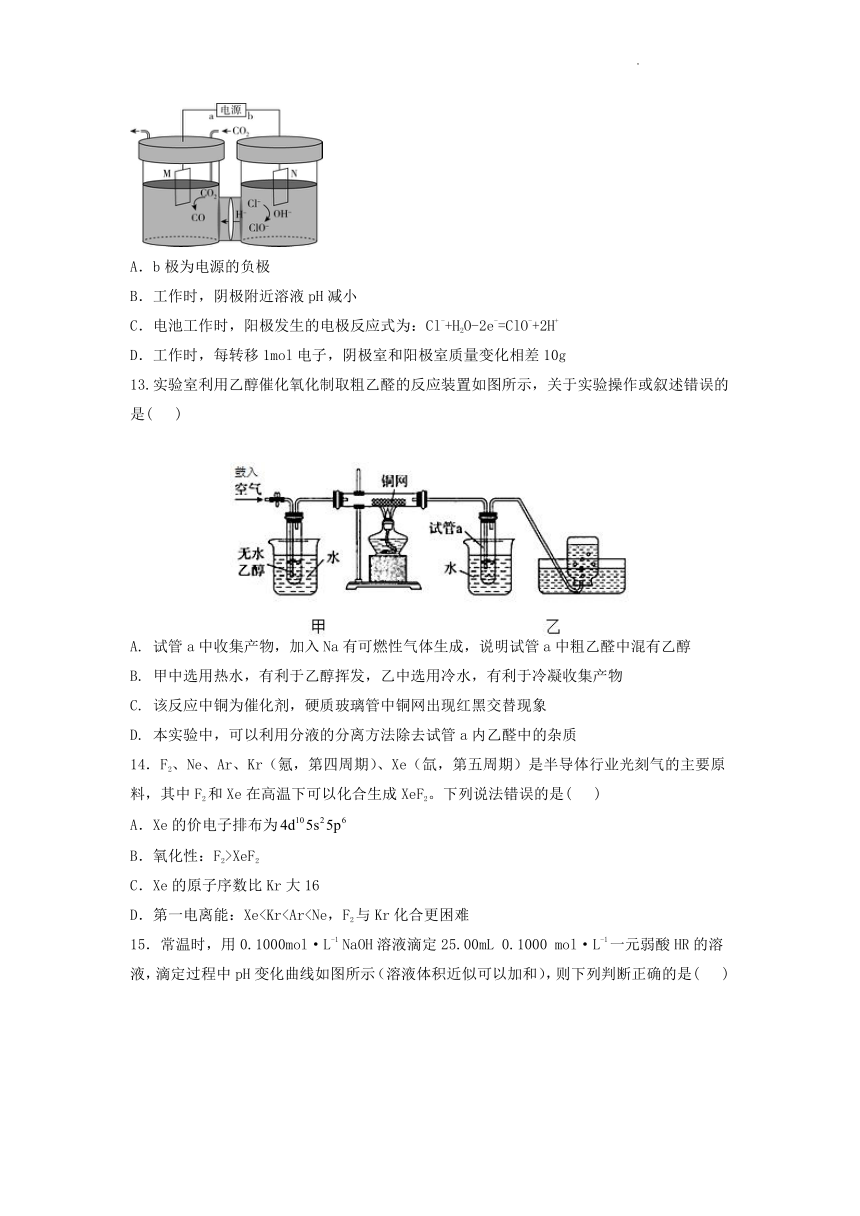
12.我国科研团队将电解食盐水的阳极反应与电催化还原CO2的阴极反应相耦合,制备CO与次氯酸盐,阴极区与阳极区用质子交换膜隔开。装置如图所示,下列说法正确的是( )
A.b极为电源的负极
B.工作时,阴极附近溶液pH减小
C.电池工作时,阳极发生的电极反应式为:Cl-+H2O-2e-=ClO-+2H+
D.工作时,每转移1mol电子,阴极室和阳极室质量变化相差10g
13.实验室利用乙醇催化氧化制取粗乙醛的反应装置如图所示,关于实验操作或叙述错误的是( )
A. 试管a中收集产物,加入Na有可燃性气体生成,说明试管a中粗乙醛中混有乙醇
B. 甲中选用热水,有利于乙醇挥发,乙中选用冷水,有利于冷凝收集产物
C. 该反应中铜为催化剂,硬质玻璃管中铜网出现红黑交替现象
D. 本实验中,可以利用分液的分离方法除去试管a内乙醛中的杂质
14.F2、Ne、Ar、Kr(氪,第四周期)、Xe(氙,第五周期)是半导体行业光刻气的主要原料,其中F2和Xe在高温下可以化合生成XeF2。下列说法错误的是( )
A.Xe的价电子排布为
B.氧化性:F2>XeF2
C.Xe的原子序数比Kr大16
D.第一电离能:Xe15.常温时,用0.1000mol·L-1 NaOH溶液滴定25.00mL 0.1000 mol·L-1一元弱酸HR的溶液,滴定过程中pH变化曲线如图所示(溶液体积近似可以加和),则下列判断正确的是( )
A.A点时, B.常温下,HR的Ka的数量级为10-4
C.B点时, D.B点和C点,水的电离程度相同
三、非选择题:本题共4小题,共50分。
16、(12分)高锰酸钾是常用的氧化剂。某化学小组在实验室以软锰矿(主要成分是MnO2)为原料制备KMnO4,下图是实验室制备高锰酸钾的操作流程。
已知:
温度 溶解度/g
K2CO3 KHCO3 KMnO4
20℃ 111 33.7 6.38
请回答:
1.反应①的化学方程式为 ,加热软锰矿、KClO3和KOH固体,除三脚架、玻璃棒、泥三角和铁坩埚外,还用到的仪器有 ,不采用瓷坩埚而选用铁坩埚的理由是_____________
2.反应②中氧化产物与还原产物的物质的量之比为 ;上述流程中可以循环利用的物质是 。
3.实验时,从滤液中得到KMnO4晶体的实验操作a为 ,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低其原因是 。
17.(12分)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是一种蓝绿色的无机复盐,易溶于水,不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小。某同学设计如图实验装置制备硫酸亚铁铵晶体。
实验步骤如下:
①用30%的NaOH溶液和铁屑(含有Fe2O3、FeS等杂质)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入C中。
②在B中用①处理过的铁屑和稀硫酸反应制取FeSO4。
③将②制得的FeSO4溶液与(NH4)2SO4溶液混合。
④将A中混合液蒸发浓缩、自然冷却、过滤、洗涤、干燥得到硫酸亚铁铵晶体。
(1)仪器a在使用前必须进行的操作是_______。C中发生反应的离子方程式为_______。
(2)按图连接好装置,经检验气密性良好,加入相应的药品后,利用铁屑和稀硫酸反应产生的氢气赶走装置中的空气及硫酸铵溶液中溶解的氧气,其目的是_______,此时活塞K1、K2、K3的状态为打开_______ 关闭_______。(填“K1”、“K2”、“K3”)
(3)完成步骤③的操作是_______。
(4)步骤④将A中混合溶液蒸发浓缩、自然冷却能析出硫酸亚铁铵晶体的原因是_______,过滤后的晶体用乙醇洗涤而不用蒸馏水洗涤原因是_______。
18.(12分)由Mg、C和Ni组成的三元合金系统具有超导电性。回答下列问题:
基态Ni原子核外电子排布式为 ______ 。
对羟基苯甲酸具有防腐、防霉和杀菌等作用,其中C原子的杂化轨道类型为 ______ ,1mol对羟基苯甲酸中键数目为 ______ 。表示阿伏加德罗常数的值
对羟基苯甲酸沸点比邻羟基苯甲酸______ 填“高”、“低”或“相等”,原因是 ______ 。
新型超导材料晶体的晶胞结构中镁原子和镍原子位于顶点和面心,它们构成两种八面体空隙,一种由镍原子构成,另一种由镍原子和镁原子一起构成,两种八面体空隙的数量比是1:3,碳原子只填充在镍原子构成的八面体空隙中,沿晶胞立方格子对角线取得的截图如图所示。
①该新型超导材料的化学式为 ______ 。
②已知晶胞参数,阿伏加德罗常数的值为,Mg的C配位数为 ______ ,该晶胞密度为 ______ 。列出计算式即可
19.(14分)F是一种天然产物,具有抗肿瘤等活性,其人工合成路线如图:
已知:。
(1)A分子含氧官能团的名称是____。
(2)C→D的反应类型有加成反应和____。
(3)A+B→C的反应需经历A+B→X+C的过程,中间体X的分子式为C17H17NO6,请写出X可能的结构简式____。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____。
①能使FeCl3溶液显色,也能发生银镜反应;
②分子中有四种不同化学环境的氢原子,且数目之比为1∶2∶2∶2。
(5)写出以为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
株洲市攸县2021-2022学年高三下学期期中考试
化学试题参考答案
一、选择题:本题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。
1.D 2.A 3.C 4.B 5.A 6.D 7.C 8.D 9.C 10.B
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.CD 12.D 13.AD 14.AC 15.BC
三、非选择题:本题共4小题,共50分。
16.(12分) 1.KClO3 + 3MnO2 + 6KOH3K2MnO4 + KCl + 3H2O;酒精灯、坩埚钳;瓷坩埚中的SiO2会与KOH发生反应
2.2∶1 ;KOH、MnO2
3.蒸发浓缩、冷却结晶、过滤、洗涤、干燥;KHCO3的溶解度较小,滤液蒸发浓缩降温结晶时KHCO3会随KMnO4一同结晶析出
17.(12分)(1)检验是否漏液 H2S+2OH-=S2-+2H2O
(2)防止Fe2+被氧化 K1、K2 K3
(3)打开K3,关闭K1
(4)溶液中存在Fe2+、和,浓缩时溶解度小的盐会先析出(或硫酸亚铁铵的溶解度随温度降低而减小) 硫酸亚铁铵易溶于水,不溶于乙醇,减少损耗;乙醇易挥发,易带走水分得到较干燥的产品
18.(12分)(1);
高 两个化合物都可以形成氢键,但前者因取代基在对位,易形成分子间氢键,沸点较高,后者因取代基在邻位,易形成分子内氢键,故沸点较低
①
②8;
19.(14分)(1)醛基、醚键
(2)还原反应(或还原)
(3)或
(4)或
(5)
化学试题
(时间:75分钟 满分:100分)
注意事项:
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量: H1 C12 O16 N14 Na23 A127 Ca40
一、选择题:本题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。
1、下列关于物质的表述不正确的是( )
A.港珠澳大桥采用超高分子量聚乙烯纤维吊绳,其商品名为“力纶”是有机高分子化合物
B.3D打印钛合金材料用于航天航空尖端领域是利用了钛合金密度小强度大等特点
C.位于贵州省平塘县的中国天眼FAST使用的SiC是一种无机非金属材料
D.泰国银饰和土耳其彩瓷是“一带一路”沿线国家的特色产品,其主要成分均为金属材料
2、NA代表阿伏加德罗常数的值。下列说法错误的是( )
A.1mol SO2与3mol O2反应生成的SO3分子数为NA
B.在标准状况下,22.4L NH3分子中含共用电子对数为3NA
C.100g质量分数为46%的HCOOH溶液中含氢原子数为8NA
D.1L 0.5mol·L-1葡萄糖溶液中含葡萄糖分子数为0.5NA
3、下列有关有机化合物(a) (b) (c)的说法正确的是( )
A.(a)(b)(c)均能与溴水发生化学反应
B.(b)二氯代物有两种
C.(a)(b)(c)互为同分异构体
D.(a)中所有原子可能共平面
4、已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是其最内层电子数的3倍。下列说法不正确的是( )
A.原子半径:Z>W>R
B.对应的氢化物的热稳定性:R>W
C.W与X、W与Z形成的化合物的化学键类型完全相同
D.Y的最高价氧化物对应的水化物是弱酸
5、下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是 ( )
A. B.
C. D.
6、化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:
下列说法正确的是( )
A.1mol Z最多能与2mol NaOH反应
B.Y可以发生取代反应、氧化反应、消去反应
C.可用FeCl3溶液鉴别Y和Z
D.X分子中所有原子在同一平面上
7.下列离子方程式错误的是
A. 向饱和碳酸钠溶液中通入过量二氧化碳:
B. 氢氧化钠溶液吸收处理尾气:
C. 漂白液中通入少量:
D. 将过量氯气通入溶液中:
8.一种高性能水系铁-氢气二次电池工作原理如图所示,下列说法中正确的是( )
A. 放电时,碳网电极为负极
B. 离子交换膜为阳离子交换膜,充电时,通过离子交换膜从左极室移向右极室
C. 放电时,负极区pH变大
D. 充电时,电池总反应为
9.气相离子催化剂(、、等)具有优良的催化效果。其中在气相催化下,乙烷发生氧化反应的机理如图所示(图中虚线为副反应)。下列说法错误的是( )
A.主反应为
B.副反应为
C.每生成,消耗的物质的量为
D.、、、 均为反应中间体
10. 40℃时,向100mL水中加入5gMg(OH)2固体溶解,一段时间后再滴入少量稀H2SO4,整个过程pH随时间的变化如图所示,下列说法正确的是( )
A. a→b段,由水电离出的c(OH-)逐渐增大
B. c→e段的变化符合勒夏特列原理
C. b点时,溶液中的c(OH-)=1.0×10-4.09
D. e点处,离子浓度大小顺序为c()>c(Mg2+)>c(OH-)>c(H+)
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.以高杂质碳酸锂含Ca、Mg杂质为原料制备电池级碳酸锂的工艺流程如图。已知EDTA对,杂质离子有很好的络合效果;的溶解度随温度升高而降低,且在乙醇中溶解度小。下列说法错误的是( )
A. 氢化过程需通入过量的,发生的主要反应方程式为:
B. 操作1为过滤,实验室进行该操作时使用的玻璃仪器为漏斗、玻璃棒、烧杯
C. 氢化阶段应控制反应温度为高温,利于反应进行,加快反应速率
D. 操作1中,提高碳酸锂回收率的方法有升高温度和加入乙醇溶剂
12.我国科研团队将电解食盐水的阳极反应与电催化还原CO2的阴极反应相耦合,制备CO与次氯酸盐,阴极区与阳极区用质子交换膜隔开。装置如图所示,下列说法正确的是( )
A.b极为电源的负极
B.工作时,阴极附近溶液pH减小
C.电池工作时,阳极发生的电极反应式为:Cl-+H2O-2e-=ClO-+2H+
D.工作时,每转移1mol电子,阴极室和阳极室质量变化相差10g
13.实验室利用乙醇催化氧化制取粗乙醛的反应装置如图所示,关于实验操作或叙述错误的是( )
A. 试管a中收集产物,加入Na有可燃性气体生成,说明试管a中粗乙醛中混有乙醇
B. 甲中选用热水,有利于乙醇挥发,乙中选用冷水,有利于冷凝收集产物
C. 该反应中铜为催化剂,硬质玻璃管中铜网出现红黑交替现象
D. 本实验中,可以利用分液的分离方法除去试管a内乙醛中的杂质
14.F2、Ne、Ar、Kr(氪,第四周期)、Xe(氙,第五周期)是半导体行业光刻气的主要原料,其中F2和Xe在高温下可以化合生成XeF2。下列说法错误的是( )
A.Xe的价电子排布为
B.氧化性:F2>XeF2
C.Xe的原子序数比Kr大16
D.第一电离能:Xe
A.A点时, B.常温下,HR的Ka的数量级为10-4
C.B点时, D.B点和C点,水的电离程度相同
三、非选择题:本题共4小题,共50分。
16、(12分)高锰酸钾是常用的氧化剂。某化学小组在实验室以软锰矿(主要成分是MnO2)为原料制备KMnO4,下图是实验室制备高锰酸钾的操作流程。
已知:
温度 溶解度/g
K2CO3 KHCO3 KMnO4
20℃ 111 33.7 6.38
请回答:
1.反应①的化学方程式为 ,加热软锰矿、KClO3和KOH固体,除三脚架、玻璃棒、泥三角和铁坩埚外,还用到的仪器有 ,不采用瓷坩埚而选用铁坩埚的理由是_____________
2.反应②中氧化产物与还原产物的物质的量之比为 ;上述流程中可以循环利用的物质是 。
3.实验时,从滤液中得到KMnO4晶体的实验操作a为 ,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低其原因是 。
17.(12分)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是一种蓝绿色的无机复盐,易溶于水,不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小。某同学设计如图实验装置制备硫酸亚铁铵晶体。
实验步骤如下:
①用30%的NaOH溶液和铁屑(含有Fe2O3、FeS等杂质)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入C中。
②在B中用①处理过的铁屑和稀硫酸反应制取FeSO4。
③将②制得的FeSO4溶液与(NH4)2SO4溶液混合。
④将A中混合液蒸发浓缩、自然冷却、过滤、洗涤、干燥得到硫酸亚铁铵晶体。
(1)仪器a在使用前必须进行的操作是_______。C中发生反应的离子方程式为_______。
(2)按图连接好装置,经检验气密性良好,加入相应的药品后,利用铁屑和稀硫酸反应产生的氢气赶走装置中的空气及硫酸铵溶液中溶解的氧气,其目的是_______,此时活塞K1、K2、K3的状态为打开_______ 关闭_______。(填“K1”、“K2”、“K3”)
(3)完成步骤③的操作是_______。
(4)步骤④将A中混合溶液蒸发浓缩、自然冷却能析出硫酸亚铁铵晶体的原因是_______,过滤后的晶体用乙醇洗涤而不用蒸馏水洗涤原因是_______。
18.(12分)由Mg、C和Ni组成的三元合金系统具有超导电性。回答下列问题:
基态Ni原子核外电子排布式为 ______ 。
对羟基苯甲酸具有防腐、防霉和杀菌等作用,其中C原子的杂化轨道类型为 ______ ,1mol对羟基苯甲酸中键数目为 ______ 。表示阿伏加德罗常数的值
对羟基苯甲酸沸点比邻羟基苯甲酸______ 填“高”、“低”或“相等”,原因是 ______ 。
新型超导材料晶体的晶胞结构中镁原子和镍原子位于顶点和面心,它们构成两种八面体空隙,一种由镍原子构成,另一种由镍原子和镁原子一起构成,两种八面体空隙的数量比是1:3,碳原子只填充在镍原子构成的八面体空隙中,沿晶胞立方格子对角线取得的截图如图所示。
①该新型超导材料的化学式为 ______ 。
②已知晶胞参数,阿伏加德罗常数的值为,Mg的C配位数为 ______ ,该晶胞密度为 ______ 。列出计算式即可
19.(14分)F是一种天然产物,具有抗肿瘤等活性,其人工合成路线如图:
已知:。
(1)A分子含氧官能团的名称是____。
(2)C→D的反应类型有加成反应和____。
(3)A+B→C的反应需经历A+B→X+C的过程,中间体X的分子式为C17H17NO6,请写出X可能的结构简式____。
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____。
①能使FeCl3溶液显色,也能发生银镜反应;
②分子中有四种不同化学环境的氢原子,且数目之比为1∶2∶2∶2。
(5)写出以为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
株洲市攸县2021-2022学年高三下学期期中考试
化学试题参考答案
一、选择题:本题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。
1.D 2.A 3.C 4.B 5.A 6.D 7.C 8.D 9.C 10.B
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.CD 12.D 13.AD 14.AC 15.BC
三、非选择题:本题共4小题,共50分。
16.(12分) 1.KClO3 + 3MnO2 + 6KOH3K2MnO4 + KCl + 3H2O;酒精灯、坩埚钳;瓷坩埚中的SiO2会与KOH发生反应
2.2∶1 ;KOH、MnO2
3.蒸发浓缩、冷却结晶、过滤、洗涤、干燥;KHCO3的溶解度较小,滤液蒸发浓缩降温结晶时KHCO3会随KMnO4一同结晶析出
17.(12分)(1)检验是否漏液 H2S+2OH-=S2-+2H2O
(2)防止Fe2+被氧化 K1、K2 K3
(3)打开K3,关闭K1
(4)溶液中存在Fe2+、和,浓缩时溶解度小的盐会先析出(或硫酸亚铁铵的溶解度随温度降低而减小) 硫酸亚铁铵易溶于水,不溶于乙醇,减少损耗;乙醇易挥发,易带走水分得到较干燥的产品
18.(12分)(1);
高 两个化合物都可以形成氢键,但前者因取代基在对位,易形成分子间氢键,沸点较高,后者因取代基在邻位,易形成分子内氢键,故沸点较低
①
②8;
19.(14分)(1)醛基、醚键
(2)还原反应(或还原)
(3)或
(4)或
(5)
同课章节目录
