t化学反应中的热量变化(用)
图片预览






文档简介
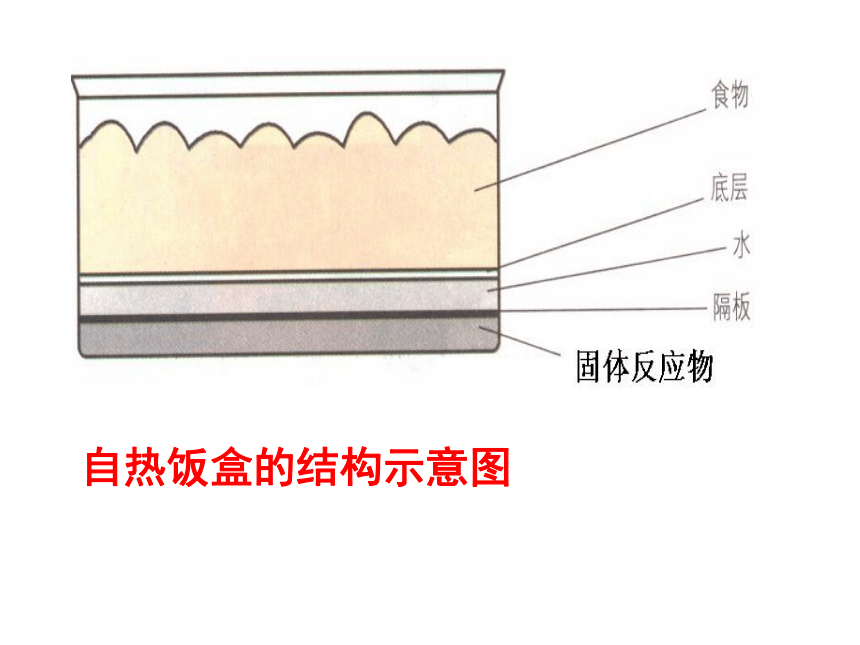
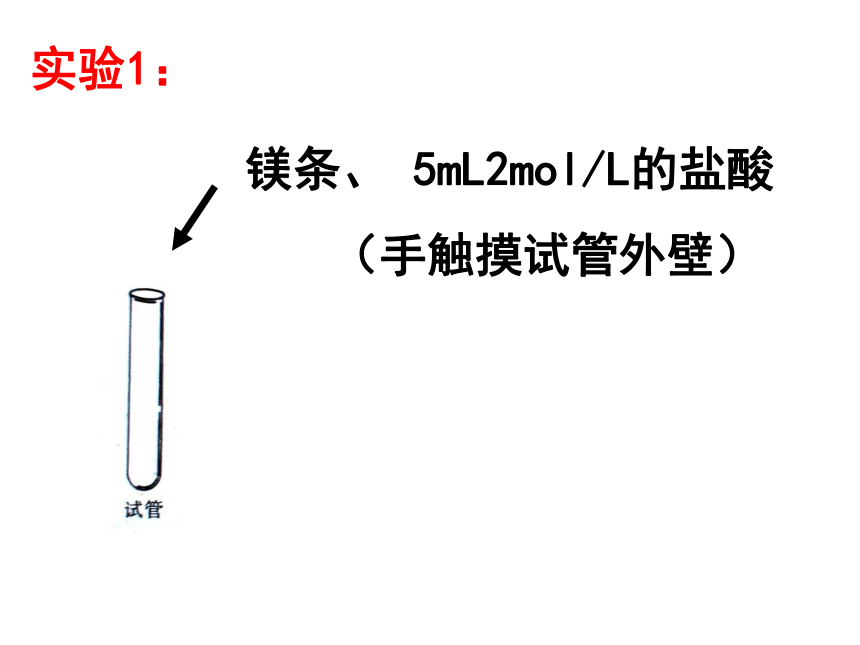
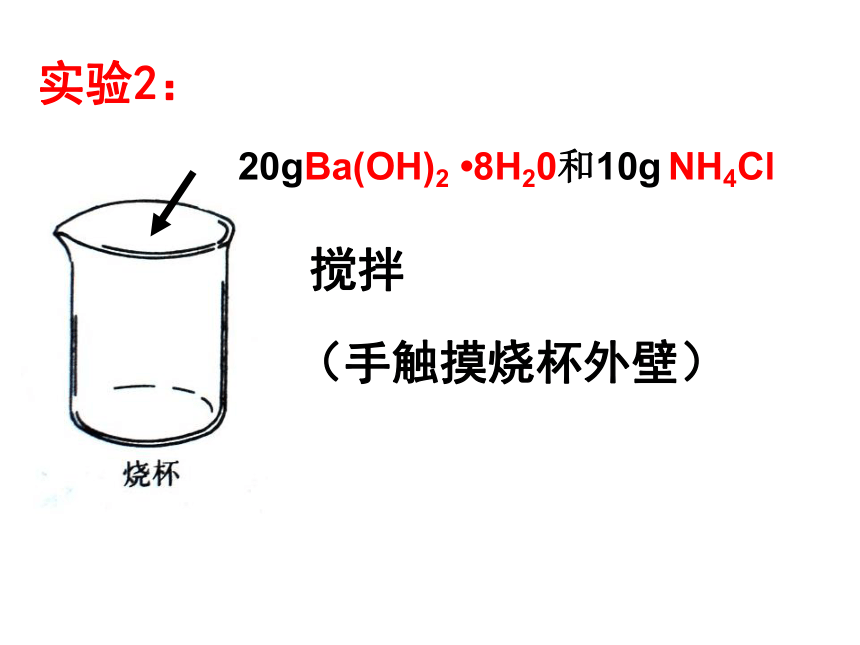
课件20张PPT。化学反应中的热量变化2006年9月5日,从北京开往拉萨的T27次列车,载着2000盒试销的“自热米饭”,沿着“天路”开往青藏高原。所谓“自熟米饭”,即不用明火和电力便可将冷饭加热,将生米煮成熟饭的一种快餐。报导:自热饭盒的结构示意图镁条的燃烧闪电时产生氮氧化物高炉冶炼铁实验1:镁条、 5mL2mol/L的盐酸(手触摸试管外壁)实验2:20gBa(OH)2 ?8H20和10g NH4Cl 搅拌(手触摸烧杯外壁)吸热反应:有吸收热量的化学反应。一、放热反应与吸热反应放热反应:有热量放出的化学反应。交流与讨论:课本35页下列反应是放热反应?是吸热反应?
①镁条的燃烧
②高温煅烧石灰石
③氧化钙与水的反应
④盐酸与氢氧化钠的中和反应疑问为什么有的反应放出热量,而有的反应吸收热量??以
为例,从旧化学键的断裂和新化学键的生成过程中热量的变化情况?探究活动一:化学键角度(微观)(放热反应)资料卡:某些共价键的键能共价键键能(KJ ? mol-1 )H-HCl-ClH-Cl436.4242.7431.8探究活动二:从能量守恒角度宏观分析反应前后能量的变化。每个物质自身内部都含有一定的能量,我们称它为化学能!化学能反应过程放出能量△H为“-”放热反应高低△H:表示反应体系所含化学能的变化量化学能反应过程吸收能量△H为“+”吸热反应高低△H:表示反应体系所含化学能的变化量①2H2(g) + O2(g) = 2H2O(l) △H = -571.6 kJ ? mol-1 ②H2(g) + I2(s) = 2HI (g) △H = + 53 .0kJ ? mol-1判断下列反应是放热反应还是吸热反应?③ H2(g) + I2(s) = HI (g) △H = + 26.5kJ ? mol-1课堂练习1:①2SO2 + O2 = 2SO3 △H = -196 . 6kJ ? mol-1课堂练习2:③ C(s) + O2(g) = CO2 (g) △H = + 393 .6kJ ? mol-1判断下列热化学反应方程式书写是否正确?×××课堂练习3:H2(g)+1/2O2(g)=H2O(l) △H = a kJ/mol根据:2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ/mol你能推算a=?H2O(l)=H2(g)+1/2O2(g) △H = b kJ/mol想想:b=?b=-a = +285.8a =-285.8课堂练习4:1、已知每1mol碳在氧气中完全燃烧生成二氧化碳时,放出393.5kJ热量,请写出该反应的热化学方程式?2、已知每1molSO2在气体氧气中完全燃烧生成SO3气体时,放出98.3kJ热量,请写出该反应的热化学方程式?这节课你有什么收获?1.能量转化的方式,特别是化学能与 热能的相互转化。
2.化学键的断裂和形成是化学反应中 能量变化的主要原因。
3.学会热化学方程式的书写,学会判
定放热反应和吸热反应。课后作业:1、课本35页《问题解决》
2、同步作业本——下周一上交
①镁条的燃烧
②高温煅烧石灰石
③氧化钙与水的反应
④盐酸与氢氧化钠的中和反应疑问为什么有的反应放出热量,而有的反应吸收热量??以
为例,从旧化学键的断裂和新化学键的生成过程中热量的变化情况?探究活动一:化学键角度(微观)(放热反应)资料卡:某些共价键的键能共价键键能(KJ ? mol-1 )H-HCl-ClH-Cl436.4242.7431.8探究活动二:从能量守恒角度宏观分析反应前后能量的变化。每个物质自身内部都含有一定的能量,我们称它为化学能!化学能反应过程放出能量△H为“-”放热反应高低△H:表示反应体系所含化学能的变化量化学能反应过程吸收能量△H为“+”吸热反应高低△H:表示反应体系所含化学能的变化量①2H2(g) + O2(g) = 2H2O(l) △H = -571.6 kJ ? mol-1 ②H2(g) + I2(s) = 2HI (g) △H = + 53 .0kJ ? mol-1判断下列反应是放热反应还是吸热反应?③ H2(g) + I2(s) = HI (g) △H = + 26.5kJ ? mol-1课堂练习1:①2SO2 + O2 = 2SO3 △H = -196 . 6kJ ? mol-1课堂练习2:③ C(s) + O2(g) = CO2 (g) △H = + 393 .6kJ ? mol-1判断下列热化学反应方程式书写是否正确?×××课堂练习3:H2(g)+1/2O2(g)=H2O(l) △H = a kJ/mol根据:2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ/mol你能推算a=?H2O(l)=H2(g)+1/2O2(g) △H = b kJ/mol想想:b=?b=-a = +285.8a =-285.8课堂练习4:1、已知每1mol碳在氧气中完全燃烧生成二氧化碳时,放出393.5kJ热量,请写出该反应的热化学方程式?2、已知每1molSO2在气体氧气中完全燃烧生成SO3气体时,放出98.3kJ热量,请写出该反应的热化学方程式?这节课你有什么收获?1.能量转化的方式,特别是化学能与 热能的相互转化。
2.化学键的断裂和形成是化学反应中 能量变化的主要原因。
3.学会热化学方程式的书写,学会判
定放热反应和吸热反应。课后作业:1、课本35页《问题解决》
2、同步作业本——下周一上交
